枣缩果病果实内微生物多样性的研究
2017-12-14杨卉芯宋晓斌岳子石
杨卉芯,宋晓斌,岳子石
(西北农林科技大学 林学院,陕西 杨凌 712100)
枣缩果病果实内微生物多样性的研究
杨卉芯,宋晓斌,岳子石
(西北农林科技大学 林学院,陕西 杨凌 712100)
比较七月鲜枣缩果病果实与健康果实内微生物的多样性,探讨枣缩果病与枣果实内微生物群落之间的关系。结果表明:在枣果微生物种群中,真菌是优势类群,株数占58.06%~60.98%,比细菌多出近20%,无放线菌。在幼果期,相对多度最高的4个属依次是交链孢属Alternaria、茎点霉属Phoma、青霉属Penicillium和曲霉属Aspergillus;白熟期后,有8个属的真菌属于优势类群,相对多度最高的4个属依次为交链孢属、茎点霉属、枝孢属Cladosporium和单格孢属Ulocladium,镰刀菌属Fusarium、盾壳霉属Coniothyrium和曲霉属次之,而且病果中优势菌株的相对多度大于健果。果实发病后真菌占微生物的比例下降,细菌上升,而健果中则相反。健果中真菌微生物群落的多样性和均匀性高于病果,随着果实的不断成熟,该趋势越明显。
七月鲜枣;枣缩果病;果实微生物多样性
七月鲜枣Ziziphusjujubevar.qiyuexian作为陕西省的品种枣,具有早熟、大果、肉质酥脆、不易裂果、树体矮小、早果性强、丰产稳产等特点[1]。但近年来由于陕北的气候发生变化,降雨量和阴雨天气明显增多,并且集中在红枣成熟的月份[2],导致2008年至2011年期间枣缩果病在陕北清涧红枣试验站连年严重发生[3]。枣缩果病是枣树的毁灭性病害,严重影响枣果的产量和品质[4],20世纪70年代已有报道[5]。目前在我国的新疆、山西、陕西、河南、河北等省份的枣种植区均有发生,但在国外未见报道。枣缩果病的侵染规律目前还不清楚,病原菌可能在幼果期侵入果实,到近成熟期才开始表现症状[6]。人们对枣缩果病的病原众说纷纭[7]。迄今为止,已公开报道过的枣缩果病的致病菌有10种真菌:轮纹大茎点菌MacrophomahawatsuhaiHara.[8-9],聚生小穴壳菌DothiorellagregariaSacc.、橄榄色盾壳霉菌ConiothyriumolivaceumBon.、细交链孢菌AlternariatenuisNees.[10-11],交互链孢菌Alternariaalternata(Fr.) Keissler、毁灭茎点霉PhomadesructivaPlowr.、壳梭孢菌Fusicoccumsp.、扩展青霉菌Penicilliumexpansum、细芽枝孢菌Cladosporiumtenuissimum[12-13],头状茎点霉Phomaglomerata[14]以及细菌:噬枣欧文氏菌ErwiniajujubovoraWang Cai Feng et Gao、解淀粉芽孢杆菌Bacillusamyloliquefaciens[15]。侵染规律的复杂性和病原的不确定性造成了防治的困难,因此探讨枣缩果病的病原问题依旧是研究的重点。
本文采用传统分离培养方法结合分子鉴定手段研究了七月鲜枣果从幼果期到成熟期健果和病果内微生物多样性及变化规律,初步揭示枣果内微生物类群与病害之间的关系。通过对其相关性的分析,为枣缩果病的发病机理和生物防治提供理论依据。
1 1 材料与方法
1.1 材料
1.1.1 供试枣果材料 从2015年7月开始,在陕西省榆林市清涧县牛家湾村清涧红枣试验站枣园(E 109.09°,N 37.13°),采集七月鲜枣的健康果实与发病果实。采用五点取样法,每点定1株枣树,每株枣树按东、南、西、北4个方位随机采集枣果。将枣果放入无菌样品袋,采用冰盒(冰袋保鲜)运输,带回实验室置于冰箱中保存,24 h内进行分离培养。
采样时间 7月11日(幼果期)、21日、31日,8月11日(发病初期)、21日和9月1日(发病盛期),当果实开始发病后,每次采样将健果和病果分开。
1.1.2 培养基 马铃薯葡萄糖琼脂培养基(PDA),牛肉膏蛋白胨培养基(NA),高氏一号培养基。
1.2 枣果实微生物的分离纯化 参照常规的组织分离法[16]进行改良。将采集的枣果用蒸馏水冲洗干净,用灭菌滤纸吸干表面残余水分。切取果实表皮下果肉部分的病健交界处组织,切成约5 mm见方的小块,用70%乙醇浸泡2 min后置于1%次氯酸钠中浸泡3 min,用无菌水冲洗3次。用组织印记法验证果实表面是否消毒干净。把处理的组织块分别接入PDA、NA、高氏一号培养基中培养。每个培养基中放入5个组织块,摆放均匀,分别置于25℃、37℃和28℃的恒温箱中培养,观察记录菌落生长情况。待组织块长出菌落后,对于真菌则挑取菌丝尖端组织接种到PDA培养基上;对于细菌则仔细挑取单菌落,再把单菌落用灭菌水稀释成悬浮液,于NA培养基上划线纯化;对于放线菌则从单菌落中挑取少许细胞接种到高氏一号培养基中获得纯培养。
1.3 枣果内微生物的鉴定 枣果内微生物的鉴定主要用形态学鉴定[17],以菌落的形状、颜色、质地、边缘特征以及分生孢子器、分生孢子和产孢方式等作为鉴定依据,用分子鉴定方法以辅助。分子鉴定:用CTAB法提取真菌基因组DNA。采用通用引物对真菌ITS基因进行PCR[18]扩增(ITS4:5′-TCCTCCGCTTATTGATATGC-3′和ITS5:5′-GGA AGTAAAAGTCGTAACAAGG-3′)。PCR反应体系为25 μL:Taq PCR Master Max12.5 μL,上游引物1 μL,下游引物1 μL,模板 DNA 1 μL,ddH2O 9.5 μL。PCR 反应条件为:95℃预变性3 min,94℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,共34个循环,后72 ℃延伸5 min。PCR扩增产物用1%琼脂糖凝胶电泳检测。将产物经琼脂糖凝胶回收试剂盒( 北京天根生物技术有限公司) 纯化,送交上海生工生物工程技术服务有限公司测序。测序结果在GenBank数据库中进行BLAST同源性比对分析。
1.4 数据处理 相对多度(relative abundance,RA),植物样本中分离到的某种或某一类微生物的菌株数量占分离到总菌株数量的百分率,能够反映不同种类的微生物在总菌群中所占优势程度。如果某微生物类群相对多度Pigt;1/S,则该类群为优势菌群,如果Pilt;1/S,则该类群为次要类群[19],S为微生物群落中类群总数。
微生物群落各相关指数计算[20]如下。
香侬—威纳(Shannon-Wiener)指数:

均匀度指数(Pielou):E=H/Hmax,Hmax=InS
其中:H、D为群落的多样性指数,Pi为相对多度,S为枣果微生物群落中类群总数,即物种的丰富度。N是全部属的菌株数总和,Ni是第i个属的菌株数:群落中生物种类越多代表群落的复杂程度增高,即H值越大,多样性越高;D值越大,表示优势物种越少,也表示奇异度越高。E为群落的均匀度指数,Hmax为最大多样性指数。E值越高,说明物种分布的均匀度越好。
2 结果与分析
2.1 健、病果实内微生物株数 当果实开始发病后,每次采样将健果和病果分开,因此罹病果实的微生物株数从8月11日开始统计。枣果在不同时期分离到的微生物种类有真菌和细菌,无放线菌,且微生物总株数、真菌、细菌的株数均不同,随着果实的成熟,数量呈上升趋势。幼果期到绿熟期(7月11—31日),分离出的微生物株数相对较低,总株数最高为82株,真菌和细菌最高分别为50和32株。白熟期(8月11日)时,健康果实内微生物的总株数达到了378株,真菌205株,细菌173株。发病果实中则更多,总株数404株,真菌261株,细菌143株。9月1日采样时,果实内微生物的总株数,真菌数,细菌数均达到最大值。健康果实中总株数、真菌和细菌株数分别达到703株、440株、263株;发病果实中总株数、真菌和细菌株数分别是662株、354株、308株(表1)。因此白熟期是微生物迅速增长的时期。
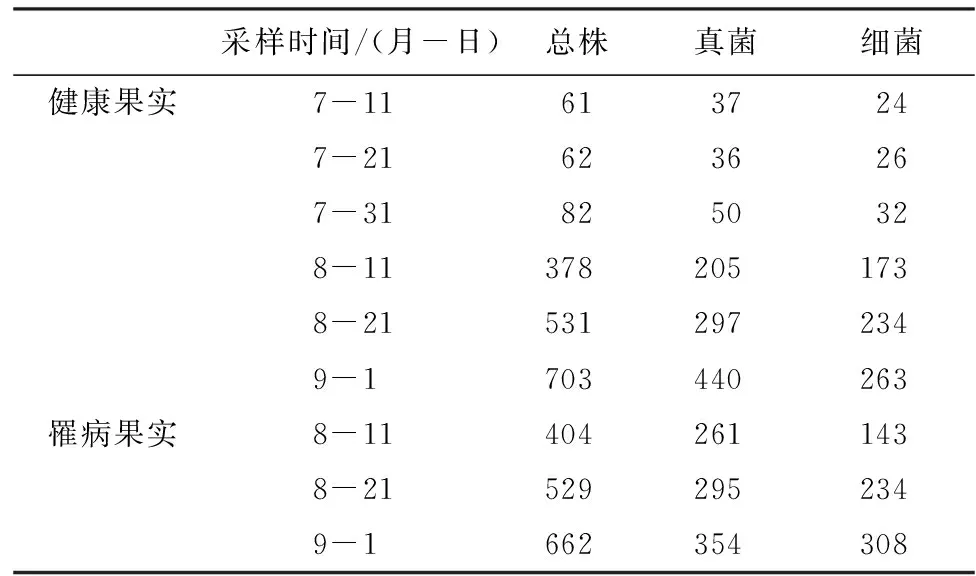
表1 枣果微生物的菌株数量与组成 株
从不同的取样期分离到的真菌和细菌中,均以真菌所占的比例最多(图1)。从幼果期到绿熟期,真菌株数占58.06%~60.98%,细菌占39.02%~41.94%。真菌和细菌的比例相对稳定。
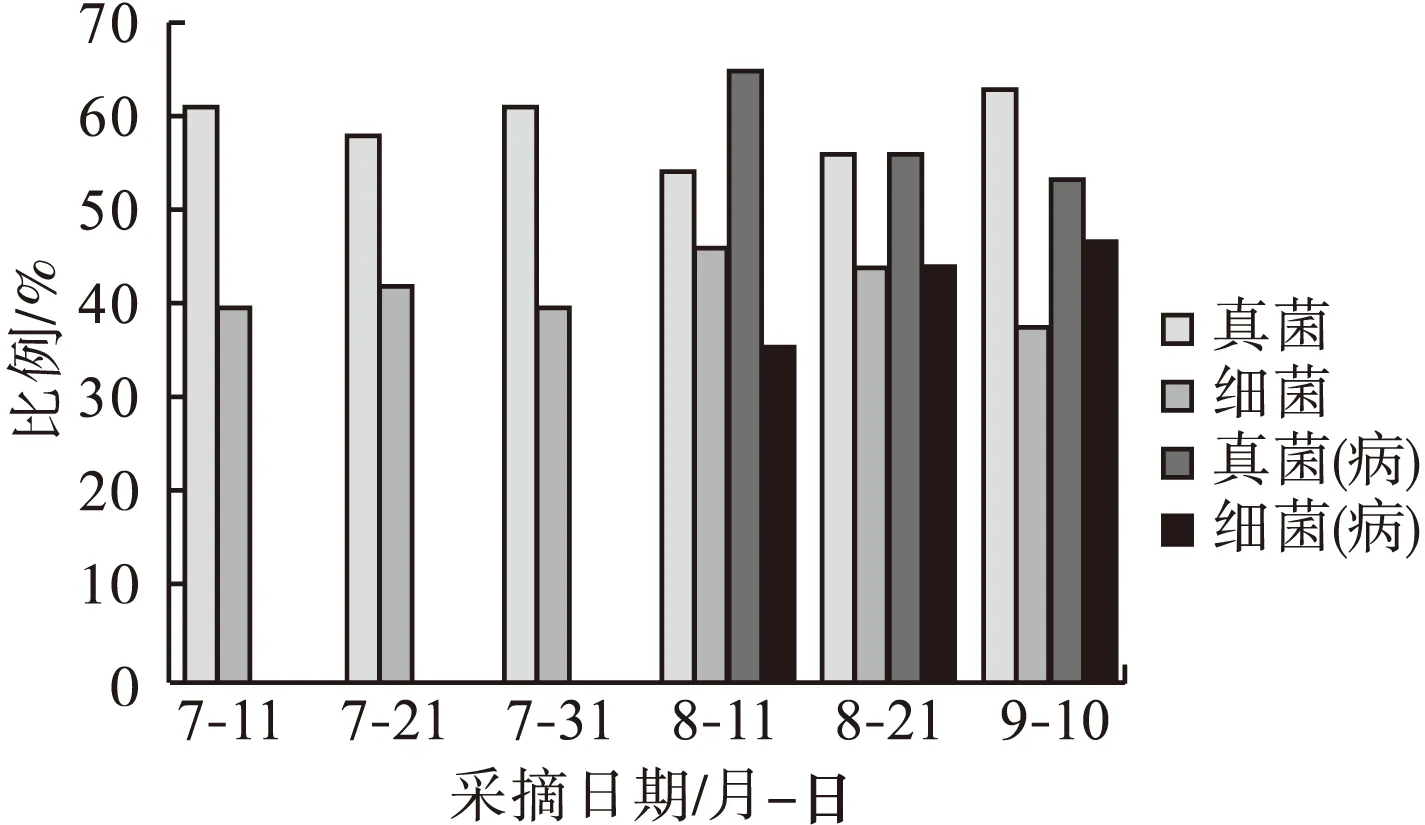
图1 不同取样期枣果实内真菌和细菌比例
白熟期时,部分果实开始表现缩果病症状,是缩果病发生的关键时期。在白熟期前后(7月31日—8月21日),健康果实和发病果实中真菌和细菌所占比例有很大不同。在健康果实中,真菌所占的比例由60.98%下降至54.23%后上升至55.93%,细菌则由39.02%上升到45.77%后下降到44.07%。在发病果实中,真菌占比由60.98%上升至64.60%,后下降至55.77%;细菌则由39.02%下降至35.40%,后上升至44.23%。通过对比发现缩果病的发生与白熟期前后真菌和细菌在微生物总量中所占的比例有很大关系。病果中,真菌在发病前期占据绝对的优势,大量繁殖。
从发病初期到盛期(8月11日—9月1日),发病果实中真菌所占比例由64.60%下降至53.47%,细菌则随病情加重而上升,由35.40%上升至46.53%,在此期间,健康果实中情形相反,真菌所占比例持续上升,54.23%~62.59%,而细菌则持续下降,45.77%下降至37.41%。在病果中,随着果实的发病,细菌大量增殖。
2.2 七月鲜枣果微生物真菌区系 经鉴定,初步确定了45个属的真菌,主要是半知菌和子囊菌类,其中交链孢属、茎点霉属的分布较为普遍,其次枝孢属、单格孢属、青霉属、曲霉属、镰刀菌属、盾壳霉属出现的几率也很高(表2)。
不同采摘期枣果真菌区系不同。成熟度较低(7月11—31日)的枣果中分离出了17个属,相对多度最高的4个属依次是交链孢属、茎点霉属、青霉属和曲霉属。成熟度较高(8月11—9月1日)的枣果中共分离出了43个属。有8个属的真菌属于优势类群,相对多度最高的4个属依次为交链孢属、茎点霉属、枝孢属和单格孢属,镰刀菌属、盾壳霉属、曲霉属和附球菌属次之。其中8月11日采集的健果中,交链孢属、茎点霉属、枝孢属和单格孢属为优势菌属。病果中交链孢属、茎点霉属、单格孢属、枝孢属和附球菌属是优势菌属。健果中除了交链孢属的相对多度为25.37%,高于病果中21.84%以外,其余3个优势菌属的相对多度均小于病果。8月21日采集的健果和病果中,交链孢属、茎点霉属、单格孢属、枝孢属和盾壳霉属是优势菌属。健果中只有枝孢属的相对多度14.14%,高于病果中的9.83%,其余4个属,均是病果中多。9月1日采集的健果中,交链孢属、茎点霉属、单格孢属、镰刀菌属、枝孢霉属、曲霉属和盾壳霉属均是优势菌属,病果中的优势菌属为交链孢属、茎点霉属、单格孢属、镰刀菌属、枝孢属和盾壳霉属,除了枝孢属的相对多度少于健果外,其余各属的相对多度值均是病果中高。随着果实的成熟,优势菌群逐渐增多。病果中优势菌属的相对多度普遍大于健果。

表2 不同采摘期枣果微生物菌属相对多度 %
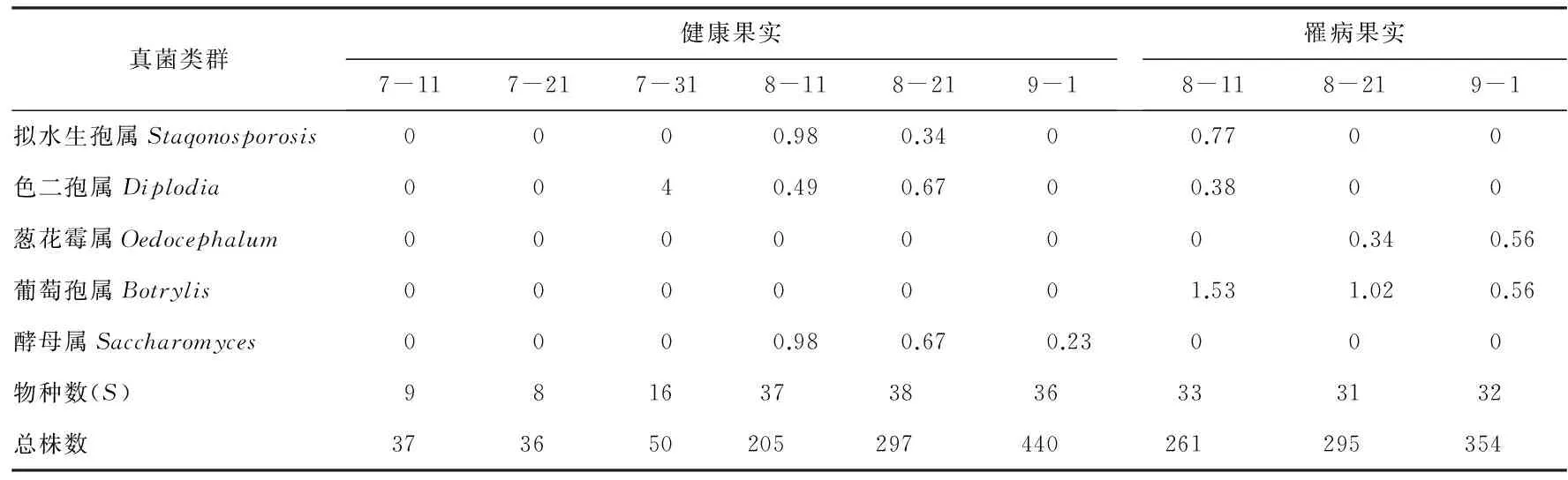
续表
根据不同采摘期的优势菌群的菌属水平结构图可以看出(图2),盾壳霉属、单格孢属和镰刀菌属的相对多度随着果实成熟整体上呈上升趋势,青霉属和曲霉属的相对多度随着果实的成熟整体上呈下降趋势。交链孢属、茎点霉属和枝孢属病原菌为枣果的弱寄生菌,在幼果期时就寄生在果实内,一旦条件成熟,便发展为致病菌。已报道的病原菌大都属于上述几类相对多度较高的真菌属。

图2 健果与病果中优势菌群菌属水平结构组成
2.3 七月鲜枣果微生物群落多样性 从图3和图4可以看出,随着果实的不断成熟,健康枣果内真菌的香侬—威纳指数和辛普森指数呈波动性增加的趋势。最后一次采样时,香侬—威纳指数和辛普森指数均达到高峰,分别是2.715和0.897;从图5可以看出均匀度指数呈现先下降后上升的趋势。其中第2次采集的枣果中,均匀度指数最高为0.887,白熟期(8月11日)时,数值下降至最低0.713,随后开始缓慢上升,9月1日采集的枣果中均匀度指数为0.758。从整体来看,成熟度低的枣果均匀度高于成熟度较高的枣果,白熟期枣果的均匀度最差。
病果中的香侬—威纳指数随着病情的加重,数值从2.483下降至2.275,辛普森指数则无明显变化;从均匀度指数的数值可以看出,病果中的均匀度指数也呈下降趋势。
果实出现病症后(8月11日至9月1日),香侬—威纳指数和辛普森指数均显示健康果实内的多样性高于发病果实内真菌群落的多样性。均匀度指数也显示出健康果实内真菌群落的均匀性高于发病果实内真菌群落的均匀性。
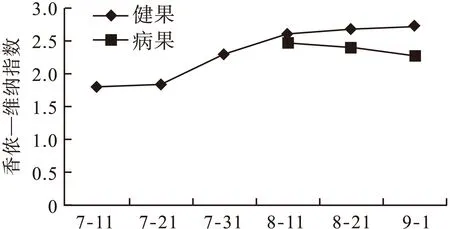
图3 不同采摘期枣果微生物群落香侬—威纳指数

图4 不同采摘期枣果微生物群落辛普森指数
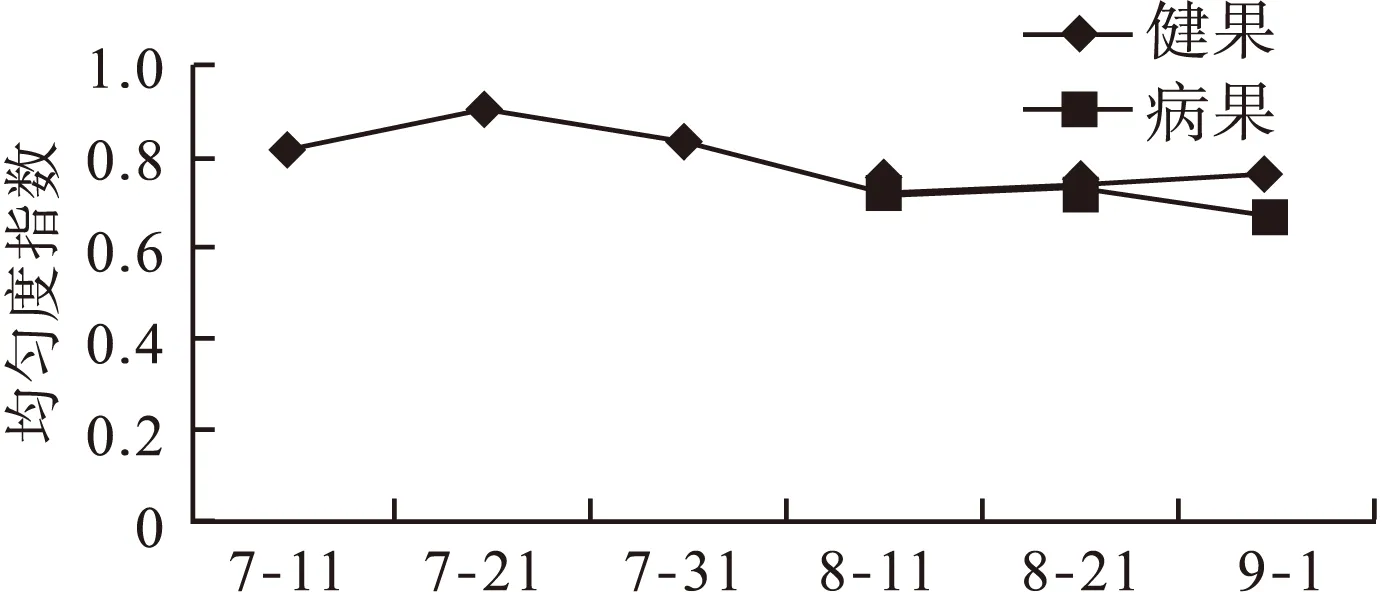
图5 不同采摘期枣果微生物群落均匀度指数
3 讨论
通过对健、病果实微生物株数分析发现,幼果期分离出的枣果微生物菌株数相对较少,白熟期后健果和病果中分离得到的菌株数量均呈迅速上升趋势,并且有部分果实开始出现症状。分析其原因可能是白熟期时,气温高,阳光充足,果实生长快,Vc、酚含量迅速下降,而可溶性糖含量增长速度加快,致使枣果系统抗性下降,为微生物的定殖、生长提供了良好条件,微生物数量在这段时期增长迅速。此时,更利于病菌的侵染,因此果实在白熟期开始发病。伴随着果实的成熟,微生物的数量越来越多,繁殖速度也越来越快,最后一次采样时,数量达到最多。而前3次所采集的样品,果实成熟度不足,果实果肉中含有过多的果酸、Vc、总酚等抑制了微生物的定殖生长,致使真菌、细菌的数量较低。因此白熟前期是防治缩果病的关键时期。
从不同的取样期分离到的真菌和细菌所占的比例来看,初期病果分离时,真菌占据绝对的优势,在发病中后期的病果中,细菌大量增殖,其增殖速率大于真菌。微生物种群分布由真菌型向细菌型转变。这也间接说明前期的发病与真菌有关,后期的发病与细菌有关。这与罗学平研究得出的观点一致[21]。
本研究从1440块枣果实组织块中共分离到了2079株真菌,其中2059株真菌经鉴定属于45个属。无论从数量上,还是种类上都表明七月鲜枣果具有丰富的真菌多样性。交链孢属、茎点霉属、枝孢属在果实不同时期均能分离到,具有生态稳定性。还有个别属真菌仅在某个时期分离到,如曲霉属、青霉孢属、镰刀菌属、附球菌属等,说明这些属的真菌属于机会菌,无稳定性。不同成熟度的枣果中分离出的优势菌属不同,可能是果实在不同发育时期外部和内部的环境不同,造成了不同的真菌类群的侵入和定殖。李冬霞[22]从六月鲜、灰枣、鸡心枣与九月青4个品种的果实中分离得到的优势菌属为交链孢属和茎点霉属,与本研究分离七月鲜品种一致,但总体上分离得到的真菌属的种类较少。杨忆[23]针对白熟期灰枣健康枣果可培养内生真菌菌群进行了分析和鉴定,其中分离到的交链孢属、茎点霉属以及镰刀菌属与本研究一致,而蠕孢属真菌、假尾孢属和间座壳属真菌,本研究未分离到。分析原因可能是地理环境和气候条件的不同影响植物内生菌的定殖[24]。这种差异也正反映了微生物对环境的适应性。
目前关于枣果实真菌多样性的研究还很少。本研究表明,果实发育中各个时期,真菌的多样性和均匀度有所不同,并且健果的多样性和均匀度均大于同时期的病果。据此可以推测健康果实内的真菌可能对潜在的病原菌存在竞争和拮抗作用,不利于病原菌发展成为优势菌属。群落的多样性与均匀度高说明群落内部组成成分与关系复杂,此时各种真菌的生长会受到其他真菌的限制与约束,同样,潜在的病原菌也不能在植物体内肆意扩张,其数量水平处于发病条件以下。当果实开始出现病害症状,真菌群落的多样性和均匀度随着果实的发病呈下降趋势,病原菌便有机会发展成了相对分离频率较高的真菌种类,本研究中果实发病后分离出的优势菌属的相对多度普遍大于健康果实内优势菌属的,而且分离出的优势菌属大部分是已报道过的病原菌。由于它们在群落中占据绝对优势,若进一步扩展,病害就会不断加重。
[1] 王长柱,高京草,刘振中.早熟大果型鲜食枣品种—七月鲜[J].园艺学报,2003,30(4):499.
[2] 王长柱,高京草.陕西枣产业发展面临的困境与思考[J].北方园艺,2013(12):181-184.
[3] 薛晓妮,宋晓斌,王长柱,等.枣树缩果病的发生规律研究[J].西北林学院学报,2012,27(4):172-176.
[4] 郑晓莲,齐秋锁,赵光耀,等.枣缩果病初侵染来源的初步研究[J].河北农业大学学报,1995,18(4):59 -63.
[5] 韩金声.北方果树病害及其防治[M].天津:天津科学技术出版社,1979:192 -194.
[6] 康绍兰,李兴红,邸垫平,等.枣铁皮病发病规律的研究[J].河北农业大学学报,1997,20(增刊):15 -19.
[7] 张朝红,刘孟军,周俊义,等.枣缩果病研究进展[J].河北林果研究,2008,23(1):62-65,81.
[8] 刘惠珍.中国主要树种病原名录[M].北京:中国林科院林业研究所,1982.
[9] 束庆龙,刘世骐.安徽枣树病害调查初报[J].安徽农学院学报,1990,34(1):37-41.
[10]曲俭绪,沈瑞祥,李志清,等.枣黑腐病病原研究[J].森林病虫通讯,1992,11(2):1-4.
[11]郑晓莲,赵光跃,茹正川,等.枣缩果病病原诊断初报[J].植物保护,1995(2):19-21.
[12]康绍兰,邸垫平,李兴红,等.枣铁皮病病原鉴定[J].植物病理学报,1998,44(2):70-76.
[13]徐祥彬,赖童飞,景云飞,等.山西壶瓶枣缩果病病原菌分离和鉴定[J].植物病理学报,2009,55(3):225-230.
[14]李冬霞,张猛,陈谟林,等.河南省枣缩果病病原的分离鉴定[C].中国植物病理学会2010年学术年会论文集.北京:中国农业科学技术出版社,2010:217.
[15]刘元荣,朱林元,姜昆,等.枣树新病害缩果病防治研究[J].河南农业科学,1988,17(10):19-20.
[16]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:193-194.
[17]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:129-136.
[18]WHITE TJ,BRUNS T,LEE S,TAYLOR J.Amplification and direct sequencing of fungal riboso mal RNA genes for phylogenetics[M].INNIS MA,GELFAND DH,SNINSKY JJ,et al.PCR protocols:a guide to methods and applications.San Diego.Academic Press,1990:315-322.
[19]CAMARGO JA .Can dominance influence stability in competitive interactions[J] Oikos,1992,64:605-609.
[20]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:367-386.
[21]罗学平.枣缩果病防治试验初报[J].落叶果树,2003(6):51 -52.
[22]李冬霞,武海燕,张猛,等.枣树内生真菌的分离、鉴定及其多样性分析[J].果树学报,2010,27(6):975-979.
[23]杨忆,张猛,武海燕,等.新郑灰枣枣果内生真菌的分离和鉴定[J].菌物学报,2015,34(1):164-168.
[24]GILLER K,BEARE M,LAVELLE P,et al.Agricultural intensification,soil biodiversity and agroecosystem function[J].Applied Soil Ecology,1997,6(1):3-16.
(责任编辑 杨静莉)
DiversityanalysisofmicrobialcommunityinZiziphusjujubesufferedfromjujubeshrinkdisease/
YANG Huixin,et al,
(College of Forestry,Northwest Aamp; F University,Yangling,Shanxi 712100,China)
The aim of the study is to learn the microbial community diversity in both healthy fruit ofZiziphusjujubevar.qiyuexianand infected fruit of jujube shrink disease and preliminarily reveal the correlation between the microbial community and the disease.The result showed that 58.06%-60.98% of the microbes isolated in the jujube fruit was fungi,about 20% more than bacteria,and actinomycetes were not isolated.At the stage of young fruit,there were four genera with the highest relative abundance which were orderlyAlternaria,Phoma,PenicilliumandAspergillus.When the fruit entered the white-ripening stage,the dominant genera had risen to eight.The four genera with the highest relative abundance wmzh were orderlyAlternaria,Phoma,CladosporiumandUlocladium,Fusarium,ConiothyriumandAspergilluswere common at the stage.The relative abundance of the most dominant genera in diseased fruit was larger than that of healthy fruit.Fungi rate of microorganism on diseased fruit showed a declined tendency while the bacteria showed a decrease tendency.In the healthy fruit,the reverse happened.Both richness index and evenness index of fungi community in healthy fruit were larger than those in diseased fruit.With the fruit ripening,this trend was becoming more obvious.
Ziziphusjujubevar.qiyuexian;jujube fruit shrink disease;microbial diversity of fruite
2016-04-06
林业公益性行业科研专项“枣树重大病虫害防治及优质商品枣安全生产技术研究”(201104017);陕西省国际统筹项目(2013KTZB02-03-01)
杨卉芯( 1989—),女,河南省许昌市人,硕士研究生,研究方向:植物病理学,E-mail:598053148@qq.com
宋晓斌,副研究员,研究方向:森林病害及其防治,E-mail:sxb88@nwsuaf.edu.cn。
S763.1
A
1671-0886(2017)01-0029-07
