支气管肺泡灌洗液对免疫功能正常肺曲霉病患者的早期诊断价值
2017-12-14唐安珏宋卫东徐平
唐安珏,宋卫东,徐平
(北京大学深圳医院 呼吸内科,广东 深圳 518000)
支气管肺泡灌洗液对免疫功能正常肺曲霉病患者的早期诊断价值
唐安珏,宋卫东,徐平
(北京大学深圳医院 呼吸内科,广东 深圳 518000)
目的探讨支气管肺泡灌洗液(BALF)对免疫功能正常患者肺曲霉病的早期诊断价值,并了解支气管肺泡灌洗术操作方法对半乳甘露聚糖(GM)试验的影响,初步探讨建立统一的检测肺泡灌洗液GM试验的支气管肺泡灌洗术及取样操作方法与流程。方法对2016年1月-2017年2月因肺部感染在该院呼吸内科诊治的患者84例,进行BALF收集。按照收集灌洗液顺序前后收集2管送检GM实验,根据结果病例组及对照组内均分为GM1及GM2亚组。根据诊断标准及分级制度,将患者分为病例组22例(包括确诊2例、临床诊断7例、拟诊13例)以及对照组62例。统计并分析病例组和对照组的GM试验结果。结果GM1与GM2组检测的GM-I值有明显差异,且GM1的I值平均秩较高(Z=-3.98,P=0.000)。BALF-GM1界限值0.60,诊断效率最高。敏感度86.36%,特异度93.55%,阳性预测值82.61%,阴性预测值95.08%。BALFGM1的曲线下面积(0.941)明显高于BALF-GM2(0.798)。结论支气管肺泡灌洗术中收集BALF的操作顺序对BALF-GM试验I值大小存在影响,送检第1管肺泡灌洗液BALF-GM试验对肺曲霉病诊断具有更高的应用价值。
支气管镜检查;支气管肺泡灌洗液;肺曲霉病;诊断
肺曲霉病当前不仅局限于免疫缺陷的患者,重症监护室患者、糖尿病、气道器质性病变如支气管扩张、慢性阻塞性肺疾病终末期等容易导致曲霉定值的患者等发病率亦有上升[1]。肺曲霉病,尤其以侵袭性肺曲霉病(invasive pulmonry aspergillosis,IPA)患者为主,在临床发病中普遍缺乏特异学症状,为后续诊治工作带来巨大挑战。其中作为曲霉抗原标志物检测方法之一,肺泡灌洗液GM试验具有便捷、经济以及早期诊断等优势。但当今对于GM试验最佳临界值(cutoff)的设定存在争议,影响了其在临床工作中的诊断效率,其中重要原因在于收集肺泡灌洗液可溶性成分检测的纤维支气管镜操作欠缺规范及统一标准。本研究针对因肺部感染就诊于北京大学深圳医院的84例患者行纤维支气管术,通过提前设定支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)相关操作,对BALF进行GM检测,评价BALF操作及BALF-GM对肺曲霉病诊断的应用价值。
1 资料与方法
1.1 一般资料
选取2016年1月-2017年2月因肺部感染就诊于北京大学深圳医院呼吸内科的84例患者为研究对象,患者均符合以下条件:①患者有血液肿瘤、肿瘤放化疗、长期使用激素类或细胞毒性药物的疾病(包括慢性阻塞性肺疾病、糖尿病、结核、肝或肾衰竭等)或长期广泛暴露于曲霉菌孢子环境,经影像学检查发现存在肺部病变;②患者无粒细胞缺乏;③严重心脑血管基础性疾病;④患者已自愿签署支气管镜检查知情同意书;⑤研究方案已通过医院伦理委员会决定。
1.2 分组
纳入的84例患者中,女43例,男41例,根据中国侵袭性真菌感染工作组以及中华内科杂志编辑委员会制定的标准[2-3],联合2008年EORTC/MSG[1]修订的诊断标准及分级,对84例患者进行诊断,涵盖确诊、临床诊断、拟诊断及非肺曲霉病各诊断层次。将确诊、临床诊断及拟诊断的患者归入病例组(n=22,包括确诊2例、临床诊断7例、拟诊13例),非肺曲霉病的患者作为对照组(n=62)。将患者一般情况差异无统计学意义(P>0.05),具有可比性。见表1。
1.3 方法
1.3.1 标本采集 患者完善高分辨胸部CT检查,发现肺部病变位置,在予抗真菌药物治疗前按照支气管镜手术进行相关操作,包括术前准备、局部麻醉、吸氧、监测术中生命体征等内容,纤维支气管镜经鼻后嵌入病变部位或亚段支气管检查,第1次予注入37℃的灭菌生理盐水20 ml,吸取前端部分含痰原液提取5 ml送检病原学检查后,进行灌洗液回收送检第1次半乳甘露聚糖(galactomannan,GM)实验;而后分别1或2次等分予注入灭菌生理盐水20 ml对病变部位或亚段支气管进行支气管肺泡灌洗并回收灌洗液,送检第2次GM实验,根据患者病情需要按需送检液基细胞学检查等,灌洗液总回收率≥50.00%。根据2次GM实验检测结果将病例组以及对照组同时分为GM1、GM2亚组;同时,依患者病情变化及高分辨率CT检查情况,进行肺组织检查及病理学检查。
1.3.2 GM检测方法 采用微孔板酶免夹心法,运用针对曲霉GM的抗体,包被微孔板用以与血清及BALF的抗原结合,并检测致敏微孔板上结合的抗原。严格按照曲霉菌GM试验试剂盒说明书操作步骤,收集并记录样本中的吸光度(absorbance)即OD值,计算出GM-I值。每次实验均进行阴性对照和阳性对照,评估检测结果。
1.4 统计学方法
所有数据均运用统计学软件SPSS 22.0软件进行分析,对资料进行正态性检验,计量资料采用均数±标准差(±s)描述,计数资料采用百分率或例描述。两组患者的年龄、住院天数、血红蛋白、总蛋白及白蛋白用t检验;两组患者性别、基础疾病谱运用χ²检验或Fisher确切概率法检验;病例组的GM1与GM2亚组采用配对(Wilcoxon)符号秩和检验,对照组的GM1与GM2亚组采用配对(Wilcoxon)符号秩和检验;病例组与对照组GM1组比较采用Mann-WhitneyU检验,病例组与对照组GM2组比较采用Mann-WhitneyU检验。通过受试者工作特征曲线(receiver operating characteristic curve,ROC),求出BALF-GM最佳界值。以P<0.05为差异有统计学意义。

表 1 两组患者一般情况比较Table 1 Comparison of general situation between the two groups
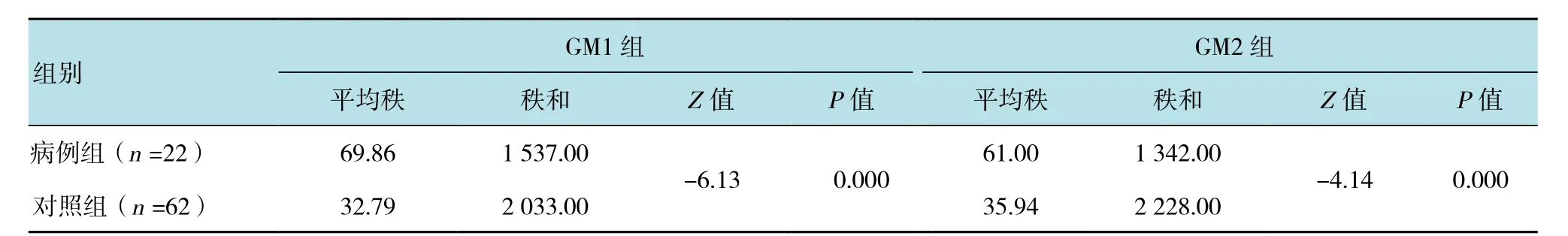
表2 两组GM1和GM2的I值比较Table 2 Comparisons of the I value of GM1 and GM2 between the two groups

表3 曲线下面积Table 3 Area under the curve
2 结果
2.1 BALF-GM值之间的比较
配对秩和检验提示病例组GM1组的I值高于病例组GM2组,对照组GM1组I值高于对照组GM2组,差异均有统计学意义(Z=-3.98,P=0.000;Z=-2.32,P=0.020);Mann-WhitneyU检验提示病例组GM1组GM试验的I值高于对照组GM1组,病例组GM2组的I值高于对照组GM2组,差异均有统计学意义(均P=0.000)。见表 2。
2.2 BALF-GM值之间的比较
运用尤登指数以及曲线下面积综合评估两管GM检测的指标,提示当第1管GM界值≥0.60诊断IPA的效率达最高,第2管GM界值≥0.19诊断效率最高。BALF-GM1的曲线下面积(0.941)明显高于BALFGM2(0.798)。见表3、4和附图。
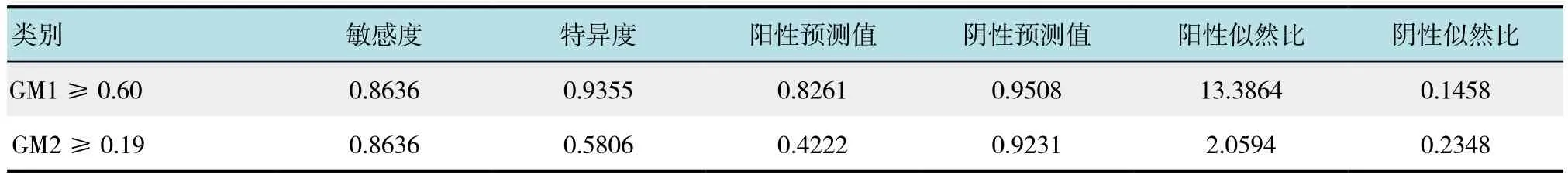
表4 第1管及第2管BALF-GM诊断效率评估Table 4 The efficiency of BALF-GM1 and BALF-GM2 in the diagnostic of IPA
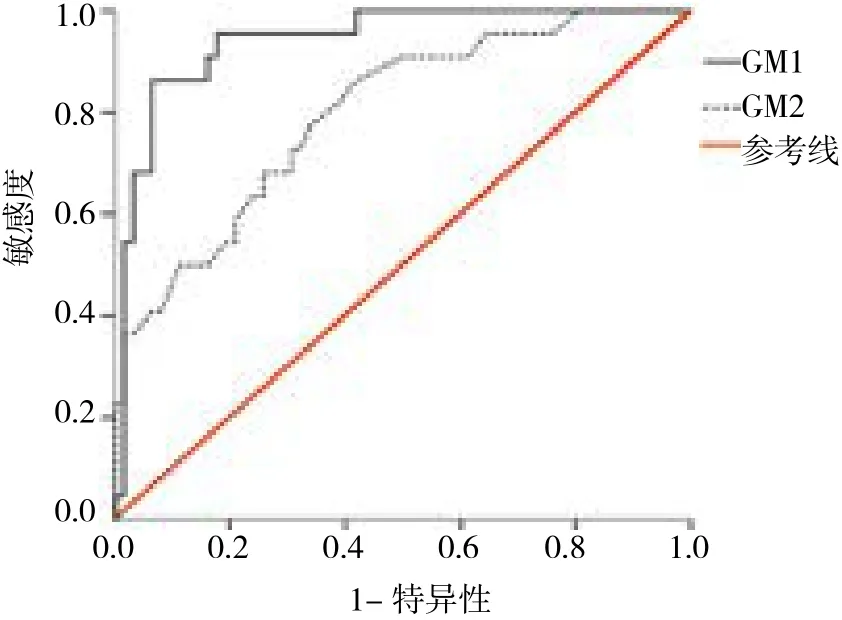
附图 BALF-GM1、GM2诊断IPA的ROC曲线Attached fig. The ROC curve of BALG-GM1 and BALGGM2 for diagnosis of invasive pulmonary aspergillosis
3 讨论
肺曲霉病病程早期缺乏典型的症状、体征等临床表现,特异的影像学表现较少,早期难以鉴别。传统的病原微生物培养阳性率低下,且培养耗时周期长;病例组织学虽然为金标准,但组织取材、耗时及费用都局限了其诊断作用。目前抗原标志物检测的技术,在辅助诊断肺曲霉病上得到认可。GM作为曲霉特有的生物标记物,血清、BALF及脑脊液的GM检测已纳入肺曲霉病诊断中的微生物标准[1]。
美国胸科协会以及我国的支气管灌洗细胞分析实践指南[4-5]指出,灌洗的总量为100~300 ml。但2个指南中并未对BALF可溶性成分检测的相关性进行规范。当前不同操作者在进行BALF-GM试验课题研究时用于灌洗的生理盐水容量都有差异[6-8]。从疾病病理改变角度考虑,IPA与间质性肺疾病(interstitial lung disease,ILD)之间存在明显差异。尤其是无明显粒缺的IPA患者以气道侵袭性曲霉菌病多见[9],大容量的肺泡灌洗液似乎并不适用。有研究显示支气管肺泡灌洗后常见的不良反应中就有发热[10-11],而即使是正常成人,术后检测中性粒细胞、C反应蛋白等都有升高趋势,可诱发多种急性期反应[12]。而IPA易患人群多为免疫功能障碍甚至缺陷的患者,大量的灌洗液有将气道分泌物不除外霉菌及定值菌等播散到远处,引起感染或炎症加重的风险。另外,研究显示[13]小剂量灌洗量对ICU患者具有安全性。当前缺乏对侵袭性IPA患者行支气管灌洗液术后不良反应以及支气管灌洗液行可溶性成分检验灌洗容积的研究,或许可以围绕当前关于BALF-GM诊断的研究进行Meta分析,对灌洗容积与其影响进行探讨。根据上述小剂量的支气管肺泡灌洗量,本实验中制定了用于灌洗的生理盐水容积为60 ml进行实验研究。
ZOU等[14]一项系统性回顾及Meta分析指出,当I的cut-off值为0.50时,BALF-GM的敏感度达0.8700,特异度0.8900,诊断效率较血清GM具有优势。而有文献研究则考虑当cut-off值为0.80时,诊断效益最高[4]。不同实验对于GM最佳界值和敏感度等评价诊断效率均存在区别,可能与BALF操作及收集、实验人群选择的不同相关。本实验通过支气管肺泡灌洗操作中前后收集2管肺泡灌洗液行GM实验,对比显示第1管与第2管GM实验所测I值存在差异性。而且根据ROC曲线,第1管与第2管收集的BALF,其计算出GM最佳界值以及敏感度、特异度均存在差异,且结果提示第1管BALF检测GM更有价值,I≥0.60,敏感度86.36%,特异度93.55%,结果与ZOU等[14]的Meta分析结果相近。2次GM实验I值差异,考虑可能是因为灌洗液第1次冲刷回收,收集BALF内含有的GM较高,故检出率较第2管高。而其他研究者的实验未曾提及BALF回收后先后送检的内容,可能没有注意将第1管送检GM,造成彼此实验结果存在差异。本实验制定了60 ml生理盐水灌洗容量,而D’HAESE等[7]为40 ml,其实验得出I值最佳界值为0.80,敏感度达86.40%,特异度达90.70%,诊断效价与本实验接近,由此推测I值与灌洗量存在相关性。本实验提示稀释问题可能影响GM检测的I值,而灌洗量不同、回收量的波动和肺泡上皮通透性等原因,均可能使灌洗液稀释度不尽相同,所以标准化的操作流程可以使GM检测更具可比性,增加病原体的检出率,提高感染性疾病的诊治成功率,更便于同行间数据及病例的相互交流及经验分享。此外,回顾本实验进行的研究对象均为非粒缺患者,结果提示BALF-GM对于非粒缺、免疫功能轻度下降甚至免疫功能正常的患者诊断IPA具有辅助意义。与其他文献针对血液肿瘤患者进行的研究对比,GM的最佳界限值与诊断效率均有一定差异[6,15]。当前肺泡灌洗液GM试验相关研究针对的对象主要分为血液肿瘤与非血液肿瘤患者[16-17]、造血干细胞移植(hemapoietic stem cell transplantation,HSCT)以及实体器官移植患者[18]、粒缺与非粒缺患者[19]、重症监护室患者以及慢性阻塞性肺疾病[8,20]四大部分,结果都有一定差异,推测GM试验可能需要根据不同的基础疾病或免疫力等而设定不同的最佳界限值,这方面可能需要更多的研究去证实。
目前关于肺泡灌洗液GM实验的研究有很多,但关于BALF操作对其诊断产生影响的相关资料甚少,目前暂无肺泡灌洗液GM试验容积相关的Meta分析。本研究通过对支气管肺泡灌洗液的操作流程研究,尝试对关于诊断IPA需要进行肺泡灌洗液GM试验的支气管镜操作流程作出自己的建议。对于灌洗的总容积控制在60~80 ml,均等分析灌洗,第1次灌洗吸出前端部分含痰原液送检微生物检查后,将第1次支气管肺泡灌洗液收集送检GM试验,随后根据病情需要送检微生物、液基细胞学等检查。
虽然本实验限定了灌洗的容积及收集灌洗液的前后顺序,回收率保证≥50.00%,但患者的气道情况、肺泡上皮通透性等独立因素,使回收的BALF容积不尽相同,稀释度较难比较,也可能对检测的结果造成差异。
综上所述,BALF-GM是诊断肺曲霉病有效的辅助手段。而肺泡灌洗液收集等支气管镜操作对诊断肺曲霉病有影响因素,收集BALF过程中应优先选取样本送检GM检测。用于灌洗液的生理盐水容积对检测结果的影响、BALF收集过程的多个细节,还需要更多样本及深入的临床试验去验证。
[1]PAUW B D, WALSH T J, DONNELLY J P, et al. Revised definitions of invasive fungal disease from the European organization for research and treatment of cancer/invasive fungal infections cooperative group and the national institute of allergy and infectious diseases mycoses study group (EORTC/MSG)consensus group[J]. Clin Infect Dis, 2008, 46(12): 1813-1821.
[2]中华内科杂志编辑委员会. 侵袭性肺部真菌感染的诊断标准与治疗原则(草案)[J]. 中华内科杂志, 2006, 45(8): 697-700.
[2]Chinese Journal of Internal Medicine Editorial Committee. The therapy principle and diagnostic standard of invasive pulmonary fungal infection (Draft)[J]. Chin J Intern Med, 2006, 45(8): 697-700. Chinese
[3]中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第四次修订版)[J]. 中华内科杂志,2013, 52(8): 704-709.
[3]The Gourp of Chinese Invasive fungal infection. The therapy principle and diagnosis standard of invasive pulmonary fungal infections in hematologic diseases/malignancy (4th Edition) [J].Chin J Intern Med, 2013, 52(8): 704-709. Chinese
[4]中华医学会呼吸病学分会. 支气管肺泡灌洗液细胞学检测技术规范(草案)[J]. 中华结核和呼吸杂志, 2002, 25(7): 390-391.
[4]Respiratory Society of Chinese Medical Association. Standards for cytology test of bronchoalveolar lavage fluid (Draft)[J]. Chin J Tuberc Respir Dis, 2002, 25(7): 390-391. Chinese
[5]MEYER K C, RAGHU G, BAUGHMAN R P, et al. An official American thoracic society clinical practice guideline: the clinical utility of bronchoalveolar lavage cellular analysis in interstitial lung disease[J]. Am J Respir Crit Care Med, 2012, 185(9): 1004-1014.
[6]MAERTENS J, MAERTENS V, THEUNISSEN K, et al.Bronchoalveolar lavage fluid galactomannan for the diagnosis of invasive pulmonary aspergillosis in patients with hematologic diseases[J]. Clin Infect Dis, 2009, 49(11): 1688-1693.
[7]D’HAESE J, THEUNISSEN K, VERMEULEN E, et al. Detection of galactomannan in bronchoalveolar lavage fluid samples of patients at risk for invasive pulmonary aspergillosis: analytical and clinical validity[J]. J Clin Microbiol, 2012, 50(4): 1258-1263.
[8]HE H, DING L, SUN B, et al. Role of galactomannan determinations in bronchoalveolar lavage fluid samples from critically ill patients with chronic obstructive pulmonary disease for the diagnosis of invasive pulmonary aspergillosis: a prospective study[J]. Crit Care,2012, 16(4): R138.
[9]HOPE W W, WALSH T J, DENNING D W. The invasive and saprophytic syndromes due to Aspergillus spp[J]. Med Mycol,2005, 43(Suppl 1): S207-S238.
[10]VEGA-BRICEÑO L E, HOLMGREN N L, BERTRAND P, et al. Utility of bronchoalveolar lavage in immunocompromised children: diagnostic yield and complications[J]. Arch Bronconeumol, 2004, 40(12): 570-574.
[11]WAINWRIGHT C E, GRIMWOOD K, CARLIN J B, et al.Safety of bronchoalveolar lavage in young children with cystic fibrosis[J]. Pediatr Pulmonol, 2008, 43(10): 965-972.
[12]HUANG Y C, BASSETT M A, LEVIN D, et al. Acute phase reaction in healthy volunteers after bronchoscopy with lavage[J].Chest, 2006, 129(6): 1565-1569.
[13]ANDRESEN M, MERCADO M, ZAPATA M, et al. Mini bronchoalveolar lavage in patients with severe respiratory failure[J]. Rev Med Chil, 2011, 139(10): 1292-1297.
[14]ZOU M X, TANG L H, ZHAO S S, et al. Systematic review and meta-analysis of detecting galactomannan in bronchoalveolar lavage fluid for diagnosing invasive aspergillosis[J]. PLoS One,2012, 7(8): e43347.
[15]AFFOLTER K, TAMM M, JAHN K, et al. Galactomannan in bronchoalveolar lavage for diagnosing invasive fungal disease[J].Am J Respir Crit Care Med, 2014, 190(3): 309-317.
[16]KU N S, HAN S H, CHOI J Y, et al. Diagnostic value of the serum galactomannan assay for invasive aspergillosis: it is less useful in non-haematological patients[J]. Scand J Infect Dis, 2012, 44(8):600-604.
[17]NUCCI M, NOUÉR S A, CAPPONE D, et al. Early diagnosis of invasive pulmonary aspergillosis in hematologic patients: an opportunity to improve the outcome[J]. Haematologica, 2013,98(11): 1657-1660.
[18]DE MOL M, DE JONGSTE J C, VAN WESTREENEN M, et al.Diagnosis of invasive pulmonary aspergillosis in children with bronchoalveolar lavage galactomannan[J]. Pediatr Pulmonol,2013, 48(8): 789-796.
[19]BROWNBACK K R, PITTS L R, SIMPSON S Q. Utility of galactomannan antigen detection in bronchoalveolar lavage fluid in immunocompromised patients[J]. Mycoses, 2013, 56(5): 552-558.
[20]ZHANG X B, CHEN G P, LIN Q C, et al. Bronchoalveolar lavage fluid galactomannan detection for diagnosis of invasive pulmonary aspergillosis in chronic obstructive pulmonary disease[J]. Med Mycol, 2013, 51(7): 688-695.
Early diagnostic value of bronchoalveolar lavage for pulmonary aspergillosis in non-immunocompromised patients
An-jue Tang, Wei-dong Song, Ping Xu
(Department of Respiratory Medicine, Shenzhen Hospital of Peking University,Shenzhen, Guangdong 518000, China)
ObjectiveTo investigate the early diagnostic value of bronchoalveolar lavage for pulmonary aspergillosis in non-immunocompromised patients. The GM absorbances of recycled bronchoalveolar lavage fluid in different orders were compared, in order to estabilsh a uniform of broncholaveolar lavage in GM test.MethodsWe mainly focused on the patients (84 cases) confirmed as pulmonary infection by HRCT chest imageological examination from January 2016 to February 2017. They underwent the bronchoalveolar lavage before empirical or pathogenic antifungal therapy. Meanwhile, the lavage was collected in order of the first and the second tube. Then,BALF-GM test was performed. The GM absorbance (A) and I value of bronchoalveolar lavage fluid were detected by ELISA method. The GM test result of the first tube of bronchoalveolar lavage fluid was included into GM1 group and the GM test result of the second tube of bronchoalveolar lavage fluid was included into GM2 group. According to the standards, the patients were divided into case group (proven 2 cases, probable 7 cases, possible 13 cases) and non-IPA group (62 cases). The GM test diagnostic efficiency of bronchoalveolar lavage fluid collected in different orders were statistically analyzed between the case group and control group.ResultsThe GM-I values showed significant difference between GM1 and GM2 groups (Z= -3.98,P= 0.000). the average rank I value of BALFGM1 (1.78 ± 1.71) was significantly higher than the BALF-GM2. According to the ROC curve, the optimal cutoff of BALF-GM1 was 0.6, the sensitivity was 86.36%, the specificity was 93.55%, the positive predictive value was 82.61% and the negative predictive value was 95.08%. The area under the curve of BALF- GM1 (0.941) was significantly higher than that of BALF-GM2 (0.798), indicating that the diagnostic efficiency of BALF-GM1 was higher.ConclusionThe operation sequence of collecting bronchoalveolar lavage could affect the I value of BALFGM test. The diagnostic efficiency of BALF-GM test result of the first tube of bronchoalveolar lavage fluid was higher and had the higher application value in the diagnosis of pulmonary aspergillosis.
bronchoscopy; bronchoalveolar lavage fluid; pulmonary aspergillosis; diagnosis
R563
A
10.3969/j.issn.1007-1989.2017.11.006
1007-1989(2017)11-0024-06
2017-03-29
徐平,E-mail:799721206@qq.com
(曾文军 编辑)
