AAS与ICP-MS法测定花生中镉含量的对比研究
2017-12-13黄露邓书健刘天鹏德阳市食品药品安全检验检测中心四川德阳618000
黄露,邓书健,刘天鹏(德阳市食品药品安全检验检测中心,四川德阳618000)
AAS与ICP-MS法测定花生中镉含量的对比研究
黄露,邓书健,刘天鹏(德阳市食品药品安全检验检测中心,四川德阳618000)
使用石墨炉原子吸收(Graphite furnace atomic absorption spectrometry,AAS)和电感耦合等离子体质谱(Inductively coupled plasma mass spectrometry,ICP-MS)分别测定5批花生中镉的含量,将测得的结果数据进行对比分析,为花生中镉含量的测定提供实用可靠的检测方法。两种方法测得的花生中镉含量结果相对平均偏差均小于10%;线性范围:石墨炉原子吸收为0~5 ng/mL,ICP-MS为0~50 ng/mL;检出限:石墨炉原子吸收为0.02 ng/mL,ICP-MS为0.004ng/mL;回收率:石墨炉原子吸收为91.8%~105.7%,ICP-MS为89.8%~95.3%;精密度:石墨炉原子吸收为2.27%,ICP-MS为1.70%。结果表明,两种方法都可以满足对花生中镉含量进行测定,对于同一来源的样品消解液,可以同时采用石墨炉原子吸收和电感耦合等离子体质谱进行测定,均可以保证测定数据的准确性。
花生;镉;石墨炉原子吸收法;电感耦合等离子体质谱法
花生是我国主要的油料作物之一,是食用油脂和蛋白质的主要来源,中国的花生产量居世界首位[1-3]。花生营养丰富,蛋白质含量高,花生中蛋白质属于优质蛋白,含人体必需的8种氨基酸,人体吸收利用率高,花生中脂肪大部分是亚油酸和油酸等不饱和脂肪酸,维生素含量丰富。常吃花生能养生,可以提高智力,促进细胞生长发育,美容,抗老化,防早衰,预防心血管等疾病[4-13]。现目前我国花生面临的主要问题是黄曲霉毒素污染、农药残留、镉含量超标等问题[14],我国花生质量出现问题也对老百姓的健康产生影响[15]。镉具有很长的半衰期,长期食用镉含量超标的花生,主要积聚在肝脏及肾脏,会对人体造成潜伏性的损害[16],还会引起骨骼变形,造成青少年生长发育迟缓[17]。
可用于镉元素的检测主要有石墨炉原子吸收光度法、火焰原子吸收光度法、示波极谱法、电感耦合等离子体质谱法、紫外分光光度法等检测方法。火焰原子吸收光度法具有操作简单、精度高、背景干扰少等优点,但测定过程中消耗样液多、雾化率低、气体稀释镉原子等缺点。示波极谱法具有灵敏度高、响应时间短等优点,但稳定性差。紫外分光光度法能快速测定、仪器简单普及率高,但干扰多,选择性较差。石墨炉原子吸收光度法测定镉灵敏度比火焰法高3个~4个数量级,样液用量少,具有原子化率高、灵敏度高等优点,适于测定镉含量低或试样量少的样品。电感耦合等离子体质谱法灵敏度高,选择性好,能同时分析多种元素[18-20]。目前食品检测机构进行镉含量测定的方法主要有2种,石墨炉原子吸收光度法(AAS)与电感耦合等离子体质谱法(ICP-MS)。对于食品中镉的测定,国标GB 5009.15-2014《食品安全国家标准食品中镉的测定》规定使用石墨炉原子吸收光度法进行测定,而电感耦合等离子体质谱法(ICP-MS)因为灵敏度高,线性范围宽,检出限低,精密度好,可同时检测多种元素等优点,被广泛的用到各种金属元素的检测中[21-25]。微波消解由于样品处理时间短、使用试剂少等优点被广泛的用于各种金属元素样品前处理[26-27]。
本试验结合石墨炉原子吸收光度法与电感耦合等离子体质谱法,采用微波消解对5批花生样品进行前处理,同时将样品液分别用石墨炉原子吸收光度法与电感耦合等离子体质谱法进行上机测定,将2种方法测得的结果数据进行对比分析,从而为花生中镉含量的测定提供实用可靠的检测方法,保证测定数据的准确性。
1 材料与方法
1.1 材料与仪器
本试验共采购5批带壳炒货花生样品:德阳市辖区内超市及小食杂店(采用随机方式进行样品采购)。
硝酸(优级纯):德国CNW公司;调谐液(1 μg/L Ce、Co、Li、Mg等)、Ge、In、Bi内标(1 000 μg/mL):Agilent Technologies公司;镉标准溶液(1 000 μg/mL):国家有色金属及电子材料分析测试中心;试验用水为超纯水(18.2 MΩ·cm)。所用的消解管、量取定容等器具均需以50%的硝酸溶液浸泡24 h以上,用水反复冲洗,最后用去离子水冲洗干净,晾干待用。
HLS-105多功能破壁料理机:海力士公司产品;FA2004B电子天平:METTLER TOLEDO公司产品;微MARSXPRESS波消解仪:美国CEM公司产品;BHW09C赶酸器:美国博通公司产品;AA900T原子吸收分光光度计:美国PE公司产品;7900电感耦合等离子体质谱仪:美国安捷伦公司产品;Synergy超纯水系统:密里博公司产品。
1.2 方法
1.2.1 样品制备
将花生样品去壳,将可食用部位混匀粉碎,过50目筛后装入洁净的装样容器中,将过筛样品手动振摇混匀,以保证样品具有代表性。
1.2.2 样液制备
称粉碎混匀后的花生样品0.3 g~0.4 g(精确到0.000 1 g),置消解管中,加硝酸8 mL,放入微波消解仪中,按照设定好的用于镉元素测定的微波消解程序(见表1)进行样品消解。仪器显示温度为90℃以下时,可将消解管取出放至室温,于通风厨内拧开外盖,赶酸器中140℃挥酸至0.5 mL~1 mL,放至室温,用去离子水少量多次冲洗消解管,并将洗液转入50 mL聚乙烯容量瓶,用去离子水定容至刻度,摇匀,待上机分析,同时做试剂空白。

表1 消解程序Table 1 Digestion program
1.2.3 加标样液制备
选同一花生样品,分别加入镉标准溶液,使加标后各浓度点分别为2.5、5.0、10.0 ng/mL,在这三个浓度分别做2个平行样,分别用AAS与ICP-MS测定其样品本底值,以及加标后样品中镉含量,并计算加标回收率。
1.3 石墨炉原子吸收分光光度法
1.3.1 AAS仪器参数
波长:228.8 nm;狭缝宽度:0.7 nm;灯电流:5 mA;进样体积:20 μL;载气类型:氩气;进样方式:自动进样;石墨炉程序见表2。
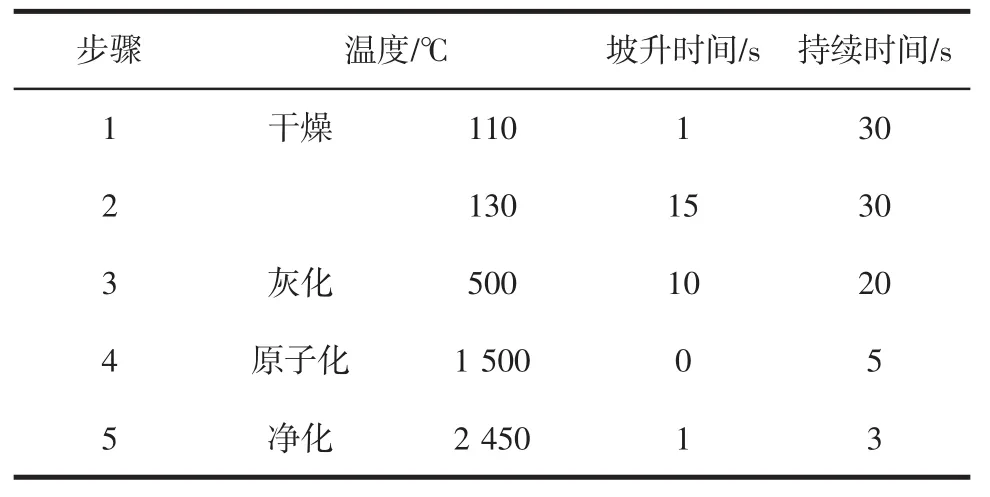
表2 石墨炉程序Table 2 Graphite furnace program
1.3.2 石墨炉原子吸收标准曲线
1.3.2.1 AAS标准使用液
用0.2%的硝酸溶液做稀释液,取1000μg/mL的镉标准储备液,逐级稀释,分别配制成浓度为1 000 ng/mL的镉中间储备液,浓度为5 ng/mL的镉标准使用液。
1.3.2.2 AAS标准系列
用0.2%的硝酸溶液做标准空白与稀释液,5 ng/mL的镉标准使用液作为母液,使用仪器自动稀释标准系列进样,将5 ng/mL的镉标准使用液依次稀释为1、2、3、4、5 ng/mL进行测定,以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
1.3.3 石墨炉原子吸收样品测定
自动进样器吸取20 μL的样液注入石墨炉进行测定,测得的吸光度代入标准曲线,可得样液中镉含量,再扣除试剂空白中镉含量,即得样品中实际镉含量。
1.4 电感耦合等离子体质谱法
1.4.1 ICP-MS仪器参数
峰型:3 个点;调谐模式:He;重复次数:3 次;内标物质:In;射频功率:1 549 W;载气流量:0.8 L/min;辅助气流量:0.8 L/min;等离子体气流量:12 L/min。
1.4.2 ICP-MS标准曲线
用0.2%的硝酸溶液作为稀释液,取1 000 ng/mL的镉中间储备液,稀释配制成浓度为100 ng/mL的镉溶液。再逐级稀释配制成镉标准系列溶液(镉浓度分别为 0、1、2、4、8、10、25、50 ng/mL)进行测定,以比率为纵坐标,浓度为横坐标绘制标准曲线。
1.4.3 ICP-MS内标使用液
精密量取1 000 μg/mL的内标物质储备液1 mL~10 mL聚乙烯容量瓶中,用去离子水稀释并定容,制备成内标物质中间储备液100 μg/mL,再精密量取1 mL内标物质中间储备液至500 mL聚乙烯容量瓶中,用去离子水稀释并定容,制备成内标物质浓度为200 ng/mL的内标使用液。
1.4.4 ICP-MS样品测定
仪器自动吸入内标溶液(200 ng/mL),测得样液中比率,代入标准曲线,可得样液中镉含量,再扣除样品空白,即得样品实际镉含量。
2 结果与分析
2.1 AAS与ICP-MS线性范围及检出限对比
根据样品中镉含量的范围以及对仪器实际使用过程的中不同浓度线性情况,确定配制标准系列浓度的范围,AAS 线性范围为:0 ng/mL~5 ng/mL;ICP-MS线性范围为0 ng/mL~50 ng/mL。
将试剂空白连续进样11针,以3倍标准偏差对应的浓度即为仪器的检出限。AAS与ICP-MS线性范围及检出限对比见表3。

表3 线性范围及检出限Table 3 Linear range and detection limit
结果表明,ICP-MS与AAS测定镉相比,两种方法相关系数均大于0.995,有较好的线性。ICP-MS线性范围更宽,较适于测定高浓度的样品,且检出限较AAS低,相关系数达0.999 9,灵敏度更高。AAS可以自动稀释配制标准曲线,操作比较简单,但线性范围较窄,如标液母液浓度过高,仪器自动稀释后线性不好。ICP-MS需要人工手动配制标线系列,并同时配制内标溶液,工作较繁琐,但线性范围较宽,检出限低,对于低浓度与高浓度的样品都能准确测定。
2.2 AAS与ICP-MS测定样品结果对比
分别用AAS与ICP-MS对5批花生样品溶液进行测定,测定数据及对比结果见表4。
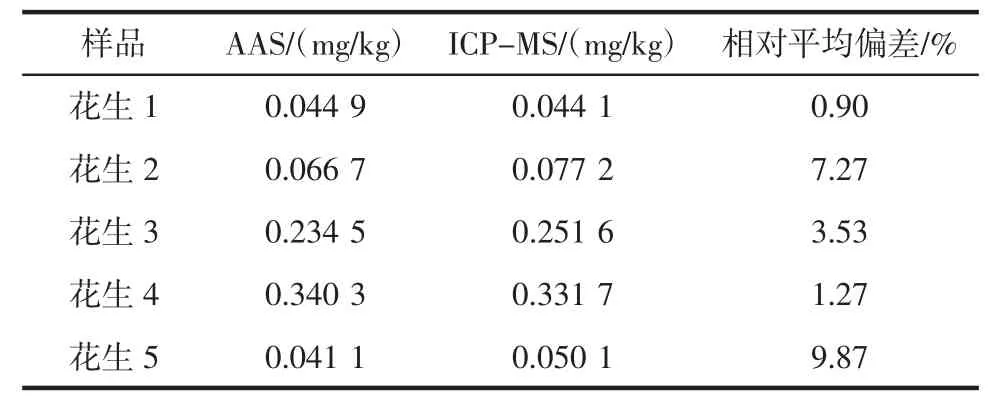
表4 样品结果Table 4 Sample results
从表4样品测定结果发现,两种方法测得的结果相对平均偏差均小于10%,两种方法测得的样品结果数据无显著差异。当样品中镉含量在0.1 mg/kg以下时,两种方法测得的结果数据相对平均偏差为0.90%~9.87%,可知当样品镉含量较低时,两种方法测定数据偏差较大。当样品中镉含量在0.1 mg/kg以上时,两种方法测得的结果数据相对平均偏差为1.27%~3.53%,可知当样品中镉含量大于0.1 mg/kg时,两种方法测定结果偏差较小,两种方法都能对花生中镉含量进行测定。5批花生镉含量范围为0.041 1 mg/kg~0.340 3 mg/kg,均低于0.5 mg/kg,满足GB 2762-2012《食品安全国家标准食品中污染物限量》对花生中镉含量的要求[28]。AAS使用高纯氩气,ICP-MS需要同时使用液氩与氦气,从两种测定方法使用的试剂与气体消耗方面对比,AAS使用成本要低于ICP-MS。两种测定花生中镉的方法数据结果无明显差异,但具体工作中选哪一种方法进行测定,可以根据各检测机构及样品镉含量的情况选择合适的检测仪器。
2.3 样品加标回收与精密度对比
对同一加标样液,分别使用AAS与ICP-MS进行测定,测得数据并计算加标回收率,加标回收率结果在89.8%~105.7%之间,测定结果见表5。
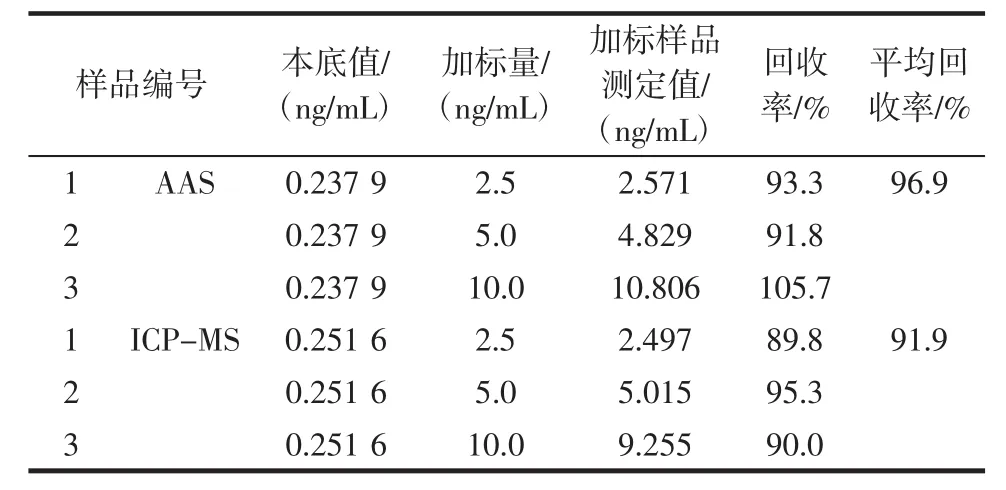
表5 加标回收Table 5 Spike recovery
取同一样品溶液,分别用AAS与ICP-MS进行6次平行测定,AAS相对标准偏差精密度为2.27%,ICP-MS相对标准偏差精密度为1.70%,两种方法测得的结果相对标准偏差精密度均小于5%,使用AAS与ICP-MS测定样品数据稳定性较好。
从表5样品加标回收测定结果可知,使用两种方法测定样品本底及浓度为2.5、5.0 ng/mL的加标样品时,计算出的加标回收率数据差异不大,加标点2.5 ng/mL时,两种方法回收率相对平均偏差为1.91%;加标点5.0 ng/mL时,两种方法回收率相对平均偏差为1.87%;加标点10.0 ng/mL时,两种方法回收率相对平均偏差为8.02%,由于此浓度点超出石墨炉原子吸收线性范围,造成计算后加标回收数据结果偏差较大。因此测定高浓度样品时可以优先选择ICP-MS进行测定。经过加标回收与精密度验证这两种方法均可用于花生中镉含量的测定。
3 结论
本文采用石墨炉原子吸收法与电感耦合等离子体质谱法分别对5批花生样品溶液进行测定,将2种测定方法的线性范围、检出限、样品含量、加标回收、精密度测定结果进行比较分析。结果表明,两种测定花生中镉的方法都具有较高的准确度和灵敏度,能满足检测中仪器精度要求,测定同一样品结果数据无明显差异,两种方法都可以满足对花生中镉含量进行准确定量测定。
[1]傅铁信.中国花生行业分析[J].粮油加工与食品机械,2004,35(12):10-15
[2]赵贵兴,陈霞,刘昊飞,等.花生的功能成分、营养价值及其开发利用研究[J].安徽农学通报,2011,17(12):39-42
[3]赵玉巧,岳春,候振健.酸性花生乳饮料稳定性的研究[J].食品科学,1999,20(5):32-34
[4]Settaluri V S,Kandala C V K,Puppala N,et al.Peanuts and Their Nutritional Aspects-A Review[J].Food and Nutrition Sciences,2012,3(12):1644-1650
[5]Liu H,Wang M J,Fu Y M,et al.Peanut cultivar selection for BLSS in terms of the biomass productivity,nutritional quality,photosynthetic character and mineral ions up-take by PTNDS cultivation[J].Acta Astronautica,2016,128(11/12):584-592
[6]Printz C.Girls who eat peanut butter may improve their breast health[J].Cancer,2014,120(13):1913
[7]Musa O M.Some nutritional characteristics of kernel and oil of peanut(Arachis hypogaea L.)[J].Journal of oleo science,2009,59(1):1-5
[8]Upadhyaya,Hari D,Mukri,et al.Variability and Stability Analysis for Nutritional Traits in thMini Core Collection of Peanu[J].Crop Science,2012,52(1):168-178
[9]Akhtar S,Khalid N,Ahmed L,et al.Physicochemical Characteristics,Functional Properties,and Nutritional Benefits of Peanut Oil:A Review[J].Critical Reviews in Food Science and Nutrition,2014,54(12):1562-1575
[10]Jonnala R S,Dunford N T,Chenault K.Nutritional Composition of Genetically Modified Peanut Varieties[J].Journal of Food Science,2010,70(4):S254-S256
[11]Mondragon C,M G,Barca C D L,et al.Nutritional composition of new Peanut(Arachis hypogaea L.)cultivars[J].Grasas y Aceites,2009,60(2):161
[12]黄小胜.花生渐成健康消费新时尚[N].中国食品安全报,2011-1-20(B03)
[13]张蕾,汪浩.花生——人体健康的新卫士[N].文汇报,2014-1-12(008)
[14]王凯荣,张磊.花生镉污染研究进展[J].应用生态学报,2008,19(12):2757-2762
[15]徐天骄,张强,李培武,等.微波消解-石墨炉原子吸收光谱法测定花生中镉含量[J].中国油料作物学报,2011,33(3):290-294
[16]Fatemi S J,Tubafard S,Nadi B.Evaluation of the effect of cadmium on rat organs and investigation of diethy carbamate as an oral drug in treatment of cadmium toxicity[J].Medicinal Chemistry Research,2009,18(3):179-186
[17]刘晓庚.环境激素对食品安全的危害及防治[J].食品科学,2003,24(8):196-200
[18]潘长春.食品分析中镉含量的几种检测方法[J].中国高新技术企业,2010,159(24):40-41
[19]张海棠,刘耀东,王淑云,等.动物性食品镉离子污染检测技术研究进展[J].中国动物检疫,2010,27(11):67-70
[20]邸万山.食品中镉的检测技术[J].理化检验(化学分册),2015,51(4):567-572
[21]刘虎生,邵宏翔.电感耦合等离子体质谱技术与应用[M].北京:化学工业出版社,2005:18-29
[22]姜娜.电感耦合等离子体质谱技术在环境监测中的应用进展[J].中国环境监测,2014,30(4):118-124
[23]中华人民共和国卫生部.GB 5009.15-2014.食品安全国家标准食品中镉的测定[S].北京:中国标准出版社,2015
[24]中华人民共和国卫生部.GB 5009.268-2016.食品安全国家标准食品中多元素的测定[S].北京:中国标准出版社,2016
[25]魏清才.微波消解-电感耦合等离子体质谱法同时测定样品中Cr、As、Se、Cd、Cu、Zn、Pb 元素[J].福建地质,2014,33(2):154-159
[26]李波,崔杰华,王颜红,等.应用一种微波消解液直接测定食品中7中元素[J].中国测试技术,2008,34(2):89-91
[27]张磊,王晓艳,李波.微波消解技术在金属分析中的应用[J].光谱实验室,2010,27(3):953-957
[28]中华人民共和国卫生部.GB 2762-2012.食品安全国家标准食品中污染物限量[S].北京:中国标准出版社,2012
Comparison Study on AAS and ICP-MS Determination of Cadmium Content in Peanut
HUANG Lu,DENG Shu-jian,LIU Tian-peng
(Deyang Food and Drug Safety Testing Center,Deyang 618000,Sichuan,China)
The contents of cadmium in five peanuts were determined by graphite furnace atomic absorption spectrometry(AAS)and inductively coupled plasma mass spectrometry (ICP-MS),the obtained results were compared and analyzed,so as to provide a reliable method for the determination of cadmium in peanut.The average relative deviation of cadmium content got from two different measurement in peanut was less than 10%;Linear range:AAS was 0 to 5 ng/mL,ICP-MS was 0 to 50 ng/mL.Detection limit:AAS was 0.02 ng/mL,ICPMS was 0.004 ng/mL.Recovery rate:AAS were 91.8%-105.7%,ICP-MS were 89.8%-95.3%.Precision:AAS was 2.27%,ICP-MS was 1.70%.The results indicated that the two methods can meet the requirement of cadmium content in peanut,and for the same sample digestion from the same source,it can be tested by graphite furnace atomic absorption spectrometry and inductively coupled plasma mass spectrometry at the same time,and both way can guarantee the accuracy.
peanut;cadmium;graphite furnace atomic absorption spectrometry;inductively coupled plasma mass spectrometry
10.3969/j.issn.1005-6521.2017.24.032
黄露(1986—),女(汉),本科,研究方向:食品检测。
2017-05-08
