退化与正常山核桃林土壤细菌多样性比较研究
2017-12-13董建华董建明袁紫倩胡俊靖赵伟明
李 皓,董建华,董建明,袁紫倩,胡俊靖,赵伟明
退化与正常山核桃林土壤细菌多样性比较研究
李 皓1,董建华1,董建明2,袁紫倩1,胡俊靖1,赵伟明1
(1. 杭州市林业科学研究院,浙江 杭州 310022;2. 杭州市临安区林业局,浙江 杭州 311300)
2014年10月,在浙江省临安市选择4个退化山核桃Carya cathayensis林样地和2个正常山核桃林样地,采土样后用16SrDNA测序技术分析两种林地土壤细菌多样性。结果表明,6个样地土壤细菌共有36门75纲96目224科924属。在门的水平上,退化和正常林地细菌主要类群基本一致,主要类群有变形菌门Proteobacteria,酸杆菌门 Acidobacteria,拟杆菌门 Bacteroidetes,绿弯菌门 Chloroflexi,厚壁菌门 Firmicutes,疣微菌门Verrucomicrobia,放线菌门Actinobacteria和浮霉菌门Planctomycetes,但不同林地中各类群相对丰度明显不同;在属的水平上,退化和正常林地差别很大。Alpha多样性分析显示,6个样地 Shannon指数,ACE指数,Chao1指数的排序各不相同,分析说明山核桃林退化程度与土壤细菌数量和多样性无关。相关分析结果表明,ACE指数与交换性H+显著相关,其余土壤物理化学性质与细菌多样性指数均无显著相关性。
山核桃;退化;土壤细菌群落;16SrDNA测序;多样性
山核桃Carya cathayensis是我国特有的木本油料树种,主要分布在浙皖交界的天目山地区,包括浙江临安及安徽宁国等县市,其果实富含不饱和脂肪酸和矿物质,可加工为干果食用,经济价值高。近年来,为了追求高产,林农大量使用化肥和化学除草剂使许多山核桃林地出现退化现象,植株生长不良、枝条死亡,产量大幅下降,甚至整片林分死亡。
土壤细菌是土壤环境的重要组成部分,参与土壤中物质转换和能量传递。土壤中细菌的种类、数量和分布影响着土壤肥力、植物营养及土壤中有毒物质降解,同时在促进土壤生态恢复方面发挥着重要作用,土壤细菌的生物多样性越丰富,越有利于土壤的可持续利用和抗压力[1-2]。
16SrDNA测序以环境样品中的微生物群体基因组为研究对象,直接从环境样品中提取全部微生物的DNA,构建 16SrDNA文库,利用高通量测序技术分析样品所包含的全部微生物的群体基因组成及功能和参与的代谢通路,解读微生物群体的多样性与丰度,探求微生物与环境之间的关系[3-4]。
本研究采用 16SrDNA测序分析技术分析退化山核桃林和正常山核桃林土壤细菌群落结构和多样性,研究山核桃生长不良及土壤环境变化对土壤细菌群落结构的影响,为山核桃退化林地的土壤管理提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于浙江省临安市龙岗镇林坑村,119°05′35.1″ E,30°09′27.6″ N,亚热带季风气候,四季分明,气候温和,雨量充足,年平均气温15.8℃,年平均日照1 939 h,无霜期234 d。研究区内山核桃林普遍为人工纯林,株行距5 m×6 m,300株·hm-2。林农通常在林地内使用大量化肥和化学除草剂,使多数山核桃林出现不同程度的退化,只有化肥施用量少、采用人工劈草方式经营的林分生长健康。2014年5月,根据山核桃林分生长状况,对山核桃林进行退化程度分级:(1)正常,山核桃长势正常良好;(2)轻度退化,叶色偏黄,顶端出现少量枯枝;(3)严重退化,多数植株树叶稀少,顶端枯死或整株死亡。
1.2 试验材料
2014年10月,选择4个退化山核桃林地(样地1,样地2,样地3,样地4)和2个正常林地(样地5和样地6),每个样地面积为666.67 m2,样地基本情况见表1。
在每个样地内随机设5个采样点,去除表面杂草和浮土,采集0 ~ 20 cm 土层中的土壤,将每个样地5个样点采样土壤充分混合后,一部分用聚乙烯袋密封,带回实验室置于-80℃冰箱中保存,另一部分样品自然风干,用于测定土壤化学性质,样地土壤基本性质见表2。

表1 样地基本情况Table1 Information of 6 sample plots

表2 不同样地土壤基本理化性质Table 2 Phisio-chemical properties of soil in 6 sample plots
1.3 试验方法
利用宏基因组测序技术对山核桃林地土壤细菌群落结构进行分析鉴定。所有样品细菌基因组 DNA提取和16S rDNA扩增与测序工作委托生工生物工程(上海)有限公司完成。实验流程:对提取到的基因组DNA进行琼脂糖电泳检测,查看基因组DNA的完整性与浓度。利用Qubit2.0DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应需加入的DNA量。PCR所用的引物已经融合了Miseq测序平台的通用引物。PCR结束后,对PCR产物进行琼脂糖电泳,采用生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收。回收产物用Qubit2.0定量,根据测得的DNA浓度,将所有样品按照1:1的比例进行混合,混合后充分震荡均匀,用于后续的样品建库(加测序标签)与测序。
测序分析流程:采用Flash软件融合双末端序列,而后通过各样品barcode使数据回归样品,并对各样本序列做 QC。去除非靶区域序列及嵌合体,采用 RDPclassifier将序列进行物种分类,根据序列间的距离对多条序列进行聚类,把序列之间的相似性作为域值分成操作分类单元(OTU)。
1.4 数据处理
运用不同分类水平的OTU分析,说明山核桃林地土壤细菌群落结构。采用Alpha多样性分析,计算Shannon指数,ACE指数,Chao1指数,Coverage等,衡量每个样本的物种多样性[5]。使用SPSS 19.0对不同样地土壤化学性质与细菌多样性指数进行相关分析。
2 结果与分析
2.1 退化山核桃林地和正常山核桃林地土壤细菌群落结构分析
通过OTU分析得出,在相似水平为97%的条件下,6个样地中土壤细菌共有36门75纲96目224科924属。在门的分类水平上,退化山核桃林地和正常山核桃林地主要类群基本一致,其中变形菌门 Proteobacteria,酸杆菌门 Acidobacteria,拟杆菌门 Bacteroidetes,绿弯菌门 Chloroflexi,厚壁菌门 Firmicutes,疣微菌门Verrucomicrobia,放线菌门Actinobacteria和浮霉菌门Planctomycetes为主要类群,详见表3。
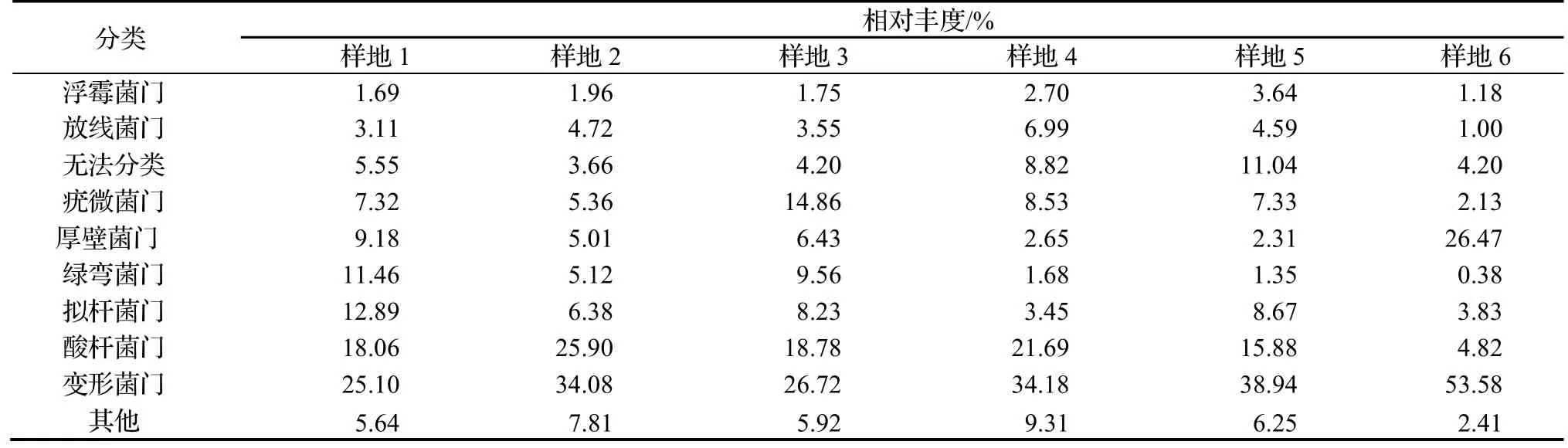
表3 不同样地土壤细菌优势门相对丰度Table 3 Relative abundance of dominant phylum in 6 sample plots
对正常样地中相对丰度超过1%的细菌主要门类进行分析,与退化林地的相比,在生长良好的山核桃林地中变形菌门相对丰度较高,酸杆菌门、绿弯菌门相对丰度较低,不同样地中存在一定数量的无法分类的类群。在属的水平上,退化山核桃林地中,红游动菌属 Rhodoplanes,慢生根瘤菌属 Bradyrhizobium,Rhizomicrobium,长绳菌属Longilinea,Gp1,Gp2和Gp3为主要类群。在严重退化的样地1和样地2中,Meniscus和Levilinea相对丰度较高,在轻度退化的样地3和样地4中,Gemmatimonas相对丰度高于严重退化林地,Rhizomicrobium相对丰度低于严重退化林地。生长良好的样地5和样地6中的主要类群与退化山核桃林完全不同,Gp6,Sphingomonas,Nitrospira,Gp10,Alcaligenes,Providencia,Pseudomonas和Paenibacillus相对丰度较高,结果见表4。
2.2 不同山核桃林地土壤细菌Alpha多样性分析
根据Alpha多样性分析显示(表5),6个样地Shannon多样性指数排序为样地5>样地3>样地2>样地1>样地4>样地6,说明样地5土壤细菌物种多样性最丰富,6号样地物种多样性最低;ACE多样性指数排序为样地1>样地3>样地5>样地2>样地4>样地6;Chao1多样性指数排序为样地3>样地1>样地5>样地2>样地4>样地6,说明样地1和样地3土壤细菌物种总数最多,样地6物种总数最少。综合3种多样性指数分析,发现山核桃林地土壤细菌多样性与山核桃退化程度无关,退化林地的土壤细菌多样性并不低于正常林地。

表4 不同样地细菌优势属相对丰度Table 4 Relative abundance of genera in 6 sample plots

表5 不同样地土壤细菌Alpha多样性统计Table 5 Alpha diversity analysis on soil bacteria in 6 sample plots
2.3 土壤理化性质与细菌多样性相关分析
对不同山核桃林地土壤理化性质与细菌多样性指数进行相关性分析,结果见表6。ACE指数与交换性H+之间呈显著相关,其余土壤理化性质指标与细菌多样性指数均无显著相关性。

表6 山核桃林地土壤理化性质与细菌多样性的相关分析Table 6 Correlation analysis on soil physiochemical properties and bacteria diversity
3 讨论
3.1 山核桃林退化与土壤理化性质
山核桃林退化是由林地土壤问题导致的。土壤的酸化、养分供应不平衡使山核桃的生长受到制约,出现根系、枝条死亡,严重退化的林地甚至会出现大量单株枯死的现象。山核桃适宜的土壤pH值通常在6.0左右[7],本研究中正常林地的pH值分别为5.73和6.08,退化山核桃林地土壤pH值低于正常林地,土壤交换性酸高于正常林地,说明退化林土壤都有一定程度的酸化。表1中碱解氮、速效磷、速效钾和有机质的数据说明,退化林地土壤中氮素积累过多,部分退化林地中磷和钾不足,有机质含量不高。
3.2 山核桃林退化与土壤细菌群落结构
6个样地中共发现36门75纲96目224科924属细菌,在门的水平上,退化山核桃林与正常山核桃林主要类群基本一致,但不同门的相对丰度明显不同,正常林地中变形菌门相对丰度较高,酸杆菌门、绿弯菌门相对丰度较低,这可能与土壤 pH值相对较高有关。在属的分类水平上,退化林与正常山核桃林优势属差别很大,退化林地细菌优势属有红游动菌属,慢生根瘤菌属,长绳菌属等,这些属在正常林地中不是优势属。正常山核林样地之间细菌优势属也有所不同,可能与2块样地土壤类型不同有关。研究显示,山核桃林地中还存在许多不能分类的类群,仍需对山核桃林地土壤细菌生态功能及山核桃生长的作用开展研究,以期通过管理和调控土壤微生物,为山核桃生长提供良好的土壤环境,有效解决山核桃林地退化问题。
降香Dalbergia odorifera,香蕉Musa nana,苹果Malus pumila和白皮松Pinus bunging等植物的土壤中,多样性较好的土壤微生物群落有利于植物的生长,促进植物营养吸收,增强抗病性[8-12]。本研究中,山核桃林地土壤细菌多样性与退化程度无关,生长良好的山核桃林地土壤细菌多样性也有低于生长不好的林地,可能是林农在生长不良的林地内施用了更多的化肥,改变了土壤肥力,同时也对土壤细菌多样性产生了影响。
4 结论
(1)6个样地土壤共发现36门75纲96目224科924属细菌,在细菌门的水平上,退化与正常山核桃林主要类群基本一致,但不同门细菌相对丰度明显不同,正常林地中变形菌门相对丰度较高,酸杆菌门、绿弯菌门相对丰度较低。在属的水平上,生长良好的林地中的主要细菌属与退化山核桃林差异很大。
(2)Alpha多样性分析显示,6个样地Shannon指数排序为样地5>样地3>样地2>样地1>样地4>样地6,ACE指数排序为样地1>样地3>样地5>样地2>样地4>样地6,Chao1指数排序为样地3>样地1>样地5>样地2>样地4>样地6。
(3)只有ACE指数与交换性H+之间呈显著相关,其余土壤化学性质指标与细菌多样性指数均无显著相关性。
[1] Fierer N,Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceed Natl Acad Sci U S A,2006,103(3):626-631.
[2] Chen Q H,Feng Y,Zhang Y P,et.al. Short-term responses of nitrogen mineralization and microbial community to moisture regimes in greenhouse vegetable soils[J]. 土壤圈(英文版),2012,22(2):263-272.
[3] 李桥. 基于高通量测序技术下土壤微生物群落结构的研究[D]. 济南:山东师范大学,2011.
[4] 曾希柏,王亚男,王玉忠,等. 不同施肥模式对设施菜地细菌群落结构及丰度的影响[J]. 中国农业科学,2013,46(1):69-79.
[5] 张彩霞. 新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应[D]. 南京:南京农业大学,2012.
[6] 秦楠,栗东芳,杨瑞馥. 高通量测序技术及其在微生物学研究中的应用[J]. 微生物学报,2011,51(4):445-457.
[7] 宋素灵. 山核桃林地土壤退化现状和施肥改良研究[D]. 临安:浙江农林大学,2014.
[8] 杨菁,周国英,田媛嫒,等. 降香黄檀不同混交林土壤细菌多样性差异分析[J]. 生态学报,2015,35(24):8117-8127.
[9] 常显波,刘举,等. 不同种植年限苹果园土壤理化性质及微生物数量[J]. 安徽农业科学,2007,35(5):1423-1426.
[10] 黄珍. 海南福山香蕉地土壤细菌和真菌多样性分析[D]. 海南:海南大学,2010.
[11] Peck G M,Merwin I A,Thies J E,et.al. Soil properties change during the transition to integrated and organic apple production in a New York orchard[J]. App Soil Ecol,2011,48:18-30.
[12] 贾丽. 珍稀濒危植物白皮松土壤微生物多样性研究[D]. 兰州:西北师范大学,2007.
Comparison on Soil Bacteria Diversity between Degrated and Healthy Carya cathayensis Forests
LI Hao1,DONG Jian-hua1,DONG Jian-ming2,YUAN Zi-qian1,HU Jun-jing1,ZHAO Wei-ming1
(1. Hangzhou Forestry Academy of Zhejiang, Hangzhou 310022, China; 2. Lin'an Forestry Bureau of Zhejiang, Hangzhou 311300, China)
Four sample plots in degraded Carya cathayensis stand and 2 in normal ones were established in October 2014 in Lin’an district, Zhejiang province. Soil samples were sequenced by 16SrDNA for comparison on bacteria community diversity of different sample plots. The results indicated that there were 924 genera of 224 families and 36 phylums, 75 classes, 96 orders in sampled plots. The main phylums were the same in the tested plots, included Proteobacteria, Acidobacteria, Bacteroidetes, Chloroflexi, Firmicutes, Verrucomicrobia, Actinobacteria and Planctomycetesbut with different relative abundance . The distribution of main genera had great difference between degraded and normal plots. The Shannon index, the ACE index and Chao1 index showed that it had no relationship between degradation of sampled stands with bacteria richness and diversity. Correlation analysis demonstrated that ACE index had evident relation with H+, the other physiochemical properties of the tested had no significant correlation with bacteria diversity index.
Carya cathayensis; degraded; soil bacteria community; 16SrDNA sequencing; diversity
S664.1
A
1001-3776(2017)05-0042-06
10.3969/j.issn.1001-3776.2017.05.007
2017-03-21;
2017-08-13
浙江省林业科研成果推广项目(2013B13)
李皓,工程师,从事经济林研究;E-mail:38761202@qq.com。
