朱红栓菌原生质体制备与再生的研究
2017-12-13王玉俊王长宝岳丽红
王玉俊,王长宝,2,岳丽红
朱红栓菌原生质体制备与再生的研究
王玉俊1,王长宝1,2,岳丽红1
(1. 佳木斯大学 生命科学学院,黑龙江 佳木斯 154007;2. 佳木斯大学 环境与生物技术研究所,黑龙江 佳木斯 154007)
将2016年7月在黑龙江省凉水国家级自然保护区采集的朱红栓菌Trametes cinnabarina子实体接种于PDA固体培养基平皿中,30℃下培养7 d,截取菌丝体接种于液体培养基中用于原生质体制备与再生实验。通过单因素试验和正交试验,研究酶解温度、酶解时间、菌丝质量分数、酶配比对原生质体制备的影响。结果表明,以0.6 mol·L-1甘露醇溶液作为高渗缓冲液,复合酶组成为 1.5%溶壁酶+1.0%纤维素酶+1.0%蜗牛酶,菌丝质量分数为 20%,30℃条件下酶解3.5 h为朱红栓菌原生质体制备的最适条件,产量达1.00×107个·mL-1;以0.6 mol·L-1蔗糖溶液作为再生高渗缓冲液,原生质体再生率最高达20.6%。
朱红栓菌;单因素试验;正交试验;原生质体;制备;再生
朱红栓菌Trametes cinnabarina(Jacq.: Fr.)Fr.,又名红栓菌、朱砂菌、胭脂栓菌、朱红密孔菌等,隶属担子亚门Basidiomycotina多孔菌科Polyporaceae[1-2]。它是一种能有效降解木质素、纤维素和半纤维素的白腐真菌,可作为降解秸秆的优良菌株,减少农业焚烧秸秆产生的污染,在环境治理方面应用前景广阔。
在真菌的改良育种中,制备出高质量的原生质体对其融合及再生至关重要。高等担子菌原生质体制备的研究,始于 1972年对裂褶菌原生质体的成功分离[3]。研究表明,影响原生质体制备的因素较多,包括酶解温度、酶解时间、复合酶配比、菌丝质量分数、菌龄、高渗缓冲液、pH值等[4],其中,复合酶的效果要好于单一酶[5-6]。近年来,关于朱红栓菌的研究主要集中在培养条件、成分提取和抗菌活性等方面[7-10],而有关其原生质体的制备和再生的研究鲜有报道。通过分析酶解温度、酶解时间、菌丝质量分数和酶配比4个主要影响因素,探索朱红栓菌原生质体制备及再生的适宜条件,旨在为今后研究朱红栓菌原生质体融合及优良品种选育提供技术基础。
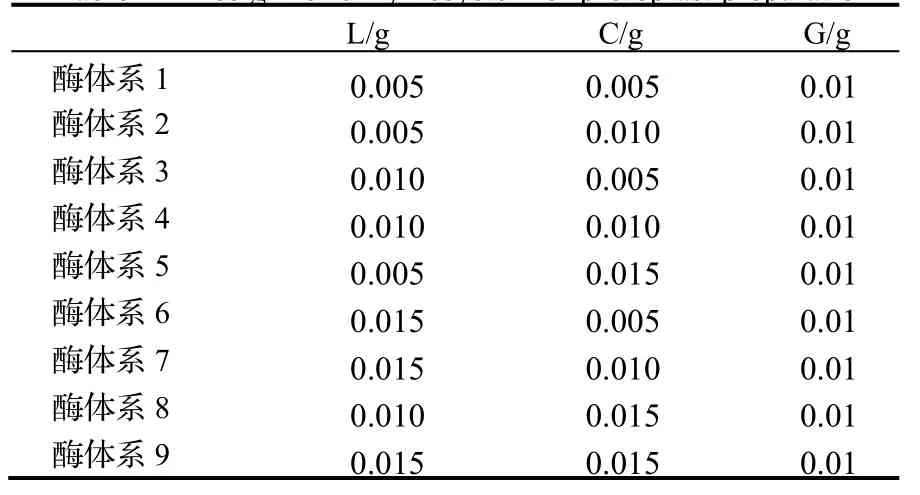
表1 原生质体制备酶体系的优化设计Table 1 Design for enzymesystem of protoplast preparatio
1 材料与方法
1.1 材料
1.1.1 供试菌株 朱红栓菌子实体于2016年7月采集于黑龙江省凉水国家级自然保护区,用无菌小剪子剪取体积为0.5 cm3的内部未受污染的菌肉,接种于PDA固体培养基平皿中,30℃下培养7 d。朱红栓菌菌种保存在佳木斯大学环境与生物技术研究所。
1.1.2 药品与试剂 溶壁酶(Lywallzyme/L)(上海金穗生物科技有限公司),纤维素酶(Cellulose/C)(南京奥多福尼生物科技有限公司),蜗牛酶(Glusulase/G)(Sigma),甘露醇(六安华源制药有限公司),山梨醇(中国医药上海化学试剂公司),蔗糖(天津市凯通化学试剂有限公司)。
1.1.3 培养基 (1)液体培养基:马铃薯200.0 g,葡萄糖20.0 g,KH2PO43.0 g,用蒸馏水补足至1 L;(2)PDA固体培养基:马铃薯200.0 g,葡萄糖15.0 g,琼脂15.0 g,用蒸馏水补足至1 L。(3)再生培养基:蔗糖15.0 g,酵母粉 3.0 g,马铃薯 200.0 g,琼脂 8.0 g,KH2PO42.0 g,MgSO41.0 g,VB14.0 mg,用 0.6 mol·L-1蔗糖溶液补足至1 L[11]。
1.1.4 主要仪器与设备 TG16-W 微量高速离心机(长沙湘仪离心机仪器有限公司),BSD-YX(F)2600立式摇床(上海博迅医疗生物仪器股份有限公司),FA3204B电子分析天平(上海习仁科学仪器有限公司),GMSX-280高压蒸汽灭菌器(北京市永光明医疗仪器有限公司),血球计数板(上海求精生化试剂仪器有限公司)。
1.2 方法
1.2.1 扩大培养 用无菌接种器截取直径为1.0 cm的朱红栓菌菌丝体,接入液体培养基中,30℃静置培养7 d,4℃保存备用。
1.2.2 酶液的配置 用分析天平称取不同质量的固体酶于1 mL离心管中(复合酶体系中L,C,G的质量见表1),加入1 mL浓度为0.6 mol·L-1的无菌甘露醇高渗透压缓冲液溶解,经微孔滤膜(直径0. 22 μm)过滤后备用。
1.2.3 原生质体的制备 取液体培养基中的菌丝体,用0.6 mol·L-1甘露醇高渗缓冲液洗3次,去除残留培养基后,无菌滤纸吸去多余水分,用无菌小剪子将其剪碎。取菌丝体置于装有1 mL酶液的离心管中,充分混匀,摇散菌丝,进行酶解。酶解完毕后,冰浴终止酶解,经0.18 mm无菌滤网过滤,滤液4 000 rpm·min-1离心5 min,弃去上清液,用1 mL浓度为0.6 mol·L-1甘露醇高渗缓冲液悬浮沉淀,重复3次,得到纯化的朱红栓菌原生质体,血球计数板检测原生质体个数(式1),4℃保存。
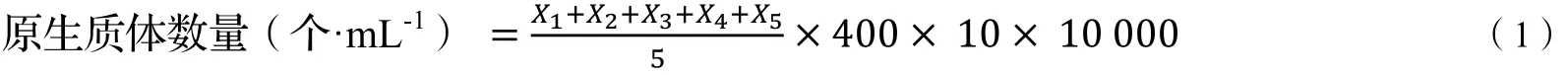
式中,X1,X2,X3,X4,X5为血球计数板单位小格中原生质体数量。
1.2.4 单因素试验 酶解条件的单因素试验设置温度为20,25,30,35℃,菌丝质量分数为10%,酶液体系为1.0% L,1.0% C和1.0% G,酶解3.5 h,初步筛选最适温度。根据筛选出的适宜酶解温度进行酶解时间的优化实验,分别设置酶解时间为2.0,2.5,3.0,3.5,4.0,4.5 h,其他条件同上。根据筛选出的适宜酶解温度、时间进行菌丝质量分数的优化,设置菌丝质量分数分别为5%,10%,15%,20%。同理设置酶配比,调节酶体系中溶壁酶、纤维素酶、蜗牛酶的浓度,初步确定最佳的酶体系。分别研究酶解温度、酶解时间、底物质量分数、酶的配比对原生质体制备量的影响。
1.2.5 正交试验 按照单因素试验结果,对温度、时间、菌丝质量分数、复合酶配比4个酶解因素进行3个水平的设置,即L9(34)。依照表2进行朱红栓菌原生质体制备条件优化正交试验,测定其原生质体制备量。
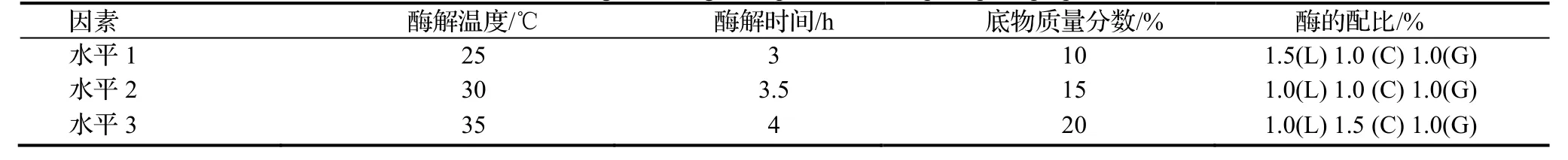
表2 原生质体制备条件优化正交设计表Table 2 Orthogonal designfor optimization of protoplast preparation
1.2.6 不同高渗缓冲液对再生及再生率的影响 根据正交试验筛选出的最佳条件进行朱红栓菌原生质体的制备,酶解3.5 h后,经0.18 mm无菌滤网过滤,滤液4 000 rpm离心5 min,弃去上清液,分别用1 mL浓度为0.6 mol·L-1的蔗糖、甘露醇、NaCl、山梨醇高渗缓冲液悬浮沉淀,得到原生质体悬液。用移液管吸取0.1 mL涂布在再生培养基上,30℃培养5 ~ 7 d,记录再生菌落生长情况,计算原生质体再生率(式2)。

2 结果与分析
2.1 酶解温度对原生质体制备数量的影响
由图1可知,原生质体产量由高到低对应的酶解温度依次为30℃>25℃>35℃>20℃。单因素方差分析结果显示,不同处理间均存在显著差异(P<0.05)。说明酶解温度对菌丝壁的酶解效率影响较大,温度过高或过低都不利于细胞壁的酶解。随着温度的升高,朱红栓菌原生质体产量显著升高,到30℃时,原生质体数量达到最高峰,为4.64×106个·L-1,但当温度继续升高时原生质体数量显著下降。酶解温度为25℃时次之,两者间差异性显著。
2.2 酶解时间对原生质体产量影响
由图2可知,酶解时间在2.0 ~ 2.5 h范围内,原生质体制备量较少,随着酶解时间的增加原生质体制备量显著升高(P<0.05)。酶解时间在3.0 ~ 4.0 h制得的原生质体数目较多。到3.5 h时,原生质体产量达到最高,为 4.68×106个·mL-1,与酶解 3 h,4 h 的产量差异显著。从3.5 h后,原生质体产量随着时间的延长开始下降,且差异显著。因此,制备朱红栓菌原生质体的适宜酶解时间为 3.5 h,产量最高。
2.3 菌丝质量分数对原生质体产量影响
在酶解体系中,菌丝质量分数在5% ~ 20%范围内,原生质体制备量随菌丝量的增多而增加,菌丝质量分数达到20%时,原生质体制备量达到最高值,为4.4×106个·mL-1(图3)。菌丝质量分数由5%增大至20%过程中,酶解速度不断提升,原生质体产量上升趋势显著。经单因素方差分析结果显示,不同处理间均存在显著差异(P<0.05),因此,菌丝质量分数对原生质体的制备至关重要。
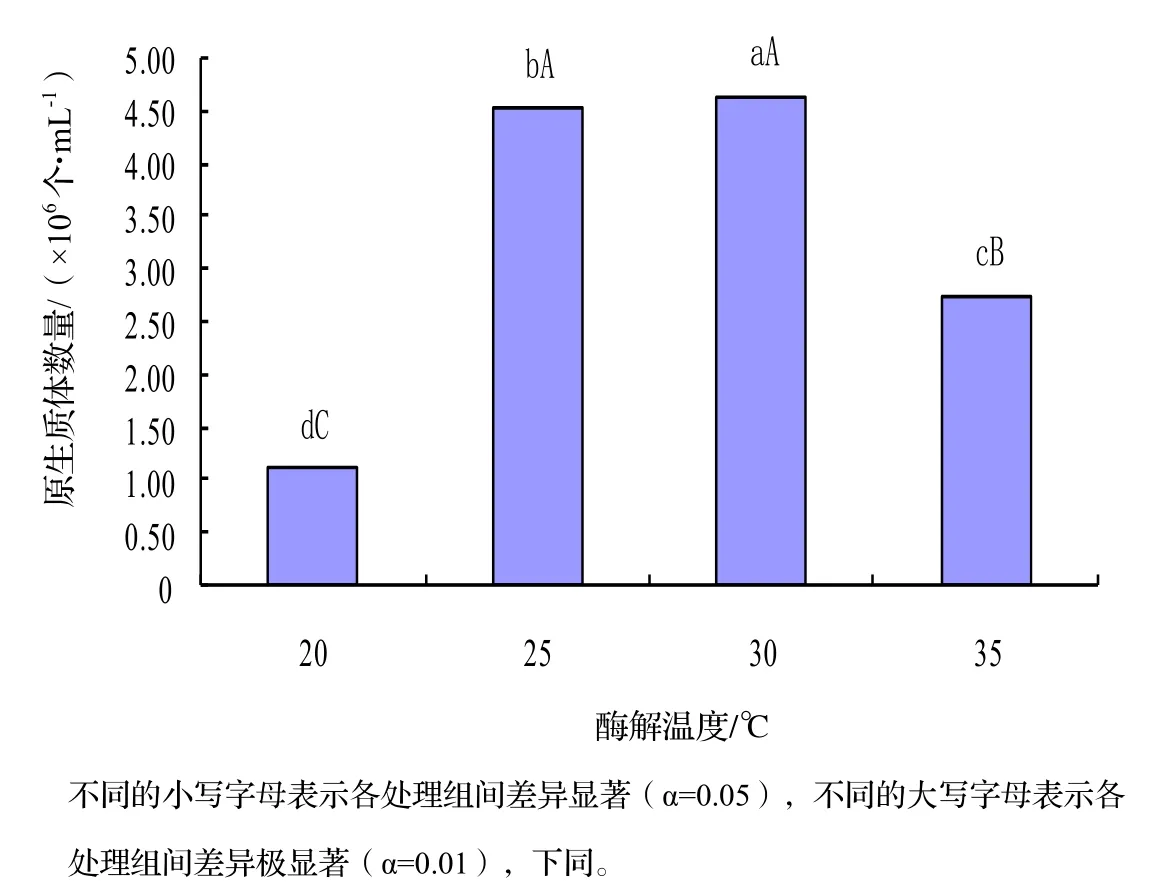
图1 酶解温度对朱红栓菌原生质体产量的影响Figure 1 Effect of enzymolysis temperature on yield of T. cinnabarina protoplast
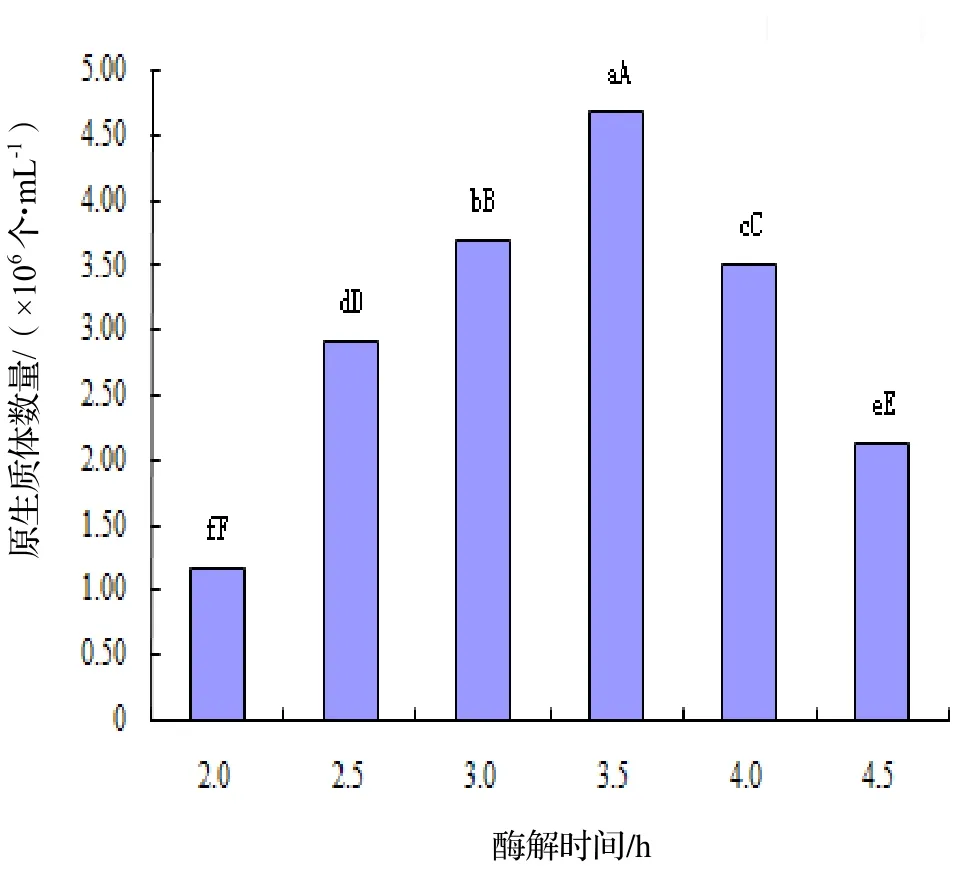
图2 酶解解时间对朱红栓栓菌原生质体体产量的影响Figure 2 Effect of enzymolysis time on yieldofT. cinnabarina protoplast
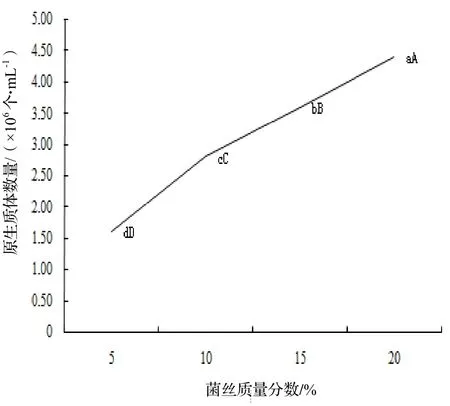
图3 底物质量分分数对朱红栓栓菌原生质体体产量的影响响Figure3 Effect of mass frraction of hyphaeon yield of T. cinnabarina protoplast
2.4 酶的浓度及配比对原生质体产量量的影响
如表3所所示,菌丝在在9种不同浓度的复合酶中均能产生原原生质体。纤维素酶、溶壁酶、蜗牛酶分分别为1.5%,1.0%,1.0%时效果最好,配比为1.0%%,1.0%,1.0%次之,朱红栓菌原生质质体制备量分别为 3.83×1006个·mL-1和3.79×106个·mL-1,两者间差异不显著,但显著高于于其他酶配比的酶解效率(P<0.05)。酶浓度在0.5% ~ 1.0%之间,随着酶浓度的升高,原生质体的产率逐渐增多,当酶液浓度达到1.5%时,原生质体产量开始下降。
2.5 诸因素对原生质体制备的影响
根据1.2.5正交设计计,9个处理的的试验结果见表4,对四个因素的极差进行比较,重要性依次为为:酶解温度((℃)>菌丝质量分数(%)>酶解时间(h)>酶配比(%)。其其中,酶解温度度的极差最大大,是影响原生质体制备的首要因素。综合考虑各因素对原生质体产量的影响,采用酶液液组成为1.5% L+1.0% C+1.0% G的复复合酶、菌丝质量分数为为20%,在30℃下酶解3.55 h为朱红栓菌原生质体制备的最佳条件,原生质体产量为10×106个·mL-1。
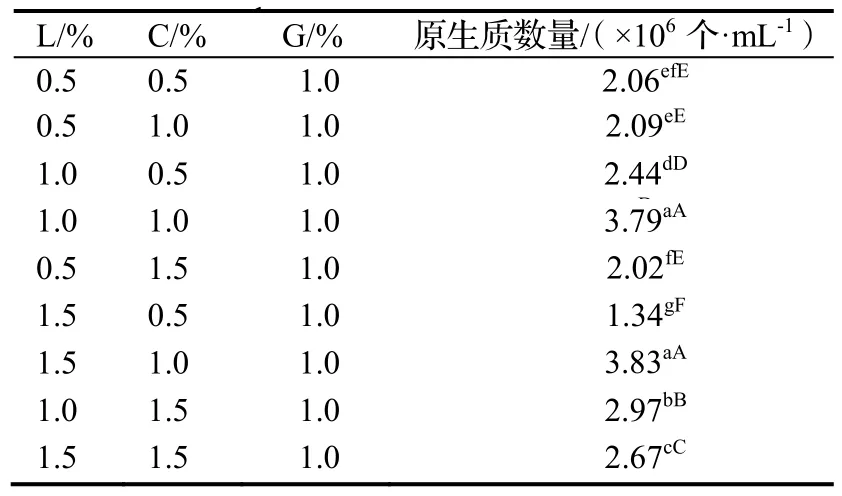
表3 不同酶的配比对朱红栓菌原生质体产量的影响Table 3Effects of different ratio of enzyme on yield of T. cinabarina
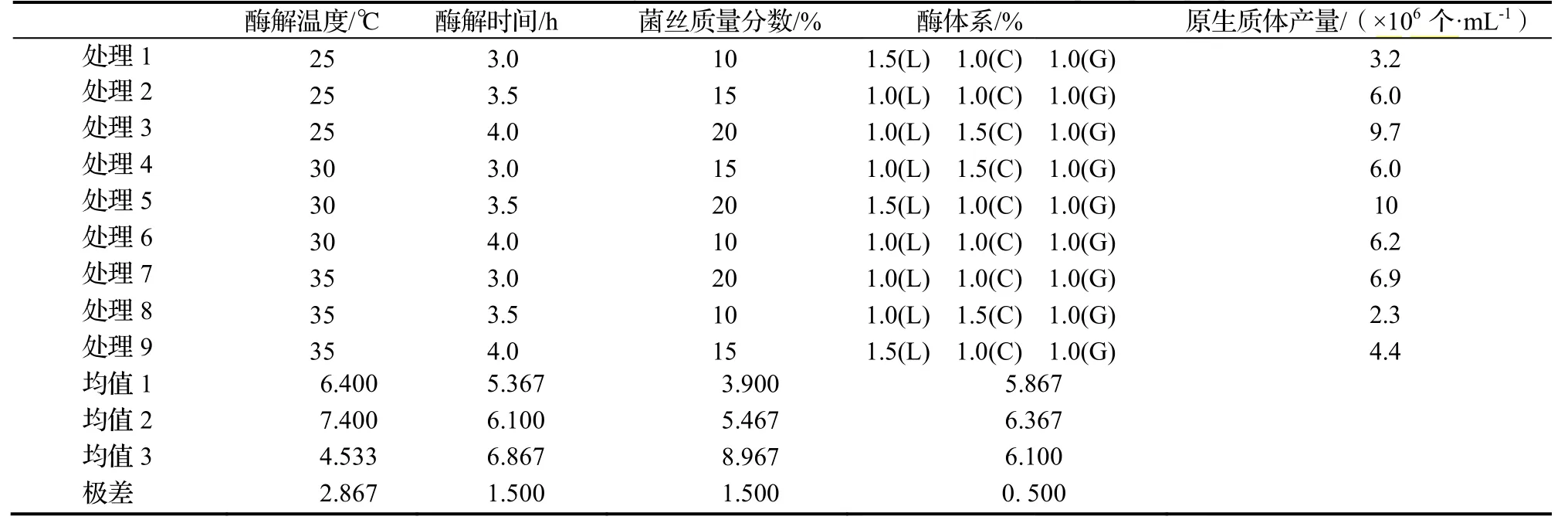
表4 朱红栓菌原生质体制备条件优化正交试验分析Table 4 Visual analysis of orthogona ltest scheme of Trametes cinnabarina protoplast proparion
图4A(箭头所指为原生质体)为最佳条件下朱红栓菌原生质体制备情况。图 4B(箭头所指为再生菌落)是以0.6 mool·L-1蔗糖溶液为高渗缓冲液,涂布于再生培养基4 d后的生长情况。镜检下视野明亮,原生质体较为密集,残余菌丝较少,因此,通过本试验方法可获得纯净的的朱红栓菌原生质体,产量为1.0×107个·mL-1。在30℃下培养5 ~ 7 d,原生质体萌发,形成白色菌落。

图4 最佳制备条件下纯化的朱红栓菌原生质体(×400)(A)及再生平皿(B)Figure 4Purified protoplasts(×400)(A) and regeneration(B) of T.cinnabarina under the optimal condition
2.6 不同高渗缓冲液对原生质体再生率的影响
不同高渗缓冲液的原生质体再生率为蔗糖>氯化钠>甘露醇>山梨醇,分别为20.6%,8.3%,7.8%,4.3%(图5)。4种高渗缓冲液中,,0.6 mol·L-1蔗糖溶液较适合朱红栓菌原生质体的再生(图4B),再生率为20.6%,显著高于其他3种高渗缓冲液(P<0.05)。氯化钠钠和甘露醇次之,两者间差异不显著。以以 0.6 mol·L-1山梨醇作为高渗缓冲液,原生质体再生率显著降低。
3 结论与讨论
根据都雯玥等的研究报道,制备截短侧耳素产生菌原生质体适宜的酶解温度为35℃,酶解时间为3.5 h[12],与本研究结果一致。酶解温度是影响原生质体释放的的主要因素,适宜的温度可以提高酶液分解细胞壁的活力。朱红栓菌原生质体制备量的高峰在第3.5 h,酶解时间超过4.0h,原生质体制备率下降,继续延长溶壁酶的的作用时间会影响原生质体膜系统,长时间浸泡在酶液中,部分原生质体出现破裂现象,这是因为原生质体失去了细胞壁的保护,较为脆弱,容易破裂。在酶液的配置过程中,酶浓度过高或过低都会导致原生质体产量下降。酶浓度过低,不能充分酶解细细胞壁,导致制备速度缓慢,制备率不高;酶浓度过高,会使酶液脱壁过于彻底,对细胞损伤较大,会影响原生质体的产量及再生率。本研究采用1.5%溶壁酶+1.0%纤维素酶+1.0%蜗牛酶的复合酶作为酶解液,分离原生质体效果较好。根据何小慧等的研究报道,浓度为2.0%的溶壁酶可获得较高的杏鲍菇原生质体制备量[13],与本研究结果中最适酶配比及酶浓度不一致,可能是由于两种真菌细胞壁成分差异较大,以及酶液的种类不同造成的。不同种类真菌细胞壁组成差异较大,所以不同种类真菌原生质体制备的方法和适宜条件有所不同。
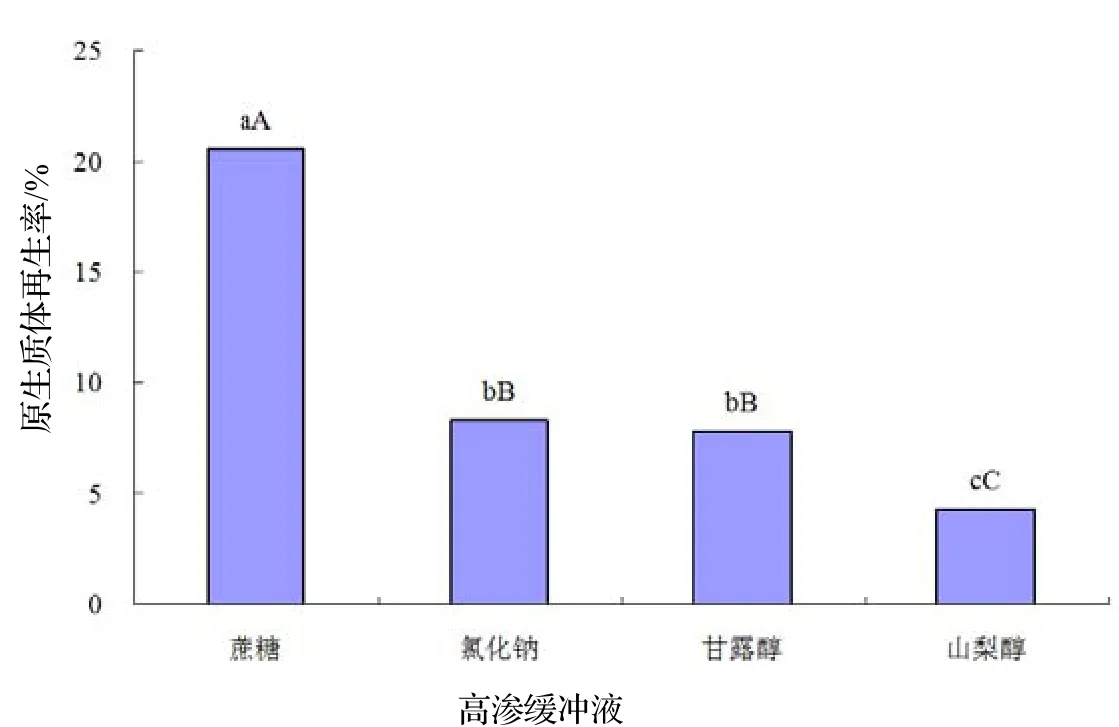
图5 不同高渗缓冲液对原生质体再生率的影响Figure 5 Effect of high osmotic buffers on regeneration rate of T. cinnabarina protoplast
菌丝质量分数由5%增大至20%时,原生质体产量显著升高,当菌丝质量分数超过20%,菌丝体会装满离心管,虽然原生质体制备量还在增加,但随着酶体系中菌丝质量分数的增加,部分菌丝体会从酶液中裸露出来,这会减少菌丝体与酶液的接触,故朱红栓菌菌丝质量分数为20%较为适宜。原生质体再生方面,本研究选择浓度为0.6 mol·L-1的蔗糖溶液作为再生稳渗液,原生质体再生率较高,为20.6%,这可能是由于蔗糖稳渗液既可保持原生质体合适的渗透压,也可为其提供碳源,有利于原生质体的再生。不同体积分数的蔗糖、山梨醇和甘露醇的混合液作为稳渗液,可能会提高再生率,需做进一步研究。
在菌丝体培养过程中,静置培养菌丝以辐射方式生长,菌丝分散,不成球,有利于溶壁酶的酶解[14]。朱红栓菌原生质体制备与再生的过程中,酶解条件对原生质体产量和再生率的影响需做统筹考虑,既要获得较高的原生质体产量,也要保证其再生率。本实验表明,采用1.5% L+1.0% C+1.0% G的复合酶,菌丝质量分数为20%,在30℃下酶解3.5 h为朱红栓菌原生质体制备的最佳条件,原生质体产量为1.0×107个·mL-1。以0.6 mol·L-1蔗糖溶液作为再生高渗缓冲液,原生质体再生率最高达20.6%。
[1] 徐锦堂. 中国药用真菌学[M]. 北京:北京医科大学,中国协和医科大学联合出版,1997.
[2] 卯晓岚. 中国蕈菌[M]. 北京:科学出版社,2009.
[3] De Vries O M H,Wessels J G H. Release of Protoplasts from Schizophyllum commune by a Lytic Enzyme Preparation from Trichoderma viride[J]. J Gen Microbiol,1972(73):13-22.
[4] 邓百万,陈文强. 美味牛肝菌胞外多糖高产菌株的诱变选育[J]. 食品与生物技术学报,2006,25(6):49-53.
[5] 李艳红,李莉,潘延宁. 猴头菌原生质体分离条件研究[J]. 微生物学杂志,2006,26(3):28-30.
[6] 万南安. 秀珍菇原生质体的分离与再生的研究[J]. 岳阳职业技术学院学报,2006,21(5):69-70.
[7] 朱峰,卢卫红,陈忻,等. 朱红栓菌中两个吩噁嗪酮类生物碱的分离与鉴定[J]. 天然产物研究与开发,2014,26(3):358-360.
[8] 王艳华,李剑梅,徐国华,等. 朱红栓菌培养条件初探[J]. 食用菌,2015,37(6):36-38.
[9] 卢卫红,朱峰,刘汉基. 朱红栓菌活性物质的提取及其抗菌活性研究[J]. 畜牧与兽医,2012(S1):375-375.
[10] 郭成金. 蕈菌生物学[M]. 北京:科学出版社,2014.
[11] 卢明锋,张月杰. 丝状真菌AL18的原生质体制备和再生条件的优化[J]. 生物技术,2012,22(3):86-90.
[12] 都雯玥,王鸣刚,梁剑平,等. 截短侧耳素产生菌原生质体的制备条件优化及再生[J]. 甘肃科技,2016,32(9):45-48.
[13] 何小慧,杨民和. 杏鲍菇原生质体制备条件的研究[J]. 安徽农学通报,2014(6):15-17.
[14] 王昱,王义,王康宇,等. 灵芝原生质体的制备与再生研究[J]. 北方园艺,2013(16):184-188.
Study on Preparation and Regeneration of Trametes cinnabarina Protoplast
WANG Yu-jun1,WANG Chang-bao1,2,YUE Li-hong1
(1. College of Life Science, Jiamusi University, Jiamusi 1540072,China; 2. Institute of Environment and Biotechnology, Jiamusi University, Jiamusi 154007, China)
Sporecarp of Trametes cinnabarina was collected in July 2016 in Liangshui National Nature Reserve of Heilongjiang province, and was cut out on PDA agarslantculture-medium under 30℃ for 7 days. Mycelium was inoculated on liquid nutrient medium for protoplast preparation and regeneration test. Single factor and orthogonal test was carried out on enzymolysis temperatures and enzymolysis time, mass fractions of hyphae and enzyme ratios. The result demonstrated that the best condition for protoplast preparation was 0.6 mol·L-1mannitol solution as buffer, 1.5% of lywallzyme, 1.0% of cellulase and 1.0% of glusulase as enzume ratio, 20% of mass fraction of mycelia, 3.5 hours foren zymolysis under 30℃. The yield of protoplast topped to 1.0×107mL-1. The highest regeneration rate was 20.6% with 0.6 mol·L-1sucrose solution as the regeneration stabilizer.
Trametes cinnabarina; single factor experiment; orthogonal experiment; protoplast; preparion; regeneration
Q 949.32
A
1001-3776(2017)05-0048-06
10.3969/j.issn.1001-3776.2017.05.008
2017-04-29;
2017-07-30
佳木斯大学研究生科技创新重点项目(YZ2016-010);黑龙江省自然科学基金项目(C201452)
王玉俊,硕士研究生,从事微生物学研究;E-mail:wangyujun2011@163.com。岳丽红,副教授,从事微生物学研究;E-mail:jmsylh@126.com。
