不同动物源肠球菌耐药性及毒力基因测定与分析
2017-12-13,,,,,,
,,, , , ,
·论著·
不同动物源肠球菌耐药性及毒力基因测定与分析
陈丽颖1,2,张留君1,秦明明1,陈飞1,金钺1,2,胡慧1,2,王亚宾1,2
目的通过测定120株不同来源肠球菌耐药性分布情况,毒力基因cylA、efaA、gelE、esp、ace和AS的携带率,旨在了解肠球菌耐药现状和毒力基因分布情况,为选择临床治疗方案和探索肠球菌致病机制提供参考。方法设计6对特异性引物,应用PCR方法对分离到的120株肠球菌进行6种毒力基因检测,同时用纸片扩散法对11种常用抗生素进行耐药性试验。结果120个肠球菌分离株对抗生素均具有3重以上的耐药性,且不同来源菌株的多重耐药性有明显差异,其中以病死猪内脏分离株多重耐药性最为严重;总体上,上述分离株对林可霉素耐药率最高,为达96.00%(115/120),对环丙沙星、卡那霉素、四环素和达福普汀的耐药率均达到50%以上,而对替考拉宁的耐药率最低,仅为0.83%(1/120)。6种毒力基因cylA、efaA、gelE、esp、ace和AS在受试菌株中的阳性检出率依次为39.17%、56.67%、68.33%、23.33%、26.67%和13.33%;不同来源的肠球菌毒力基因携带率不同,且携带毒力基因数量也有明显差异,其中,来自病死猪内脏的肠球菌分离株携带毒力基因的比例较高,且有超过50%的菌株同时携带4种毒力基因及以上。结论肠球菌的耐药率和多重耐药性与毒力基因携带阳性率有一致性,且与菌株来源关系密切,因此对这一传统意义上的机会性病原体值得深入研究其中的因果关系。
动物;肠球菌;毒力基因;耐药性;聚合酶链式反应
肠球菌分布广泛,是一种重要的条件性致病菌,也是人和动物胃肠道常在菌群成员[1]。近年来,肠球菌已成为医院内感染的重要病原之一,由其引发的医院内感染率不断上升[2-3]。肠球菌还可引起人类食物中毒。另外,肠球菌也可以感染猪、鸡、家蚕、羔羊、驴等多种动物[4-5]。另有研究表明,肠球菌可以在人与动物之间进行水平传播[6]。大量资料显示,肠球菌已经成为具有重要公共卫生学意义的人兽共患病原体。
肠球菌毒力因子与其致病性密切相关,目前已发现十多种[7-10]。大量研究表明,不同种类肠球菌的毒力基因携带率有明显差异,而且肠球菌的毒力因子表型随宿主、环境等多种因素影响而变化复杂。Shankar等(2002)鉴定出粪肠球菌第一个致病岛(pathogenicity island,PAI)并发现其中含有cyl、esp和agg等毒力基因[9]。吴敏等(2008)报道粪肠球菌菌株毒力基因阳性率和数量均明显高于屎肠球菌菌株[11],但Worth等(2008)发现来自住院病人的屎肠球菌VRE菌株携带esp基因的比例高达81.5%[12]。
近年来,由于在人和动物临床中广泛和大剂量应用抗生素,细菌耐药性问题日益突出,给临床治疗带来了极大困难[12-13]。研究证明,肠球菌对多种抗生素有耐受性且具有固有耐药和获得性耐药的特性[14-15]。因此监测肠球菌的耐药状况和寻找高效抗菌药物对于人类医学和兽医实践均具有重要的参考价值和指导意义。
本研究选择11种常用抗菌药物,采用纸片扩散法(K-B法),对自行分离的120个不同来源肠球菌菌株进行了耐药性检测。同时,应用PCR方法检测了肠球菌的6种常见毒力基因,依此分析不同来源肠球菌耐药性及其与毒力基因分布的关系。现报告如下。
1 材料与方法
1.1受试菌株 120株肠球菌均由河南农业大学牧医工程学院微生物实验室分离,并经细菌常规生化试验、16S rRNA基因测定和Vitec-32全自动细菌生化鉴定系统等鉴定至种(属)。菌株来源与数量分别为:牛粪便分离株16,羊粪便分离株21,猪粪便分离株13,蜂猴粪便分离株17,生鲜猪肉分离株19,病死猪内脏分离株34。上述菌株均于50%甘油中在-20 ℃保存,临用时接种于添加0.5%蔗糖的BHI培养基中过夜培养活化。
1.2主要药品与培养基、试剂 供试药敏纸片庆大霉素(10 μg/片,GM)、万古霉素(30 μg/片,VA)、替考拉宁(30 μg/片,TCL)、环丙沙星(5 μg /片,CIP)、氯霉素(30μg /片,C)、卡那霉素(30 μg /片,K)、红霉素(15 μg /片,E)、四环素(30 μg /片,TE)、氨苄西林(10 μg /片,AM)和林可霉素(2 μg /片,林)均由北京天坛药物生物技术开发公司提供;链阳霉素(15 μg /片,QD,奎奴普汀/达福普汀)由赛默飞世尔生物化学制品(北京)有限公司提供。BHI培养基由上海西宝生物科技有限公司生产。
2×PCR TaqMix和EZ-10柱式细菌基因组DNA抽提试剂盒由生工生物工程(上海)股份有限公司提供;琼脂糖(西班牙进口分装)、溶菌酶和DNA Marker均购自宝生物工程(大连)有限公司;酚、氯仿、异戊醇购自郑州瑞兴科技有限公司;其他试剂均为国产分析纯产品。
1.3主要仪器设备 主要包括:PTC-200型PCR扩增仪(美国Bio-rad公司),SIGMA3K30高速冷冻离心机(德国Sigma公司),DYY-6C型电泳仪(北京市六一仪器厂),ZF型紫外投射反射分析仪(上海康华生物仪器制造厂);SHA-C水浴恒温振荡器;微量加样器(德国Eppendorf公司);sp-D垂直净化工作台(蚌埠净化设备厂);AlphaImagerTM2200型凝胶成像仪(美国ProteinSimple公司)。
1.4细菌耐药表型检测 采用纸片扩散法(K-B法)。分别取分离菌株培养物100 μL于BHI琼脂平板上(每平皿倾注培养基约15 mL,厚度约2~3 mm),用细菌涂棒均匀涂布;待菌液稍干燥后,将药敏纸片紧贴于平板表面,以药敏片间距不少于24 mm、纸片中心距平皿边沿不少于15 mm为宜,37 ℃培养24 h;用游标卡尺测量各抑菌圈直径,并记录结果。根据美国临床和实验室标准化协会(CLSI,M100-S22,2012)的标准进行敏感性结果判读[16]。
1.5 细菌毒力基因测定
1.5.1细菌基因组DNA的提取 采用EZ-10柱式细菌基因组DNA抽提试剂盒,按照试剂盒使用说明进行操作,提取肠球菌基因组DNA并经核酸电泳检查。
1.5.2肠球菌6种毒力基因PCR引物设计及合成
根据GenBank和文献[18]公布的基因序列,自行设计检测肠球菌6种常见毒力基因的PCR引物,并由生工生物工程(上海)股份有限公司合成。引物序列和目的条带大小见表1。
1.5.3PCR反应体系 25 μL PCR反应体系:其中2×PCR TaqMix 8 μL;上、下游引物各1 μL;模板DNA 2 μL,最后补充双蒸去离子水至25 μL总量。
1.5.4扩增程序 94 ℃预变性5 min,94 ℃变性1 min,退火各1 min,退火温度分别为:cylA53.3 ℃、ace46.5 ℃、gelE51.7 ℃、efaA54 ℃、AS54.6 ℃、esp58.1 ℃,72 ℃延伸1 min,从第2步开始30个循环,72 ℃再延伸10 min,最后12 ℃保存。
1.5.5空白对照 反应体系中未加入DNA模板,用双蒸去离子水代替模板,扩增条件同上。
1.5.6PCR产物分析 取10 μL PCR 产物,经含GoldView 的1.0%琼脂糖凝胶110 V电压下电泳30 min后,用紫外投影仪观察结果,以Marker DL 2000为分子量对照,观察扩增片断的长度。然后,将扩增产物进行胶回收并送至上海生工进行测序。
表1 六种毒力基因引物序列
Tab.1 Primer sequences for six virulence genes

基因Gene引物序列5′-3′Primersequence,5′-3′目的条带大小/bpProductlengthcylA上游ForwardGATGGGACAGATGGAAAC431下游ReverseGAAACTAGCGATGTAGGGace上游ForwardAAAGTAGAATTAGATCCACAC320下游ReverseTCTACTACATTCGGTTGCGgelE上游ForwardAGTTCATGTCTATTTTCTTCAC402下游ReverseCTTCATTATTTACACGTTTGefaA上游ForwardGTGAGAAAGAAATGGAGGA499下游ReverseCTACTAACACGTCACGAATGAS上游ForwardCCAGTAATCAGTCCAGAAACAACC406下游ReverseTAGCTTTTTTCATTCTTGTGTTTGTTesp上游ForwardTTGCTAATGCTAGTCCACGACC932下游ReverseGCGTCAACACTTGCATTGCCGA
2 结 果
2.1 耐药性试验结果
2.1.1肠球菌耐药性试验总体结果 试验发现,120个肠球菌分离株对替考拉宁的耐药率最低,仅为0.83%(1/120);对林可霉素耐药率最高,为96.00%(115/120);而50%以上的菌株对环丙沙星、卡那霉素、四环素、达福普汀耐受。上述肠球菌分离株对替考拉宁和氨苄西林的敏感率较高,分别为75.00%(90/120)和74.17%(89/120);全部菌株对林可霉素不敏感。详见表2。
表2 肠球菌总体耐药性试验结果(%)
Tab.2 Antibiotic resistance test results of Enterococcus isolates

药物Drug耐药率Resistant中介率Intermediate敏感率Sensitive药物Drug耐药率Resistant中介率Intermediate敏感率Sensitive庆大霉素Gentamicin81.67107.50四环素Tetracycline80.836.6710.83环丙沙星Ciprofloxacin54.1738.335.00红霉素Erythromycin45.0049.175.83万古霉素Vancomycin20.8336.6742.50氨苄西林Ampicillin22.50074.17替考拉宁Teicoplanin0.8324.1775.00林可霉素Lincomycin96.004.000氯霉素Chloromycetin36.6712.5050.83达福普汀Dalfopristin64.1725.009.17卡那霉素Kanamycin87.913.308.79
2.1.2不同来源肠球菌分离株对11种常见抗菌药耐药性试验结果 经检测,不同来源肠球菌对抗生素的耐受性不同(详见表3)。其中,各种来源肠球菌均对林可霉素高度耐药(耐药率在90%以上);对替考拉宁耐药的菌株仅局限于猪粪源肠球菌(7.69%);肠球菌对卡那霉素的耐药率也非常普遍,耐药率均高于70%;此外,各来源肠球菌菌株对庆大霉素和达福普汀的耐药性均超过45%。
表3 不同来源肠球菌耐药性试验结果 (%)
Tab.3 Antibiotic resistance test results of swine and sheep fecal Enterococcus isolates (%)

抗菌药Drug猪粪源分离株Swinefecalisolates羊粪源分离株Ovinefecalisolates耐药率Resistant中介率Intermediate敏感率Sensitive耐药率Resistant中介率Intermediate敏感率Sensitive庆大霉素Gentamicin92.3107.6942.8628.5728.57环丙沙星Ciprofloxacin15.3876.927.6919.0557.1423.81万古霉素Vancomycin30.7738.4630.774.7619.0576.19替考拉宁Teicoplanin7.697.6984.6204.7695.24氯霉素Chloromycetin53.85046.1514.2914.2971.43卡那霉素Kanamycin76.9215.387.6976.19023.81四环素Tetracycline92.3107.6923.8128.5747.62红霉素Erythromycin84.627.697.699.5285.714.76林可霉素Lincomycin1000090.489.520达福普汀Dalfopristin69.2330.77047.6247.624.76氨苄西林Ampicillin30.77069.2319.05080.95抗菌药Drug蜂猴粪源肠球菌Lorisfecalisolates牛粪源肠球菌Bovinefecalisolates耐药率Resistant中介率Intermediate敏感率Sensitive耐药率Resistant中介率Intermediate敏感率Sensitive庆大霉素Gentamicin1000068.7531.250环丙沙星Ciprofloxacin47.0635.29025.0075.000万古霉素Vancomycin58.8241.18012.5056.2531.25替考拉宁Teicoplanin029.4170.59018.7581.25氯霉素Chloromycetin41.1841.1817.656.256.2587.50卡那霉素Kanamycin———87.50012.50四环素Tetracycline88.240087.506.256.25红霉素Erythromycin47.0641.1811.7612.5075.0012.50林可霉素Lincomycin0088.2418.75081.25达福普汀Dalfopristin———10000氨苄西林Ampicillin70.5911.765.8856.2531.2512.50抗菌药Drug病死猪内脏源肠球菌Diseasedviscusisolates生鲜肉源肠球菌Rawporkisolates耐药率Resistant中介率Intermediate敏感率Sensitive耐药率Resistant中介率Intermediate敏感率Sensitive庆大霉素Gentamicin94.122.942.9447.37052.63环丙沙星Ciprofloxacin94.125.88078.9521.050万古霉素Vancomycin11.7620.5967.6521.0563.1615.79替考拉宁Teicoplanin047.0652.94015.7984.21表3(续)抗菌药Drug病死猪内脏源肠球菌Diseasedviscusisolates生鲜肉源肠球菌Rawporkisolates耐药率Resistant中介率Intermediate敏感率Sensitive耐药率Resistant中介率Intermediate敏感率Sensitive氯霉素Chloromycetin76.4711.7611.7600100卡那霉素Kanamycin97.062.94010000

四环素Tetracycline94.122.942.9410000红霉素Erythromycin73.5326.47031.5863.165.26林可霉素Lincomycin11.76088.2473.68026.32达福普汀Dalfopristin——————氨苄西林Ampicillin76.478.8214.7157.8931.5810.53
2.1.3不同来源肠球菌多重耐药结果 肠球菌的多重耐药测定结果显示,各肠球菌分离株均具有3重以上的耐药性,但不同来源菌株的多重耐药性有统计学差异。其中以病死猪内脏分离株表现最为严重,达到或超过7重耐药的菌株占比高达61.53%(21/34);猪粪便、生鲜肉、蜂猴粪便分离株中超过6重耐药的菌株亦在50%以上;相比之下,羊粪便分离株的多重耐药现象略轻,绝大多数菌株均在5重耐药以下(20/21)。
2.2 不同来源肠球菌6种毒力基因检测结果
2.2.1肠球菌6种毒力基因PCR检测结果 肠球菌6种毒力基因cylA、efaA、gelE、esp、ace、AS的PCR扩增片段预期大小依次为431 bp、499 bp、402 bp、932 bp、320 bp和406 bp(如图1)。扩增产物经测序证明其序列正确。PCR结果显示,120株肠球菌分离株携带上述6种毒力基因的阳性率分别为30.19%(cylA)、59.12%(efaA)、75.47%(gelE)、18.24%(esp)、26.42%(ace)和10.06%(AS),其中以gelE基因的携带率最高,而AS基因携带率最低。在各分离株中同时携带3种、4种、5种、6种毒力基因的菌株分别有27株(22.5%)、12株(10.0%)、9株(7.5%)和5株(4.17%)。
2.2.2不同来源肠球菌毒力基因携带情况与分析
不同来源肠球菌毒力基因携带情况见表4。由表4可知,各毒力基因的携带情况在不同来源的肠球菌菌株中有显著区别。其中,efaA基因在生鲜肉分离株中携带率高达89.4%,而在牛粪源肠球菌中最低(18.8%);AS基因在各种来源分离株中携带率均最低。
值得注意的是,病死猪内脏分离株毒力基因携带率明显高于其他来源菌株,尤其是gelE和cylA基因的阳性率均高达97.1%(33/34)。进一步分析发现,该来源菌株中同时携带多种毒力基因的数量也显著高于其他来源菌株,例如,同时携带4~6种毒力基因的菌株数高达13个(13/34)。
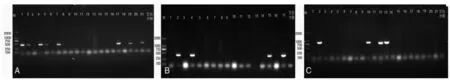
M:DNA分子量标记 A:部分菌株efaA基因PCR电泳图 B:部分菌株cylA基因PCR电泳图 C:部分菌株esp基因的PCR电泳图 编号1~21表示分离菌株。M:DNA marker A:Gel eleclrophoresis for PCR product of virulence gene efaA B:Gel electrophoresis for PCR product of virulence gene cylA C:Gel electrophoresis for PCR product of virulence gene esp No 1~21:number of isolates图1 部分肠球菌分离株的部分毒力基因PCR电泳图Fig.1 The gel electrophoresis result of some virulence genes in Enterococcal isolates
表4 不同来源肠球菌分离株毒力基因携带情况
Tab.4 Carriage rates of virulence genes in Enterococci isolates from different sources

毒力基因Virulencegene牛粪便Bovinefeces羊粪便Ovinefeces猪粪便Swinefeces阳性数/样品数Positive/sample携带率%Carriage%阳性数/样品数Positive/sample携带率%Carriage%阳性数/样品数Positive/sample携带率%Carriage%efaA3/1618.88/2138.18/1361.5gelE6/1637.511/2152.45/1338.5esp2/1612.54/2119.05/1338.5AS2/1612.54/2119.01/137.7ace0/1607/2133.35/1338.5cylA2/1612.54/2119.04/1330.8毒力基因Virulencegene蜂猴粪便Lorisfeces生鲜肉Rawpork病死猪内脏Deadpigviscus阳性数/样品数Positive/sample携带率%Carriage%阳性数/样品数Positive/sample携带率%Carriage%阳性数/样品数Positive/sample携带率%Carriage%efaA15/1788.217/1989.417/3450.0gelE13/1776.414/1973.633/3497.1esp5/1729.42/1910.510/3429.4AS0/1702/1910.57/3420.6ace4/1723.54/1921.112/3435.3cylA4/1723.50/19033/3497.1
3 讨 论
当前,细菌耐药性肠球菌耐药性越来越强,临床发病报道越来越多。肠球菌属因其固有和获得性耐药性,给临床肠球菌感染的治疗造成了很大困难,治疗肠球菌感染应依据分离株的耐药特点选择相应的治疗方案,严格控制抗菌药的使用,以达到最好的治疗效果和减少新的耐药菌株的产生。
本次分离的肠球菌菌株对临床常用的抗菌药物均产生了一定的耐药性,且多为具有多重耐药的菌株。这与来源于医院内感染肠球菌株的耐药性报道相同[17]。在耐药性试验中,病死猪内脏中分离的肠球菌耐药性也要高于其他来源菌株,而且其多重耐药性也明显较高;而且,具有6重耐药性以上菌株占病死猪内脏中分离株总数79.41%,居6种来源肠球菌之首。这在人源分离株中也有类似报道[18]。
肠球菌感染的致病机制复杂,单一毒力因子并不能决定其致病性,而是有多种因子参与其致病过程[16]。目前公认的肠球菌主要毒力因子有Cyl、GelE、AS、Ace、Esp和EfaA,这些毒力因子在抵抗机体的免疫清除,增强肠球菌吸附、侵入、抗杀死以及损伤机体的能力方面起着不同的作用。本次调查的病死猪内脏分离株携带毒力基因的种类和数量远高于其他来源肠球菌分离株,也说明病死猪内脏分离株较其他来源肠球菌具有较高的毒力。
祝进等研究分析了粪肠球菌健康人分离株和临床分离株的毒力基因携带情况,发现临床分离株毒力基因阳性率明显高于健康人分离株[17]。本研究对120株不同来源肠球菌的毒力基因的检测结果表明,分离自病死猪内脏的菌株毒力基因携带率明显高于其他来源的肠球菌。由此可见,在肠球菌由正常定植菌到致病菌的转变过程中,其主要毒力因子的表达同时增强,但其机制尚有待于进一步研究。
[1] Fisher K, Phillips C. The ecology, epidemiology and virulence ofEnterococcus[J]. Microbio, 2009, 155: 1749-1757. DOI:10.1099/mic.0.026385-0
[2] Noskin G, Peterson L, Warren J.EnterococcusfaeciumandEnterococcusfaecalisbacteremia: acquisition and outcome[J]. Clin Infect Dis, 1995, 20: 296-301. DOI:10.1093/clinids/20.2.296
[3] Sanchez-Silos RM, Perez-Giraldo C, Martin P, et al. Pathogenicity ofEnterococcusspp. characteristics of 169 hospital isolates[J]. Enferm Infect Microbiol Clin, 2000, 18: 165-169.
[4] Baddour LM, Harris E, Huycke MM, et al. Outbreak of pseudobacteremia due to multidrug- susceptibleEnterococcusfaecium[J]. Clin Infect Dis, 1999, 28: 1333-1334. DOI: 10.1086/517791
[5] Top J, Willems R, van der Velden S, et al. Emergence of clonal complex 17Enterococcusfaeciumin The Netherlands[J]. J Clin Microbiol,2008, 46(1): 214-219. DOI:10.1128/JCM.01351-07
[6] Van den Bogaard AE, Jansen LB, Stobberingh EE. Vancomycin-resistant enterococci in turkeys and farmers[J]. N Engl J Med,1997,337:1558-1559.DOI:10.1056/NEJM199711203372117
[7] Giridhara Upadhyaya PM, Ravikumar KL, Umapathy BL. Review of virulence factors of enterococcus: An emerging nosocomial pathogen[J]. Indian J Med Microbiol,2009, 27: 301-305. DOI:10.4103/0255-0857.55437
[8] Wang YB, Chen LY, Zhang HY, et al. Identification and determination of virulence gene for different isolates ofE.faecalisoriginated from infected piglets[J]. Chin J Vet Sci, 2010, 30(5): 615-619. (in Chinese)
王亚宾, 陈丽颖, 张红英, 等. 感染仔猪粪肠球菌不同分离株的鉴定和毒力基因测定[J]. 中国兽医学报,2010, 30(5): 615-619.
[9] Shankar N, Baghdayan AS, Willems R, et al. Presence of Pathogenicity island genes inEnterococcusfaecalisisolates from pigs in Denmark [J]. J Clin Microbiol, 2006, 44(11): 4200-4203. DOI: 10.1128/ JCM.01218-06
[10] Zoletti GO, Pereira EM, Schuenck RP,et al. Characterization of virulence factors and clonal diversity ofEnterococcusfaecalisisolates from treated dental root canals[J]. Res Microbiol, 2011, 162(2):151-158. DOI:10.1016/j.resmic.2010.09.018
[11] Wu M. presence of virulence genes, PAI-associated genes and drug resistance inE.faecalisandE.faecium[D].Guangzhou:Southern Medical University,2008(in Chinese)
吴敏. 粪肠球菌和屎肠球菌毒力基因、PAI相关基因及耐药性分析[D]. 广州:南方医科大学, 2008.
[12] Worth LJ, Slavin MA, Vankerckhoven V, et al. Virulence determinants in vancomycin-resistantEnterococcusfaeciumvanB: clonal distribution, prevalence and significance of esp and hyl in Australian patients with haematological disorders[J]. J Hosp Infect, 2008, 68: 137-144. DOI:10.1016/j.jhin.2007.10.017
[13] Shen ZY,Wang HB, Sun ZY, et al. A surveillance on the bacterial resistance in surgical infection in Hubei area[J].Chin J Gene Surge, 2001, 28(4): 215-216. (in Chinese)
申正义, 王红波, 孙自镛. 湖北地区外科感染常见致病菌1 314株耐药性监测分析[J]. 中华普通外科杂志,2001, 28(4): 215-216.
[14] Jansen LB, Hammerum AM, Poulsen RL, et a1.Vancomycin-resistantEnterococcusfaeciumstrains with highly similar pulsed-field gel electrophoresis patterns containing similar Tn1546-like elements isolated from a hospitalized patient and pigs in Denmark[J]. Antimicro Agents Chemother, 1999, 43: 724-725. PMID:10070584
[15] Ruiz-Garbajosa P, Canto′n R, Pintado V, et al. Genetic and phenotypic differences amongEnterococcusfaecalisclones from intestinal colonisation and invasive disease[J]. Clin Microbiol Infect. 2006, 44(12): 1193-1198. DOI:10.1111/j.1469-0691.2006.01533.x
[16] Sun CG. Standard for the implementation of antimicrobial drug susceptibility tests[S]. CLSI_M100-S22, 2012(in Chinese)
孙长贵译. 抗菌药物敏感性试验执行标准[S].美国临床和实验室标准化协会(CLSC). 2012.
[17] Zhu J, Bai YF, Lu J, et al. The incidence of virulence genes and antibiotic resistence inEnterococcusfaecalisstrain[J]. J Radioimmunol, 2012, 25(3): 276-279. (in Chinese)
祝进, 白永凤, 陆军,等. 粪肠球菌毒力基因及耐药性分析[J].放射免疫学杂志,2012, 25(3): 276-279.
[18] Li C. Analysis of healthy check-up and hospitalization intestinal carry bowel coccus drug resistance[J]. J Aerospace Med,2012,23(9):1045-1047. (in Chinese)
李朝. 健康体检者与住院患者肠道携带肠球菌耐药性分析[J]. 航空航天医学志, 2012, 23(9):1045-1047.
DrugresistancespectrumandvirulencegenedistributioninEnterococcusisolatesofanimalorigin
CHEN Li-ying1,2, ZHANG Liu-jun1, QIN Ming-ming1, CHEN Fei1, JIN Yue1,2, HU Hui1,2, WANG Ya-bin1,2
(1.CollegeofAnimalHusbandryandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China; 2.HenanKeyLaboratoryofAnimalFoodSafety,Zhengzhou450002,China)
One hundred and twenty enterococcal isolates, which were identified from animal specimen, were investigated for the drug-resistance and virulence gene status ofEnterococci, so as to provide reference for clinical therapy as well as exploration ofEnterococcuspathogenicity. For the 120Enterococcusisolates, six virulence genescylA,efaA,Gele,esp,aceandASwere detected with PCR method, and drug-resistance of 11 commonly used antibiotics were measured by K-B disk diffusion tests. The results showed that all of the 120 isolates presented resistance to at least 3 kinds of drugs, and multi-resistance occurred among different originated strains, especially prominent among those isolates from dead swine organs. Generally, the isolates performed highest resistance ratio against lincomycin (115/120), and more than 50 percent isolates were resisted to ciprofloxacin, kanamycin, tetracycline and dalfopristin, while the isolates were least resistant to teicoplanin (1/120). The incidence ofcylA,efaA,GelE,esp,aceandASvirulence genes, as a whole, was 39.17%, 56.67%, 68.33%, 23.33%, 26.67% and 13.33%, respectively, but it varied markedly among those of different sources, which showed consistent trend with that drug resistance. It is concluded that the drug-resistance incidence among the test enterococcal isolates showed correlation with that of virulence gene status, and both were closely related to the bacteria origin, therefore, the conventional opportunisticEnterococcusis of value for further exploring these profound relations.
animal;Enterococcus; virulence gene; drug-resistance; polymerase chain reaction
Wang Ya-bin, Email: ybwang8686@126.com
10.3969/j.issn.1002-2694.2017.11.007
河南省重点科技攻关项目(No.152102310081)
王亚宾,Email:ybwang8686@126.com
1.河南农业大学牧医工程学院,郑州 450002;
2.河南省动物性食品安全重点实验室,郑州 450002
R378.1
A
1002-2694(2017)11-0984-07
Supported by the Henan Provincial Science and Technology Key Project(No.152102310081)
2017-06-26编辑李友松
