多重PCR结合核酸侵入反应及纳米金显色技术检测病毒性脑炎脑膜炎病原体
2017-12-13,,,,,,,
,, ,,,, ,
·论著·
多重PCR结合核酸侵入反应及纳米金显色技术检测病毒性脑炎脑膜炎病原体
樊欢,戚宇华,朱政,崔仑标,葛以跃,赵康程,吴涛,史智扬
目的建立一种病毒性脑炎脑膜炎病原体多重PCR结合核酸侵入反应及纳米金显色的检测方法。方法针对几种重要的脑炎脑膜炎病毒(东方马脑炎病毒、西方马脑炎病毒、流行性乙型脑炎病毒、西尼罗病毒和尼帕病毒)保守区基因设计引物,进行多重PCR反应、核酸侵入反应及纳米金显色反应,对多种脑炎脑膜炎病毒同时进行检测,以森林脑炎病毒、圣路易脑炎病毒、基孔肯雅病毒和登革病毒4种病原核酸评价其检测特异性,以体外转录的病毒RNA或扩增的PCR片段评价其检测敏感性, 并对流行性乙型脑炎患者临床标本进行检测。结果成功建立了一种脑炎脑膜炎病毒多重PCR结合核酸侵入反应及纳米金显色的检测技术。建立的检测方法可特异的检测目的病原体,且与森林脑炎病毒、圣路易脑炎病毒、基孔肯雅病毒和登革病毒无交叉反应。该方法对不同靶标的检测灵敏度均为103拷贝/μL, 临床标本检测结果均为阳性。结论建立的脑炎脑膜炎病毒多重PCR结合核酸侵入反应及纳米金显色技术的检测方法,具有较高的检测特异性及灵敏度,检测通量高,肉眼即可观察结果,在传染病病原体检测方面具有广阔的应用前景。
病毒性脑炎脑膜炎;多重PCR;核酸侵入反应;纳米金显色
病毒感染引起的神经系统损伤已经逐渐成为临床上最常见的中枢神经系统感染性疾病。其临床表现为:发热、头疼、呕吐、意识模糊、颈项强直、呼吸衰竭、多器官损伤,甚至导致死亡。常见的可能诱发脑炎脑膜炎的病毒包括虫媒病毒类的东方马脑炎病毒、西方马脑炎病毒、流行性乙型脑炎病毒和西尼罗病毒,副粘病毒科尼帕亨德拉病毒属的尼帕病毒等,这5种病毒均为RNA病毒,且均为烈性人兽共患传染病病原体,可造成烈性传染病暴发流行,严重危害公共卫生的安全[1-3]。不同脑炎脑膜炎病毒引起人的感染症状及流行特征相似,因此仅靠临床症状很难明确病原体,因此亟待研究一种早期快速准确鉴别这5种病毒的检测方法。
当前,针对脑炎脑膜炎病毒的PCR(包括荧光定量PCR)诊断技术已在国内外得到应用。然而脑炎脑膜炎病毒种类繁多,荧光定量PCR检测技术由于荧光相互干扰很难做到高通量检测,多重PCR检测技术虽然通量高,但其扩增产物需要通过琼脂糖凝胶电泳进行鉴定,不仅操作繁琐,需要电泳设备,而且很难区分与目的条带大小接近的非特异性扩增产物。针对以上不足,本研究利用多重PCR结合核酸侵入反应[4-5]及纳米金显色技术[6]建立了一种针对脑炎脑膜炎病毒的检测方法,可对东方马脑炎病毒、西方马脑炎病毒、流行性乙型脑炎病毒、西尼罗病毒和尼帕病毒同时进行检测,以期为脑炎脑膜炎病毒的快速鉴定提供一种敏感、特异、高效的方法。
1 材料与方法
1.1 材料
1.1.1毒株与样本选择 东方马脑炎病毒(EEEV)E2基因、西方马脑炎病毒(WEEV)、E1基因、西尼罗病毒(WNV)、non-structural protein 5基因及尼帕病毒(NiPA)nucleoprotein 基因为北京六合华大基因科技有限公司合成,并克隆于pUC57载体。流行性乙型脑炎病毒(JEV)、森林脑炎病毒(TBEV)、圣路易脑炎病毒病病毒(StLEV)、基孔肯雅病毒(CHIKV) 和登革病毒(DV)均为本实验室分离、鉴定、保存。
1.1.2仪器与试剂 全自动核酸提取仪MagNA Pure LC及配套试剂(Roche公司),QIAxcel毛细管电泳仪及配套试剂(QIAGEN公司),Multiplex PCR Kit(QIAGEN公司)。发卡探针、核酸内切酶及纳米金探针由南京军区军事医学研究所周国华课题组提供。
1.2 方法
1.2.1核酸提取 采用Roche公司MagNA Pure LC全自动核酸提取仪和MagNA Pure LC Total Nucleic Acid Isolation Kit提取上述毒株核酸并放置于-80 ℃保存。
1.2.2RNA逆转录 根据Invitrogen公司SuperScript III First-Strand Synthesis SuperMix 说明书操作方法,使用该试剂盒提供的随机引物将JEV、TBEV、StLEV、CHIKV和DV病毒核酸逆转录为DNA置于-20 ℃保存。
1.2.3多重PCR引物及核酸侵入反应探针的设计与合成 检索文献、查询NCBI GenBank数据库,下载病原体基因序列,通过MEGA 5.1软件进行序列比对,查找上述病原基因保守序列,确定待测病原体靶片段。通过Primer 5.0设计针对各病原体的扩增引物。利用Universal Invader 1.2.4 软件设计核酸侵入反应的上、下游探针。序列如表1及表2所示,以上引物均由上海生工生物工程公司合成。
表1 多重PCR引物
Tab.1 Primers of multiplex PCR

引物Primer序列(5′-3′)Sequence(5′-3′)片段大小/bpFragmentlengthEEEV⁃FTCACCCAGTATAAGCTGGCA278EEEV⁃RGTAATAGCCGTGGTGCGACAWEEV⁃FACCACAAGTTAAATGCTGCG299WEEV⁃RGTGAGGAACCTGGCGTGACGWNV⁃FGACACTACTCCYTTYGGVCA301WNV⁃RCCCGCAGATGYGCCTCRCGCNiPA⁃FTGATTAGATCTCCGAGTGCT286NiPA⁃RAGACCGTAAGCTCGGCTGTCJEV⁃FCACTGACATYTCRACGGTGG302JEV⁃RTTGCCGCCTGGGACGCCCYW
表2 核酸侵入反应探针
Tab.2 Probes of invasive reaction

探针Probe序列(5′-3′)Sequence(5′-3′)EEEV⁃F′CAACCTGCATGTGCGCATEEEV⁃R′CGCGCCGAGGCCTCWGCCCCTTGTWEEV⁃F′AGGGTACACACCGCCRAAAATWEEV⁃R′CGCGCCGAGGCGCGGCATGTGTAAWNV⁃F′CCGCCAGAAGGAGTGAAGTTWNV⁃R′CGCGCCGAGGAYGTSCTCAAYGAGACNiPA⁃F′CARGAGGAGATGGAAGGCTTGTNiPA⁃R′CGCGCCGAGGATGAGAATCCTCAARACTGCJEV⁃F′TGCGCTGARTAATTCCMATGGTCJEV⁃R′CGCGCCGAGGTTTCYGARGTGGTGG
1.2.4多重PCR反应 利用表1中多重PCR引物,参照QIAGEN Multiplex PCR Kit说明书配置多重PCR反应体系(20 μL),每个体系中均含5对扩增引物,终浓度为1 μmol,向各体系中分别加入EEEV、WEEV、WNV、NiPA和JEV核酸模板,并设置阴性对照。PCR反应条件为:95 ℃变性、15 min, 94 ℃、30 s,60 ℃、90 s, 72 ℃、90 s,40个循环,72 ℃延伸10 min,99 ℃,10 min灭活DNA酶。扩增产物通过QIAxcel毛细管电泳仪进行检测验证。
1.2.5核酸侵入反应及纳米金探针杂交反应 核酸侵入反应体系(20 μL)包括:上、下游核酸侵入反应探针及发卡探针0.2 μmol,发卡探针序列为:5′-GTCTTGTGGTACTGCACTCGTCTCGGTTTT-CCGAGACGAGTCCTCGGCGCGAATATTGAT-AATCAT-3′,核酸内切酶AfuFEN 1 L,体系配制完成后,每管加入10 μL矿物油,再加入5 μL多重PCR扩增产物;核酸侵入反应程序为:85 ℃、1 min,63 ℃、20 min。向反应完成的核酸侵入反应体系中加入纳米金探针6 μL,3 mol NaCl 5 μL震荡混匀后55 ℃,30 min进行纳米金显色反应。
1.2.6特异性试验 采用上述多重PCR扩增体系,分别扩增EEEV、WEEV、WNV、NiPA、JEV、TBEV、StLEV、CHIKV和DV的核酸样品,每一种反应产物均采用方法中的5种核酸侵入反应探针进行检测,以观察该方法的检测特异性。
1.2.7敏感性试验 针对RNA病毒JEV、EEEV、WEEV、WNV及NiPA病毒样本,以带有T7 RNA聚合酶启动子序列(5′-AATTCTAATACGACTCACTATAGGGAG-3′)的上游引物和下游引物对病毒核酸进行扩增,扩增产物纯化回收后,以T7 RNA聚合酶进行体外转录获得每一种病原的RNA,纯化定量后10倍稀释成1×100~1×104拷贝模板/μL。取1 μL梯度稀释后的模板,采用上述多重PCR反应结合核酸侵入反应及纳米金显色技术进行检测。
1.2.8临床标本检测 取15份乙脑病毒抗体检测阳性病人的急性期血清标本,提取RNA, 按照上述多重PCR反应结合核酸侵入反应及纳米金显色技术进行检测。同时, PCR反应产物送上海生工技术有限公司测序。
2 结 果
2.1多重PCR反应 对EEEV、WEEV、WNV、NiPA和JEV的核酸目的片段进行多重PCR反应后,扩增产物通过QIAxcel毛细管电泳仪进行检测,检测结果均在预测位置上出现单一的目的条带(见图1)。

1:size marker;2:阴性对照;3-7:EEEV、WEEV、WNV、NiPA和JEV目的片段扩增条带1: size marker; 2: negative control; 3-7: multiplex PCR amplification results of EEEV, WEEV, WNV, NiPA and JEV图1 多重PCR扩增产物毛细管电泳结图Fig.1 Capillary electrophoretogram of multiplex PCR product
2.2核酸侵入反应及纳米金显色体系的建立 对上述多重PCR扩增产物进行核酸侵入反应及纳米金显色后,EEEV、WEEV、WNV、NiPA和JEV的检测结果均为肉眼可见的红色,而阴性对照为无色(图2),表明成功建立了多重PCR结合核酸侵入反应及纳米金显色技术对脑炎脑膜炎病毒进行检测。

注:2、4、6、8、10为EEEV、WEEV、WNV、NiPA和JEV阳性标本纳米金检测结果;1、3、5、7、9为EEEV、WEEV、WNV、NiPA和JEV阴性对照纳米金检测结果2, 4, 6, 8, 10 are results of chromogenic reaction catalyzed by gold nanoparticles for EEEV, WEEV, WNV, NiPA and JEV positive samples; 1, 3, 5, 7, 9 are results of chromogenic reaction catalyzed by gold nanoparticles for EEEV, WEEV, WNV, NiPA and JEV negative control图2 纳米金显色结果Fig.2 Results of chromogenic reaction catalyzed by gold nanoparticles
2.3特异性检测结果 脑炎脑膜炎病毒EEEV、WEEV、WNV、NiPA和JEV在采用多重PCR反应结合核酸侵入反应及纳米金显色技术进行检测后只有对应核酸侵入反应探针的检测体系为阳性,其余侵入反应体系均为阴性。其他病毒如TBEV、StLEV、CHIKV和DV在上述所有核酸侵入反应体系中均为阴性(表3),表明本方法用于检测脑炎脑膜炎病毒具有较高特异性。
2.4敏感性检测结果 多重PCR反应结合核酸侵入反应及纳米金显色敏感性检测结果显示,该方法检测EEEV、WEEV、WNV、NiPA和JEV病毒最低检测限为103拷贝/μL(图3)。
2.5临床标本检测结果 采用多重PCR反应结合核酸侵入反应及纳米金显色技术检测15份临床血清标本,检测结果均为乙型脑炎病毒阳性。PCR反应产物的测序结果经NCBI数据库比对,扩增产物的核苷酸序列与数据库中流行性乙型脑炎病毒基因同源性均达到98%以上。
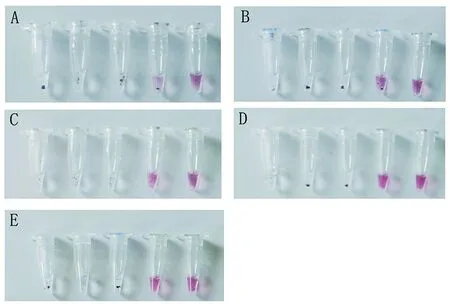
A、B、C、D、E分别为EEEV、WEEV、WNV、NiPA和JEV敏感性检测结果示意图;检测限从左至右依次为:1,10,100,1 000,10 000拷贝/μLA, B, C, D, E are result of sensitivity test for EEEV, WEEV, WNV, NiPA and JEV; Detection limits are 1, 10, 100, 1 000, 10 000 copies/μL from left to right图3 敏感性检测结果Fig.3 Result of sensitivity test
表3 多重PCR结合核酸侵入反应及纳米金显色技术检测脑炎脑膜炎病毒特异度结果
Tab.3 Specificity of multiplex PCR combined with invasive reaction and chromogenic reaction catalyzed by gold nanoparticles in detection of encephalitis and meningitis virus

探针Probe病原体OrganismEEEVWEEVWNVNiPAJEVTBEVStLEVCHIKVDVEEEVprobe+--------WEEVprobe-+-------WNVprobe--+------NiPAprobe---+-----JEVprobe----+----
注:+ 表示检测结果为阳性,- 表示检测结果为阴性
Note: + positive result; - negative result
3 讨 论
目前,东方马脑炎病毒、西方马脑炎病毒、西尼罗病毒和尼帕病毒在我国尚未流行,但由于我国部分地区的地理、气候、传播媒介等条件与上述病毒流行区域——非洲、中、南美洲等地区相似,并且随着全球经济的发展,全球贸易一体化等趋势,每年数百万人口出入疫区,在我国边境口岸对来自疫区的人群、动物、禽类以及相关传播媒介等开展检测与检疫,将有效防控上述病毒传入我国[7]。由于这5种病毒的自然宿主和传播媒介相同或者类似,临床症状也大致相同,因此建立同时可检测这5中病毒的快速检测方法可显著提高检测效率,对于边境口岸的检测检疫具有重要意义。
现有脑炎脑膜炎病毒实验室诊断技术中,以病毒分离培养、酶联免疫法和血清中和试验为主。这些方法存在着所需时间过长,灵敏度较低等缺点。近年来,PCR检测技术因其具有较好的敏感性和特异性,在各种分子诊断中得到了广泛应用和发展,但基本都是用于单种病毒检测(如乙型脑炎病毒)而难以对未知病原感染病例做出快速准确诊断。而多重PCR检测技术因其快速、简便和高通量等特点,在病毒检测中得到广泛应用[8-10],但其缺点是操作繁琐,需要电泳设备,而且很难区分与目的条带大小接近的非特异性扩增产物。将多重PCR与核酸侵入反应及纳米金显色技术联用,可利用纳米金显色技术对PCR产物进行肉眼观察,不像其他方法通过检测电泳条带和荧光信号等衍生变化来确定PCR反映结果。因此,多重PCR结合核酸侵入反应及纳米金显色技术在检测多重靶点上具有较明显的优势。
本研究采用多重PCR技术结合核酸侵入反应及纳米金显色来检测脑炎脑膜炎病毒,检测反应整体共分为3个阶段,首先进行多重PCR扩增,实现对目标模板的扩增;接着采用核酸侵入反应[11-14]进行核酸侵入信号放大,将目标模板的检测转化为信号分子的检测,并实现检测信号放大;最后进行纳米金探针杂交反应[6],实现对信号分子的检测。多重PCR技术结合核酸侵入反应及纳米金显色技术可以同时检测多种脑炎脑膜炎病毒,无需电泳设备,肉眼即可观察结果,避免了在电泳过程中出现交叉污染,当不同病原体扩增的核酸片段大小没有明显差异,仍然可以鉴定病原体种类。
本实验针对EEEV、WEEV、WNV、NiPA和JEV保守区基因进行多重PCR反应后,扩增产物通过毛细管电泳检测显示在预测位置上均出现单一的目的条带,将上述扩增产物进行核酸侵入反应及纳米金显色,检测结果显示各个样本的阳性显色结果均为肉眼可见的红色,而阴性对照为无色,待测样本只有采用相应的引物探针时,纳米金显色后才会显示阳性,对于其他脑炎脑膜炎病毒如TBEV、StLEV、CHIKV和DV检测结果均为阴性,无交叉反应。对EEEV、WEEV、WNV、NiPA和JEV采用该方法进行检测时,检测限为1 000拷贝/μL。采用上述方法检测乙型脑炎患者血清标本时,检测结果均为阳性。上述结果表明:多重PCR技术结合核酸侵入反应及纳米金显色方法可以同时检测多种不同脑炎脑膜炎病毒,当不同病原体扩增的核酸片段大小没有明显差异时,仍然可以鉴定病原体种类,并且避免了毛细管电泳过程中容易出现的交叉污染,肉眼即可观察结果,具有较高的特异性和敏感性。此外,本方法不需要配备昂贵的仪器,通过肉眼即可观察检测结果,成本低廉。而且在核酸侵入反应不依赖核酸序列,而只依赖核酸形成的特异性结构,并且由于该反应并非扩增待测模板本身,极大的降低了模板交叉污染的风险, 可投入临床使用。
综上所述,多重PCR结合核酸侵入反应及纳米金显色技术检测脑炎脑膜炎病毒的方法,具有较高的检测特异性及灵敏度,检测通量高,肉眼即可观察结果,在本实验中,我们选择了上述几种脑炎脑膜炎病毒进行检测,而在实际应用中可根据需要对多重PCR引物及引物探针进行调整或增加,从而促进本方法在更多脑炎脑膜炎病毒检测方面的应用,为口岸防范外来传染病预警措施提供帮助。
[1] Shyu WR, Wang YC, Chin C, et al. Assessment of neutralizing antibodies elicited by a vaccine (Nakayama) strain of Japanese encephalitis virus in Taiwan[J]. Epidemiol Infect, 1997, 119(1): 79-83. DOI: 10. 1017/S095026889700753X
[2] Weaver SC, Powers AM, Brault AC, et al. Molecular epidemiological studies of veterinary arboviral encephalitides[J]. Vet J, 1999, 157(2): 123-138. DOI: 10. 1053/ tvjl. 1998. 0289
[3] Thompson NN, Auguste AJ, Travassos da Rosa AP, et al. Seroepidemiology of selected alphaviruses and flaviviruses in bats in Trinidad[J]. Zoonoses Public Hlth, 2015, 62(1): 53-60. DOI: 10. 1111/zph. 12118
[4] Tadokoro K, Yamaguchi T, Egashira T, et al. Quantization of viral load by real-time PCR-monitoring Invader reaction[J]. J Virol Methods, 2009, 155(2): 182-186. DOI: 10. 1016/j. jviromet. 2008. 10. 017
[5] Tadokoro K, Kobayashi M, Yamaguchi T, et al. Classification of hepatitis B virus genotypes by the PCR-Invader method with genotype-specific probes[J]. J Virol Methods, 2006, 138(1/2): 30-39. DOI: 10. 1016/j. jviromet. 2006. 07. 014
[6] Thaxton CS, Georganopoulou DG, Mirkin CA. Gold nanoparticle probes for the detection of nucleic acid targets[J]. Clin Chim Acta, 2016, 363 (1/2): 120-126. DOI: 10.1016/j.cccn.2005.05.042
[7] Gould EA, Higgs S. Impact of climate change and other factors on emerging arbovirus dieases[J]. Trans R Soc Trop Med Hyg, 2009, 103(2): 109-121. DOI: 10. 1016/j. trstmh. 2008. 07. 025
[8] Jiang T, Deng YQ, Yu M, et al. Development of a multiplex RT-PCR to detect three important encephalitis and meningitis virus[J]. Bull Acad Milit Med Sci,2007, 31(3): 218-220.DOI: 10. 3969/j. issn. 1674-9960. 2007. 03. 005 (In Chinese)
姜涛,邓永强,于曼,等.3种重要脑炎病毒的多重RT-PCR检测方法的建立[J].军事医学科学院院刊,2007,31(3): 218-220.
[9] Cai XY, Kang XP, Liu H, et al. Establishment of multiplex PCR for the detection of five encephalitis zoonosis viruses[J]. Chin J Prev Vet Med, 2011, 33(2): 118-121. DOI: 10. 3969/j. issn. 1008-0589. 2011. 02. 09 (In Chinese)
蔡绪禹,康晓平,刘洪,等.5种脑炎人兽共患病病毒多重RT-PCR检测方法的建立[J].中国预防兽医学报, 2011, 33(2): 118-121.
[10] Gupta S, Bandyopadhyay D, Paine SK, et al. Rapid identification of mycobacterium species with the aid of multiplex polymerase chain reaction(PCR) from clinical isolates[J]. Open Microbiol J, 2010, 21(4): 93-97. DOI: 10. 2174/1874285801004010093
[11] Kaiser MW, Lyamicheva N, Ma W, et al. A comparison of eubacterial and archaeal structure-specific 5′-exonucleases[J]. J Biol Chem, 1999, 274(30): 21387-21394. DOI: 10. 1074/jbc. 274. 30. 21387
[12] Lyamichev V, Mast AL, Hall JG, et al. Polymorphism identification and quantitative detection of genomic DNA by invasive cleavage of oligonucleotide probes[J]. Nat Biotechnol, 1999, 17(3): 292-296. DOI: 10. 1038/7044
[13] Allawi HT, Li H, Sander T, et al. Invader plus method detects herpes simplex virus in cerebrospinal fluid and simultaneously differentiates types 1 and 2[J]. Clin Microbiol, 2006, 44(9): 3443-3447. DOI: 10.1128/JCM. 01175-06
[14] de Arruda M, Lyamichev VI, Eis PS, et al. Invader technology for DNA and RNA analysis: principles and applications[J]. Expert Rev Mol Diagn, 2002, 2(5): 487-496. DOI: 10. 1586/14737159. 2. 5. 487
ApplicationofmultiplexPCRcombinedwithinvasivereactionandchromogenicreactioncatalyzedbygoldnanoparticlesindetectionofencephalitisandmeningitisvirus
FAN Huan, QI Yu-hua, ZHU Zheng, CUI Lun-biao, GE Yi-yue, ZHAO Kang-cheng,WU Tao,SHI Zhi-yang
(InstituteofPathogenMicrobiology,JiangsuProvincialCenterforDiseasePreventionandControl,KeyLaboratoriesofEntericPathogenicMicrobiology,MinistryofHealth,Nanjing210009,China)
We developed a method for detecting encephalitis and meningitis virus by using multiplex PCR combined with invasive reaction and a chromogenic reaction catalyzed by gold nanoparticles. Primers were designed based on the conservative regions of encephalitis and meningitis virus (Eastern equine encephalitis virus, EEEV; Western equine encephalomyelitis virus, WEEV; West Nile virus, WNV; Nipah virus, NiPA; Japanese encephalitis virus, JEV). Multiplex PCR system, invasive reaction and a chromogenic reaction catalyzed by gold nanoparticles were established to detect different encephalitis and meningitis virus in one reaction. Tick-borne encephalitis virus (TBEV), St Louis encephalitis virus (StLEV), Chikungunya virus(CHIKV) and Dengue virus(DV) were used to test its specificity. Quantitative RNA transcribedinvitroand PCR fragments were used to assess its sensitivity. Clinical specimens collected from JEV patients were detected by this method. A method for detecting encephalitis and meningitis virus by using multiplex PCR, invasive reaction and a chromogenic reaction catalyzed by gold nanoparticles were successfully established. This method can detect targeted pathogens specifically, and it has no cross reaction with TBEV, StLEV, CHIKV and DV. The detecting limitation for different targets was 103copies/μL. Clinical samples were positive for JEV nucleic acids for above assay. The method presented here has characteristic of high specificity, sensitivity and throughput. The results can be observed by visual inspection. This method has broad application prospects in pathogen detection.
encephalitis and meningitis virus; multiplex PCR; invasive reaction; chromogenic reaction catalyzed by gold nanoparticles
Shi Zhi-yang, Email: shizhiyang@jscdc.cn
10.3969/j.issn.1002-2694.2017.11.008
艾滋病和病毒性肝炎等重大传染病防治科技重大专项(No.2013ZX10004103)资助
史智扬,Email:shizhiyang@jscdc.cn
卫生部肠道病原微生物重点实验室,江苏省疾病预防控制中心病原微生物研究所,南京 210009
R373.3
A
1002-2694(2017)11-0991-05
Supported by Grand Science and Technology Special Program “AIDS and Viral Hepatitis and Other Major Infectious Diseases Prevention and Control” (No.2013ZX10004103)
2017-03-02编辑梁小洁
