全球人体旋毛虫病的暴发情况分析
2017-12-13,,,
,,,
·综述·
全球人体旋毛虫病的暴发情况分析
翟铖铖,陈家旭,陈韶红,吴秀萍
旋毛虫病的暴发属于突发性公共卫生事件,危害人数多、社会影响大,严重威胁着民众的身心健康和社会秩序的稳定。本文通过查找现有文献,收集近5年来全球人体旋毛虫病的暴发事件,重点分析暴发事件的地区、起因、感染源的肉类种类、发病人数、旋毛虫种属及迁徙进化情况、诊断方法等方面,为进一步做好旋毛虫病的防控工作提供策略支持和重要的理论参考依据。
人体旋毛虫病;暴发;分析
旋毛虫病是一种危害严重的食源性人兽共患寄生虫病。人类的旋毛虫病主要通过生食或半生食含有感染性旋毛虫包囊的肉类及其制品所致,旋毛虫进入人体后可出现急性期症状,主要表现为发烧、面部水肿、肌肉剧烈疼痛、严重的腹泻以及嗜酸性粒细胞增多等。症状往往持续数周从而造成机体严重衰竭,重度感染者可造成严重的心肌及大脑损伤从而导致死亡。若感染的旋毛虫数量较少,可无症状产生或者出现慢性带虫,通常表现为原因不明的常年肌肉酸痛(似风湿)和乏力,重者丧失劳动能力[1]。
尽管旋毛虫病是一种古老的疾病,至今已发现约180多年,但其对动物、人类和社会的危害从未减少。人体旋毛虫病已经在55个国家报道过,全球每年约有5 751个病例,5例死亡病例。据估计,全世界由旋毛虫病导致的伤残调整寿命年约为每年每十亿人为76(95%置信区间为38-129),许多国家每年花费高额预算来预防旋毛虫病[2]。比起散发,旋毛虫病的暴发危害更为严重,影响人数更多、社会危害更大,属于突发性公共卫生事件,严重威胁着民众的身心健康和社会秩序的稳定。
本文通过查找现有文献,回顾性地收集近5年来全世界暴发人体旋毛虫病的事件。重点分析暴发事件的地区、起因、感染源的肉类种类、发病人数、旋毛虫虫种、诊断方法等方面,总结旋毛虫暴发的防控经验,为进一步做好旋毛虫病的防控工作提供策略支持和重要的理论参考依据。
1 近五年内全球人体旋毛虫病的暴发事件
目前,除了南极洲以外,世界的其他洲均有人体旋毛虫病的记录[3]。由于贫穷地区的烹饪习惯、恶劣的卫生条件以及缺乏兽医控制,发展中国家比起发达国家更有暴发人类旋毛虫病的可能。
1.1亚洲 亚洲48个国家中,18个国家有人体旋毛虫病的报道[4]。在亚洲的东南部,每年都会发生几起旋毛虫病的暴发,尤其是在柬埔寨、中国东南部、老挝、泰国北部以及越南这些国家的山区[5]。
在越南,暴发旋毛虫病的报道很常见,在1997-2012年5次暴发人体旋毛虫病,共诊断出126名旋毛虫病患者,11人住院治疗,8人死亡。所有感染病例皆因生食猪肉造成[6]。最近的一次为2012年,在越南的清化省,有24人被确诊为旋毛虫病,虫种为旋毛形线虫(T1)[7]。2014年8月,韩国6名公司人员因生食甲鱼肉,后经两次ELISA被诊断为旋毛虫病。通过爬行动物的肉类引起人体旋毛虫病的案例较少,这是韩国第8起、也是第2次涉及甲鱼肉的人体旋毛虫病暴发案例[8]。
在中国,由于云南、广西、西藏地区有些民族有食生肉的饮食习惯,所以旋毛虫病的暴发时有发生。云南普洱市自2005—2014年发生4起人体旋毛虫病暴发[9]。2013年3月云南省澜沧县发生的旋毛虫病暴发事件中,共有27人患旋毛虫病,1人死亡,患者均有生食猪肉史,取2例重症患者腓肠肌样本直接压片镜检结果均阳性,26例现症病人用ELISA试剂盒检测旋毛虫抗体全部阳性,患者口服阿苯达唑治疗,7 d后痊愈[10]。2015年中国云南省起胜村由于婚宴吃生皮,导致人体旋毛虫病的暴发。5人发病后,采用ELISA方法为408个食用过生皮的村民检测抗旋毛虫IgG抗体,阳性率为64.22%[11]。2015年1月,西藏自治区拉萨市4人在林芝地区集体进食半风干猪肉后发生严重的旋毛虫病,对所食用的剩余猪肉进行检测,检出旋毛形线虫(T1)囊包,使用人旋毛虫抗体检测试剂盒对4例患者进行血清学检测,结果均为阳性[12]。同年,西藏再次发生暴发,16人均有生食藏香猪肉史,其中5例患旋毛虫病,重症2例,无死亡病例。食剩余的猪肉压片镜检结果均阳性,5例现症患者用ELISA方法检测抗旋毛虫抗体全部阳性,口服阿苯达唑治疗2个疗程后痊愈[13]。
1.2非洲 非洲北部的许多国家信仰伊斯兰教,受宗教文化的影响,穆斯林不允许食用猪肉,所以在非洲这些国家,动物感染旋毛虫的案例时有发生,而人体旋毛虫病则很少,一般是外来人员感染后入内。撒哈拉以南的某些国家,如肯尼亚、刚果、几内亚、埃塞俄比亚、埃尔及利亚等[14],均有发生人体旋毛虫病的案例,红河猪是这些地区引发人体旋毛虫病的主要来源。
1.3美洲 在加拿大,由于黑熊和海象的食用,在美国及墨西哥,野生动物如黑熊、美洲豹、红狐等感染旋毛虫病的概率很高,所以人们通过食入野生猎物而感染的概率也随之升高。2014年西格陵兰岛发生一起因食用海象引发的人体旋毛虫病的暴发。2016年3月加拿大的安大略省北部,10人因食用狩猎而来的黑熊肉出现急性临床病症,急性期血清无阳性反应,后被诊断为旋毛虫病,虫种经多重PCR鉴定为本地旋毛虫(T2)。并且食用的黑熊肉在零下22 ℃储存了8个月后依然可造成感染。经10例病例的病情发展说明,T2会造成严重的血栓性并发症[15]。美国的旋毛虫病例由美国疾病预防控制中心报道,自2008-2012年共报道5起人体旋毛虫病的暴发[16]。阿拉斯加自2005年至2014年共发生9起旋毛虫病的暴发[17]。这些病例由猪肉制品、野猪肉、家养猪、熊肉、鹿肉或牛肉导致。2016年7月至2017年3月,阿拉斯加的诺顿湾地区因食用生的或未熟的海象肉而导致两起人体旋毛虫病的暴发,每起各有5人患病。这是阿拉斯加地区自1992年以来因海象引起的再一次暴发[18]。
再以南美洲的阿根廷为例,阿根廷2010年突发64人旋毛虫病大暴发[19]。人体旋毛虫暴发集中在南部的布宜诺斯艾利斯[20]、圣菲、科尔多瓦、圣路易斯、门多萨等城市,发病的主要来源为猪肉及其制品[15]。
1.4欧洲 旋毛虫病是东欧最常见的食源性寄生虫病,被称为“被忽视的感染的贫困”[21]。在欧洲,主要感染源是野猪肉及马肉,曾造成过多起暴发,欧盟国家及有些非欧盟成员国为保证食品安全,均颁布过针对旋毛虫的相关法令。德国在2013年发生了因食野猪肉引起的旋毛虫病暴发[22]。斯洛伐克在1980-2008年间共发生过6起人体旋毛虫病的暴发[23]。罗马尼亚大多数的暴发都起源于家庭庆祝而食用本地养的猪肉[24]。在保加利亚,人体旋毛虫病暴发依然是对公共卫生的挑战。自2008年至2014年,共发生29起,影响了1670人,有710例旋毛虫病,并有着很高的致死率。引起人体旋毛虫病的虫种主要是旋毛形线虫(T1)及布氏旋毛虫(T3)[25]。2014年,由于食用从西班牙进口的野猪肉,比利时发生了一起人体旋毛虫病的暴发。共有16人经血清学方法(包括ELISA、in-house ELISA和WB)和PCR方法被确诊,并鉴定虫种为旋毛形线虫(T1)[26]。
在法国和意大利,生马肉的消费,一种与法国美食相关联的餐饮,这个食用马肉的习惯是几百年前由法国传入的,并一直延续到近代。最近又有多起在意大利因食用野猪肉而暴发流行人体旋毛虫病的报道。在法国科西嘉岛,食用生的猪肉香肠是当地一种传统的饮食习惯。2015年3月暴发了一起由于食用这种香肠引起的人体旋毛虫病的暴发。3人经ELISA和WB确诊为旋毛虫病,另外同食14人因烹调充分未见发病,虫种经多重PCR鉴定为布氏旋毛虫[27]。2012年11月,意大利托斯卡纳区因食用半生的野猪肉制成的香肠,38人中有34人通过ELISA和WB检查血清中抗旋毛虫抗体为阳性,32人出现旋毛虫病临床症状,虫种经多重PCR鉴定为布氏旋毛虫(T3)[28]。2016年2月,又报道了一起意大利南部发生的布氏旋毛虫病的暴发。2016年1月1人因发烧、肌痛、面部及眼眶水肿、腹泻、呕吐等症状入院治疗,并伴嗜酸性粒细胞、肌酸激酶增多。后经流行病学调查,30人生食由非法狩猎而来的野猪肉自制的香肠,肉类样本经消化法检验为旋毛虫阳性,由多重PCR鉴定为布氏旋毛虫(T3),其中5人经ELISA确诊为旋毛虫病。所有病例经甲苯咪唑治疗后预后良好[29]。
1.5大洋洲 关于澳大利亚暴发人旋毛虫病的报道较少,2010年曾发生过一起,起因是父子两人食用熏猪排[30]。其他国家如新西兰、巴布亚新几内亚及美国的夏威夷洲均有人由于食用家猪及野猪而感染旋毛虫的记录。
2 人体旋毛虫病暴发情况分析
2.1暴发流行地区 目前,人类旋毛虫病暴发疫情的报告是自愿的,非强制性的,这通常会导致关于暴发的信息不够完整,因而从发布的文献中获得的数据可能仅仅只是冰山一角。就现有资料来看,全世界都有随时暴发人体旋毛虫病的潜力。据统计,WHO欧洲区域是人体旋毛虫病全球负担的主要责任者(69%),紧接着是WHO美洲区域与WHO西太平洋区域[2]。近5年来,就所得资料分析,欧洲、北美洲、亚洲的东南部尤其严重,这与主要责任地区一致,几乎每年都有多起旋毛虫病暴发,其他地区如非洲和大洋洲,也许是5年之前较严重现在防控较好有所减轻,或者资料收集不全面,又或者是未报道,暴发的事件数较欧洲、北美洲和亚洲少。
2.2暴发发生的原因 有些民族生食肉类的传统饮食习惯依然是旋毛虫病暴发的主要原因,并且宴请、婚宴、聚会这种聚集性的饮食活动为暴发旋毛虫病创造了条件。除此之外,非法狩猎、食用野生动物成为暴发的又一大重要原因,尤其是在森林较多的欧洲和美洲国家。肉类烹调不充分、混用生熟菜板等原因所占的比例正逐渐减小。教育民众旋毛虫病的危害、调整传统的饮食习惯、严惩非法狩猎者成为防控旋毛虫病暴发的重中之重。
2.3暴发所涉及的肉类种类 虽然猪肉仍然是导致暴发的主要肉类,但暴发的感染源正由猪肉向野生动物肉类转变[31],从传统的肉类如野猪肉、马肉、狗肉、熊肉等,逐渐扩大到野生动物如黑熊、海象、獾、美洲狮等,以及爬行动物如甲鱼等[32]。
另外,动物的旋毛虫感染率与人类感染旋毛虫有很大关系。动物中的高旋毛虫感染率为人类旋毛虫病的暴发留下重大隐患,例如,立陶宛松貂的旋毛虫感染率超过50%[33],以及罗马尼亚的赤狐[34]。斯洛伐克家犬旋毛虫感染率为12.8%[35]。意大利中部的阿布鲁奇地区从2004-2014年共有6种哺乳动物经消化法或压片镜检法检查为旋毛虫阳性,包括狼、红狐、野猪、石貂、松貂和野猫,虫种均为布氏旋毛虫(T3),野猪肉被认为是此地区人体旋毛虫病的主要来源[36]。波兰喀尔巴阡山狼的布氏旋毛虫的感染率比较高[37],甚至波兰入侵物种美洲水鼬中也有感染[38]。
2.4暴发所涉及的旋毛虫种属 目前已知旋毛虫有9个种和3个基因型[39],即旋毛形线虫(T.spiralis,T1)、乡土旋毛虫(T.nativa,T2)、布氏旋毛虫(T.britovi,T3)、伪旋毛虫(T.pseudospiralis,T4)、穆氏旋毛虫(T.murrelli,T5)、纳氏旋毛虫(T.nelsoni,T7)、巴布亚旋毛虫(T.papuae,T10)、津巴布韦旋毛虫(T.zimbabwensis,T11)、T.patagoniensis(T12)以及3个地位尚不明确的基因型T6、T8、T9。除了成囊型的T1,其他每个种都有自己的地理分布及流行区域,见表1[40]。
关于旋毛虫虫种迁徙与进化也有研究报道[41],根据多数多细胞动物门动物的基因变异率,即每年每个位点大约2.5亿年变异1次,推测旋毛虫属和鞭毛属共同祖先可能存在于4 500-5 000万年之间,旋毛虫T1种最为古老,出现在亚洲-中国-云南,其他旋毛虫种的出现大约发生在3 500-4 000万年之间,见图1。而T1可能源自东亚,通过人类运输猪肉类产品被动扩散到其他洲,然后导致与其他成囊型的虫种混合感染(在欧洲T1/T3、在欧洲和北美T1/T2、在北美T1/T5),也有不包括T1的混合感染(在欧洲T2/T3,在南非T8/T7);然而成囊型和非成囊型虫种在同一个地域也能独立共存,如在古北区T4/T1(T3或T2),在撒哈拉南部非洲T11/T7(T2或T8),在东南亚T10和T11。已知的所有旋毛虫种都可感染哺乳动物,其中感染力最强、危害最大的是T1;由T1与T3引发的暴发相对较多;但是加拿大出现了罕见的本地旋毛虫(T2)暴发,说明T2的生存能力更强,T2所引起的并发症可能比T1更为严重、危害性更大。
表1 旋毛虫种属主要流行及地理分布
Tab.1 Genus of Trichinella and geographic distribution
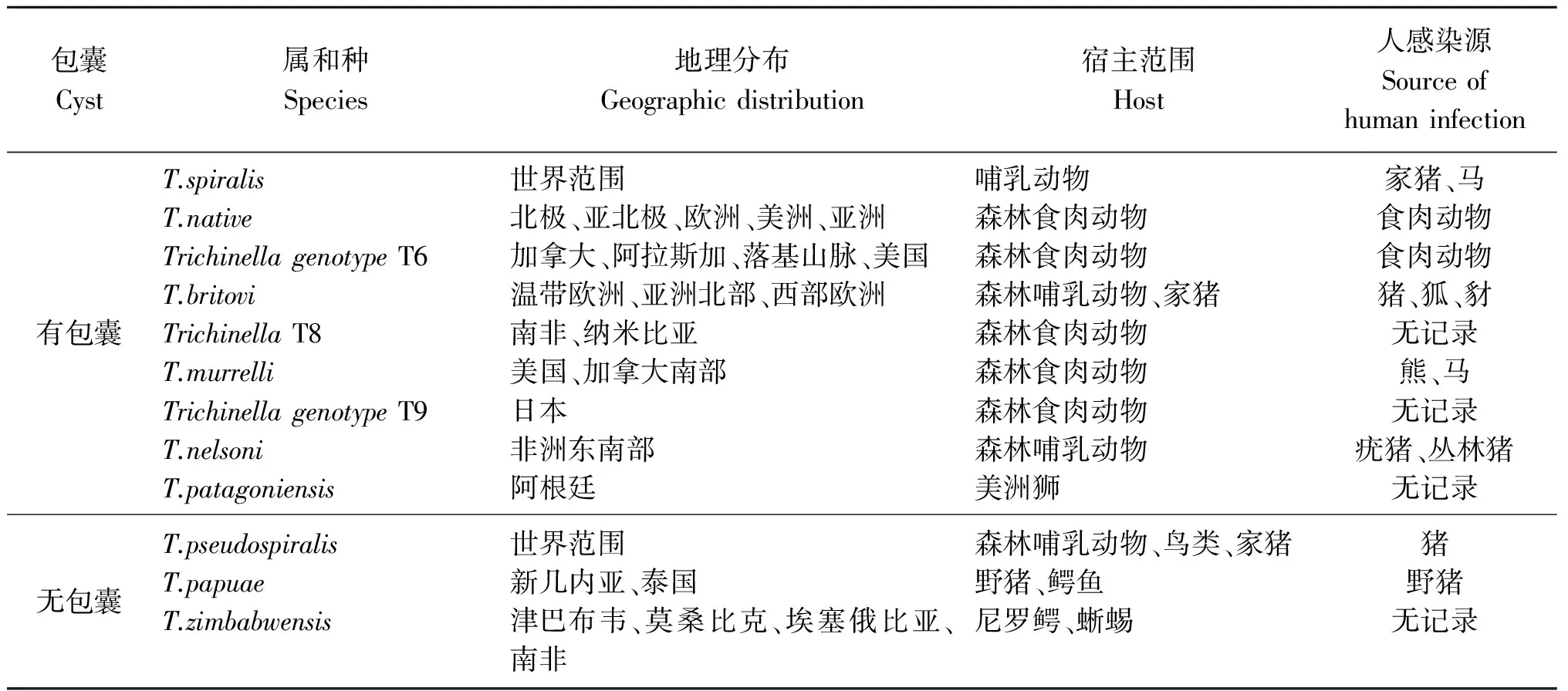
包囊Cyst属和种Species地理分布Geographicdistribution宿主范围Host人感染源Sourceofhumaninfection有包囊T.spiralisT.nativeTrichinellagenotypeT6T.britoviTrichinellaT8T.murrelliTrichinellagenotypeT9T.nelsoniT.patagoniensis世界范围北极、亚北极、欧洲、美洲、亚洲加拿大、阿拉斯加、落基山脉、美国温带欧洲、亚洲北部、西部欧洲南非、纳米比亚美国、加拿大南部日本非洲东南部阿根廷哺乳动物森林食肉动物森林食肉动物森林哺乳动物、家猪森林食肉动物森林食肉动物森林食肉动物森林哺乳动物美洲狮家猪、马食肉动物食肉动物猪、狐、豺无记录熊、马无记录疣猪、丛林猪无记录无包囊T.pseudospiralisT.papuaeT.zimbabwensis世界范围新几内亚、泰国津巴布韦、莫桑比克、埃塞俄比亚、南非森林哺乳动物、鸟类、家猪野猪、鳄鱼尼罗鳄、蜥蜴猪野猪无记录

图1 旋毛虫种间变异与迁徙示意图Fig.1 Variation and migration of Trichinella spp.
2.5暴发所用的诊断方法 欧洲疾病预防控制中心认为,旋毛虫病的诊断应该基于3个标准,即临床症状、实验室检验和流行病学调查。目前,我国针对旋毛虫病的诊断及暴发后的处理已有相应的行业标准[42-43],简单概述其诊断依据和诊断标准如下。
诊断依据:
1)流行病学史有吃生或半生吃动物肉类,及其制品史或食入混有生肉屑的食物史。
2)临床表现发热,眼睑或面部水肿,肌肉酸痛等。
3)实验室检查剩余肉类检查发现旋毛虫;血常规检查,包括急性期白细胞总数(WBC)可正常或升高,嗜酸性粒细胞(Eos)10%~40%,甚至高达90%;血清学检查,ELISA等方法检查旋毛虫抗体阳性;病原学检查,肌肉活组织检查或脑脊液中发现旋毛虫。
诊断标准:
(a) 疑似病例同时符合(1)和(2);同时符合(2)和(3)中的血常规检查结果。
(b) 临床诊断病例疑似病例且同时符合(3)中剩余肉类检查发现旋毛虫;疑似病例且同时符合(3)中血清学检查。
(c) 确诊病例临床诊断病例且同时符合(3)中病原学检查结果。
通过以上暴发事件得知,基本上采用的是ELISA方法诊断旋毛虫病后,再利用肌肉组织活检辅助诊断,或阳性结果利用WB进行验证,或将感染源经PCR方法找到旋毛虫基因。而ELISA方法难以独自进行诊断,需要采用多种方法同时确诊,繁琐的诊断过程无法满足大型暴发的及时应用。
3 结 语
综上所述,即使人类旋毛虫病疫情报告是自愿的,非强制性的,但每年在世界各地仍有多起暴发,感染源的动物种类越来越复杂,控制旋毛虫病的暴发与流行依然是各国公共卫生工作的重要方面。教育群众、严惩非法狩猎者、加强旋毛虫病防控意识,改变传统不良饮食习惯,以及寻找一种适用于大规模流行病学调查并及时确诊的诊断方法是未来防控旋毛虫病的重中之重。
[1] Wang ZQ, Cui J. Diagnosis and treatment of trichinellosis[J]. Chin J Parasitol Parasit Dis, 2008, 26(1): 53-57. (in Chinese)
王中全, 崔晶. 旋毛虫病的诊断与治疗[J]. 中国寄生虫学与寄生虫病杂志, 2008, 26(1): 53-57.
[2] Devleesschauwer B, Praet N, Speybroeck N, et al. The low global burden of trichinellosis: evidence and implications[J]. Intl J Parasitol, 2015, 45(2-3): 95-99. DOI: 10.1016/j.ijpara.2014.05.006
[3] Pozio E, Murrell KD. Systematic and epidemiology ofTri-chinella[J]. Adv Parasitol, 2006, 63: 367-439.
[4] Xu DM, Cui J, Wang ZQ. The epidemic situation of trichinellosis in Asia[J]. Int J Med Parasit, 2011, 38(1): 50-56. (in Chinese)
徐冬梅, 崔晶, 王中全. 亚洲国家旋毛虫病的流行历史与现状[J]. 国际医学寄生虫病杂志, 2011, 38(1): 50-56.
[5] Thi NV, Nguyen VD, Praet N, et al.Trichinellainfection in wild boars and synanthropic rats in northwest Vietnam[J]. Vet Parasitol, 2014, 200(1-2): 207-211. DOI: 10.1016/j.vetpar.2013.11.011
[6] Van DN, Thi NV, Dorny P, et al. Trichinellosis in Vietnam[J]. Am J Trop Med Hyg, 2015, 92(6): 1265-1270. DOI: 10.4269/ajtmh.14-0570
[7] Ng-Nguyen D, Stevenson MA, Traub RJ. A systematic review of taeniasis, cysticercosis and trichinellosis in Vietnam[J]. Parasit Vectors, 2017, 10(1): 150. DOI: 10.1186/s13071-017-2085-9
[8] Jeong JT, Seo M, Hong ST, et al. An outbreak of trichinellosis by consumption of raw soft-shelled turtle meat in Korea[J]. Korean J Parasitol, 2015, 53(2): 219-222. DOI:10.3347/kjp.2015.53.2.219
[9] Yang H. Analysis on epidemiological characteristics of foodborne disease outbreak in Puer from 2005 to 2014[J]. Soft Sci Health, 2015, 29(12): 798-801. DOI:10.13604/j.cnki.46-1064/r.2013.11.031 (in Chinese)
杨华. 普洱市2005-2014年食源性疾病暴发事件流行病学分析[J]. 卫生软科学, 2015, 29(12): 798-801.
[10] Wang CQ, Wu FW, Wang XR, et al. Survey of an outbreak of trichinellosis in Lanchang county of Yunnan province[J]. China Tropical Med, 2013, 13(11): 1433-1434. (in Chinese)
王春泉, 吴方伟, 王兴荣,等. 云南省澜沧县一起旋毛虫病暴发的调查[J]. 中国热带医学, 2013, 13(11): 1433-1434.
[11] Wang YM, Qi YL. Analysis of outbreak of trichinosis in qisheng village, eryuan county, yunnan province in 2015[J]. J Occupational Health Damage, 2016, 31(1): 61-62. (in Chinese)
王玉梅, 起云亮. 2015年云南省洱源县起胜村旋毛虫病暴发疫情分析[J]. 职业卫生与病伤, 2016, 31(1): 61-62.
[12] Zhaxi CM, Jin F, Sun P. Report of 4 cases of trichinosis in Lhasa, Tibet [J]. Chin J Parasitol Parasit Dis, 2015, 33(4): 305-306. (in Chinese)
扎西措姆, 金峰, 孙萍. 西藏拉萨市旋毛虫病4例报告[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(4): 305-306.
[13] Da Z, Danzeng GG, Zhaxi SM, et al. An investigation into the outbreak of human trichinosis in Tibet[J]. Medical Informat, 2015, (36): 222-223. (in Chinese)
达珍, 旦增贡嘎, 扎西桑姆, 等. 西藏一起人体旋毛虫病暴发的调查[J]. 医学信息, 2015, (36): 222-223.
[14] Mukaratirwa S, La Grange L, Pfukenyi DM.Trichinellainfections in animals and humans in sub-Saharan Africa: a review[J]. Acta Trop, 2013, 125(1): 82-89. DOI:10.1016/j.actatropica.2012.09.005
[15] Dalcin D, Zarlenga DS, Larter NC, et al.Trichinellanativaoutbreak with rare thrombotic complications associated with meat from a black bear hunted in Northern Ontario[J]. Clin Infect Dis, 2017, 64(10): 1367-1373. DOI:10.1093/cid/cix165
[16] Wilson NO, Hall RL, Montgomery SP, et al. Trichinellosis surveillance--United States, 2008-2012[J]. MMWR Surveill Summ, 2015, 64(1): 1-8.
[17] Fearey D, Provo RNG. Trichinellosis cases-Alaska,2005-2014. Bull[J]. State Alasca Epidemiol, 2015, 6.
[18] Springer YP, Casillas S, Helfrich K, et al. Two outbreaks of trichinellosis linked to consumption of Walrus Meat-Alaska, 2016-2017 [J]. MMWR Morb Mortal Wkly Rep, 2017, 66(26): 692-696. DOI:10.15585/mmwr.mm6626a3
[19] Calcagno MA, Bourlot I, Taus R, et al. Description of an outbreak of human trichinellosis in an area of Argentina historically regarded asTrichinella-free: the importance of surveillance studies[J]. Vet Parasitol, 2014, 200(3-4): 251-256. DOI:10.1016/j.vetpar.2013.12.028
[20] Randazzo V, Sala LFL, Costamagna SR. Determinants of infestation during an outbreak of trichinellosis in southwest Buenos Aires province[J]. Acta Bioquimica Clinica Latinoamericana, 2013, 47(3): 587-593.
[21] Hotez PJ, Gurwith M. Europe’s neglected infections of poverty[J]. Int J Infect Dis, 2011, 15(9): 611-619. DOI:10.1016/j.ijid.2011.05.006
[22] Faber M, Schink S, Mayer-Scholl A, et al. Outbreak of trichinellosis due to wild boar meat and evaluation of the effectiveness of post exposure prophylaxis, Germany, 2013[J]. Clin Infect Dis, 2015, 60(12): e98-e104. DOI:10.1093/cid/civ199
[23] Dubinsk P, Antolová D, Reiterová K. HumanTrichinellainfection outbreaks in Slovakia, 1980-2008[J]. Acta Parasitol, 2016, 61(2): 205-211. DOI:10.1515/ap-2016-0029
[24] Dobrescu C, Hriscu H, Emandi M, et al. Consumption of untested pork contributed to over two-thousand clinical cases of human trichinellosis in Romania[J]. Folia Parasitol, 2014, 61(6): 558-560.
[25] Rainova I, Kaftandjiev I, Harizanov R, et al. Outbreaks of human trichinellosis, still a challenge for the public health authorities in Bulgaria[J]. J Public Health, 2016, 24(4): 291-297.
[26] Peter M, Annemie F, Steven V, et al. Outbreak of trichinellosis related to eating imported wild boar meat, Belgium, 2014[J]. Eurosurveill, 2016, 21(37): 30341. DOI: 10.2807/1560-7917.ES.2016.21.37.30341
[27] Ruetsch C, Delaunay P, Armengaud A, et al. Inadequate labeling of pork sausages prepared in Corsica causing a trichinellosis outbreak in France[J]. Parasite, 2016, 23: 27. DOI:10.1051/parasite/2016027
[28] Fichi G, Stefanelli S, Pagani A, et al. Trichinellosis outbreak caused by meat from a wild boar hunted in an Italian region considered to be at negligible risk fortrichinella[J]. Zoonoses Public Health, 2015, 62(4): 285-291. DOI:10.1111/zph.12148
[29] Turiac IA, Cappelli MG, Olivieri R, et al. Trichinellosis outbreak due to wild boar meat consumption in southern Italy[J]. Parasit Vectors, 2017, 10(1): 107. DOI:10.1186/s13071-017-2052-5
[30] Lechner A, Kraus J, Hoppe UC, et al. Outbreak of human trichinellosis, Austria 2010[J]. Wiener Tierärztliche Monatsschrift, 2012, 2: 20-23.
[31] Murrell KD. The dynamics ofTrichinellaspiralisepidemiology: Out to pasture[J]. Vet Parasitol, 2016, 231: 92-96. DOI:10.1016/j.vetpar.2016.03.020
[32] Rostami A, Gamble HR, Dupouy-camet J, et al. Meat sources of infection for outbreaks of human trichinellosis[J]. Food Microbiol, 2017, 64: 65-71. DOI:10.1016/j.fm.2016.12.012
[33] Kirjušina M, Bakasejevs E, Pezzotti P, et al.Trichinellabritovibiomass in naturally infected pine martens (Martesmartes) of Latvia[J]. Vet Parasitol, 2016, 231: 110-114. DOI:10.1016/j.vetpar.2016.05.008
[34] Imre K, Pozio E, Tonanzi D, et al. The red fox (Vulpesvulpes) plays a minor role in the epidemiology of the domestic cycle ofTrichinella, in Romania[J]. Vet Parasitol, 2015, 212(3-4): 448-450. DOI:10.1016/j.vetpar.2015.06.032
[35] Miterpáková M, Antolová D, Hurníková Z, et al. Seroprevalence ofTrichinellainfections in domestic dogs from Slovakia [J]. J Helminthol, 2016: 1-6. DOI:10.1017/S0022149 X16000602
[36] Badagliacca P, Di Sabatino D, Salucci S, et al. The role of the wolf in endemic sylvaticTrichinellabritovi, infection in the Abruzzi region of Central Italy[J]. Vet Parasitol, 2016, 231: 124-127. DOI:10.1016/j.vetpar.2016.07.030
[37] Bień J, Moskwa B, Gozdzik K, et al. The occurrence of nematodes of the genusTrichinella, in wolves (Canislupus) from the Bieszczady Mountains and Augustowska Forest in Poland[J]. Vet Parasitol, 2016, 231: 115-117. DOI:10.1016/j.vetpar.2016.04.010
[38] Hurníková Z, Koodziej-Sobocińska M, Dvorožňáková E, et al. An invasive species as an additional parasite reservoir:Trichinellain introduced American mink (Neovisonvison) [J]. Vet Parasitol, 2016, 231: 106-109. DOI:10.1016/j.vetpar.2016.06.010
[39] Pozio E, Zarlenga DS. New pieces of theTrichinellapuzzle[J]. Int J Parasitol, 2013, 43(12-13): 983-97. DOI:10.1016/j.ijpara.2013.05.010
[40] Sun SM, Zhang FZ. Research Advances on Identification and Molecular Evolution ofTrichinellaSpecies[J]. Chin Agricul Sci Bulletin, 2014, 30(8): 23-28. (in Chinese)
孙树民, 张凤珍. 旋毛虫种属鉴定及分子进化研究进展[J]. 中国农学通报, 2014, 30(8): 23-28.
[41] Rosenthal BM, Larosa G, Zarlenga D, et al. Human dispersal ofTrichinellaspiralisin domesticated pigs[J]. Infect Genet Evol, 2008, 8(6): 799-805. DOI:10.1016/j.meegid.2008.07.008
[42] Wang ZQ, Cui J, Xu BL, et al. Diagnosis of trichinellosis[S]. Health Industry Standards of China: WS369-2012.(in Chinese)
王中全, 崔晶, 许汴利,等.旋毛虫病的诊断[S].中华人民共和国卫生行业标准:WS369-2012.
[43] Wang ZQ, Cui J, Xu BL, et al. Technical standard for management of trichinellosis outbreak[S]. Health Industry Standards of China: WS470-2015.(in Chinese)
王中全, 崔晶, 许汴利, 等.旋毛虫病暴发处理技术规范[S].中华人民共和国卫生行业标准:WS470-2015.
Globaloutbreaksofhumantrichinellosis
ZHAI Cheng-cheng, CHEN Jia-xu, CHEN Shao-hong, WU Xiu-ping
(NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention,KeyLaboratoryofParasiteandVectorBiology,MinistryofHealth,NationalCenterforInternationalResearchonTropicalDiseases,MinistryofScienceandTechnology,WHOCollaboratingCenterforTropicalDisease,Shanghai200025,China)
Outbreak of trichinellosis belongs to the sudden public health events, with number of hazards and social influence, and is a serious threat to people’s health and the social order stability. Through literature search, we collected the global outbreaks of human trichinellosis in recent years, focused on analyzing outbreak areas, cause of the outbreak, kind of infected meat, the number of cases, the genus ofTrichinellaand migration, diagnostic methods, etc., in order to further prevent and control trichinellosis and to provide the important theoretical reference basis.
human trichinellosis; outbreak; analysis
Wu Xiu-ping, Email: lvy.2001@163.com
10.3969/j.issn.1002-2694.2017.11.013
国家重点研发计划(No.2016YFC1202000)资助
吴秀萍,Email: lvy.2001@163.com
中国疾病预防控制中心寄生虫病预防控制所,世界卫生组织热带病合作中心,科技部国家级热带病国际联合研究中心,卫生部寄生虫病原与媒介生物学重点实验室,上海,200025
R532.1
A
1002-2694(2017)11-1018-06
Funded by the National Key Research and Development Plan (No.2016YFC1202000)
2017-03-27编辑王晓欢
