棉花冠菌素不敏感因子GhCOI1基因分离和对大丽轮枝菌的抗性分析
2017-12-12谢彩玲司怀军吴家和
范 强,王 乐,谢彩玲,张 宁,司怀军,吴家和
(1. 甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2. 中国科学院 微生物研究所,植物基因组学国家重点实验室,北京 100101)
棉花(Gossypiumspp.)是锦葵科棉属草本植物,涉及农业生产和纺织业,在日常生活中具有重要作用[1]。然而棉花黄萎病(Verticilliumwilt)严重制约着棉花的生产,它是一种土壤传播的维管束病害[2]。黄萎病病原菌为大丽轮枝菌,该真菌属于半知菌亚门轮枝菌属。病原菌从棉花根部入侵,植株发病后会严重影响棉花的纤维产量和品质[3]。因此,分离和解析抗病功能基因已成为棉花抗病研究的一个重要方向。
植物毒素冠菌素不敏感因子(Coronatine-insensitive 1, COI1)是茉莉酸(Jasmonate, JA)信号转导途径的关键调控因子。在拟南芥中,COI1缺失突变体表现为对各种茉莉酸应答反应不敏感或者不响应,在受到病原菌侵染时不能启动相应的应答反应[4]。植物中COI1与JAZ结合参与SCFCOI1(Skpl-Cullin-F-box protein, SCF)复合物的形成,这个复合物组成蛋白的缺失突变体,如AXR1、CUL1等都表现为茉莉酸不敏感,从而丧失抗病性[5]。研究表明COI1处于JA信号通路的上游,其功能的丧失会引起JA信号通路的中断[6]。虽然COI1在拟南芥、烟草等模式植物中的研究比较清楚,但是有关棉花COI1和其在JA信号转导途径的研究还未见报道。
本研究从陆地棉中分离一个棉花COI1基因,并利用病毒诱导基因沉默(Virus-induced gene silencing, VIGS)技术从棉花植株沉默该基因表达[7]。对沉默植株接菌研究表明,抑制GhCOI1基因表达会减弱对大丽轮枝菌的抗性。总之,GhCOI1基因参与了棉花的抗病反应,促进棉花对大丽轮枝菌的抗性。因此,该基因可以作为棉花抗病育种的候选基因。
1 材料和方法
1.1 试验材料
棉花材料为陆地棉品种中棉所35,由山西农业科学院棉花研究所资源室提供。所用VIGS系统载体烟草脆裂病毒(TRV)干扰表达载体pYL-156和辅助载体pYL-192由清华大学刘玉乐教授惠赠。阳性对照载体pYL-156-PDS、农杆菌GV3101、LBA4404和棉花黄萎病菌菌系 V991(Verticilliumdahliaestrain V991)均由植物基因组学国家重点实验室保存。
PCR(Polymerase chain reaction)扩增所用试剂和酶、限制性内切酶、DNA连接酶、RNA提取试剂盒、逆转录cDNA合成试剂盒、pEASY-T1克隆载体试剂盒和大肠杆菌感受态细胞等购自北京全式金生物技术有限责任公司,qPCR试剂盒(SYBR Prime ScriptTMRT-PCR Kit)购自TaKaRa公司。
1.2 试验方法
1.2.1 材料培养 将中棉所35种植在直径20 cm花盆里,培养土为富含腐殖质的营养土。花盆放置于16 h/8 h光照/黑暗、28 ℃的温室中培养。
1.2.2 棉花RNA提取及cDNA的合成 称取一定量的棉花样品,液氮研磨成粉末。用RNA提取试剂盒分离棉花样品的总RNA。取2 μg总RNA,50 pmol的Anchored Oligo(dT)18用于第1链cDNA的合成,具体步骤参照逆转录cDNA合成试剂盒说明书进行。获得的cDNA用于基因克隆及表达分析。
1.2.3GhCOI1克隆和沉默载体构建 为了分离GhCOI1基因,分析棉花基因组序列(http://cgp.genomics.org.cn),设计1对特异引物,引物序列为:(F:5′-ATGGGGGAAAATTATAACG-3′,R:5′-TTATAAACTTATACTCCT-3′)。以生长21 d棉花整株cDNA为模板进行PCR扩增,扩增片段被亚克隆到pEASY-T1载体上,然后进行测序鉴定。
为了构建GhCOI1基因的病毒沉默载体,首先利用生物信息学技术分析GhCOI1基因的序列,发现753~1 025核苷酸序列片段是该基因特异的序列,设计引物(GhCOI1VF:5′-CCGGAATTCCAACGGTGGTTCTTTCTACG-3′,GhCOI1 VR:5′-CGCGGATCCCTTACAACTTCGGGCAACA-3′,下划线部分为保护碱基及酶切位点)进行PCR扩增,获得该特异片段。通过EcoR Ⅰ和BamH Ⅰ双酶切扩增产物和pYL-156载体,纯化后进行连接反应,转化到大肠杆菌感受态细胞中得到重组载体[8]。最后将重组载体进行双酶切和测序验证,获得带有目的基因片段的质粒,命名为pYL-156-GhCOI1。
1.2.4 序列分析及系统进化树的构建 将GhCOI1与其他物种的COI1蛋白进行同源比对分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并用Clustalx 2.1进行多重比对,用MEGA 5.0构建系统进化树。通过在线Protparam工具(http://www.expasy.org/tools/protparam.html)将ORF(Open reading frame)翻译成氨基酸序列,并对其蛋白质进行分析,如等电点、结构域等。
1.2.5 沉默GhCOI1植株的培育 将重组质粒pYL-156-GhCOI1通过电击的方法导入农杆菌GV3101中。电击完成的农杆菌利用含有卡拉霉素(Kan)和利福平(Rif)的固体LB培养基进行划线培养。过夜培养后,挑单克隆在含有Kan(50 μg/mL)和Rif(25 μg/mL)的液体LB培养基再次进行过夜培养。取过夜后的菌液于10 mL离心管中,4 000 r/min离心15 min弃上清液,加入适量重悬液(重悬液成分MgCl210 mmol/L,AS 200 μmol/L,MES 10 mmol/L)重悬菌体,并测OD值调整到OD600=1.5左右。再分别将含pYL-156-GhCOI1、pYL-156、阳性对照pYL-156-PDS与pYL-192菌液按体积比1∶1 混合,室温下静置3 h待用。
温室中培养的棉花子叶平展时(一般7~10 d),用针头在子叶背面轻划出小伤口,用去掉针头的1 mL注射器将混合菌液从背面注入子叶中,尽量使整个子叶被侵染。注射后的植株避光处理12 h后,再次置于光照下培养。每个试验单元进行3次生物学重复。
1.2.6 RT-PCR和qPCR分析 RT-PCR检测:利用样品cDNA为模板,采用半定量RT-PCR方法检测GhCOI1的表达水平。特异引物为F:5′-AGGAGGTTGCTTCTTCAGC-3′,R:5′-CGGATGCTCTACCACGACTA-3′,扩增片段大小为214 bp,选用Actin为内参基因来进行半定量。
qPCR检测方法:将cDNA模板稀释10倍,反应体系为20 μL,具体步骤参照试剂盒说明书进行,40个循环后作熔解曲线。设计特异性引物(F:5′-TTACACGACGAGTCCCGAAC-3′,R:5′-GCACCGATTTCAAGCAAGTC-3′),以Actin为内参,获得的结果采用2-ΔCt或2-ΔΔCt方法计算基因的相对表达量,试验重复3次。
1.2.7 大丽轮枝菌接种棉花 取出保存于-80 ℃冰箱中的大丽轮枝菌,在冰上溶解后,吸取50 μL孢子液涂布于马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基[9]。在25 ℃培养箱中避光培养4 d。用打孔器取出菌丝块,置于Czapek′s液体培养基上避光培养7 d(25 ℃,120 r/min)后用双层医用纱布过滤出去菌丝[10]。通过血球计数板来统计真菌孢子浓度,并用无菌水将滤液调整到适宜浓度备用。
为了验证GhCOI1的抗病功能,采用直接注射法进行孢子接种。首先选用1 mL注射器针头在棉花植株子叶节以下1 cm处向下轻划,然后在伤口处滴加3~5 μL已经制备好的孢子液,待植株将液滴完全吸入后放置到温室中进行培养,培养条件如上所述。接菌后观察植株生长和发病情况,在21 d后统计发病株数和发病程度,计算病株率和病情指数。相同的试验进行3次重复。
另外,为了分析GhCOI1基因对大丽轮枝菌的应答反应,采用水培接菌法进行试验。简单的步骤为:将发芽好的棉花种子定植到水培培养盒中,水培液中加入1/16 MS培养基无机盐,培养盒放在温室中,培养条件如上所述。待棉花苗生长到2片真叶时,将棉花根浸染在上述制备好的大丽轮枝菌孢子液中30 min,然后再转到水培盒中继续培养。然后进行不同时间的根器官取样,取样时间为0,3,12,36,48 h,收集根材料用流水洗净并用灭菌的滤纸将多余水分吸干,放于-80 ℃冰箱中备用。
2 结果与分析
2.1 棉花COI1基因克隆和序列分析
使用植物RNA提取试剂盒分别提取棉花根、茎、叶的总RNA。通过琼脂糖凝胶电泳对不同组织器官的总RNA进行分离,图1-A显示这些总RNA包含清晰的28S和18S RNA条带,表明这些RNA的质量较好,能够用于后续的分子研究。根据棉花基因组数据库(http://cgp.genomics.org.cn)释放的GhCOI1基因序列,设计1对特异性引物,以棉花根的cDNA为模板,进行PCR扩增。扩增产物在凝胶电泳上显示出2 213 bp大小的目的基因(图1-B)。利用胶回收试剂盒,将上述扩增产物切胶回收,回收产物进行测序。测序结果表明获得的目的序列与棉花基因组释放的GhCOI1序列一致(图2)。
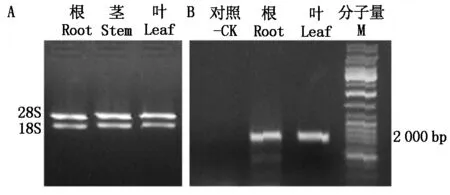
A.棉花不同组织器官总RNA的电泳图;B.GhCOI1基因的PCR扩增。-CK.水为阴性对照;M.DNA分子量。A. Isolation of total RNA from cotton root, stem and leaf;B. Detection of GhCOI1 gene by PCR amplification.-CK.H2O used as negative control;M.DNA molecular marker.
通过生物信息学分析,GhCOI1蛋白含有600个氨基酸,分子量大小为68 kDa,其等电点pI为7.06,在多肽的N端含有典型F-box,在C端富含亮氨酸重复序列(Leueine rich repeat, LRR)结构域(图2)。
在NCBI上选取与GhCOI1直系同源的不同植物进行分析,它们包括TcCOI1、VvCOI1、GmCOI1、PtCOI1、SlCOI1、MtCOI1、AtCOI1。多重序列比对分析表明这些COI1蛋白在氨基酸序列进化组成上差异较小,具有较高的同源性,并都具有典型的F-box和LRR保守区域(图3-A)。再将棉花COI1蛋白与上述所选的植物COI1蛋白进行系统进化分析,利用Clustalx 2.1分析,采用邻接法(Neighbor-Joining, NJ)构建系统进化树。图3-B显示GhCOI1和TcCOI1蛋白高度相似,同时从进化的相似程度来看,该蛋白在植物进化中变异速度较慢。

框里氨基酸代表F-box;下划线氨基酸代表亮氨酸重复序列。
2.2 GhCOI1基因组织器官表达分析
为了分析GhCOI1基因在棉花不同营养器官中的表达情况,利用RT-PCR和qRT-PCR分析棉花GhCOI1在根、茎、叶中的表达水平。以棉花Actin作为内参基因来均一化各棉花组织器官的表达量,半定量和定量qPCR分析结果均表明,GhCOI1在陆地棉的根、茎、叶中均有表达,但是在根中优势表达,茎中表达量最低(图4)。
2.3 大丽轮枝菌对GhCOI1的诱导表达分析
用大丽轮枝菌接种生长2片真叶的棉花,分别提取接种后0,3,12,36,48 h的根,通过qPCR检测GhCOI1基因的表达情况,以棉花Actin为内参基因。结果表明GhCOI1的表达受到病原菌的诱导,表达量随着诱导时间的增加而上升,在接种病原菌12 h时表达水平达到高峰,此后略有下降(图5)。结果说明GhCOI1可能参与棉花的抗病反应。
2.4 GhCOI1基因沉默减弱棉花抗病性
选取GhCOI1基因特异核苷酸序列(图6方框中所示)作为基因沉默的靶序列,这段序列覆盖A、D亚组的2个拷贝。利用PCR技术克隆了这个片段,然后插入到烟草脆裂病毒TRV载体中,构建了病毒沉默载体pYL-156-GhCOI1(图6-A)。把pYL-156-GhCOI1和标记载体pYL-156-PDS以及辅助载体pYL-192通过农杆菌注射法感染棉花子叶,获得VIGS棉花植株。感染14 d后,注射标记基因PDS的VIGS植株叶片沿着叶脉呈现白色,随着时间的延长,叶片失绿加重,直至全白;而注射空载体的阴性对照叶片仍然为绿色(图6-B)。标记基因的沉默表型表明TRV系统在棉花植株中已经成功地进行基因沉默。为了分析VIGS植株中GhCOI1基因的抑制水平,利用RT-PCR和qPCR方法分别分析了沉默植株的表达情况,结果表明,目标基因GhCOI1已经被成功地抑制,平均抑制水平在90%以上(图6-C)。
选择GhCOI1基因抑制较好的VIGS植株进行大丽轮枝菌接菌处理,分析该基因在棉花抗病中的功能。对鉴定过后的沉默植株进行子叶节下方注射孢子,接菌处理21 d后进行分析。结果表明,所有接种黄萎病菌的植株均出现发病症状,叶片出现黄化、萎蔫并脱落,植物生长状况较差。相较于对照植株,沉默植株发病症状更加严重(图7-A)。发病株率和病情指数(DI)分析表明,GhCOI1基因沉默植株明显高于对照(图7-B),暗示该基因的沉默降低了棉花的抗病能力。

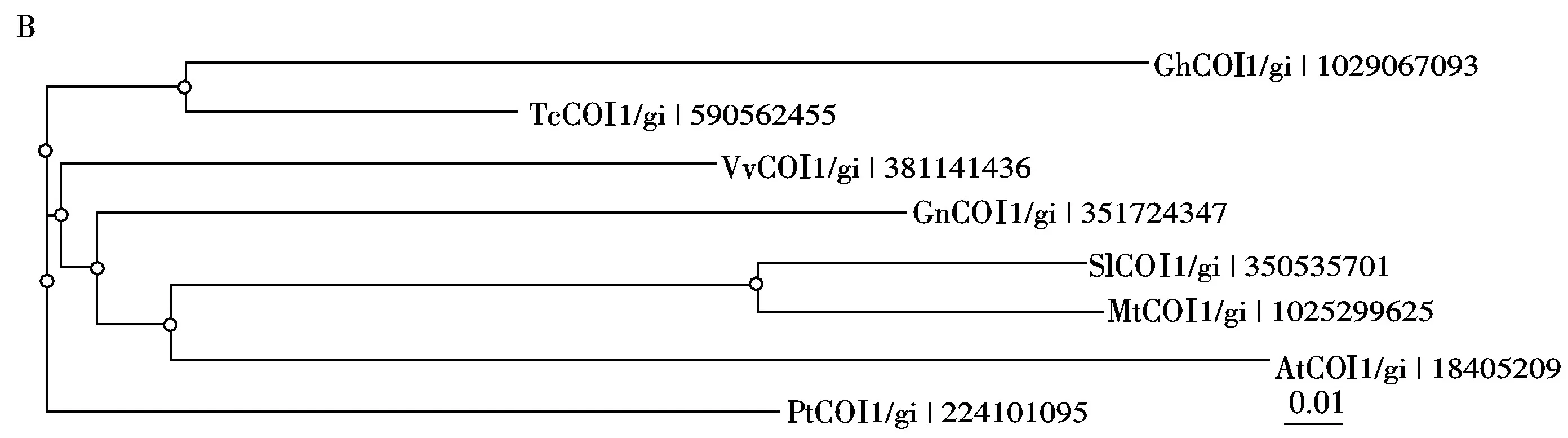
A.不同种植物COI1的氨基酸序列多重比对;B.不同种植物COI1蛋白的系统进化树分析;划线部分为保守结构域F-box和LRR。
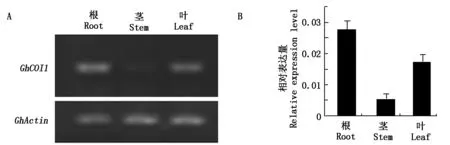
图4 棉花不同组织中GhCOI1的表达情况Fig.4 The relative expression levels of GhCOI1 in different tissues of cotton
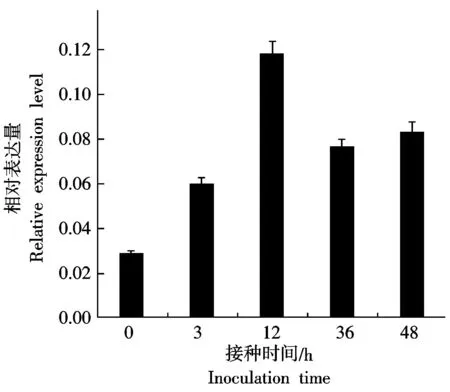
图5 棉花受到大丽轮枝菌侵染后GhCOI1基因在不同时间段的表达情况Fig.5 The relative expression levels of GhCOI1 incourse of time under V.dahliae infection
3 讨论
棉花是一种重要的经济作物,其生产的天然纤维是纺织工业的重要原材料。随着人们生活质量的日益提高,对棉纺织业的要求也愈来愈高。因此,提高棉花的产量和质量成为当前棉花生产的主要目标。然而棉花病虫害的危害严重地制约了棉花的生产,尤其棉花黄萎病的危害大大降低了棉花的品质和产量[11]。当前由于棉花缺少黄萎病的抗原,造成棉花抗病育种裹步不前[12]。利用基因工程分子育种技术也是目前改良植物抗病性的一个主要手段,其中最主要的是抗病基因的分离和功能鉴定。在这个研究中笔者分离了一个棉花抗病相关基因COI1,研究报道说明COI1是JA信号途径中的一个重要成分,参与植物的抗性,包括生物和非生物逆境的抗性。通过VIGS的手段来沉默基因的表达,并对沉默植株进行接菌分析,研究表明,GhCOI1参与了棉花对大丽轮枝菌的抗性。因此,该基因可以作为棉花抗病育种的一个候选基因。
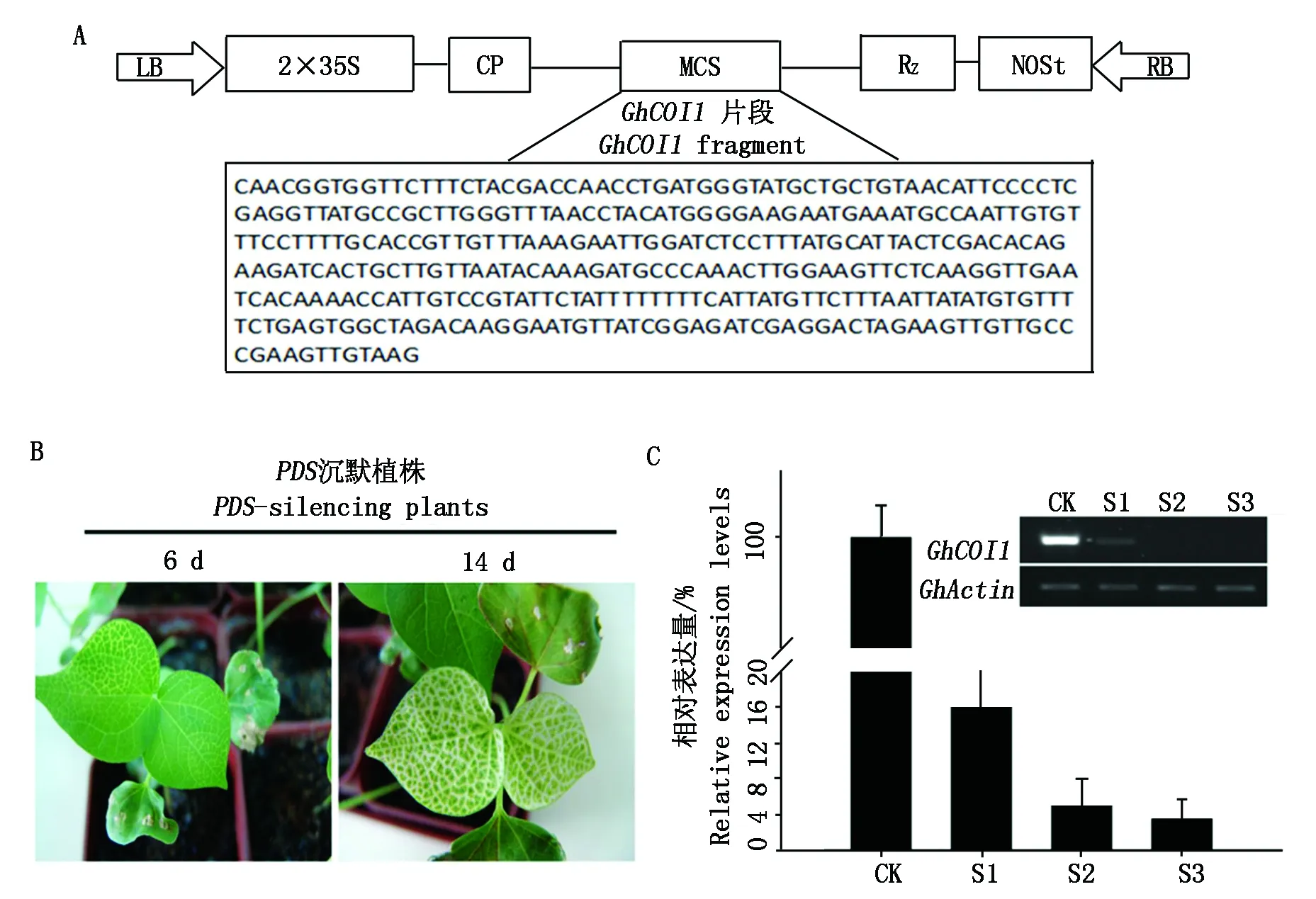
A.沉默载体构建示意图;B. GhPDS沉默植株的叶片漂白表型;C.GhCOI1基因沉默效果;
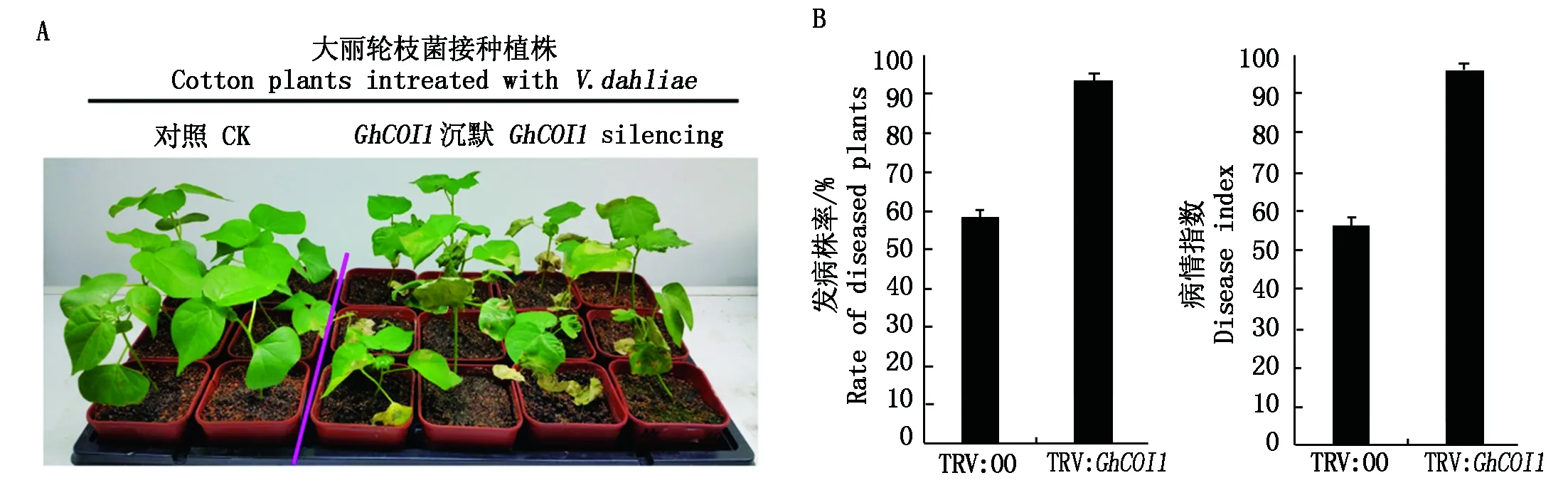
A.GhCOI1基因沉默植株的抗病性下降;B.病株率(左图)和病指(右图)分析。
研究表明,GhCOI1基因受到大丽轮枝菌浸染的诱导,其表达量随着浸染时间的延长呈现上调,结合利用VIGS的反向遗传学方法确证了GhCOI1正调控棉花对大丽轮枝菌的抗性。有研究指出,COI1作为JA分子的一个共受体(Co-receptor)参与SCFCOI1复合体的形成[13]。目前大量研究数据表明,JA在植物抗逆反应中发挥着重要的作用,JA直接调控防卫化学物质的合成与代谢,最终精细调控植物对病原微生物或逆境的抗性反应[14]。COI1蛋白的抗性功能已在多种植物进行报道,如拟南芥、番茄、烟草、大豆和水稻等[15-21]。本研究在棉花中研究结果也表明GhCOI1也参与棉花黄萎病的抗性反应,进一步确证了COI1是一个JA抗病途径中主要成分,是植物抗病反应中重要调控蛋白。
本研究中分离的棉花GhCOI1基因在根器官中优势表达,在茎中表达量较低,并受到大丽轮枝菌浸染的诱导。沉默GhCOI1基因棉花的抗病性减弱,说明该基因编码的蛋白是棉花抗病反应的一个正调控因子,可以考虑作为棉花抗病育种的候选基因。然而有关该蛋白过量表达是否能够提高棉花的抗病性,以及其是否和拟南芥等植物中拥有一样的抗病机制等问题,有待于进一步的研究和探讨。
