马铃薯A病毒重组CP多克隆抗体的制备及其在DAS-ELISA检测中的应用
2017-12-12宋志成费新敏乔利仙王晶珊李广存郭宝太
宋志成,费新敏,杨 煜,乔利仙,王晶珊,李广存,郭宝太
(1.青岛农业大学 生命科学学院,山东省植物生物技术高校重点实验室,山东 青岛 266109;2.山东省农业科学院 蔬菜花卉研究所,山东 济南 250100;3.中国农业科学院 蔬菜花卉研究所,北京 100081)
马铃薯A病毒(PotatovirusA,PVA)是在欧洲、北美等马铃薯产区分布广泛,可侵染多种茄科植物的病毒,造成减产达40%[1]。该病毒可随种薯传播,也可通过蚜虫以非持久的方式传播。PVA与PVX、PVY等可发生复合侵染,对马铃薯生产有很大的危害。目前在我国PVA有少量发现,但该病毒具有较高的流行风险,加强防治研究及口岸检验检疫控制非常必要。
马铃薯感染PVA后会出现花叶、坏死病斑等症状,因品种及病毒株系的不同而异[2]。PVA为马铃薯Y病毒属成员,病毒粒子为弯曲线状,2013年Ksenofontov等[3]对其紫外吸收光谱等物理化学特性进行了细致的研究。PVA的基因组为正义单链RNA,1994年Puurand等[4]获得了PVA全基因组序列,其长度约为9.6 knt,随后的研究深入到PVA基因组全序列的比较[5]。在获得PVA基因组全序列以前,通过基因组3′端部分序列的测定与分析便确定了PVA-CP基因的序列,CP含有269个氨基酸残基[6]。对不同地区PVA分离物CP序列的分析发现其N端第5~7残基为蚜传基序DAG,该基序变异为DAS、DTG、DTS时,PVA病毒失去蚜虫传播能力[7]。在我国PVA研究起步很晚,2002年程晔等[8]报道了PVA杭州分离物,随后的研究集中在PVA新分离物的分析鉴定、CP基因的克隆与序列分析[9-11]、PVA检测方法及其改进等内容[12-16]。
防治PVA的有效途径是生产中使用脱毒种薯或抗病品种,其中使用脱毒种薯更切实可行。Sip[17]利用茎尖组织培养和热处理相结合的方法高效率地脱除了PVA与PVS。针对PVA进行严格的检测,则是无毒种薯脱毒质量的重要保障。脱毒种薯的生产利用中,ELISA检测仍然是普遍采用的方法,检测PVA所用抗体及试剂盒均为进口产品,未见国内制备出PVA抗血清的报道。
1 材料和方法
从PVA-CP基因原核表达载体的构建到ELISA测定于2014-2016年在青岛农业大学遗传研究室完成。
1.1 载体、菌株与病毒标准物
PVA-ACP基因的亚克隆载体pMD18-ACP由本实验室构建,pET22b-PhTPS是坛紫菜TPS基因(PhTPS)的原核表达载体[19]。大肠杆菌菌株DH5α、BL21由本实验室保存。马铃薯A病毒阳性标准物和马铃薯病毒阴性标准物购自美国Agdia公司。
1.2 主要试剂与试剂盒
DNA Marker、蛋白Marker、限制性内切酶为宝生物(大连)有限公司产品,IPTG、蛋白提取试剂、蛋白酶抑制剂PMSF、碱性磷酸酶、辣根过氧化物酶或碱性磷酸酶标记的羊抗兔二抗、质粒小量提取试剂盒、胶回收试剂盒等购自上海生工生物工程股份有限公司,蛋白纯化柱HiTrap Chelating HP、抗体纯化柱Protein G购自美国GE公司,高效无蛋白封闭液为Thermo产品。
1.3 PVA-CP基因原核表达载体的构建
质粒pMD18-ACP进行NdeⅠ与Hind Ⅲ双酶切,回收含PVA-CP基因的723 bp片段,pET22b-PhTPS经同样双酶切后回收长度约为5 000 bp的载体大片段,2个片段的连接产物就是PVA-CP基因的原核表达载体,命名为pET22b-ACP,经酶切鉴定与DNA序列测定确认表达载体构建的正确性,测序由上海生工生物工程股份有限公司完成。
1.4 细菌总蛋白的提取及重组CP的纯化
重组菌BL21(pET22b-ACP)接种于液体LB培养基(Amp 100 μg/mL)中,37 ℃振荡培养至菌液OD600为0.4~0.6,加入IPTG至终浓度为0.1 mmol/L,37 ℃振荡培养10 h。菌体总蛋白的提取采用溶菌酶裂解法,包涵体用含8 mol/L尿素的磷酸盐缓冲溶液(20 mmol/L Na2HPO3,0.5 mol/L NaCl,20 mmol/L咪唑,pH值7.4)溶解,目的蛋白的纯化采用镍离子亲和层析法。分别取1 mL未诱导和诱导菌液离心,用40 μL 1×上样缓冲液悬浮菌体;分别取40 μL包涵体悬浮液、目的蛋白纯化溶液加入10 μL 5×上样缓冲液并混匀;上述样品煮沸5 min后,取20 μL上样,SDS-PAGE电泳检测蛋白表达、提取及纯化效果。
1.5 重组CP抗血清的制备
纯化的重组CP经透析、浓缩及定量后作为抗原免疫家兔,共进行4次免疫,重组CP与等体积弗氏完全佐剂混匀乳化后用于初免,剂量为1 mg/只;蛋白抗原与等体积弗氏不完全佐剂混匀乳化后用于二免、三免与四免,剂量为0.5 mg/只,抗血清效价的测定采用间接ELISA法。抗血清制备及效价测定由上海生工生物工程股份有限公司完成。
1.6 多克隆抗体的分离、纯化与酶标记
多克隆抗体(IgG)的分离采用饱和硫酸铵沉淀法,其纯化采用Potein G亲和层析法。IgG的酶标记采用了戊二醛一步法:取1 mL浓度为2 mg/mL的IgG装入透析袋中,用PBS(pH值7.4)于4 ℃透析18 h,期间换液3次;加5 mg碱性磷酸酶,溶解并混匀,继续用PBS(pH值7.4)于4 ℃透析12 h,期间换液2次;取出混合溶液并加入2 μL 50%的戊二醛,室温反应2 h,经PBS(pH值7.4)透析后取出酶标抗体(IgG-AP)加入200 μL的甘油,4 ℃保存待用。
1.7 抗体与酶标抗体活性的测定
重组CP多克隆抗体活性的测定采用间接ELISA法,用浓度为2 μg/mL的重组CP作抗原包被反应孔,以免疫前抗血清为阴性对照,并设空白对照。酶标抗体(IgG-AP)活性的测定采用直接ELISA法,重组CP包被浓度为2 μg/mL,设阴性对照与空白对照。DAS-ELISA测定时,阴性对照中用免疫前抗血清包被反应孔,并设空白对照。ELISA测定中反应孔的封闭采用高效无蛋白封闭液,每孔200 μL;用PBST洗涤反应孔,每次3遍,在BioTek 公司Elx800型酶标仪上测定OD值。
1.8 马铃薯A病毒的ELISA检测
用重组CP多克隆抗体进行间接ELISA检测,用酶标抗体(IgG-AP)进行直接ELISA检测,用2 mL的病毒提取缓冲溶液(含0.01 mmol/L Na2SO3,2% PVP-4000,0.2% BSA,2% Tween-20的PBS,pH值7.4)将PVA阳性病毒标准物溶解并制成抗原包被工作液,每孔包被量100 μL,马铃薯病毒阴性物为阴性对照,设空白对照。用重组CP多克隆抗体及酶标抗体进行PVA的DAS-ELISA检测时,以PVA重组CP(2 μg/mL)为阳性对照,马铃薯病毒阴性物为阴性对照,同时设空白对照。
2 结果与分析
2.1 PVA-CP基因的原核表达及重组CP的提取与纯化
用 含PVA-CP基因的NdeⅠ-Hind Ⅲ片段替代表达载体pET22b-PhTPS中的PhTPS基因,获得了PVA-CP基因的原核表达载体,命名为pET22b-ACP。从转化子中提取重组质粒,NdeⅠ与Hind Ⅲ双酶切后获得了载体片段与723 bp的基因片段(图1,泳道5,6),酶切结果符合预期,测序结果显示PVA-CP基因插入载体的方向正确,序列没有改变,原核表达载体构建正确。
SDS-PAGE电泳检测显示经诱导后菌体中表达出了特异性的蛋白条带(图2,泳道2,3),其分子量约为30 kDa。723 bp的PVA-CP基因片段的翻译产物约为26.9 kDa,pET22b(+)载体中3′端His标签序列对应的翻译产物为3.0 kDa,预期的重组蛋白为29.9 kDa,结果与预期相符。该目的蛋白主要以包涵体的形式存在,用镍离子亲和层析柱进行纯化后获得了高纯度的重组CP(图2,泳道4)。

1.DNA Marker (DL15000);2.表达载体pET22b-ACP;3.质粒pET22b-ACP/Hind Ⅲ;4.质粒pET22b-ACP/Nde Ⅰ;5~6.质粒pET22b-ACP/Hind Ⅲ+Nde Ⅰ。

M.蛋白 Marker;1.未诱导的菌体蛋白;2.诱导后的菌体蛋白;3.包涵体蛋白;4.纯化的重组CP。M.Protein Marker;1.Without induction;2.Induction with IPTG;3.Protein of inclusion body;4.Purified recombinant CP.
2.2 抗血清制备及重组CP多克隆抗体的纯化与标记
利用高纯度重组CP溶液免疫家兔制备出了抗血清,间接ELISA测定显示其效价为1∶512k,即获得了高效价抗血清。SDS-PAGE电泳结果显示与抗血清相比抗体粗分离液中杂蛋白的含量明显减少(图3,泳道2,3),柱层析纯化得到的多克隆抗体中重链和轻链清晰,结果表明,获得了高纯度多克隆抗体(图3,泳道4),并用戊二醛法进行碱性磷酸酶标记获得了其酶标抗体。
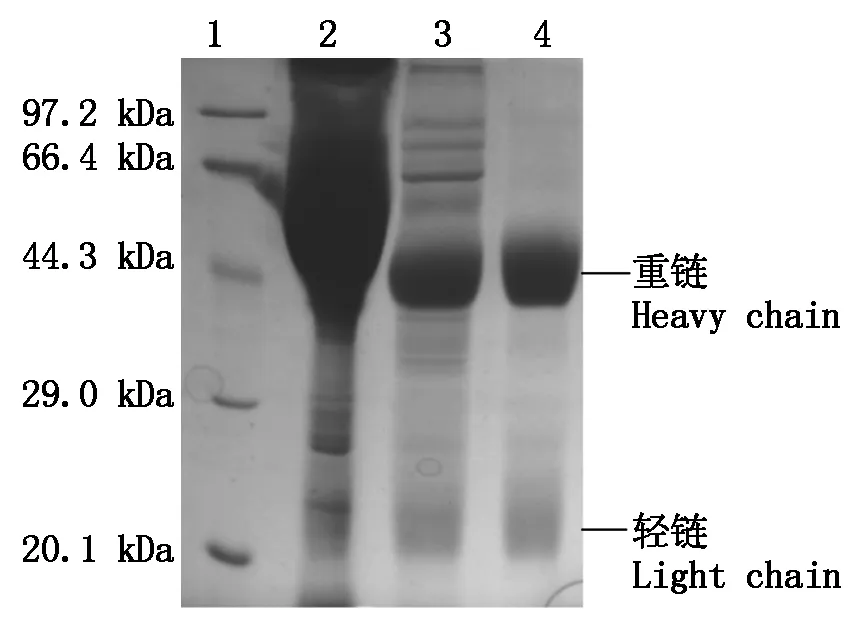
1.蛋白 Marker;2.PVA重组CP抗血清;3.抗体粗分离物;4.纯化的多克隆抗体。1.Protein Marker;2.Antiserum of recombinant CP;3.Crude IgG;4.Purified IgG.
2.3 重组CP纯化抗体及酶标抗体活性的测定
以PVA重组CP为抗原包被反应孔,在间接ELISA与直接ELISA测定中,阴性对照与空白对照都不显色,含纯化抗体或酶标抗体的反应孔显色,目
测结果反应为阳性,但稀释度增加后反应孔颜色变浅。OD值测定结果显示抗体稀释度在1∶64k的范围内,多克隆抗体与抗原(重组CP)具有较强的结合活性,反应孔与阴性对照OD值之比≥2.5(表1),判断为阳性;酶标抗体稀释度达1∶6 400时,仍与PVA重组CP具有较强的反应活性,该比值≥2.5(表2),也判断为阳性反应。
重组CP的IgG与IgG-AP分别进行1∶100、1∶200与1∶300稀释,在与PVA重组CP的DAS-ELIS反应中目测结果为阳性,阴性与空白对照孔呈阴性反应。在波长为405 nm下测定OD值(表3),结果表明,随着IgG和IgG-AP稀释度的增大,OD值变小,IgG与IgG-AP稀释度都为1∶100时,反应孔OD值最大;二者稀释度都为1∶300时,反应孔OD值最小,与阴性孔OD值的比值小于2.5,判断为阴性,其余孔都为阳性。

表1 重组CP多克隆抗体(IgG)活性的间接ELISA测定Tab.1 Activity determination of IgG against recombinant CP by indirect ELISA
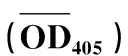
表2 重组CP酶标抗体(IgG-AP)活性的直接ELISA测定Tab.2 Activity determination of IgG-AP against recombinant CP by direct ELISA
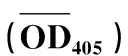
表3 多克隆抗体及其酶标抗体活性的DAS-ELISA测定Tab.3 Activity determination of IgG against recombinant CP and Its IgG-AP by
2.4 马铃薯A病毒的ELISA检测
以马铃薯A病毒阳性标准物为抗原包被反应孔,间接与直接ELISA测定中反应孔的目测结果均为阳性。根据反应孔OD值与阴性孔OD值之比≥2.5的标准,多克隆抗体稀释度达1∶8 000时,还能够与PVA阳性标准物发生阳性反应(表4);酶标抗体(IgG-AP)稀释度达1∶800时,仍能与PVA阳性标准物发生反应(表5),结果表明本试验制备的酶标抗体具有较高抗原结合能力与酶活性。
在DAS-ELISA反应中,PVA阳性标准物及阳性对照(重组CP)的反应孔都呈现黄色,其余孔无色,目测判断PVA标准物和重组CP反应孔都为阳性,且重组CP反应孔颜色明显深于病毒阳性物,这是正常表现。OD405测定结果表明PVA阳性标准物与重组CP反应孔的OD值明显大于阴性对照(表6),依照OD测≥2.5倍OD阴的标准判断反应都为阳性。另外,检测中病毒阳性物反应孔有3列,OD测定值重复性好,表明DAS-ELISA反应稳定性强(表6)。
本试验制备的IgG和IgG-AP达到了马铃薯A病毒DAS-ELISA检测的要求,为利用重组CP多克隆抗体检测PVA或组装马铃薯A病毒DAS-ELISA检测试剂盒奠定了基础。
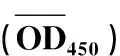
表4 PVA阳性标准物的间接ELISA检测Tab.4 Detection of PVA positive standard by indirect
表5 PVA阳性标准物的直接ELISA检测Tab.5 Detection of PVA positive standard by direct
表6 PVA阳性标准物的DAS-ELISA检测Tab.6 Detection of PVA positive standard by DAS-ELISA
注:1列、2列与3列分别指第1、第2与第3列反应孔。
Note:Column 1,column 2 and column 3 mean the first,the second and the third column of reaction wells respectively.
3 讨论
目前,针对PVA的检测方法主要是分子生物学方法与免疫学方法,后者应用方便、特异性强、要求条件简单,仍然是最基本的方法,特别是DAS-ELISA检测法。利用马铃薯A病毒粒子作抗原免疫家兔可制备出PVA特异性抗血清,并可用于ELISA检测[20]。我国进行PVA检测的抗血清(抗体)及ELISA试剂盒依赖进口,实现其国产化意义明显。
利用CP基因原核表达产物(重组CP)作抗原制备血清,具有抗原纯度高、制备速度快、成本低等优点,值得深入研究。2002年Cerovsk等[18]利用PVA重组CP出了鼠抗血清,但获得的多克隆抗体用于间接ELISA检测有效,用于DAS-ELISA则反应信号弱、噪音信号(阴性对照)强,达不到DAS-ELISA检测的要求。
本研究利用pET22b载体实现了PVA-CP基因的高效率表达,用重组CP制备出了高效价抗血清。针对重组CP多克隆抗体及其酶标抗体的活性进行了系统比较与研究,结果表明:在间接、直接与DAS的3种ELISA测定中,PVA阳性标准物反应信号强、目测及OD值测定结果都呈现阳性;阴性与空白对照不显色,前者OD值高于后者,但远远低于其他反应孔;用重组CP作抗原,显色深度高于PVA阳性标准物;从间接ELISA到直接ELISA、再到DAS-ELISA,抗体的有效使用浓度逐渐降低。这些表现属于正常,没有发现异常。本研究制备的重组CP多克隆抗体及其酶标抗体达到了DAS-ELISA检测的要求,这与开始就使用高纯度重组CP作抗原,最后使用高纯度抗体,整个过程严格有关,也可能与抗血清制备方法及ELISA测定的具体方法不同有关。本研究室制备的马铃薯卷叶病毒重组CP多克隆抗体可用于PLRV的DAS-ELISA检测[21],制备的PVS及PVM重组CP多克隆抗体也达到了DAS-ELISA检测的要求,目前PLRV、PVS、PVM与PVA等4种主要病毒重组CP多克隆抗体都达到了DAS-ELISA检测的要求。
本研究室的目标就是制备出6种马铃薯主要病毒的重组CP多克隆抗体,都达到DAS-ELISA的要求,并推进其在生产中的利用,针对PVX与PVY重组CP多克隆抗体的研究正在进行中,但抗血清(抗体)的大量制备与应用仍是具有挑战性的任务。即使利用重组CP作抗原,制备的抗血清(抗体)仍然存在功能单一的问题,有必要研究新型的抗血清(抗体),以减少检测量、降低检测成本。Kapoor等[22]利用PVX与PVY嵌合CP基因的原核表达产物制备出了多克隆抗体,在直接ELISA检测中该抗体既与PVX也与PVY有阳性反应。这一研究表明用重组CP制备出的1种多克隆抗体可用于2种马铃薯病毒的ELISA检测,为降低ELISA检测成本提供了新的技术途径。另外,ELISA检测技术存在步骤多、需要时间长的问题,改进ELISA具体检测方法[23]也是非常必要的。
