元宝枫种仁70%乙醇提取物的化学成分分析
2017-12-11张玉伟李珊珊宋明杰陈建波李岱龙孙印石
张玉伟,李珊珊,宋明杰,陈建波,刘 畅,张 磊,李岱龙,孙印石,*
元宝枫种仁70%乙醇提取物的化学成分分析
张玉伟1,李珊珊1,宋明杰1,陈建波1,刘 畅1,张 磊1,李岱龙2,孙印石1,*
(1.中国农业科学院特产研究所,吉林 长春 130112;2.山东永春堂集团有限公司,山东 泗水 273299)
目的:对新资源食品元宝枫种仁中的化学成分进行研究。方法:采用硅胶、聚酰胺、凝胶(Sephadex LH-20)柱色谱及重结晶等技术进行分离纯化,综合运用质谱和波谱学方法鉴定化合物结构。结果:从元宝枫种仁70%乙醇溶液提取物中分离鉴定了12 种化合物,分别为二氢去氢二愈创木基醇-4’-O-β-D-葡萄糖苷(1)、1,2,3,6-四没食子酰基-O-β-D-吡喃葡萄糖(2)、1,2,3,4,6-五没食子酰基-O-β-D-吡喃葡萄糖(3)、槲皮素(4)、山柰酚-3-O-α-L-吡喃鼠李糖苷(5)、槲皮素-3-O-α-L-吡喃鼠李糖苷(6)、槲皮素-3-O-β-D-吡喃半乳糖苷(7)、槲皮素-3-O-α-L-吡喃阿拉伯糖苷(8)、阿夫儿茶素(9)、儿茶素(10)、表儿茶素(11)、胡萝卜苷(12)。结论:经SciFinder检索发现,化合物1~12均为首次从元宝枫种仁中分离得到,其中化合物1、2、9~11为首次从槭树属植物中分离得到。
元宝枫;新资源食品;化学成分
元宝枫(Acer truncatum Bunge)为槭树科(Aceraceae)槭树属(Acer)落叶乔木,因翅果形状像中国古代金锭“元宝”而得名,也叫五角枫,广布于我国的东北、华北及西北各省区。元宝枫的根和叶具有祛风除湿的功效,在临床上用于治疗关节疼痛、骨折、跌打损伤等症[1]。元宝枫的树皮、果、叶都可提取栲胶[2],是一种集医疗保健价值和经济价值为一体的具有极高使用价值的树种,在绿色食品开发、医疗保健、疾病防治以及建材化工等领域都有良好的应用和开发前景[3]。
元宝枫籽油是一种优质的食用油和医药保健用油,研究表明元宝枫种仁中油脂量可达45%~48%,其脂肪酸组成中含有5%~6%的神经酸,该化合物是人体大脑发育的必需营养物质,对提高脑神经活跃性、防止脑神经衰老有很大作用[4-5],鉴于此,2011年3月,国家卫生部正式发出公告(2011年第9号),批准元宝枫籽油为新资源食品,这将使元宝枫产业迎来崭新、快速的发展。从文献调研来看,大多只注重了元宝枫籽油的开发利用,而种仁中除籽油以外的其他方面鲜有报道,为充分挖掘元宝枫种仁中的功能性成分并评价其作为食品新资源的安全性,本实验对元宝枫种仁的化学成分进行了系统研究,本研究从脱脂后元宝枫种仁的醇提物中分离得到12种化合物,结构式如图1所示,其中化合物1、2、9~11为首次从该属植物中分离得到。

图1 化合物1~12的结构式Fig. 1 Chemical structures of compounds 1–12
1 材料与方法
1.1 材料与试剂
实验所用元宝枫材料于2015年6月购于内蒙赤峰,经中国农业科学院特产研究所王英平研究员鉴定为槭树科槭树属植物元宝枫(Acer truncatum Bunge)的种子。植物标本(TCS20150633)保存于中国农业科学院特产研究所植物标本室。
AB-8型大孔吸附树脂 河北宝恩化工有限公司;柱层析硅胶(200~300目)、薄层层析硅胶 青岛海洋化工厂;Sephadex LH-20 瑞士Pharmacia公司;柱层析聚酰胺(100~200目) 天津南开化工厂;乙醇、石油醚、乙酸乙酯、二氯甲烷、甲醇(均为分析纯)北京化工厂。
1.2 仪器与设备
回流提取器(3 000 mL) 天津玻璃仪器厂;旋转蒸发仪(3 000 mL) 上海申生科技有限公司;SHZ-D型循环水式多用真空泵 郑州长城科工贸有限公司;ZK072B真空干燥型电热真空干燥箱 上海市实验仪器总厂;YanacoMP-S3型熔点测定仪 日本岛津公司;YP2002型电子天平 上海越平科学仪器有限公司;Ultra Shield Av400mhznmr超导核磁共振波谱仪 德国Bruker公司。
1.3 方法
1.3.1 元宝枫种仁化学成分的提取
取干燥的元宝枫种子10 kg,脱掉翅果皮后将种仁适当粉碎,先用石油醚连续回流提取3 次,每次2 h,除去油脂类成分,残渣用70%乙醇溶液回流提取3 次,每次2 h。将70%乙醇溶液提取液合并,在60 ℃条件下减压浓缩,得总浸膏2 400 g。
1.3.2 元宝枫种仁化学成分的分离纯化
取总浸膏1 500 g经过AB-8大孔树脂吸附,用去离子水反复洗脱去除极性较大的多糖、蛋白等水溶性成分,再依次用10%、30%、60%和95%乙醇溶液洗脱,得4个不同极性的洗脱物。其中30%乙醇溶液和60%乙醇溶液洗脱物有较大交叉,将二者合并后经200~300目硅胶柱层析(1 200 mm×80 mm),以二氯甲烷-甲醇(0∶100~100∶0,V/V)溶液进行梯度洗脱,洗脱液每1000 mL接收1份,以薄层色谱检测并合并相同流分,得到Fr.1~Fr.23共23个部分。其中Fr.3直接析出白色粉末,经甲醇反复溶解沉淀后得到化合物12(54 mg);Fr.4和Fr.5合并后经硅胶层析柱(1 200 mm×30 mm)再次分离,以石油醚-乙酸乙酯(20∶1~0∶20,V/V)溶液梯度洗脱,各级流分再经Sephadex LH-20层析柱得到化合物9(5 mg)、10(12 mg)和11(3 mg);Fr.8经Sephadex LH-20层析柱(1500 mm×30 mm)分离,以二氯甲烷-甲醇(1∶1,V/V)溶液进行等度洗脱,得化合物1(5 mg)和4(11 mg);Fr.10、Fr.11和Fr.12合并后经100~200目聚酰胺柱层析(1200 mm×40 mm),以甲醇-水(10%~100%,V/V)梯度洗脱,各次级流分经反复凝胶柱层析和重结晶得到化合物5(18 mg)、6(22 mg)、7(14 mg)和8(6 mg);Fr.14和Fr.15合并后经Sephadex LH-20层析柱(1500 mm×30 mm)分离,以甲醇-水(10%、30%、60%、100%,V/V)溶液梯度洗脱,得到化合物2(11 mg)和3(24 mg)。分离纯化流程如图2所示。
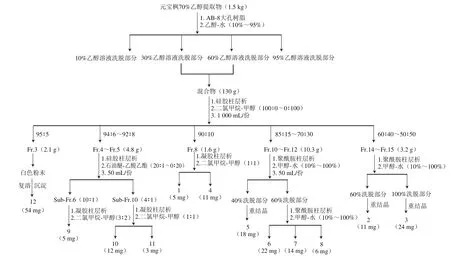
图2 元宝枫种仁70%乙醇溶液提取物的分离流程图Fig. 2 Flow chart for the fractionation of 70% EtOH extract from A. truncatum
2 结果与分析
通过对化合物的理化性质、质谱及核磁波谱数据分析,结合文献对照,鉴定了12种化合物的结构,其中包括1种木脂素类化合物:二氢去氢二愈创木基醇-4’-O-β-D-葡萄糖苷(1);2种没食子酰基葡萄糖:1,2,3,6-四没食子酰基-O-β-D-吡喃葡萄糖(2)、1,2,3,4,6-五没食子酰基-O-β-D-吡喃葡萄糖(3);8种黄酮类化合物:槲皮素(4)、山柰酚-3-O-α-L-吡喃鼠李糖苷(5)、槲皮素-3-O-α-L-吡喃鼠李糖苷(6)、槲皮素-3-O-β-D-吡喃半乳糖苷(7)、槲皮素-3-O-α-L-吡喃阿拉伯糖苷(8)、阿夫儿茶素(9)、儿茶素(10)、表儿茶素(11);1种其他类化合物:胡萝卜苷(12)。
2.1 化合物1的结构鉴定
化合物1为白色无定形粉末(甲醇),Molish反应呈阳性,酸水解检出D-葡萄糖。准分子离子峰m/z为545.2 [M+Na]+,结合碳谱(nuclear magnetic resonance carbon spectrum,13C-NMR)、氢谱(nuclear magnetic resonance spectroscopy,1H-NMR)提供的信息,推测分子式为C26H34O11。1H-NMR(500 MHz,DMSO-d6)信息可知:δ 6.68(1H,s,H-2),6.68(1H,s,H-6),2.52(2H,t,J=7.8 Hz,H-7),1.67(2H,m,H-8),3.42(2H,m,H-9),6.95(1H,d,J=1.9 Hz,H-2’),7.05(1H,d,J=8.5 Hz,H-5’),6.83(1H,dd,J=8.5,1.9 Hz,H-6’),5.45(1H,d,J=6.6 Hz,H-7’),3.3-3.5(1H,m,H-8’),3.62(1H,dd,J=5.4,10.7 Hz,H-9’a),3.66(1H,dd,J=5.2,10.7 Hz,H-9’b),3.76(3H,s,3-OCH3),3.73(3H,s,3’-OCH3),4.86(1H,d,J=7.5 Hz,H-1’),3.42(1H,m,H-6’a),3.64(1H,m,H-6’b)。由13C-NMR(125 MHz,DMSO-d6)信息可知:δ 135.1(C-1),112.5(C-2),143.3(C-3),145.4(C-4),128.8(C-5),116.4(C-6),31.5(C-7),34.7(C-8),60.2(C-9),135.4(C-1’),110.3(C-2’),148.9(C-3’),146.1(C-4’),115.3(C-5’),118.0(C-6’),86.5(C-7’),53.5(C-8’),63.0(C-9’),55.66(3-OCH3),55.72(3’-OCH3),100.1(C-1’),73.2(C-2’),77.0(C-3’’),69.6(C-4’’),76.8(C-5’),60.6(C-6’)。以上数据与文献[6]报道基本一致,故鉴定化合物1为二氢去氢二愈创木基醇-4’-O-β-D-葡萄糖苷。
2.2 化合物2的结构鉴定
化合物2白色粉末(甲醇),紫外灯下有蓝色荧光,三氯化铁反应呈阳性。ESI-MS显示准分子离子峰m/z 811.1 [M+Na]+,结合碳谱、氢谱提供的信息,推测分子式为C34H28O22。由1H-NMR(400 MHz,DMSO-d6)信息可知:δ 9.32(2H,br. s)、9.30(2H,br. s)、9.21(2H,br. s)、9.20(2H,br. s)、9.11(1H,br. s)、8.98(1H,br. s)、8.95(1H,br. s)、8.92(1H,br. s)为12个活泼质子信号;δ 6.99(2H,s)、6.90(2H,s)、6.88(2H,s)、6.80(2H,s)为4组芳香质子信号;δ 6.14(1H,d,J=8.4 Hz,H-1)为一糖端基质子信号。13C-NMR(100MHz,DMSO-d6)谱图中,在低场区给出4组没食子酰基碳信号:δ 165.6(C-7’)、165.0(C-7’’)、164.6(C-7’’)、164.0(C-7’’’)、145.5(C-3’,5’,3’,5’’)、145.4(C-3’’,5’’,3’’,5’’)、139.5(C-4’)、138.9(C-4’)、138.6(C-4’’)、138.5(C-4’’)、119.1(C-1’)、119.0(C-1’)、118.1(C-1’’)、117.5(C-1’’)、109.0(C-2’,6’)、108.8(C-2’,6’)、108.7(C-2’’,6’’)、108.6(C-2’’,6’’);在稍高场区给出1 组葡萄糖碳信号:δ 91.9(C-1)、74.6(C-5)、74.3(C-3)、70.6(C-2)、67.6(C-4)、62.6(C-6),由δ 91.9推测葡萄糖端基碳与一分子没食子酰基成酯苷,另外δ 70.6(C-2)、74.3(C-3)和62.6(C-6)也是由于酰化效应而向低场位移了2~3个化学位移,因此葡萄糖C-2、C-3、C-6位也分别与一分子没食子酰基结合成酯键。综合理化性质及波谱数据分析,并参考文献[7],鉴定化合物2为1,2,3,6-四没食子酰基-O-β-D-吡喃葡萄糖。
2.3 化合物3的结构鉴定
化合物3为灰白色粉末(甲醇),紫外灯下有蓝色荧光,三氯化铁反应阳性。准分子离子峰m/z 939.3[M-H]+,结合碳谱、氢谱提供的信息,推测分子式为C34H28O22,二级质谱图给出连续失去5个没食子酰基片段的碎片离子峰m/z 769、601、429、259和123。由1H-NMR(400 MHz,CD3OD)信息可知:δ 6.80(2H,s)、6.85(2H,s)、6.88(2H,s)、6.95(2H,s)、7.01(2H,s)分别为5 组没食子酰基的芳香质子信号(H-2’,6’~H-2’’’,6’’’);δ 6.13(1H,d,J=8.1 Hz,H-1)为一糖端基质子信号。13C-NMR(100MHz,CD3OD)谱图中,除5 组没食子酰基碳信号外,在稍高场区给出一组五取代的葡萄糖碳信号:δ 92.3(C-1)、70.7(C-2)、72.6(C-3)、68.3(C-4)、72.9(C-5)、61.6(C-6)。综合理化性质、质谱及波谱数据分析,并参考文献[8],鉴定化合物3为1,2,3,4,6-五没食子酰基-O-β-D-吡喃葡萄糖。
2.4 化合物4的结构鉴定
化合物4为黄色粉末(甲醇),三氯化铁反应呈阳性,SrCl2反应阳性,盐酸-镁粉反应阳性,表示为一黄酮类化合物。由1H-NMR(400 MHz,DMSO-d6)信息可知:δ 12.51(1H,s)为5位缔合酚羟基质子信号,10.81(1H,s),9.62(1H,s),9.46(1H,s),9.33(1H,s)为另外4个酚羟基质子信号;δ 6.91(1H,d,J=8.5 Hz),7.56(1H,dd,J=8.5,1.8 Hz),7.69(1H,d,J=1.8 Hz)为B环上5’,6’,2’组成的ABX偶合系统质子信号,δ 6.20(1H,d,J=1.5 Hz),6.42(1H,d,J=1.5 Hz)为A环上6、8位质子信号。综合以上理化性质和波谱数据,并与文献[9]进行对照,鉴定化合物4为槲皮素。
2.5 化合物5的结构鉴定
化合物5为黄色粉末(甲醇),三氯化铁-铁氰化钾反应阳性,表示有酚羟基存在;盐酸-镁粉反应阳性,Molish反应阳性,推测为黄酮苷类化合物;酸水解检出L-鼠李糖。由1H-NMR(400 MHz,DMSO-d6)信息可知,δ 12.63(1H,s,5-OH),10.82(1H,s,7-OH),10.20(1H,s,4’-OH)为3个酚羟基质子信号;δ 6.21(1H,d,J=1.8 Hz,H-6),6.43(1H,d,J=1.8 Hz,H-8),7.76(2H,d,J=8.5 Hz,H-2’,6’)和δ 6.93(2H,d,J=8.5 Hz,H-3’,5’),确定其母核为山柰酚;糖区给出糖的端基质子信号δ 5.35(1H,br. s,H-1’)以及δ 0.78(3H,d,J=6.0 Hz,H-6’)为鼠李糖甲基信号。13C-NMR数据见表1,与文献[10]报道的山柰酚-3-O-α-L-吡喃鼠李糖苷的数据基本一致,鉴定该化合物5为山柰酚-3-O-α-L-吡喃鼠李糖苷。
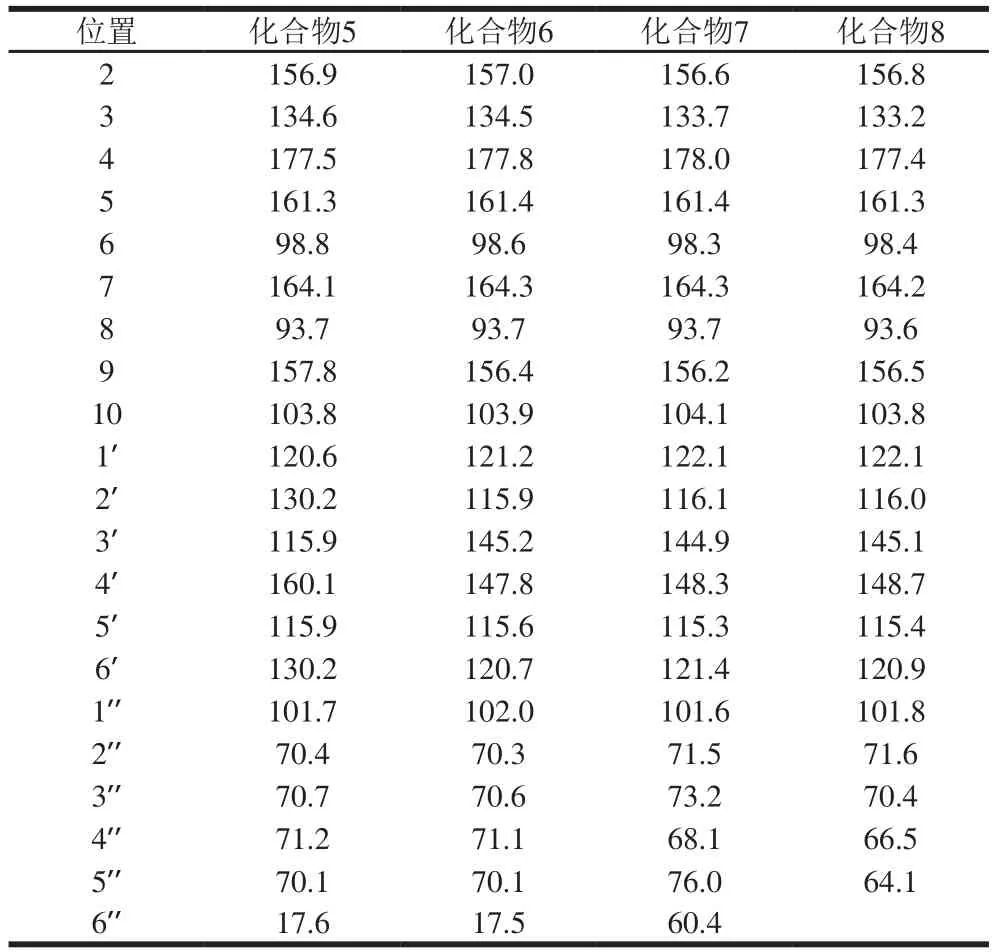
表1 化合物5~8的13C-NMR数据(100 MHz,DMSO-d6)Table 1 13C-NMR data of compounds 5–8 (100 MHz, DMSO-d6)
2.6 化合物6的结构鉴定
化合物6为黄色粉末(甲醇),三氯化铁反应阳性,表示有酚羟基存在;盐酸-镁粉反应阳性,Molish反应阳性,推测为黄酮苷类化合物;酸水解检出L-鼠李糖。由1H-NMR(400 MHz,DMSO-d6)信息可知,δ 12.64(1H,s,5-OH),10.92(1H,s,7-OH),10.35(2H,br. s,3’,4’-OH)为4 个酚羟基质子信号;δ 6.20(1H,d,J=2.0 Hz,H-6),6.40(1H,d,J=2.0 Hz,H-8),7.24(1H,d,J=1.8 Hz,H-2’),6.89(1H,d,J=8.4 Hz,H-5’),7.29(1H,dd,J=8.4,1.8 Hz,H-6’),确定其母核为槲皮素;糖区给出糖的端基质子信号δ 5.27(1H,br. s,H-1’)以及δ 0.81(3H,d,J=5.8 Hz,H-6’)为鼠李糖甲基信号。13C-NMR数据见表1,与文献[11]报道的槲皮素-3-O-α-L-吡喃鼠李糖苷的数据基本一致,鉴定该化合物6为槲皮素-3-O-α-L-吡喃鼠李糖苷。
2.7 化合物7的结构鉴定
化合物7为黄色粉末(甲醇),三氯化铁-铁氰化钾反应阳性,表示有酚羟基存在;盐酸-镁粉反应阳性,Molish反应阳性,推测为黄酮苷类化合物;酸水解检出D-半乳糖。由1H-NMR(400 MHz,DMSO-d6)信息可知,δ 12.88(1H,s,5-OH),11.06(1H,s,7-OH),10.69(2H,br. s,3’,4’-OH),6.22(1H,d,J=2.1 Hz,H-6),6.44(1H,d,J=2.1 Hz,H-8),7.28(1H,d,J=2.1 Hz,H-2’),6.90(1H,d,J=8.4 Hz,H-5’),7.33(1H,dd,J=8.4,2.1 Hz,H-6’),5.40(1H,d,J=8.2 Hz,H-1’)。13C-NMR数据见表1,与文献[12]报道的槲皮素-3-O-β-D-吡喃半乳糖苷的数据基本一致,因此鉴定化合物7为槲皮素-3-O-β-D-吡喃半乳糖苷。
2.8 化合物8的结构鉴定
化合物8为黄色粉末(甲醇),三氯化铁反应阳性,盐酸-镁粉反应阳性,Molish反应阳性,推测为黄酮苷类化合物,酸水解检出L-阿拉伯糖。1H-NMR(400 MHz,DMSO-d6)δ 12.50(1H,s,5-OH),10.78(1H,s,7-OH),10.61(1H,br. s,4’-OH),9.76(1H,br. s,3’-OH),6.18(1H,d,J=1.9 Hz,H-6),6.42(1H,d,J=1.9 Hz,H-8),7.21(1H,d,J=1.8 Hz,H-2’),6.88(1H,d,J=8.2 Hz,H-5’),7.31(1H,dd,J=8.2,1.9 Hz,H-6’),5.25(1H,br. s,H-1’)。13C-NMR数据见表1,与文献[13]报道的槲皮素-3-O-α-L-吡喃阿拉伯糖苷的数据基本一致,鉴定该化合物8为槲皮素-3-O-α-L-吡喃阿拉伯糖苷。
2.9 化合物9的结构鉴定
化合物9为灰白色粉末(甲醇),10%硫酸-乙醇溶液显棕黄色,三氯化铁-铁氰化钾反应呈阳性。由1H-NMR(400 MHz,DMSO-d6)信息可知,δ 9.36(1H,br. s,5-OH),9.19(1H,br. s,7-OH),8.90(1H,br. s,4’-OH),7.12(2H,d,J=8.2 Hz,H-2’,6’),6.71(2H,d,J=8.2 Hz,H-3’,5’),5.90(1H,d,J=1.8 Hz,H-8),5.69(1H,d,J=1.8 Hz,H-6),4.89(1H,d,J=5.2,C3-OH),4.53(1H,d,J=7.8Hz,H-2),3.87(1H,m,H-3),2.69(1H,dd,J=16.0,5.4 Hz,H-4a),2.36(1H,dd,J=16.0,8.4Hz,H-4b)。13C-NMR(100 MHz,DMSO-d6)δ 80.8(C-2),66.0(C-3),28.2(C-4),155.2(C-5),95.1(C-6),156.1(C-7),93.6(C-8),156.3(C-9),99.2(C-10),129.7(C-1’),128.4(C-2’,6’),114.5(C-3’,5’),156.6(C-4’)。以上数据与文献[14]中的阿夫儿茶素数据进行对照基本一致,故确定化合物9为阿夫儿茶素。
2.10 化合物10的结构鉴定
化合物10为白色球状结晶(氯仿-甲醇),三氯化铁反应呈阳性,示有酚羟基存在。由1H-NMR(400MHz,DMSO-d6)信息可知,δ 9.18(1H,br. s,5-OH),8.94(1H,br. s,7-OH),8.84(1H,br. s,4’-OH),8.76(1H,br. s,3’-OH),6.71(1H,d,J=2.1 Hz,H-2’),6.67(1H,d,J=8.5 Hz,H-5’),6.58(1H,dd,J=8.5,2.1 Hz,H-6’),5.88(1H,d,J=2.4 Hz,H-8),5.65(1H,d,J=2.4 Hz,H-6),4.84(1H,d,J=5.2,C3-OH),4.46(1H,d,J=7.2 Hz,H-2),3.83(1H,m,H-3),2.66(1H,dd,J=16.0,5.2 Hz,H-4a),2.33(1H,dd,J=16.0,8.0 Hz,H-4b)。13C-NMR(100MHz,DMSO-d6)δ 81.2(C-2),66.5(C-3),27.9(C-4),155.6(C-5),95.3(C-6),156.2(C-7),93.8(C-8),156.6(C-9),99.3(C-10),130.8(C-1’),114.5(C-2’),144.6(C-3’),144.9(C-4’),115.2(C-5’),118.7(C-6’)。与文献[15-16]所报道的儿茶素数据一致,故鉴定化合物10为儿茶素。
2.11 化合物11的结构鉴定
化合物11为白色粉末(甲醇),FeCl3反应呈阳性,表示有酚羟基存在。由1H-NMR(400MHz,DMSO-d6)信息可知,δ 9.09(1H,br. s,5-OH),8.88(1H,br. s,7-OH),8.78(1H,br. s,4’-OH),8.73(1H,br. s,3’-OH),6.88(1H,d,J=2.1 Hz,H-2’),6.67(1H,dd,J=8.0,2.1 Hz,H-6’),6.63(1H,d,J=8.0 Hz,H-5’),5.90(1H,d,J=2.0 Hz,8-H),5.68(1H,d,J=2.0 Hz,6-H),4.74(1H,s,3-OH),4.63(1H,d,J=4.4,H-2),4.02(1H,m,H-3),2.69(1H,dd,J=16.0,4.5 Hz,H-4a),2.31(1H,dd,J=16.0,2.0 Hz,H-4b)。13C-NMR(100MHz,DMSO-d6)δ 77.9.0(C-2),64.7(C-3),28.0(C-4),155.4(C-5),95.0(C-6),156.2(C-7),94.0(C-8),156.2(C-9),98.4(C-10),130.6(C-1’),114.7(C-2’),144.2(C-3’),144.6(C-4’),114.9(C-5’),117.6(C-6’)。与文献[16-17]所报道的表儿茶素基本一致,故鉴定化合物11为表儿茶素。
2.12 化合物12的结构鉴定
化合物12为白色无定型粉末(甲醇),熔点大于300℃。10%硫酸-乙醇溶液显紫色,Liebermann-Burchard反应阳性,Molish反应阳性。与胡萝卜苷对照品比较,比移值在3 种溶剂系统中与对照品一致,故鉴定化合物12为胡萝卜苷。
3 讨 论
本研究所得到的化合物1~11属于天然多酚类物质,大量的研究已经表明,这类化合物具有很好的抗氧化活性,即清除自由基的活性[18-20]。几十年来,天然药物的发展和广泛应用为人类疾病的防治和功能性食品的研发发挥了极大的作用,且大部分归因于其含有能清除人体过量自由基的抗氧化成分[21-22]。
本研究得到的没食子酰基葡萄糖类化合物2和化合物3,具有多酚羟基的结构特点,这使它们成为优质的天然抗氧化剂。化合物2具有抗氧化、抗炎、抗肿瘤等多种药理活性[23-25],提示该化合物可能成为一种潜在的、具有广泛应用前景的生物活性成分。另外,化合物2和化合物3均有明显的抗幽门螺杆菌活性[8,26],对于预防和治疗由幽门螺杆菌引发的胃部疾病具有很好的潜力。
化合物4~11属于黄酮类化合物,大量研究表明,黄酮类化合物具有抗氧化、抗突变、抗肿瘤、抗菌、抗病毒和调节免疫、防治血管硬化、降血糖等功能,并有毒性低、见效快等特点,长期以来一直是天然药物和功能性食品研究开发的热点[27]。如化合物4,即槲皮素,具有抗氧化、抗肿瘤、抗炎、抗血小板聚集、免疫抑制和心血管保护等多种药理作用[28],在食品工业中可以作为天然抗氧化剂和食用黄色素。又如化合物5,即山柰酚-3-O-α-L-吡喃鼠李糖苷,对神经系统、消化系统、免疫系统等都具有调节作用,已经是一些保健食品的标志性成分[29]。另外,黄烷类化合物9~11也是一类优质的天然抗氧化剂,存在于许多水果和茶叶中,其抗氧化保健作用已得到国内外医学、食品和营养界的公认[30]。
元宝枫在我国的资源十分丰富,本研究得到的化合物1~11都是种仁中含量较大的多酚类物质,这些化合物具有广泛的药理活性和保健功能。随着人们对元宝枫活性成分功能性和营养性的深入研究,以及提取工艺技术的不断进步,元宝枫多酚类物质在功能性食品、保健品、化妆品和医药品领域的应用前景必将更加广阔。
4 结 论
经SciFinder检索发现本研究从元宝枫种仁中首次分离得到的12 种化合物,其中包括1 种木脂素类化合物、2 种没食子酰基葡萄糖、8 种黄酮类化合物及1 种其他类化合物,化合物1、2、9~11为首次从槭树属植物中分离得到,所得化合物绝大多数为天然多酚类物质,在食品和医学上具有广泛的用途。因此,本研究为元宝枫的进一步开发利用提供了理论依据。
[1] 全国中草药汇编编写组. 全国中草药汇编∶ 下册[M]. 北京∶ 人民卫生出版社, 1978∶ 293.
[2] 北京林学院. 树木学[M]. 北京∶ 中国林业出版社, 1991∶ 328-329.
[3] 李云志, 曾凡骏, 曾里. 元宝枫的综合开发利用[J]. 食品与发酵工业,2004, 30(6)∶ 90-94. DOI∶10.3321/j.issn∶0253-990X.2004.06.020.
[4] SARGENT J R, COUPLAND K, WILSON R. Nervonic acid and demyelinating disease[J]. Medical Hypotheses, 1994, 42(4)∶ 237-242.DOI∶10.1016/0306-9877(94)90122-8.
[5] NTOUMANI E, STRANDVIK B, SABEL K G. Nervonic acid is much lower in donor milk than in milk from mothers delivering premature infants of neglected importance?[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2013, 89(4)∶ 241-244. DOI∶10.1016/j.plefa.2013.06.005.
[6] TAKARA K, MATSUI D, WADA K, et al. New phenolic compounds from Kokuto, non-centrifuged cane sugar[J]. Bioscience Biotechnology &Biochemistry, 2003, 67(2)∶ 376-379. DOI∶10.1271/bbb.67.376.
[7] TAKASHI Y, TONG C, AYA N, et al. Woodfordin C, a macro-ring hydrolyzable tannin dimer with antitumor activity, and accompanying dimers from Woodfordia fruticosa flowers[J]. Chemical &Pharmaceutical Bulletin, 1990, 38(5)∶ 1211-1217. DOI∶10.1248/cpb.39.1157.
[8] NGAN L T M, MOON J K, SHIBAMOTO T, et al. Growth-inhibiting,bactericidal, and urease inhibitory effects of Paeonia lactiflora Root constituents and related compounds on antibiotic-susceptible and-resistant strains of Helicobacter pylori[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36)∶ 9062-9073. DOI∶10.1021/jf3035034.
[9] 张京, 况燚, 刘力, 等. 金荞麦块根化学成分的研究[J]. 中草药, 2016,47(5)∶ 722-725. DOI∶10.7501/j.issn.0253-2670.2016.05.005.
[10] KIM Y K, KIM Y S, SANG U C, et al. Isolation of flavonol rhamnosides from Loranthus tanakae, and cytotoxic effect of them on human tumor cell lines[J]. Archives of Pharmacal Research, 2004,27(1)∶ 44-47. DOI∶10.1007/BF02980044.
[11] 尚小雅, 李帅, 王素娟, 等. 红绒毛羊蹄甲中的黄酮类成分[J]. 中草药, 2009, 40(2)∶ 196-199. DOI∶10.3321/j.issn∶0253-2670.2009.02.009.
[12] BEZUIDENHOUDT B C B, BRANDT E V, FERREIRA D. Flavonoid analogues from Pterocarpus species[J]. Phytochemistry, 1987, 26(2)∶531-535. DOI∶10.1016/S0031-9422(00)81448-X.
[13] 于德泉, 杨峻山. 分析化学手册∶ 核磁共振波谱分析[M]. 北京∶ 化学工业出版社, 1999∶ 820-821.
[14] SAIJYO J, SUZUKI Y, OKUNO Y, et al. α-Glucosidase inhibitor from Bergenia ligulata[J]. Journal of Oleo Science, 2008, 57(8)∶431-435. DOI∶10.5650/jos.57.431.
[15] 施贵荣, 李冬梅, 刘光明. 西南鬼灯檠的化学成分研究[J]. 大理学院学报, 2008, 7(4)∶ 1-2. DOI∶10.3969/j.issn.1672-2345.2008.04.002.
[16] FOO L Y, NEWMAN R, WAGHORN G, et al. Proanthocyanidns from Lotus corniculatus[J]. Phytochemistry, 1996, 41(2)∶ 617-624.DOI∶10.1016/0031-9422(95)00602-8.
[17] 任恒春, 万定荣, 邹忠梅. 血三七化学成分的研究[J]. 中国中药杂志,2009, 34(2)∶ 183-185. DOI∶10.3321/j.issn∶1001-5302.2009.02.017.
[18] SHON M Y, KIM T H, SUNG N T. Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenachactaccae) extracts[J]. Food Chemistry, 2003, 82(4)∶593-597. DOI∶10.1016/S0308-8146(03)00015-3.
[19] MULERO J, MARTÍNEZ G, OLIVA J, et al. Phenolic compounds and antioxidant activity of red wine made from grapes treated with different fungicides[J]. Food Chemistry, 2015, 180(1)∶ 25-31.DOI∶10.1016/j.foodchem.2015.01.141.
[20] ZHANG B, DENG Z Y, DAN RAMDATH D, et al. Phenolic profiles of 20 Canadian lentil cultivars and their contribution to antioxidant activity and inhibitory effects on α-glucosidase and pancreatic lipase[J]. Food Chemistry, 2015, 172∶ 862-872. DOI∶10.1016/j.foodchem.2014.09.144.
[21] HUSSAIN P S, HOFSETH L J, HARRIS C C. Radical cause of cancer[J]. Nature Reviews Cancer, 2003, 3(4)∶ 276-285. DOI∶10.1038/nrc1046.
[22] RICE-EVANS C A, DIPLOCK A T. Current status of antioxidant therapy[J]. Free Radical Biology and Medicine, 1993, 15(1)∶ 77-96.DOI∶10.1016/0891-5849(93)90127-G.
[23] PIAO M J, KANG K A, ZHANG R, et al. Antioxidant properties of 1,2,3,4,6-penta-O-galloyl-beta-D-glucose from Elaeocarpus sylvestris var. ellipticus[J]. Food Chemistry, 2009, 115(2)∶ 412-418.DOI∶10.1016/j.foodchem.2008.12.020.
[24] PEI Y, CHEN Z P, JU H Q, et al. Autophagy is involved in antiviral activity of pentagalloylglucose (PGG) against Herpes simplex virus type 1 infection in vitro[J]. Biochemical & Biophysical Research Communications, 2011, 405(2)∶ 186-191. DOI∶10.1016/j.bbrc.2011.01.006.
[25] MIZUSHINA Y, ZHANG J, PUGLIESE A, et al. Anti-cancer gallotannin penta-O-galloyl-beta-D-glucose is a nanomolar inhibitor of select mammalian DNA polymerases[J]. Biochemical Pharmacology,2010, 80(8)∶ 1125-1132. DOI∶10.1016/j.bcp.2010.06.031.
[26] MODOLO L V, SOUZA A X D, HORTA L P, et al. An overview on the potential of natural products as ureases inhibitors∶ a review[J].Journal of Advanced Research, 2015, 6(1)∶ 35-44. DOI∶10.1016/j.jare.2014.09.001.
[27] TOH J Y, TAN V M, LIM P C, et al. Flavonoids from fruit and vegetables∶a focus on cardiovascular risk factors[J]. Current Atherosclerosis Reports,2013, 15(12)∶ 368. DOI∶10.1007/s11883-013-0368-y.
[28] 李广韶, 王清刚, 王义明, 等. 黄酮类化合物的定量色谱分析[J]. 食品科学, 2001, 22(2)∶ 57-61. DOI∶10.3321/j.issn∶1002-6630.2001.02.019.
[29] 李敏芳, 李慧, 王学美. 金丝桃苷药理作用研究进展[J]. 中国中医药信息杂志, 2008, 15(4)∶ 102-104. DOI∶10.3969/j.issn.1005-5304.2008.04.054.
[30] 毛清黎, 施兆鹏, 李玲, 等. 茶叶儿茶素保健及药理功能研究新进展[J].食品科学, 2007, 28(8)∶ 584-589. DOI∶10.3321/j.issn∶1002-6630.2007.08.148.
Chemical Constituents of 70% EtOH Extract from the Kernel of Acer truncatum Bunge
ZHANG Yuwei1, LI Shanshan1, SONG Mingjie1, CHEN Jianbo1, LIU Chang1, ZHANG Lei1, LI Dailong2, SUN Yinshi1,*
(1. Institute of Special Animal and Plant Sciences, Chinese Academy of Agricultural Sciences, Changchun 130112, China;2. Shandong Yongchun Church Group Co. Ltd., Sishui 273299, China)
Objective∶ To study the functional components from the kernel of Acer truncatum Bunge as a new food resource.Methods∶ The chemical constituents were isolated and purified by sequential chromatographies on silica gel, polyamide and Sephadex LH-20 columns and recrystallization. Electrospray ionization mass spectrometry (ESI-MS),1H-NMR and13C-NMR spectroscopic analysis were employed for the structural elucidation. Results∶ A total of twelve compounds were obtained and they were chemically identified as (7S,8R)-urolignoside (1), 1,2,3,6-tetra-O-galloyl-β-D-pyranglucose (2),1,2,3,4,6-penta-O-galloyl-β-D-pyranglucose (3), quercetin (4), kaempferol-3-O-α-L-rhamnopyranoside (5), quercetin-3-O-α-L-rhamnopyranoside (6), quercetin-3-O-β-D-galactopyranoside (7), quercetin-3-O-α-L-arabinopyranoside (8), (+)-afzelechin(9), (+)-catechin (10), (-)-epicatechin (11), and daucosterol (12). Conclusions∶ All these compounds were identified for the first time in the kernel of this plant, while compounds 1, 2, and 9-11 were obtained for the first time from the genus Acer.
Acer truncatum; new food resource; chemical composition
DOI∶10.7506/spkx1002-6630-201724022
TS201.2
A
1002-6630(2017)24-0137-07
张玉伟, 李珊珊, 宋明杰, 等. 元宝枫种仁70%乙醇提取物的化学成分分析研究[J]. 食品科学, 2017, 38(24): 137-143.
10.7506/spkx1002-6630-201724022. http://www.spkx.net.cn
ZHANG Yuwei, LI Shanshan, SONG Mingjie, et al. Chemical constituents of 70% EtOH extract from the kernel of Acer truncatum Bunge[J]. Food Science, 2017, 38(24)∶ 137-143. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724022. http∶//www.spkx.net.cn
2017-02-13
吉林省医药健康产业发展引导资金项目(20150311055YY;201603078YY)
张玉伟(1979—),男,助理研究员,博士,研究方向为特种动植物功能性成分。E-mail:zhangyw_2010@126.com
*通信作者:孙印石(1980—),男,研究员,博士,研究方向为特种动植物加工。E-mail:sunyinshi2015@163.com
