抗氧化活性酸奶对D-半乳糖诱导氧化损伤大鼠脑的保护作用
2017-12-11彭新颜贺红军柳全文张翠云姜秀静杨晓莹
彭新颜,贺红军,柳全文,黄 磊,张翠云,姜秀静,杨晓莹
(1.鲁东大学食品工程学院,山东 烟台 264025;2.烟台大学生命科学学院,山东 烟台 264005)
抗氧化活性酸奶对D-半乳糖诱导氧化损伤大鼠脑的保护作用
彭新颜1,贺红军2,柳全文1,黄 磊1,张翠云1,姜秀静1,杨晓莹1
(1.鲁东大学食品工程学院,山东 烟台 264025;2.烟台大学生命科学学院,山东 烟台 264005)
研究植物乳杆菌(Lactobacillus plantarum)NDC75017和嗜热链球菌(Streptococcus thermophilus)偶联发酵酸奶对D-半乳糖(D-galactose,D-Gal)氧化损伤大鼠大脑的保护作用。实验分为6 个组,包括空白对照组、阴性对照组(D-Gal模型)、阳性对照组(VE)、酸奶低、中、高剂量组。检测大鼠的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)活力,丙二醛(malondialdehyde,MDA)、一氧化氮含量以及大鼠体质量变化,脑组织中半胱氨酸天冬氨酸蛋白酶(caspase)-3、caspase-9的表达,并采用苏木素伊红(hematoxylin and eosin,HE)染色分析脑损伤程度。结果表明,与阴性对照相比,酸奶各剂量组能增强大鼠脑组织SOD、GSH-Px、CAT活力,同时降低MDA、NO的含量和iNOS活力。其中,高剂量处理组对提高脑组织SOD、GSH-Px活力效果最好,分别比阴性对照组提高了67.8%、22.8%(p<0.05)。高剂量酸奶组使大脑CAT活力达到了阳性对照组的水平(P>0.05)。在大鼠脑中,随着酸奶剂量的升高,MDA含量也随之下降,其中高剂量效果最好,达到了空白对照水平(P>0.05)。同时,酸奶各剂量组对降低NO的含量和iNOS活力也有一定的效果。结论:植物乳杆菌和嗜热链球菌偶联发酵酸奶能够通过提高衰老大鼠血清和脑组织内抗氧化酶系的活力,降低MDA、NO的含量和iNOS活力,并抑制了caspase-9、caspase-3的表达。HE染色结果也证实,一定量的酸奶能减少氧化应激对脑组织的损害,具有延缓衰老的作用。
植物乳杆菌;酸奶;D-半乳糖;抗氧化;大脑保护作用
现代食品营养学和医学研究证明,活性氧自由基会导致机体蛋白质、脂质和DNA氧化损伤,破坏细胞内的抗氧化酶系统,从而引发高血压、心血管疾病、糖尿病和癌症等多种慢性病的发生[1]。为保持机体免受自由基的侵害,最有效的方法是在食物中添加抗氧化剂或食用具有抗氧化功效的食品[2]。我国自古以来就有药食同源的说法,因此,从科学的角度获得食物中存在的天然、安全、高效的抗氧化物质,对降低自由基引发的氧化性损伤、提升机体的抗氧化能力、预防疾病具有重要的意义。
近年来,乳酸菌及其发酵产品的抗氧化功效逐渐成为研究热点。如Kuda等[3]利用所筛选的具有抗氧化活性的乳酸杆菌在42 ℃制备酸奶,结果发现,酸奶有较好的自由基清除能力。Yang Mei等[4]研究发现,乳酸菌发酵豆奶在清除超氧阴离子自由基(O2-·)、羟自由基(·OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力以及鳌合铁离子等方面均明显强于未发酵产品。刘娟等[5]研究了琼玉膏酸奶对D-半乳糖(D-galactose,D-Gal)衰老模型大鼠的影响,结果发现,琼玉膏酸奶可以通过提高大鼠抗氧化酶活力,减少自由基的生成,从而达到延缓衰老的作用。王俊国等[6]研究分离自酸马奶的2 株干酪乳杆菌Zhang及MG1-4,结果证实,干酪乳杆菌Zhang能够明显改善大鼠体内抗氧化酶活性。李广富等[7]将灵芝多糖添加入植物乳杆菌发酵酸奶中,结果发现,灵芝多糖和酸奶在抗衰老功能方面具有协同作用。王辑等[8]利用1 株具有较强体外抗氧化活性的植物乳杆菌K25制备发酵乳,并将该酸奶灌胃D-Gal所致衰老模型大鼠,结果证实,该发酵乳在大鼠体内具有较好的抗氧化作用。
本课题组前期从内蒙古科尔沁草原牧民家传统酸奶中筛选出一株具有自由基清除能力植物乳杆菌(Lactobacillus plantarum)NDC75017[9],通过建立D-Gal氧化应激模型发现,该株植物乳杆菌可以通过提高大鼠抗氧化酶活性,增强肝脏组织中抗凋亡因子B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达,抑制半胱氨酸天冬氨酸蛋白酶(caspase)-9、caspase-3和Bcl-2相关X蛋白(bcl-2-related X protein,Bax)表达,对氧化损伤肝细胞起到保护作用[10]。同时发现,该株植物乳杆菌处理组显著提高了大鼠的学习和记忆能力,改善了线粒体膜电位和线粒体通透性转换能力,从而保护了线粒体超微结构和功能[11]。另外,王静雅等[12]利用该株植物乳杆菌与嗜热链球菌(Streptococcus thermophilus)偶联发酵,研制出具有自由基清除效果的酸奶。因此,本实验继续以该款具有抗氧化功效酸奶为研究对象,探究其对D-Gal氧化损伤大鼠脑的保护作用,以期为丰富我国功能型乳酸菌菌种资源及酸奶的体内抗氧化模式研究提供参考。
1 材料与方法
1.1 材料与试剂
健康Wistar雄性大鼠由北京维通利华实验动物中心提供,合格证号:SCXK(京)2011-0011,使用许可证号:SYXK(鲁)20160022,84 只,体质量(300±20)g。
过氧化氢酶(catalase,CAT)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 上海酶联生物科技有限公司提供;丙二醛(malondialdehyde,MDA)试剂盒 上海岚派生物科技有限公司提供;NO试剂盒、一氧化氮合酶(inducible nitric oxide synthase,iNOS)试剂盒 南京建成生物工程研究所;caspase-3测定试剂盒、caspase-9测定试剂盒 北京普利莱基因技术有限公司;D-Gal 国药集团(上海)化学试剂公司。
1.2 仪器与设备
电热恒温水浴箱、DHG-9140A型电热恒温鼓风干燥箱上海一科仪器有限公司;酶标仪 郑州博赛生物工程有限责任公司;S-25型pH酸度计 北京华瑞博远科技发展有限公司;冷冻离心机 湖南凯达科学仪器有限公司;电动搅拌器 郑州市亚荣仪器有限公司;AL-104型精密电子天平 上海梅特勒-托利多仪器设备有限公司;XHF-I高速分散器 宁波新芝生物科技股份有限公司;微型混合器 上海康达电子仪器厂制造;722型紫外-可见分光光度计 上海精密科学仪器有限公司;光学显微镜 苏州工业园区汇光科技有限公司。
1.3 方法
1.3.1 酸奶的制备
酸奶的制备参考王静雅等[12]的方法并稍加修改。工艺流程:鲜牛奶→净化(预热32 ℃,经离心净乳机净化)→搅拌、过滤(将为原料质量分数8%的白糖融入60 ℃的热奶中)→均质(65 ℃、16 MPa)→杀菌(95 ℃、5 min)→冷却接种(冷却到43 ℃,接入接种量2%、植物乳杆菌与球菌复配比为1∶1.5)→分装、发酵(43 ℃恒温发酵)→冷却、后熟(发酵终点pH 4.5左右)。
1.3.2 D-Gal致衰老模型大鼠的建立
参考Peng Xinyan等[2]的方法。实验前将84 只大鼠给予基础饲料适应性饲养1 周,饲养温度为18~22 ℃,自然光照,自由采食和饮水。每组剩余10 只用于实验。将大鼠随机平均分为6 组:空白对照组、阴性对照组(D-Gal模型)、阳性对照组(VE)、酸奶低、中、高剂量组。空白对照组颈背部注射生理盐水,并在第2周给予双蒸水;其他5 组的大鼠皮下注射120 mg/kg mbD-Gal,连续注射6 周建立衰老模型,于第2周每日分别灌胃:阴性对照组大鼠给予等量双蒸水,酸奶低、中、高剂量3 个组分别给予2.5、5.0、10.0 mL/kg mb酸奶,阳性对照组的大鼠给予50 mg/kg mb的VE。
1.3.3 血清和组织匀浆的制备
持续8 周灌胃处理,大鼠的行为、食量和体质量增长均无异常。实验末日禁食12 h后摘除眼球取血,颈椎脱臼处死。取脑组织,用冰生理盐水洗净污血后滤纸吸干,取0.5 g置于烧杯,加9 倍体积的生理盐水,冰浴匀浆(4 000 r/min,10 min),取上清液,制成10%组织浆液。大鼠血样于4 ℃冰箱放置12 h,在4 ℃条件下3 000 r/min离心10 min,取上清液,即为血清。
1.3.4 生化指标测定
SOD、GSH-Px、CAT、iNOS、caspase-3、caspase-9活力及MDA、NO含量的测定均参照试剂盒说明书操作。SOD活力使用黄嘌呤氧化酶比色法测定,以反应体系产生的超氧阴离子的自由基清除率定义为一个酶活力单位。GSH-Px活力使用比色法测定,每0.1 mL血清在37 ℃反应5 min,扣除非酶促反应作用,使体系中谷胱甘肽浓度降低1 μmol/L为一个酶活力单位。CAT活力使用紫外法测定,每克血红蛋白中CAT每秒分解吸光度为0.50~0.55底物中的过氧化氢相对量为一个活力单位。iNOS以每毫克组织蛋白每分钟生成1 nmol NO为一个酶活力单位。caspase-3及caspase-9活力单位定义为当底物饱和时,在37 ℃可以剪切1 nmol的Ac-LEHD-pNA产生1 nmol pNA所需caspase-3和caspase-9的量。
1.3.5 脑组织形态学观察
采用石蜡切片观察病理变化,取大鼠脑组织,体积约为2.0 cm×2.0 cm×0.3 cm。甲醛固定,用80%、90%、95%、100%乙醇脱水、石蜡包埋、切片、苏木素伊红(hematoxylin and eosin,HE)法染色、封片等步骤制成切片,用光学显微镜观察病理变化。
1.4 数据统计分析
采用Excel 6.0和Sigmaplot 12.0软件作图,用Statistix 8.1软件进行统计学分析,数据用表示,两组间均数比较(实验组与对照组)。p<0.05表示具有显著差异,使用Tukey HSD程序分析。
2 结果与分析
2.1 酸奶对大鼠体质量的影响
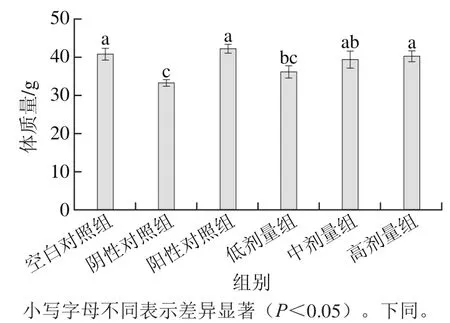
图1 不同剂量酸奶对大鼠体质量的影响Fig. 1 Inf l uence of different doses of yogurt on body weight of rats
由图1可以看出,实验期间,阴性对照组大鼠体质量明显低于空白对照组(p<0.05),说明D-Gal造模对体质量有影响。酸奶中、高剂量组都达到了空白对照组和阳性对照组的水平(P>0.05),效果较好。随着酸奶剂量的升高,与阴性对照组相比,低、中、高剂量组体质量分别增长了8.2%、18.6%、20.9%,表明酸奶较好地改善D-Gal对大鼠的损伤,减轻体质量下降程度。
2.2 酸奶对大鼠血清和脑组织中SOD活力的影响
从图2A可知,阳性对照组中大鼠血清中SOD的活力比空白对照组低23.1%、比阴性对照组高32.8%,具有显著差异(p<0.05)。酸奶各剂量组之间差异显著(p<0.05),呈现明显的量效依赖关系,高剂量组效果最好,比阴性对照组提高了38.2%,中、高剂量组均达到了阳性对照水平(P>0.05)。
图2B中,阴性对照组SOD活力明显低于空白对照组(p<0.05),说明造模成功。酸奶各剂量组差异显著(p<0.05),呈现剂量关系,低剂量组与阴性对照组相比无显著差异(P>0.05),高剂量组效果最好,达到了空白对照组水平(P>0.05),与阴性对照组相比活力提高了67.8%,差异显著(p<0.05),说明高剂量组对降低大脑中SOD活力的效果最佳。
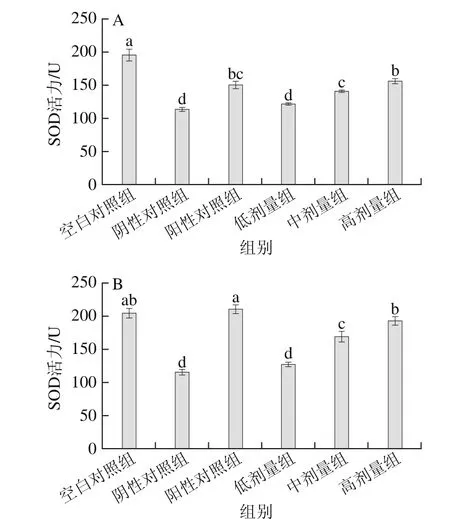
图2 酸奶不同剂量对大鼠血清(A)和脑组织(B)中SOD活力的影响Fig. 2 Effect of different doses of yogurt on SOD activity in serum (A)and brain tissue (B) of rats
2.3 酸奶对大鼠脑组织GSH-Px活力的影响

图3 酸奶剂量对大鼠脑组织中GSH-Px活力的影响Fig. 3 Effect of different doses of yogurt on GSH-Px activity in brain tissue of rats
从图3可知,在脑组织中,阳性对照组GSH-Px的活力最高,比阴性对照组高43.7%。与阴性对照组比,低、中、高剂量组GSH-Px的活力分别提高了8.5%、18.2%、28.8%,且中、高剂量组都达到了空白对照组的水平(P>0.05),与阴性对照组相比具有显著差异(p<0.05)。由此可知,在大鼠大脑中,酸奶在一定的剂量范围内对提高GSH-Px活力是有效的。
2.4 酸奶对大鼠脑组织中CAT活力的影响

图 4 酸奶剂量对大鼠脑组织中CAT活力的影响Fig. 4 Effect of different doses of yogurt on CAT activity in brain tissue of rats
从图4可以看出,在大鼠脑组织中,空白对照组和阳性对照组CAT活力均显著高于阴性对照组(p<0.05)。酸奶低、中、高剂量组存在显著差异(p<0.05),比阴性对照组分别提高了5.7%、20.2%、26.4%(p<0.05),其中,酸奶中剂量组达到了空白对照组的水平(P>0.05),高剂量组达到了阳性对照组水平(P>0.05),说明酸奶对大鼠脑组织中CAT活力有较好的改善作用且呈明显的量效依赖关系。
2.5 酸奶对大鼠血清和脑组织中MDA浓度的影响
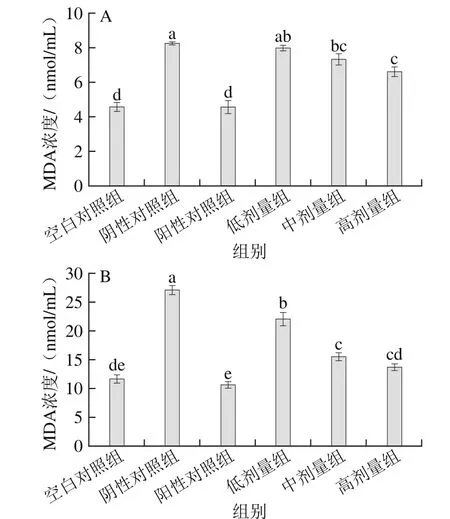
图5 酸奶剂量对大鼠血清(A)和脑组织(B)中MDA浓度的影响Fig. 5 Effect of different doses of yogurt on MDA concentrations in serum (A) and brain tissue (B) of rats
从图5A可知,大鼠经D-Gal处理后,空白对照组和阳性对照组血清中MDA浓度相当,比阴性对照组分别低了44.5%、44.8%,并具有显著性差异(p<0.05)。低、中、高剂量组MDA浓度比阴性对照组分别降低了3.0%、10.9%、19.7%,酸奶低剂量组和阴性对照组差异并不显著(P>0.05),中、高剂量组明显优于阴性对照组(p<0.05),但显著高于空白对照及阳性对照(p<0.05)。
由图5B可知,空白对照组和阳性对照组脑组织中MDA浓度并无显著差异(P>0.05),比阴性对照组分别降低了56.8%和61.0%,酸奶各剂量组与阴性对照组相比差异显著(p<0.05),其中,高剂量组效果最好,达到了空白对照组水平(P>0.05)。
2.6 酸奶对大鼠血清和脑组织中NO浓度的影响
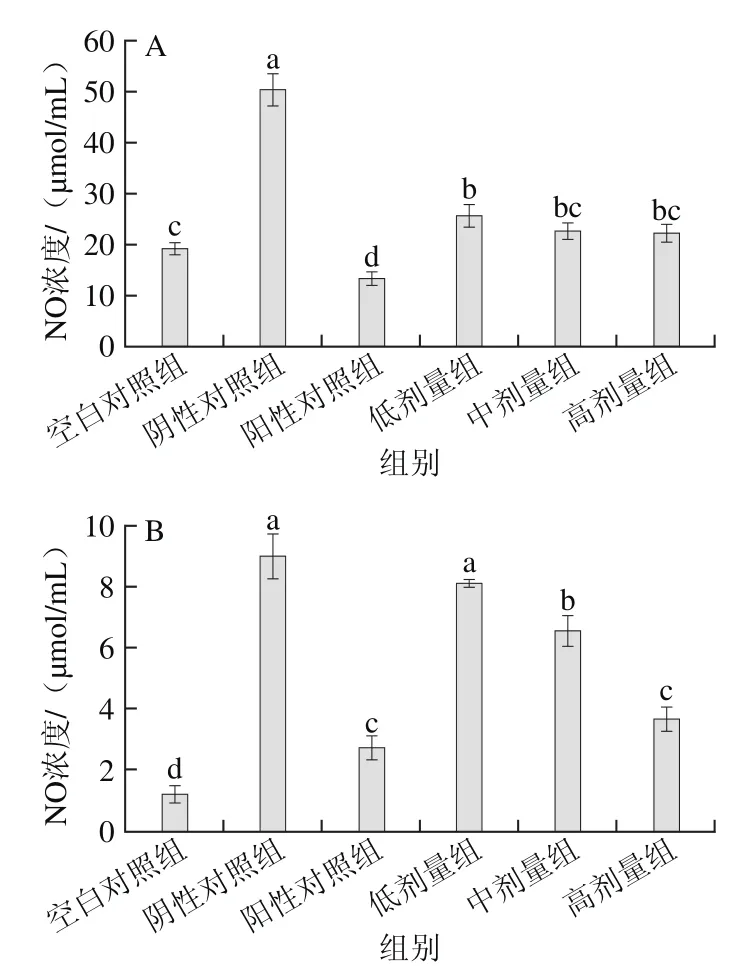
图6 酸奶剂量对大鼠血清(A)和脑组织(B)中NO浓度的影响Fig. 6 Effect of different doses of yogurt on NO levels in serum (A)and brain tissue (B) of rats
从图6A可知,空白对照组、阳性对照组和酸奶各剂量组大鼠血清中NO浓度与阴性对照组比,均显著降低(p<0.05),酸奶低、中、高剂量组与阴性对照组相比分别降低了49.1%、54.9%、56.0%,各剂量组之间无明显差异(P>0.05),其中,中、高剂量组达到了空白对照的水平(P>0.05)。
从图6B可知,空白对照组与阳性对照组大鼠脑中NO浓度与阴性对照组相比差异显著(p<0.05),分别降低了86.2%、69.6%。随着酸奶剂量的升高,NO浓度也随之降低,有明显的剂量依赖关系(p<0.05),低、中、高剂量组与阴性对照组相比分别降低了9.8%、26.9%、59.1%,但低剂量组与阴性对照组水平相当(P>0.05),高剂量组达到了阳性对照水平(P>0.05),效果显著。
2.7 酸奶对大鼠血清和脑组织中iNOS活力的影响
从图7A可看出,与阴性对照组比较,空白对照组和阳性对照组大鼠血清中iNOS活力均显著降低(p<0.05),给予低、中、高剂量酸奶灌胃处理后,大鼠血清中iNOS活力明显低于阴性对照组(p<0.05)。其中,高剂量组iNOS活力达到阳性对照和空白对照组水平(P>0.05),效果显著。
如图7B,在脑组织中,空白对照组和阳性对照组iNOS活力相当,且明显低于阴性对照和酸奶各处理组(p<0.05)。酸奶低、中剂量组,中、高剂量组之间也无明显差异(P>0.05),随着酸奶剂量的增加,其iNOS活力随之降低,与阴性对照组相比,低、中、高剂量组分别降低了7.0%、14.4%、17.4%。中、高剂量组优于阴性对照组(p<0.05),说明酸奶对降低iNOS活力有一定的效果。

图7 酸奶剂量对大鼠血清(A)和脑组织(B)中iNOS活力的影响Fig. 7 Effect of different doses of yogurt on iNOS activity in serum (A)and brain tissue (B) of rats
2.8 酸奶处理对大鼠脑组织的影响
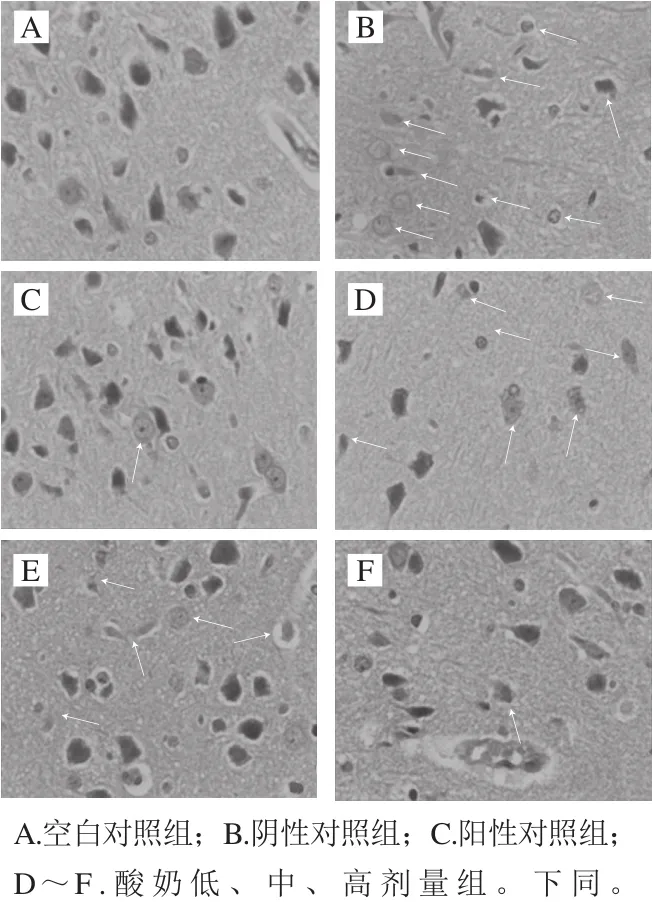
图8 各处理组大鼠脑病理学切片(400×)Fig. 8 Histopathological examination of brain tissues of rats (400 ×)
大鼠脑组织常规病理检查HE染色如图8所示,空白对照组脑组织形态结构清晰,神经细胞排列规整。神经元细胞密集,颜色深染。阴性对照组光镜下海马轮廓模糊,神经元细胞减少;可见到少许肿胀、变性的神经元细胞,且分支减少,核仁浓缩变小,分叶不清,细胞间排列松散,界限模糊(箭头所指)。3 个酸奶组与阴性对照组比较,形态学明显改善,尤其中、高剂量组,只有少量神经元细胞胞浆疏松淡染、神经细胞排列较规则(箭头所指);阳性对照组与空白对照组比较无明显差异。
2.9 酸奶对大鼠脑组织caspase-3、caspase-9表达的影响

图9 各处理组大鼠脑组织caspase-3表达(400×)Fig. 9 Caspase-3 expression in brain tissues of rats (400 ×)
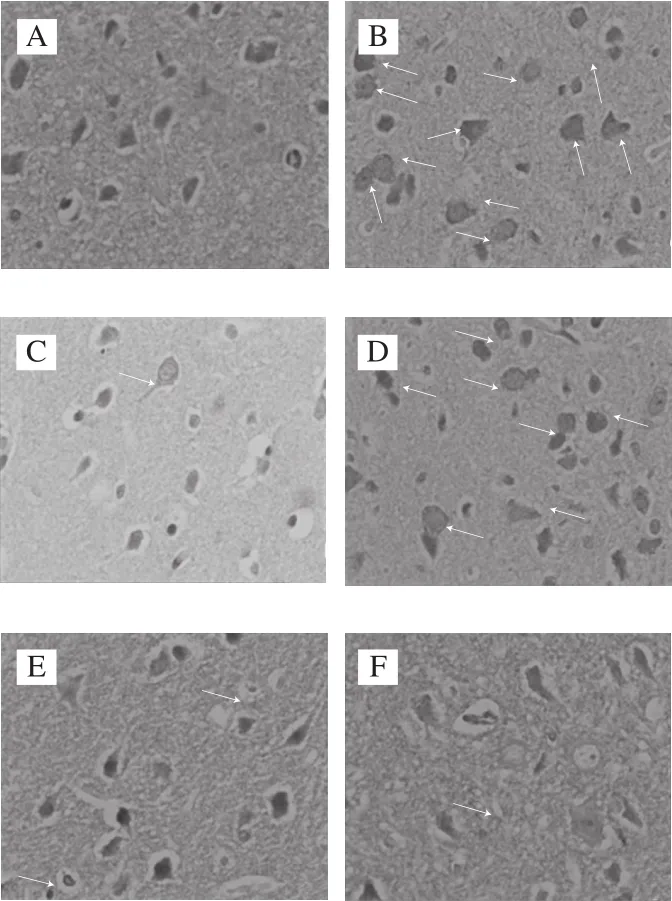
图10 各处理组大鼠脑组织caspase-9表达(400×)Fig. 10 Caspase-9 expression in brain tissues of rats (400 ×)
由图9、10可知,caspase-3、caspase-9其阳性表达部位主要是脑组织神经细胞的胞浆、胞质,出现棕黄色颗粒(箭头所指)。在空白对照组中,caspase-3、caspase-9的表达率低,阳性表达极少。而阴性对照组与空白对照组比较,具有显著差异,caspase-3、caspase-9的阳性表达明显增高,出现深棕黄色颗粒。而阳性对照组、中、高剂量组caspase-3、caspase-9表达降低,低剂量组与阴性对照组相似。
3 讨 论
机体衰老的分子机理包括诸多因素,其中机体自由基学说认为引起衰老的主要原因是机体细胞代谢过程中不断产生自由基、活性氧簇(reactive oxygen species,ROS),两者与内在的抗氧化防御系统之间的平衡被破坏[13]。简单来说,就是指体内氧化与抗氧化状态失衡,过剩的自由基就会使类脂质中的不饱和脂肪酸发生过氧化,从而破坏细胞的膜结构,使膜功能失常,导致细胞死亡[14]。
实际上,机体内产生的多余的ROS可被机体自身防御系统消耗掉。SOD是机体内天然存在的超氧自由基清除因子,可以清除机体代谢过程中产生的过量自由基,减轻氧自由基对机体的损害,从而保护细胞不受损害[15]。GSH-Px是生物体内普遍存在的一种重要的过氧化物分解酶。硒是GSH-Px酶系中重要的组成成分,可将有毒的过氧化物还原为无毒的羟基化合物[16]。CAT也是体内抗氧化系统的主要成员[17],可促使H2O2分解为氧分子和水分子,清除体内的过氧化氢,使细胞免于H2O2的毒害,是生物防御体系的关键酶之一[18]。因此,SOD、GSH-Px、CAT能有效清除自由基,阻止脂质过氧化,保护机体细胞免受氧化性损伤[19],并且通过清除过量自由基来预防各种疾病的产生[20],同时它们之间存在协同作用与相互保护关系,共同形成抗氧化酶系网络,任何一种酶活性变化都可能在一定程度上影响着其他酶活性[21]。实验表明,阴性对照组与空白对照组相比,SOD、GSH-Px、CAT活力显著降低(p<0.05),经酸奶灌胃后,SOD、GSH-Px、CAT活力升高,说明酸奶具有增强衰老大鼠脑中这3 种抗氧化酶活力的作用,从而清除体内堆积的自由基,减少细胞氧化损伤,起到延缓衰老的作用。
机体内自由基的增加,可以引起过氧化反应,生成脂质过氧化物(lipide peroxide,LPO),进而使细胞膜和溶酶体损伤释放出多种酶,造成局部组织损伤[22]。MDA是LPO产物之一,它的醛基能导致生物膜结构和功能改变,激发自由基链式反应造成恶性循环,因此MDA的含量间接反映自由基的代谢水平[23]。从实验结果中可以看出,衰老大鼠MDA浓度比空白对照组高,经酸奶灌胃处理后,大鼠脑和血清中的MDA浓度降低,并呈量效关系,这说明降低MDA浓度可能也是本款酸奶延缓衰老的内在机制之一。
NO是一种由一氧化氮合酶催化氧化L-精氨酸产生的内源性信号分子[18],参与调节多个免疫相关脑区的功能活动及机体多种生理及病理过程[24]。iNOS是体内催化合成NO的酶,主要分布在肝巨噬细胞和肝脏细胞中,在生理情况下较少表达[25]。但在炎性介质的激活下,几小时内iNOS含量会迅速上升,此时会持续地产生过量NO[26]。NO与超氧阴离子反应,产生过氧化亚硝酸盐阴离子,最终生成硝基酪氨酸[27],从而影响细胞内信号传导使细胞受损。本实验血清中,阴性对照组iNOS活力明显上升(p<0.05),各剂量组处理后iNOS活力显著降低(p<0.05),脑组织中阴性对照组iNOS活力也显著升高(p<0.05),证明了氧化衰老的发生对大脑的损伤作用。而酸奶各剂量组对NO含量和iNOS活力均有明显抑制作用(p<0.05),说明本款酸奶可通过抑制iNOS表达,减少NO生成,达到减轻脑损伤的作用。
caspase家族是调节细胞凋亡的重要基因,caspase家族中蛋白质调节细胞凋亡先后顺序,caspase-9是参与细胞凋亡的起始凋亡蛋白,能够诱导激活下游的caspase,促使细胞发生凋亡[28]。caspase-3位于细胞凋亡级联反应的下游位置,是细胞凋亡过程最终执行者,常被称为终止因子,使众多组织细胞发生不可逆转的凋亡过程[29]。当生物体内存在过多活性氧自由基时,细胞膜结构遭到严重氧化损伤,增大膜通透性,使得线粒体内细胞色素C泄漏到细胞外,进而引起caspase-9被激活,进而激活caspase-3,使得与组织细胞结构功能相关的蛋白质或酶失活,导致细胞凋亡[30]。本实验结果表明,偶联发酵酸奶可通过阻断caspase-9的活化,降低caspase-3的表达,从而对衰老性脑损伤大鼠起到保护作用。
在本实验中,6 组大鼠灌胃处理8 周后,不同剂量的酸奶,在提高大脑的SOD、GSH-Px、CAT的酶活力,降低MDA、NO含量和iNOS活力,减少caspase-3、caspase-9的表达上均有一定程度的作用。因此,以植物乳杆菌NDC75017和嗜热链球菌偶联发酵的酸奶对大鼠的抗衰老能力有显著提高,也为今后开发和生产具有一定功能性的发酵乳制品提供了理论基础。
[1] ALBANO E. Alcohol, oxidative stress and free radical damage[J].Proceedings of the Nutrition Society, 2006, 65(3): 278-290.DOI:10.1079/pns2006496.
[2] PENG Xinyan, KONG Baohua, YU Haiyang, et al. Protective ef f ect of whey protein hydrolysates against oxidative stress in D-galactoseinduced ageing rats[J]. International Dairy Journal, 2014, 34(1): 80-85.DOI:10.1016/j.idairyj.2013.08.004.
[3] KUDA T, KANEKO N, YANO T, et al. Induction of superoxide anion radical scavenging capacity in Japanese white radish juice and milk by Lactobacillus plantarum isolated from aji-narezushi and kaburazushi[J]. Food Chemistry, 2010, 120(2): 517-522. DOI:10.1016/j.foodchem.2009.10.046.
[4] YANG Mei, LI Li. Physicochemical, textural and sensory characteristics of probiotic soy yogurt prepared from germinated soybean[J]. Food Technology and Biotechnology, 2010, 48(4): 490-496.
[5] 刘娟, 蒋俊和, 肖作为, 等. 琼玉膏酸奶对实验性衰老模型小鼠抗氧化作用的研究[J]. 湖南中医药大学学报, 2015, 35(6): 9-13; 73.DOI:10.3969/j.issn.1674-070X.2015.06.004.
[6] 王俊国, 孟和毕力格, 张和平, 等. 干酪乳杆菌Zhang对大鼠抗氧化能力的影响[J]. 营养学报, 2009, 31(1): 63-65; 70. DOI:10.13325/j.cnki.acta.nutr.sin.2009.01.012.
[7] 李广富, 陈伟, 李听听, 等. 灵芝多糖益生菌酸奶抗衰老的研究[J].食品与发酵工业, 2015, 41(2): 41-45. DOI:10.13995/j.cnki.11-1802/ts.201502008.
[8] 王辑, 王影, 张雪, 等. 植物乳杆菌K25发酵乳对衰老模型小鼠的抗氧化作用[J]. 吉林农业大学学报, 2013, 35(1): 98-101; 105.DOI:10.13327/j.jjlau.2013.01.009.
[9] 宋晓辰, 彭新颜, 李凤梅, 等. 植物乳杆菌NDC75017抗氧化活性研究[J]. 食品科学, 2014, 35(21): 106-112. DOI:10.7506/spkx1002-6630-201421021.
[10] PENG Xinyan, JIANG Yujun. Protective effects of Lactobacillus plantarum NDC75017 against lipopolysaccharide-induced liver injury in mice[J]. Inflammation, 2014, 37(5): 1599-1607. DOI:10.1007/s10753-014-9886-1.
[11] PENG Xinyan, MENG Jiong, CHI Tao, et al. Lactobacillus plantarum NDC75017 alleviates the learning and memory ability in aging rats by reducing mitochondrial dysfunction[J]. Experimental and Therapeutic Medicine, 2014, 8(6): 1841-1846.
[12] 王静雅, 彭新颜, 姜毓君, 等. 抗氧化活性发酵酸乳制备条件的优化[J].食品科学, 2015, 36(1): 153-157. DOI:10.7506/spkx1002-6630-201501029.
[13] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry, 2016, 204(2): 365-372. DOI:10.1016/j.foodchem.2016.02.127.
[14] CHI Changfeng, HU Fayuan, WANG Bin, et al. Antioxidant and anticancer peptides from the protein hydrolysate of blood clam(Tegillarca granosa) muscle[J]. Journal of Functional Foods,2015,15(5): 301-313. DOI:10.1016/j.jf f.2015.03.045.
[15] KERASIOTI E, STAGOS D, TZIMI A, et al. Increase in antioxidant activity by sheep/goat whey protein through nuclear factor-like 2 (Nrf2)is cell type dependent[J]. Food and Chemical Toxicology, 2016, 97:47-56. DOI:10.1016/j.fct.2016.08.022.
[16] TONG Xing, LI Wei, XU Jiaying, et al. Effects of whey protein and leucine supplementation on insulin resistance in non-obese insulin-resistant model rats[J]. Nutrition, 2014, 30(9): 1076-1080.DOI:10.1016/j.nut.2014.01.013.
[17] TEIXEIRA K R, SILVA M E, DE LIMA W G, et al. Whey protein increases muscle weight gain through inhibition of oxidative effects induced by resistance exercise in rats[J]. Nutrition Research, 2016,36(10): 1081-1089. DOI:10.1016/j.nutres.2016.08.003.
[18] ABDEL K G, FAWZI H, MANNAA F A. Paraoxonase-1(PON1) inhibition by tienilic acid produces hepatic injury:antioxidant protection by fennel extract and whey protein concentrate[J]. Pathophysiology, 2016, 23(1): 19-25. DOI:10.1016/j.pathophys.2015.10.002.
[19] SHITULENI S A, GAN F, NIDO S A, et al. Effects of yeast polysaccharide on biochemical indices, antioxidant status,histopathological lesions and genetic expressions related with lipid metabolism in mice fed with high fat diet[J]. Bioactive Carbohydrates and Dietary Fibre, 2016, 8(2): 51-57. DOI:10.1016/j.bcdf.2016.10.001.
[20] SONG Ru, WEI RongBian, RUAN Guangqiang, et al. Isolation and identification of antioxidative peptides from peptic hydrolysates of half-fin anchovy (Setipinna taty)[J]. LWT-Food Science and Technology, 2015, 60(1): 221-229. DOI:10.1016/j.lwt.2014.06.043.
[21] JOBARA K, KAIDO T, HORI T, et al. Whey-hydrolyzed peptideenriched immunomodulating diet prevents progression of liver cirrhosis in rats[J]. Nutrition, 2014, 30(10): 1195-1207. DOI:10.1016/j.nut.2014.02.005.
[22] ALI D A, EI-DIN N K B, ABOU R F. Antioxidant and hepatoprotective activities of grape seeds and skin against Ehrlich solid tumor induced oxidative stress in mice[J]. Egyptian Journal of Basic and Applied Sciences, 2015, 2(2): 98-109. DOI:10.1016/j.ejbas.2015.02.003.
[23] ZHAO Jing, HUANG Guangrong, JIANG Jiaxin. Purification and characterization of a new DPPH radical scavenging peptide from shrimp processing by-products hydrolysate[J]. Journal of Aquatic Food Product Technology, 2013, 22(3): 281-289. DOI:10.1080/10498850.20 11.645125.
[24] KARLSSON J O G, IGNARRO L J, LUNDSTROM I, et al.Calmangafodipir Ca4Mn(DPDP)(5) , mangafodipir (MnDPDP)and MnPLED with special reference to their SOD mimetic and therapeutic properties[J]. Drug Discovery Today, 2015, 20(4):411-421. DOI:10.1016/j.drudis.2014.11.008.
[25] DIETRICH S J, FASS M I, JACOBO P V, et al. Inhibition of NOS-NO system prevents autoimmune orchitis development in rats: relevance of no released by testicular macrophages in germ cell apoptosis and testosterone secretion[J]. PLoS ONE, 2015, 10(6): e0128709.DOI:10.1371/journal.pone.0128709.
[26] 胡成穆, 姜辉, 刘洪峰, 等. 金银花总黄酮对免疫性肝损伤小鼠的影响[J]. 安徽医药, 2008, 12(4): 295-297. DOI:10.3969/j.issn.1009-6469.2008.04.003.
[27] ZHU Jianhong, ZHANG Xiaomei, RONEKER C A, et al. Role of copper, zinc-superoxide dismutase in catalyzing nitrotyrosine formation in murine liver[J]. Free Radical Biology and Medicine,2008, 45(5): 611-618. DOI:10.1016/j.freeradbiomed.2008.05.018.
[28] 王春光, 刘北忠, 金丹婷, 等. 大黄素对裸鼠体内K562细胞移植瘤的抑制作用及其与调控Caspase-3和Caspase-9表达的关系[J]. 中草药,2010, 41(5): 751-756. DOI:10.7501/j.issn.0253-2670.2010.5.024.
[29] KERO D, GOVORKO D K, MIKIC I M, et al. Analysis of expression patterns of IGF-1, caspase-3 and HSP-70 in developing human tooth germs[J]. Archives of Oral Biology, 2015, 60(10): 1533-1544.DOI:10.1016/j.archoralbio.2015.07.004.
[30] VENKATESAN R S, SADIQ A M M. Ef f ect of morin-5′-sulfonic acid sodium salt on the expression of apoptosis related proteins caspase 3,Bax and Bcl 2 due to the mercury induced oxidative stress in albino rats[J]. Biomedicine & Pharmacotherapy, 2017, 85: 202-208.DOI:10.1016/j.biopha.2016.09.090.
Protective Effect of Antioxidant Yogurt against D-Galactose-Induced Brain Damage in Rats
PENG Xinyan1, HE Hongjun2, LIU Quanwen1, HUANG Lei1, ZHANG Cuiyun1, JIANG Xiujing1, YANG Xiaoying1
(1. College of Food Engineering, Ludong University, Yantai 264025, China;2. College of Life Sciences, Yantai University, Yantai 264005, China)
The aim of this study was to evaluate the protective effect of yogurt fermented by a mixed culture of Lactobacillus plantarum NDC75017 and Streptococcus thermophilus on D-galactose (D-Gal)-induced brain damage in rats. Wistar rats were divided into six groups, including normal control, negative control, low-, medium- and high-dose yogurt, and D-Gal + VE(positive control) groups. The activities of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), catalase (CAT) and inducible nitric oxide synthase (iNOS), and malondialdehyde (MDA) and nitric oxide (NO) concentrations in rat serum and brain tissue, body weight, and the expression of caspase-3 and caspase-9 in rat brain were tested. Histopathological examination with hematoxylin and eosin (HE) staining was used to analyze the extent of brain damage. The results showed that compared with the negative control group, all doses of the yogurt enhanced SOD, GSH-Px and CAT activities, and decreased MDA and NO concentrations as well as iNOS activity in rat brain. The yogurt at high dose was the most effective in enhancing SOD and GSH-Px activities, resulting in an increase of 67.8% and 22.8% compared with the negative control group, respectively(P < 0.05). Moreover, brain CAT activity in the high-dose yoghurt group was comparable to that in the positive control group (P > 0.05). In rat brain, MDA level declined with increasing dose (P > 0.05), closest to that of the normal control group at high dose. At the same time, all doses of the yogurt also reduced NO level and iNOS activity. Conclusion:Yogurt co-fermented by Lactobacillus plantarum and Streptococcus thermophilus can protect the rat brain againstD-Gal-induced oxidative damage by improving antioxidant enzymes activities in serum and brain tissue, reducing MDA and NO concentrations and iNOS activity, and decreasing the expression of caspase-9 and caspase-3, which was also conf i rmed by HE staining results.
Lactobacillus plantarum; yogurt; D-galactose; antioxidant; brain protection
2017-05-30
国家自然科学基金青年科学基金项目(31401491);山东省重点研发计划项目(2015GNC113009);
城新创新奖学金项目;大学生创新创业训练计划项目(201610451329)
彭新颜(1976—),女,副教授,博士,研究方向为功能性食品开发。E-mail:pengxinyan2006@163.com
10.7506/spkx1002-6630-201723025
TS252.5
A
1002-6630(2017)23-0157-08
彭新颜, 贺红军, 柳全文, 等. 抗氧化活性酸奶对D-半乳糖诱导氧化损伤大鼠脑的保护作用[J]. 食品科学, 2017, 38(23):157-164.
10.7506/spkx1002-6630-201723025. http://www.spkx.net.cn
PENG Xinyan, HE Hongjun, LIU Quanwen, et al. Protective effect of antioxidant yogurt against D-galactose-induced brain damage in rats[J]. Food Science, 2017, 38(23): 157-164. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723025. http://www.spkx.net.cn
