基于红外光谱分析热处理对牛乳蛋白质二级结构的影响
2017-12-11孙佳悦姜淑娟妥彦峰牟光庆
孙佳悦,钱 方,姜淑娟,妥彦峰,牟光庆,2,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.东北农业大学,食品安全与营养协同创新中心,黑龙江 哈尔滨 150030)
基于红外光谱分析热处理对牛乳蛋白质二级结构的影响
孙佳悦1,钱 方1,姜淑娟1,妥彦峰1,牟光庆1,2,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.东北农业大学,食品安全与营养协同创新中心,黑龙江 哈尔滨 150030)
运用傅里叶变换红外光谱技术对乳蛋白及其酰胺Ⅰ带进行解析,进一步用红外解谱法对其二级结构进行表征。以原料乳为对照,研究65 ℃/30 min(低温长时巴氏杀菌)、80 ℃/15 s(高温短时巴氏杀菌)、95 ℃/5 min(酸乳热处理)、137 ℃/5 s(超高温灭菌)等不同热处理条件对乳中蛋白质二级结构的影响。结果表明,热处理会导致乳蛋白间发生相互作用,乳蛋白原空间结构受到破坏,导致分子内氢键被破坏。不同热处理程度的乳蛋白酰胺Ⅰ带均向低波数方向发生了不同程度的红移,表明乳蛋白变性过程中疏水氨基酸残基暴露形成分子间氢键。同时热处理后乳蛋白各二级结构比例发生明显改变。α-螺旋含量显著降低(p<0.05),无规卷曲含量显著升高(p<0.05),β-转角及β-折叠含量在加热过程均呈先增加后减少变化趋势,表明热处理程度增强导致部分有序结构向无规卷曲结构转化,蛋白质热变性后会发生热聚集现象,且β-折叠、β-转角结构在热聚集体的形成过程中具有重要作用。
傅里叶变换红外光谱;热处理;乳蛋白;热聚集;二级结构
热处理是乳品加工的重要环节,能保证产品保质期和安全性,影响乳制品加工性能。牛乳蛋白是人体优质的食物蛋白来源,不仅能为生命成长和维持提供物质基础,还由于其理化性质的独特性赋予乳品各种功能特性。乳蛋白主要包括酪蛋白胶束(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)和乳清蛋白(β-乳球蛋白和α-乳白蛋白)。热处理导致变性乳清蛋白除相互聚集外,还与酪蛋白胶束发生不可逆的结合[1]。目前人们普遍认为,在热诱导乳蛋白变性并发生聚集过程中,非共价作用(疏水作用力和盐键作用)及巯基和二硫键的交换反应起到了重要作用,但热处理导致乳蛋白空间结构变化才是造成牛乳理化和功能特性改变的内在原因[2]。因此,研究不同程度热处理导致的乳蛋白二级结构变化,对明确热处理时乳蛋白间热聚合反应的过程及机理具有重要意义。
分析蛋白质二级结构常用X射线衍射、圆二色谱(circular dichroism,CD)、核磁共振(nuclear magnetic resonance,NMR)、傅里叶变换红外光谱(Fourier transformation infrared spectroscopy,FT-IR)等方法。其中X射线衍射需获得合格的单晶体,而牛乳体系复杂很难获得;CD仅对测定α-螺旋含量较多单一体系的蛋白质二级结构较为准确[3];NMR只能测定小分子蛋白质结构[4]。比较而言FT-IR具有分辨率高、测定所需样品少、操作简便、测量速度快等优点,广泛用于定性定量分析不同环境状态下蛋白质的二级结构[5]。O’Loughlin等[6]认为FT-IR可准确有效地对热处理时蛋白质的变化机理进行分析。目前,关于热处理对乳蛋白结构影响的研究鲜有报道。本实验基于FT-IR法,研究不同热处理程度导致的牛乳中蛋白质二级结构的差异性,旨在探讨不同热处理方式对乳蛋白结构的影响,为进一步研究热处理乳品质的变化提供理论参考。
1 材料与方法
1.1 材料与试剂
原料乳采集于大连三寰乳业有限公司。
1.2 仪器与设备
Spectrum 10型FT-IR仪 上海铂金埃尔默仪器有限公司;PL303型电子分析天平 梅特勒-托利多(上海)仪器有限公司;Z326K型冷冻离心机 德国Hermle公司;SL-Ⅱ型层析实验冷柜 宁波新芝生物科技股份有限公司;FD-1C-50型冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 牛乳热处理
选用65 ℃/30 min(低温长时杀菌)、80 ℃/15 s(高温短时杀菌)、95 ℃/5 min(酸乳热处理)、137 ℃/5 s(超高温瞬时灭菌)4 种乳品加工常用的热处理方法[7]对原料乳进行处理,热处理后的乳样于4 ℃冷藏。
1.3.2 乳蛋白制备
不同热处理后的乳样4 ℃、10 000 r/min离心10 min,弃上层脂肪,收集下层蛋白溶液[8]。于-20 ℃冷冻后,冷冻干燥呈粉末状备用。
1.3.3 乳蛋白FT-IR分析
(6) 响应电流法是检测开关开通和关断时母线电流的值,而端电压法需要计算开关管开通和关断时非导通相端电压的差值,比较导通两相自感的大小来判断转子位置。
KBr压片法制样[9]:将乳蛋白样品与一定量KBr用研钵充分研磨成均匀粉末,压制成薄片。进行全波段扫描(4 000~400 cm-1),扫描次数为32 次,分辨率4 cm-1,每个样品做3 次平行实验。
1.3.4 FT-IR谱图处理
用Omnic 8.2软件进行谱图采集、标峰、基础红外光谱图解析。用Peakfit Version 4.12软件在谱带范围内(酰胺Ⅰ带1 700~1 600 cm-1)进行基线校正,并经Savitsk-Golay函数平滑,去卷积处理,在二阶导数谱图基础上用高斯曲线拟合[10],估算出子峰的个数和位置,调整各子峰的峰高和半峰宽,计算机多次拟合使残差最小(R2≥0.999),确保重叠谱带可完全分辨[11]。确定各子峰与各个二级结构单元的对应关系后,根据峰面积计算各二级结构组分的相对百分含量。
1.4 数据统计分析
以上所有实验均至少重复3 次,结果以 ±s表示,并用IBM SPSS Statistics v20.0.0软件,在α=0.05水平用ANOVA分析方法进行数据显著性分析。
2 结果与分析
2.1 不同热处理的乳蛋白FT-IR谱图
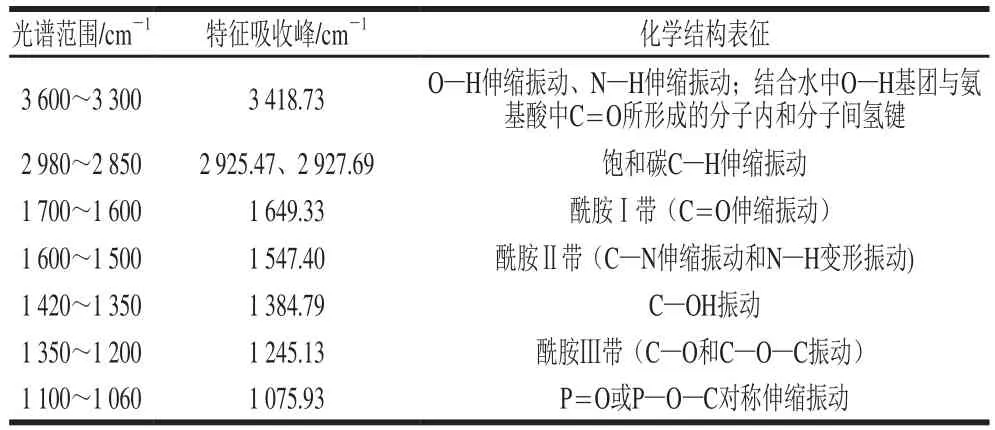
表1 原料乳中乳蛋白FT-IR谱图的各谱带特性[12-13]Table 1 Characteristic absorption peaks in FT-IR spectra of milk proteins in raw milk[12-13]
表1为原料乳中乳蛋白FT-IR谱图的各谱带范围和其特征吸收峰,以及相对应的化学结构表征信息。图1整体上看,与原料乳的乳蛋白(未处理)相比,不同程度热处理乳蛋白FT-IR谱图谱型无较大差异。游离态O—H的特征振动吸收为3 600~3 500 cm-1,当形成分子内或分子间氢键时,羟基的吸收峰向低波数移动,且与N—H的振动吸收峰重叠而峰形变宽[14]。乳蛋白FT-IR谱图中于3 400 cm-1左右呈现宽而强的吸收峰,表明乳蛋白分子多聚体中可能存在大量分子内或分子间氢键[15]。

图1 不同热处理条件下乳蛋白的FT-IR谱图Fig. 1 FT-IR spectra of milk protein samples subjected to various heat treatment conditions
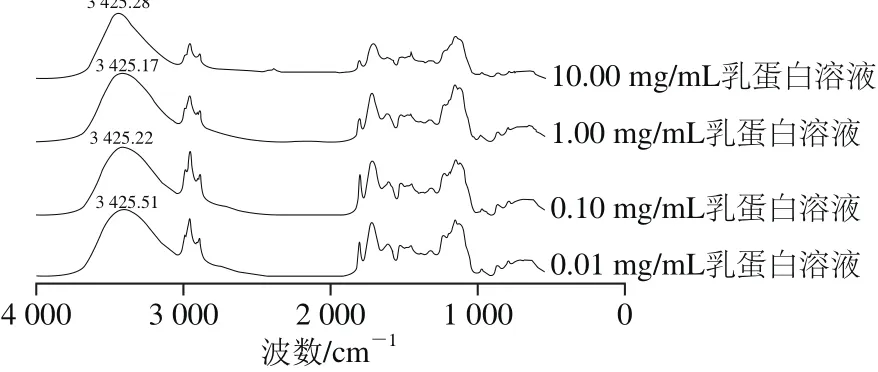
图2 137 ℃/5 s热处理不同质量浓度乳蛋白的FT-IR谱图Fig. 2 FT-IR spectra of different concentrations of milk protein samples heated at 137 ℃ for 5 s
由于分子间氢键与溶液的浓度和性质有关,峰位随浓度改变而移动,但分子内氢键不受溶液浓度影响[16]。因此将137 ℃/5 s热处理的1.00、0.10、0.01 mg/mL的乳蛋白溶液与10.0 mg/mL乳蛋白溶液的FT-IR谱图进行对比分析。从图2可见,热处理乳蛋白的O—H吸收峰的峰位不受溶液质量浓度改变的影响,保持在3 425 cm-1附近,表明该吸收峰代表乳蛋白分子内氢键的作用[17]。结合图1可见,随着热处理程度的增加该峰位向高波数移动,即从3 418.72 cm-1位移至3 425.28 cm-1,说明热处理直接影响乳蛋白原空间结构,热变性过程中维持乳蛋白结构的分子内氢键被破坏。
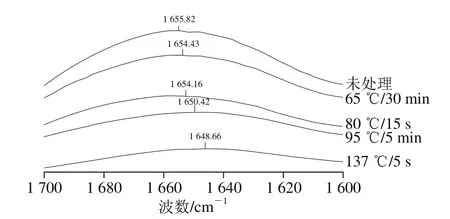
图3 不同热处理条件下乳蛋白酰胺Ⅰ带FT-IR谱图Fig. 3 FI-IR spectra of amide Ⅰ of milk protein samples subjected to various heat treatment conditions
同时,图1中乳蛋白的酰胺Ⅰ带(1 700~1 600 cm-1)信号较强,由羰基(C=O)键伸缩振动产生[18],其峰型受蛋白质特定二级结构影响。结合图3酰胺Ⅰ带的峰形可更清楚地看出,热处理强度增强,峰形由尖锐趋于平缓。从峰位变化分析,原料乳中乳蛋白(未处理)酰胺Ⅰ带为1 655.82 cm-1。热处理后其酰胺Ⅰ带向低波数方向发生了不同程度的位移:65 ℃/30 min和80 ℃/15 s热处理乳蛋白质的酰胺Ⅰ带向低波数方向红移约1 cm-1,即从1 655.82 cm-1分别移至1 654.43 cm-1和1 654.16 cm-1;137 ℃/5 s热处理乳蛋白的酰胺Ⅰ带向低波数方向红移约7 cm-1,即从1 655.82 cm-1位移至1 648.66 cm-1。说明乳蛋白具有热不稳定性,热变性过程中随着其球状折叠结构的展开,游离氨基酸残基间形成分子间氢键[19]。当氢键作用较强时C=O的电子云密度降低,导致吸收峰位向低波数方向移动[20]。
2.2 不同热处理乳蛋白酰胺Ⅰ带的拟合
蛋白质二级结构包括α-螺旋、β-折叠、β-转角、无规卷曲等[21]。不同二级结构信息均叠加在酰胺Ⅰ带,而酰胺Ⅰ带的二阶导数谱图却保留吸收峰的积分面积,对谱图进行多次曲线拟合可确定各子峰与各二级结构对应关系[22],再根据积分面积计算各二级结构的相对百分含量。酰胺Ⅰ带各峰位为:1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠特征峰;1 646~1 664 cm-1为α-螺旋特征峰;1 637~1 645 cm-1为无规卷曲特征峰;1 664~1 681 cm-1为β-转角特征峰[23]。
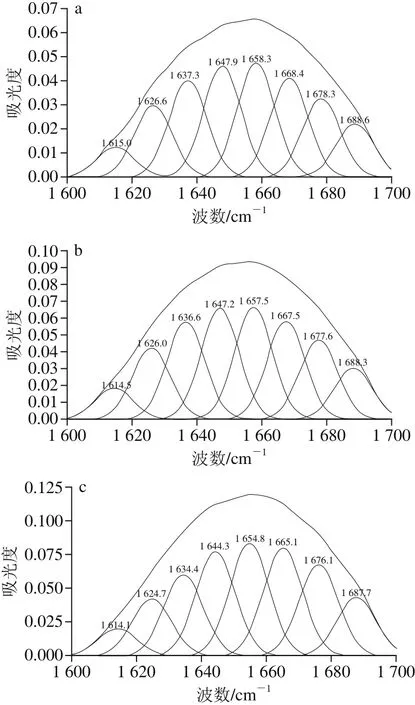

图 4 不同热处理条件下乳蛋白酰胺Ⅰ带高斯曲线拟合图Fig. 4 Gaussian curve fi tting of amide Ⅰ of milk proteins subjected to different heat treatment conditions
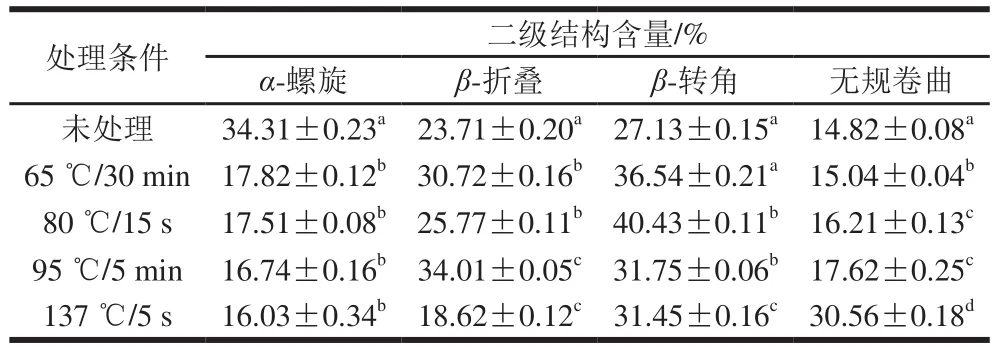
表2 不同热处理乳蛋白质二级结构的含量Table 2 Estimated secondary structures of milk protein subjected to different heat treatment conditions
图4为未处理(原料乳中乳蛋白)及4 种热处理的乳蛋白酰胺Ⅰ带经去卷积和二阶导数技术处理后,叠加峰分解为各子峰的高斯曲线拟合图。结合表2可知,对比原料乳的乳蛋白,4 种热处理牛乳中乳蛋白二级结构发生如下变化:1)原料乳的乳蛋白二级结构主要组成为α-螺旋,占总量34.3%。α-螺旋经137 ℃/5 s热处理后含量显著降低(p<0.05)。α-螺旋是蛋白质二级结构中最稳定的,随着热处理程度增大,蛋白的结构稳定性下降,乳蛋白热变性导致α-螺旋中的氢键逐渐断裂,发生解螺旋。2)随着温度的升高,无规卷曲含量逐渐升高,137 ℃/5 s热处理的乳蛋白中无规卷曲含量为30.5%,明显高于原料乳蛋白的14.8%(p<0.05)。表明热处理导致蛋白二级结构部分被破坏,结构的随机性增强。随着热处理程度的增强,乳蛋白部分有序结构逐渐向无规卷曲结构转化[24]。3)相比于原料乳的乳蛋白,热处理的乳蛋白中β-折叠和β-转角含量在加热过程中呈先增加后降低趋势。这种变化趋势与乳蛋白的变性及逐渐形成聚集体有关。乳蛋白中热稳定性较差的一种蛋白是β-乳球蛋白,60 ℃以上的热处理主要使β-乳球蛋白热变性并促进分子间的聚集[25]。β-折叠结构常见于蛋白质内部折叠区域,且β-折叠结构的含量增加与β-乳球蛋白热变性有关[26-27]。加热程度继续增强,α-乳白蛋白也开始变性,进一步与β-乳球蛋白聚集体形成更大的热聚合物[28]。此外乳蛋白热变性后的聚集现象也可能导致β-折叠结构含量减少。对于137 ℃/5 s热处理乳蛋白,其β-折叠结构显著降低(p<0.05),主要原因为100 ℃以上热处理会导致酪蛋白胶束内部疏水基团暴露[29],使酪蛋白胶束表面疏水作用力增强。由于热处理形成热聚集体,分子间的β-折叠结构易转变为β-转角结构,同时部分β-转角结构还会向无规卷曲结构转变[30]。因而可以推断不同热处理过程中β-折叠、β-转角结构在热聚集体的形成过程中具有重要作用。
3 结 论
利用FT-IR技术分析表明,热处理破坏乳蛋白原空间结构,热变性过程中维持乳蛋白结构的分子内氢键被破坏。同时热处理会导致乳蛋白间发生相互作用,形成热变性乳蛋白聚合物。
热处理后乳蛋白的FT-IR光谱图中酰胺Ⅰ带向低波数方向产生不同程度红移,峰形由尖锐趋于平缓。表明在乳蛋白热变性过程中,随着蛋白质分子结构的展开,游离氨基酸残基间形成分子间氢键。
通过FT-IR酰胺Ⅰ带谱图进行二阶导数、去卷积处理后对乳蛋白的二级结构定量分析:热处理程度增强会导致乳蛋白二级结构发生显著改变,α-螺旋含量显著降低(p<0.05),无规卷曲含量显著升高(p<0.05),β-折叠结构和β-转角结构含量在加热过程均呈现先增加后减少的变化趋势。表明热处理后牛乳蛋白稳定性下降,乳蛋白质热变性疏水基团暴露,部分有序结构向无规卷曲结构转化,β-折叠、β-转角结构在热聚集体的形成过程中具有重要作用。
[1] 韩荣伟, 王加启, 郑楠. 热处理对牛乳成分的变化影响及热损标识物的选择[J]. 中国食物与营养, 2011, 17(7): 22-29. DOI:10.3969/j.issn.1006-9577.2011.07.007.
[2] 王伟军. 牛乳加热及乳粉热相关工艺对蛋白聚合及凝固特性的影响[D]. 哈尔滨: 哈尔滨工业大学, 2012: 125-134.
[3] 何文英. 小分子与蛋白质作用的谱学及应用[M]. 北京: 科学出版社,2012: 116-126.
[4] 马红梅. 实用药物研发仪器分析[M]. 上海: 华东理工大学出版社,2014: 23-24.
[5] 刘斌, 马海乐, 李树君, 等. 应用FT-IR研究超声对牛血清白蛋白二级结构的影响[J]. 光谱学与光谱分析, 2010, 30(8): 2072-2076.DOI:10.3964/j.issn.1000-0593(2010)08-2072-05.
[6] O’LOUGHLIN I B, KELLY P H, MURRAY B A, et al. Concentrated whey protein ingredients: a Fourier transformed infrared spectroscopy investigation of thermally induced denaturation[J].International Journal of Dairy Technology, 2015, 68(3): 349-356.DOI:10.1111/1471-0307.12239.
[7] 李子超, 徐明芳, 向明霞, 等. 巴氏杀菌与超高温灭菌牛乳酪蛋白结构差异性的研究[J]. 华南农业大学学报, 2013, 34(2): 192-196.DOI:10.7671/j.issn.1001-411X.2013.02.013.
[8] 臧长江, 王加启, 杨永新, 等. 热处理牛乳中乳蛋白变化的比较蛋白质组学的研究[J]. 畜牧兽医学报, 2012, 43(11): 1754-1759.
[9] 张波波, 王丹, 马越, 等. FT-IR分析超高压处理对调配草莓汁蛋白二级结构的影响[J]. 中国食品学报, 2014, 14(11): 200-206.DOI:10.16429/j.1009-7848.2014.11.033.
[10] 王晓琳, 朱力杰, 陈妍婕, 等. 不同干热处理对花生蛋白二级结构及乳化性的影响[J]. 食品与发酵工业, 2016, 42(5): 86-90.DOI:10.13995 /j.cnki.11-1802/ts.201605015.
[11] FARRELL H M, WICKHAM E D, UNRUH J J, et al. Secondary structural studies of bovine caseins: temperature dependence of β-casein structure as analyzed by circular dichroism and FTIR spectroscopy and correlation with micellization[J]. Food Hydrocolloids, 2001, 15(4/5/6): 341-354. DOI:10.1016/S0268-005X(01)00080-7.
[12] 刘燕燕, 曾新安, 陈晓东. FT-IR分析脉冲电场和热处理后的大豆分离蛋白结构变化[J]. 光谱学与光谱分析, 2010, 30(9): 2340-2344.DOI:10.3964/j.issn.1000-0593(2010)09-2340-05.
[13] 李明梅, 王文渊, 吴琼林. 分析化学[M]. 武汉: 华中科技大学出版社,2012: 163-164.
[14] 秦洋, 邱超, 曹金苗, 等. 干热处理对稻米复配粉及米蛋白性质的影响[J]. 现代食品科技, 2015, 31(9): 180-184. DOI:10.13982/j.mfst.1673-9078.2015.9.030.
[15] KHER A, UDABAGE P, MCKINNON I, et al. FTIR investigation of spray-dried milk protein concentrate powders[J].Vibrational Spectroscopy, 2007, 44(2): 375-381. DOI:10.1016/j.vibspec.2007.03.006.
[16] 王庆文. 有机化学中的氢键问题[M]. 天津: 天津大学出版社, 1993:236-258.
[17] JEAN K, RENAN M, FAMELART M, et al. Structure and surface properties of the serum heat-induced protein aggregates isolated from heated skim milk[J]. International Dairy Journal, 2006, 16(4): 303-315. DOI:10.1016/j.idairyj.2005.04.001.
[18] MORAND M, GUYOMARC’H F, PEZENNEC S, et al. On how κ-casein affects the interactions between the heat-induced whey protein/κ-casein complexes and the casein micelles during the acid gelation of skim milk[J]. International Dairy Journal, 2011, 21(9): 670-678. DOI:10.1016/j.idairyj.2011.01.012.
[19] 石燕, 刘凡, 葛辉, 等. 微胶囊形成过程中蛋白质二级结构变化的红外光谱分析[J]. 光谱学与光谱分析, 2012, 32(7): 1815-1819.DOI:10.3964/j.issn.1000-0593(2012)07-1815-05.
[20] 阎微. 高压和热处理对蛋黄体系中蛋白质的影响[D]. 无锡: 江南大学, 2009: 38-45. DOI:10.7666/d.y1583855.
[21] 顾小红, 孟旭, 汤坚. 豆浆凝固过程中大豆蛋白质二级结构的研究[J]. 分析科学学报, 2006, 22(6): 675-678. DOI:10.3969/j.issn.1006-6144.2006.06.013.
[22] 李顺, 张聚华, 李秀艳, 等. FT-IR自去卷积法对丝织物蛋白酰胺Ⅲ带二级结构研究初探[J]. 北京服装学院学报(自然科学版), 2011,31(2): 68-73. DOI:10.3969/j.issn.1001-0564.2011.02.011.
[23] LONG G H, JI Y, PAN H B, et al. Characterization of thermal denaturation structure and morphology of soy glycinin by FTIR and SEM[J]. International Journal of Food Properties, 2015,18(4):763-774. DOI:10.1080/10942912.2014.908206.
[24] 吴黎明, 周群, 周骁, 等. 蜂王浆不同贮存条件下蛋白质二级结构的Fourier变换红外光谱研究[J]. 光谱学与光谱分析, 2009, 29(1): 82-87. DOI:10.3964/j.issn.1000-0593(2009)01-0082-06.
[25] 任发政. 乳蛋白及多肽的结构与功能[M]. 北京: 中国农业科学技术出版社, 2015: 325-335.
[26] GUYOMARC’H F, NONO M, NICOLAI T, et al. Heat-induced aggregation of whey proteins in the presence of κ-casein or sodium caseinate[J]. Food Hydrocolloids, 2009, 23(4): 1103-1110.DOI:10.1016/j.foodhyd.2008.07.001.
[27] WIJAYANTI H B, BANSAL N, DEETH H C. Stability of whey proteins during thermal processing: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(6): 1235-1251.DOI:10.1111/1541-4337.12105.
[28] 卢雁, 张玮玮, 王公轲. FTIR 用于变性蛋白质二级结构的研究进展[J]. 光谱学与光谱分析, 2008, 28(1): 88-93. DOI:10.3964/j.issn.1000-0593.2008.01.021.
[29] DICKINSON E, PARKINSON E L. Heat-induced aggregation of milk protein-stabilized emulsions: sensitivity to processing and composition[J]. International Dairy Journal, 2004, 14(7): 635-645.DOI:10.1016/j.idairyj.2003.12.005.
[30] 李杨, 王中江, 王瑞, 等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技, 2016, 37(8): 104-109. DOI:10.13386/j.issn1002-0306.2016.08.013.
Effect of Heat Treatments on the Secondary Structure of Milk Proteins Analyzed by Fourier Transform Infrared Spectroscopy
SUN Jiayue1, QIAN Fang1, JIANG Shujuan1, TUO Yanfeng1, MU Guangqing1,2,*
(1. School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2. Synergetic Innovation Center of Food Safety and Nutrition, Northeast Agricultural University, Harbin 150030, China)
Fourier transform infrared spectroscopy was used to investigate protein conformation changes in pasteurized milk(65 ℃/30 min and 80 ℃/15 s), yoghurt (95 ℃/5 min) and ultra-high temperature sterilized milk (137 ℃/5 s) in comparison with raw milk as a control. The aim was to examine the effect of heat treatments on the secondary structure of milk proteins.The results showed that heat treatments could cause interactions between milk proteins, resulting in damage to the spatial structure of milk proteins and intramolecular hydrogen bonds. Different heat treatment conditions could result in different degrees of red shift of milk protein amide Ⅰ bands to lower wavenumbers, suggesting that intermolecular hydrogen bonds were formed between hydrophobic amino acid residues exposed during denaturation. Meanwhile, the secondary structure composition of milk proteins changed signif i cantly after heat treatments; α-helix content decreased signif i cantly(P < 0.05), random coil content increased signif i cantly (P < 0.05), and both β-sheet and β-turn content decreased after an initial increase, indicating that the ordered structure was partially transformed to random coil. Protein aggregation occurred after thermal denaturation, and β-sheet and β-turn played an important role in the formation of heat-induced protein aggregates.
Fourier transform infrared spectroscopy; heat treatment; milk protein; thermal aggregation; secondary structure
10.7506/spkx1002-6630-201723014
TS252.1
A
1002-6630(2017)23-0082-05
孙佳悦, 钱方, 姜淑娟, 等. 基于红外光谱分析热处理对牛乳蛋白质二级结构的影响[J]. 食品科学, 2017, 38(23): 82-86.
DOI:10.7506/spkx1002-6630-201723014. http://www.spkx.net.cn
SUN Jiayue, QIAN Fang, JIANG Shujuan, et al. Effect of heat treatments on the secondary structure of milk proteins analyzed by Fourier transform infrared spectroscopy[J]. Food Science, 2017, 38(23): 82-86. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723014. http://www.spkx.net.cn
2016-09-28
辽宁省自然科学基金面上项目(201602053);“十二五”国家科技支撑计划项目(2013BAD18B04);国家自然科学基金青年科学基金项目(31501513);国家自然科学基金面上项目(31571813)
孙佳悦(1993—),女,硕士研究生,研究方向为乳品科学。E-mail:sunjiayue66@163.com
*通信作者:牟光庆(1967—),男,教授,博士,研究方向为乳品科学。E-mail:gq6552002@aliyun.com
