盐提和碱提酸沉两种方法提取腰果蛋白的结构及其功能性质分析
2017-12-11颜小燕李雨婷刘成梅
彭 倩,颜小燕,李雨婷,梁 露,刘成梅*,王 芳
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
盐提和碱提酸沉两种方法提取腰果蛋白的结构及其功能性质分析
彭 倩,颜小燕,李雨婷,梁 露,刘成梅*,王 芳
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
使用盐提和碱提酸沉两种提取方法从腰果脱脂粉中提取分离蛋白,并对比研究盐提腰果蛋白(CNSPI)和碱提酸沉腰果蛋白(CNPI)的结构和功能性质。结果表明CNPI和CNSPI在结构、微观形态、功能性质和营养价值等方面有明显差异,CNSPI蛋白含量较高,溶解性和乳化性也优于CNPI,CNPI表现出较好的起泡性。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果表明两种提取方法对分离蛋白的亚基组成没有显著影响;本研究使用氨基酸分析仪来测定分离蛋白的营养价值,结果表明两种方法提取的腰果蛋白氨基酸含量无明显差异,其营养价值都远高于腰果脱脂粉。表面疏水性测定结果表明CNPI的表面疏水性显著高于CNSPI。扫描电子显微镜结果表明CNSPI呈现出大量的片状微观结构,而CNPI呈现出少量球状和薄片结合成的不规则形状。圆二色光谱结果显示CNSPI和CNPI中主要二级结构是β-折叠,CNPI中有较多的无规卷曲,约占29.3%,CNSPI有较多的α-螺旋(27.0%)。在中性条件下,CNPI的起泡性为119.00%,CNSPI的乳化性达到30.14 m2/g。
腰果蛋白;功能性质;微观结构;二级结构;碱提酸沉法;盐提法
腰果(Anacardium occidentale Linnaeus)又名槚如树、鸡腰果或者介寿果,是一种肾形坚果,在全世界范围内广泛种植,为世界著名四大坚果之一[1]。我国是亚洲腰果主要的生产国之一,于20世纪40年代开始引入种植,目前主要产地分布于云南、海南等地区[2]。
腰果作为一种经济型油料作物,具有优良的营养功能和药用价值,腰果仁含有46%的脂肪,高于常用食用油加工原料大豆(约20%)、花生(约43%)等,可作为制备食用油的原料,脂肪酸分析表明腰果仁油中主要为不饱和脂肪酸,其中油酸和亚油酸的比例高达73%和11%[3],且富含多种维生素和微量元素,如VA、VB1、VB2以及锰、镁、硒等,腰果仁油具有抗氧化、防衰老和抗肿瘤的作用[4]。此外,腰果仁中还含有21%的蛋白质,与花生(约23%)、葵花籽(约20%)等坚果种子蛋白含量相当,荣瑞芬[5]的研究表明,腰果蛋白的氨基酸种类和含量与人体氨基酸模式十分相近,是一种营养价值很高的优质蛋白。
腰果蛋白具有其他动、植物蛋白无可比拟的营养价值,目前国内外对于腰果加工还停留在初级阶段,关于腰果的研究主要集中在腰果粉的物化性质[6]、腰果仁油的提取分析[7]及腰果仁分离蛋白和浓缩蛋白的功能性[8-9],蛋白抗原性[10]等。食品工业中榨油后的腰果粕一般用于动物饲料,为了减少资源浪费,提高产品附加值,从腰果粕中提取蛋白质具有极大的实用意义。目前对于油料植物蛋白的提取主要有水提法、有机溶剂提取法、酶法和膜分离等方法[11],其中水提法因操作简单、提取率高而广泛用于各种植物蛋白的提取中,碱提酸沉法是蛋白提取的经典方法,已经成功运用于大豆、花生和油菜籽等蛋白的提取,盐提法提取蛋白条件温和,在保证提取率的同时能较大程度保持蛋白活性[12]。在本课题组的前期研究中,对腰果分离蛋白的提取工艺优化[13]和腰果蛋白的功能性质研究[14]进行了报道。在进一步的研究过程中,课题组发现提取方法的不同会造成腰果蛋白结构和功能性质的差异性。本研究结合腰果蛋白的特性,在前期钟俊桢等[13]关于腰果蛋白提取工艺优化的研究基础上,选用碱提酸沉和盐提两种方法得到分离蛋白,对比分析蛋白微观结构变化对功能性质的影响,以期为腰果蛋白加工及新产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
生腰果(W320)产自越南,4 ℃下保存待用。
8-苯胺基-1-萘磺酸钠(8-a n i l i n o-1-naphthalenesulfonic acid,ANS)、Tris、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、过硫酸氨(ammonium persulphate,AP)、N,N,N’,N’-四甲基乙二氨(N,N,N’,N’-tetramethylethylenediamine,TEMED) 北京索莱宝生物科技有限公司;其他所有试剂均为国产分析纯。
1.2 仪器与设备
FreeZone 12-Plus真空冷冻干燥机 美国Labconco公司;LXJ-IIBB高速离心机 上海安亭科学仪器厂;K9840半自动凯氏定氮仪 济南海能仪器有限公司;Ultra-Turrax T25高速分散机 德国IKA公司;UV-1600PC紫外分光光度计 上海美谱达仪器有限公司;F-4500荧光分光光度计、L-8800全自动氨基酸分析仪日本Hitachi公司;Mini-Protean Tetra Cell电泳仪 美国Bio-Rad公司;MOS-450圆二色谱(circular dichroism,CD)仪 法国Bio-Logic公司。
1.3 方法
1.3.1 材料处理
腰果用高速粉碎机粉碎,以1∶4(m/V)的料液比加入沸程30~60 ℃的石油醚,室温下磁力搅拌20 h,布氏漏斗抽滤分离油脂,重复3 次脱脂后于通风橱中挥干石油醚,过60 目筛后收集,即得腰果脱脂粉(DCNF),保存在4 ℃冰箱中备用。
1.3.2 碱提酸沉腰果蛋白的制备
将脱脂粉与去离子水以料液比1∶10(m/V)混合,并用1 mol/L NaOH溶液调pH值为9.0,室温下磁力搅拌30 min,4 800 r/min离心30 min后收集上清液,残渣复提一次,合并两次上清液,并用1 mol/L HCl溶液调整pH值为4.6,4 800 r/min离心20 min后收集沉淀,水洗沉淀并调pH值至中性,4 ℃下经6~8 kD透析袋透析72 h,冻干得到碱提酸沉腰果蛋白(CNPI)粉末,4 ℃保存备用。
1.3.3 盐提腰果蛋白的制备
脱脂粉与0.05 mol/L含有0.1 mol NaCl的Tris-HCl缓冲液(pH 7.0)以1∶10(m/V)的料液比混合,室温下磁力搅拌2 h,4 800 r/min离心30 min后收集上清液,重复离心两次以便进一步分离上清液中的不溶性残留物,收集上清液于4 ℃下透析(6~8 kD)72 h,再次离心30 min后收集沉淀即为得到盐提腰果蛋白(CNSPI),冻干后保存在4 ℃下备用。
1.3.4 腰果蛋白的性质测定
1.3.4.1 蛋白质提取率的测定
采用Bradford法[15],以牛血清白蛋白(bovine serum albumin,BSA)为标准蛋白,考马斯亮蓝G250染色,标准曲线方程为:Y=0.004 5X-0.010 6,R2=0.996 9。按式(1)计算蛋白提取率。

1.3.4.2 蛋白质纯度的测定
采用凯氏定氮法测定蛋白质含量(换算系数5.30),按式(2)计算蛋白质纯度。

1.3.4.3 溶解度测定
取50 mg腰果蛋白分散在25 mL去离子水中,常温下磁力搅拌30 min,用0.1 mol/L的HCl溶液或0.1 mol/L的NaOH溶液调节pH值为3~9之后磁力搅拌30 min,再于4 800 r/min离心15 min,使用福林-酚法测定上清液的蛋白质含量。用BSA作标准曲线,取50 mg腰果蛋白溶于25 mL 0.1 mol/L的NaOH溶液中,磁力搅拌1 h后离心过滤,测得溶液中蛋白含量为总蛋白含量。溶解度按照式(3)计算。

1.3.4.4 起泡性和泡沫稳定性测定
蛋白质的起泡性和起泡稳定性参照Lassissi等[16]的方法测定,取50 mg腰果蛋白均匀分散在10 mL 0.01 mol/L pH 7.0的磷酸盐缓冲液(phosphate buf f ered saline,PBS)中,记录最初体积为V0/mL,用Ultra-Turrax T25分散机分散均质,转速10 000 r/min高速分散2 min后记录体积为V1/mL,放置30 min后的体积记为V2/mL。
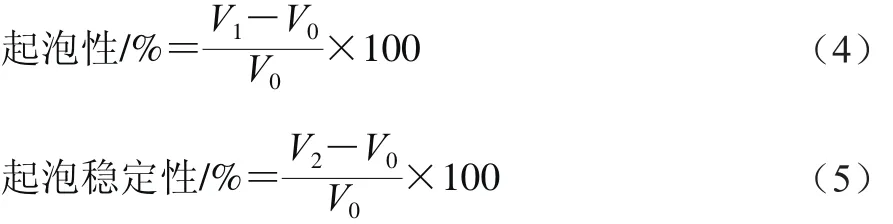
1.3.4.5 乳化性及乳化稳定性测定
根据参考文献[17]测定腰果蛋白的乳化性及乳化稳定性。取60 mg腰果蛋白于6 mL 0.01 mol/L pH 7.0的PBS中,搅拌分散30 min后加入2 mL大豆油,然后使用Ultra-Turrax T25分散机以转速20 000 r/min 均质1 min,从底部吸取50 μL,立即与5 mL 0.1 g/100mL SDS 混合5 s,于500 nm波长处测定吸光度A0。10 min后再次吸取50 μL乳状液与5 mL 0.1 g/100 mL SDS溶液混合均匀,在500 nm波长处测吸光度A10。乳化性和乳化稳定性计算如式(6)、(7)所示。
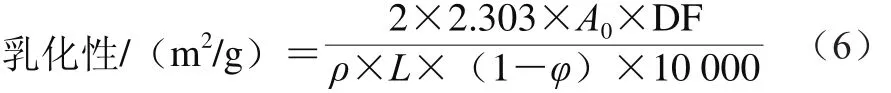
式中:ρ为稀释前的蛋白质质量浓度/(mg/mL);L为光程(1 cm);φ为形成乳液的油的体积分数(0.25%);DF为稀释倍数(100)。
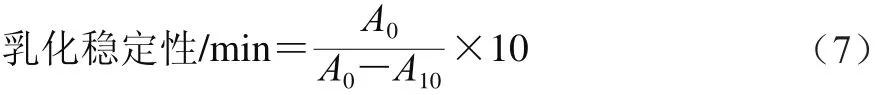
1.3.4.6 表面疏水性测定
表面疏水性采用ANS作荧光探针的方法测定[18],即配制1 mg/mL的腰果蛋白溶液,并用磷酸缓冲液稀释成质量浓度为0.002~0.020 mg/mL,取稀释后的腰果蛋白溶液4 mL,加入20 μL ANS溶液后涡旋振荡,避光静置10 min后摇匀,使用F-4500荧光光度计测定蛋白样品的荧光强度(f l uorescence intensity,FI)。以蛋白质量浓度为横坐标,FI为纵坐标作图,曲线的斜率即为蛋白质的表面疏水性指数(H0),以此表征表面疏水性。
1.3.4.7 氨基酸分析
精确称量50 mg腰果蛋白,再加入10 mL 6 mol/L的HCl溶液,1 g苯酚进行水解,在110 ℃真空条件下水解24 h后冷却,之后混匀过滤,定容至50 mL。使用L-8800自动氨基酸分析仪进行测定。
1.3.4.8 SDS-PAGE分析
SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)根据Laemmli等[19]的方法并略作改动。电泳凝胶分别是5%的浓缩胶和12%的分离胶。
1.3.4.9 圆二色光谱分析
蛋白质溶于0.01 mol/L pH 7.0的磷酸缓冲溶液中,制成质量浓度为0.1 mg/mL的腰果蛋白溶液,使用MOS-450圆二色谱仪扫描远紫外区域(190~250 nm),扫描8 次取平均值。用Dichro Web网站Contin程序分析蛋白质二级结构并进行计算。
1.3.4.10 微观结构观察
根据参考文献[20]的方法,使用扫描电子显微镜(scanning electron microscope,SEM)观察蛋白质的微观结构。冻干后的CNPI和CNSPI粉末均匀置于贴有导电胶的样品台上,喷金处理,观察成像时加速电压30 kV。
1.4 数据处理
所有的实验都重复3 次取平均值,使用SPSS 17.0软件对实验数据进行显著性和相关性分析,Tukey法比较平均值之间的差异性(p<0.05)。采用Origin 8.0软件作图。
2 结果与分析
2.1 两种方法提取腰果蛋白的微观形貌差异

图1 两种方法提取腰果蛋白的SEM图Fig. 1 SEM images of cashew nut protein obtained by different extraction methods
CNSPI纯度(蛋白质含量)为80.7%,提取率为40.12%,CNSPI纯度为91.4%,提取率为24.10%。由图1可知,3 种物质在微观形态上面差异明显,如图1A中DCNF有明显的簇状球形蛋白,分子直径约为4 μm;图1B中CNSPI颗粒较小,形状不规则,部分蛋白质出现团聚现象,表面凹凸不平;图1C中CNPI呈现较大的片状结构,无球状结构出现,表面较平整。对比两种提取方法下蛋白的微观形貌可以看出,酸碱处理蛋白使其结构发生了变化,多肽链展开使它从团聚的球状变为较大的片状结构,螺旋展开使蛋白质结构更为疏松,可能会暴露出较多的疏水基团。同时,毛晓英[21]指出这种片状结构有利于蛋白质溶解度的增加。
2.2 表面疏水性分析结果

图2 两种方法提取腰果蛋白的表面疏水性质Fig. 2 Surface hydrophobicity of cashew nut extracted by different methods
H0反映了蛋白质分子疏水基团的暴露程度,与内部蛋白的球状结构和变性程度有关,如图2所示,CNPI的H0为2 171.00,显著高于CNSPI(1 706.11)(p<0.05),DCNF的H0最低,仅为1 592.25,在Papalamprou等[22]报道的关于鹰嘴豆分离蛋白的研究中,碱提酸沉蛋白的表面疏水性也高于超滤法和酸提与超滤相结合提取的蛋白,碱提酸沉蛋白的H0更高,可能是由于在蛋白提取过程中,碱提酸沉蛋白经过酸碱处理后暴露出更多的疏水基团与ANS结合,从而得到较高的表面疏水性指数,这种现象可能暗示着变性程度越高,蛋白的表面疏水性越高[23-24]。Karaca等[12]的研究也表明酸沉处理易导致蛋白质变性,使天然结构展开,暴露出更多的疏水基团。而盐提蛋白是通过蛋白质吸附盐离子后彼此排斥并使其与水之间的相互作用增强而达到提取蛋白的目的,蛋白能较大程度地保持天然构象[25],因而表现出较低的表面疏水性。蛋白质的表面疏水性能显著影响其功能性质,田斌强等[26]的研究表明燕麦蛋白起泡性变化趋势与疏水性较为一致。
2.3 SDS-PAGE分析结果
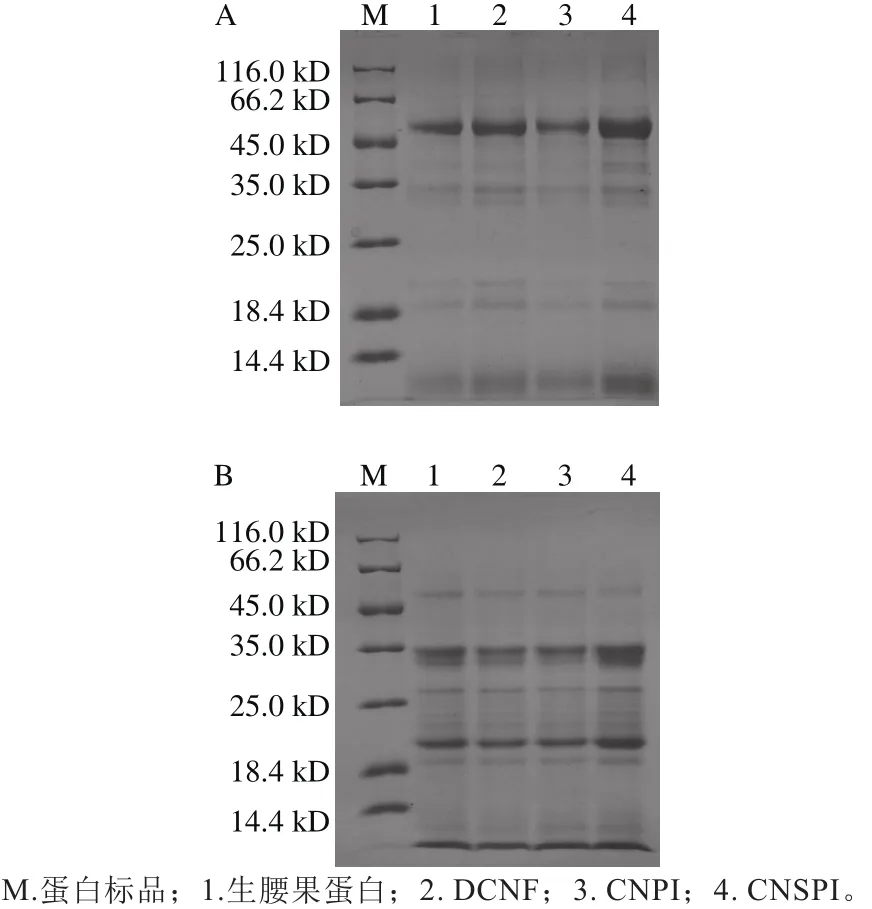
图3 两种方法提取腰果蛋白在非还原(A)和还原(B)条件下的SDS-PAGE图谱Fig. 3 SDS-PAGE pro fi les of cashew nut protein under non-reducing (A) and reducing (B) conditions
生腰果蛋白、DCNF、CNPI、CNSPI在非还原条件(图3A)和还原条件下(图3B)的SDS-PAGE图谱如图3所示。在非还原条件下,所有的条带都表现出很高的相似性,蛋白质分子质量在19~53 kD之间,出现了7 个主要条带,分子质量分别为19、21、32、34、40、45、53 kD,其中53 kD的条带浓度最大,加入β-巯基乙醇后,蛋白质的亚基分布发生了变化,40、45 kD的条带消失,在原来的基础上新增了23、24、26、27 kD 4 条小分子条带,53 kD条带的浓度明显变小,而21 kD和32 kD的条带明显加深,这是因为53 kD的肽链断开了二硫键,形成了两条分子质量分别为21 kD和32 kD的条带。
DCNF、CNPI和CNSPI的亚基组成没有明显区别,这表明不同提取方法对腰果蛋白质亚基组成没有显著性差异,由此可推测CNPI和CNSPI在功能性质上的差异可能是由于在提取过程中构象发生了改变。
2.4 氨基酸分析结果
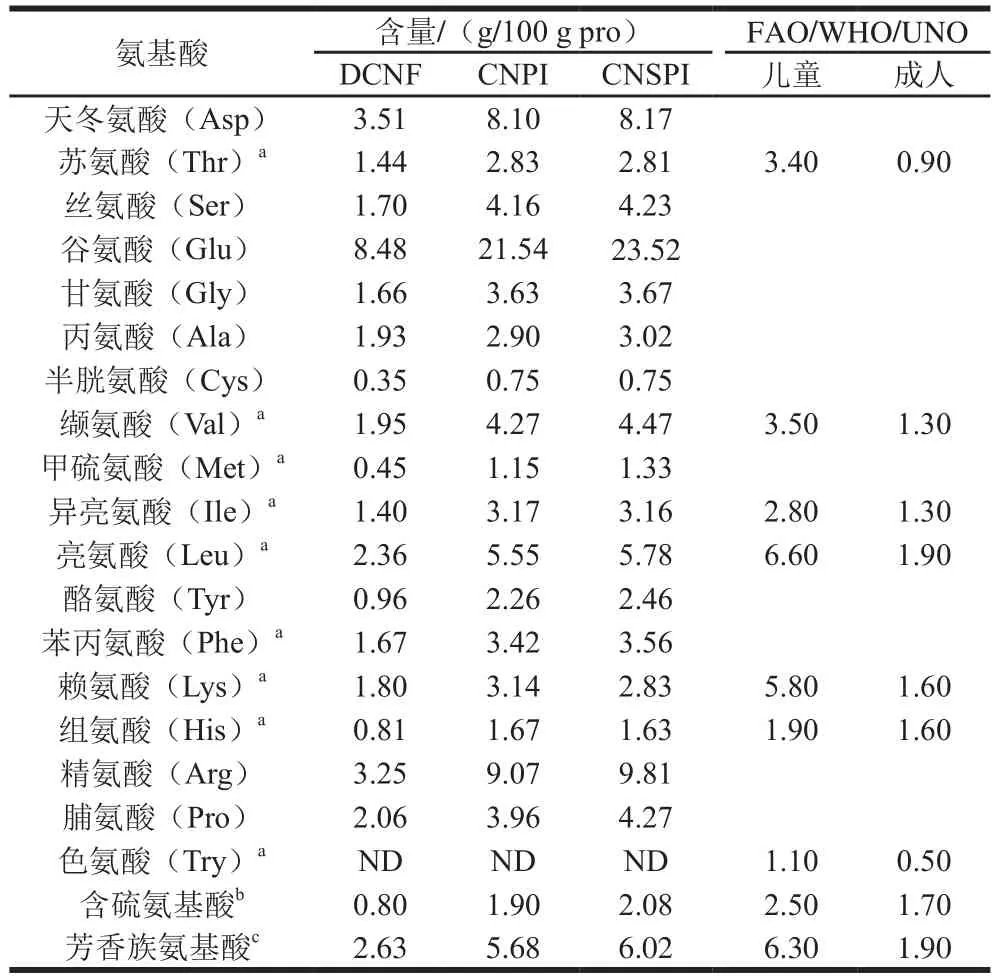
表1 两种方法提取腰果蛋白的氨基酸组成对比分析Table 1 Comparative amino acid compositions of DCNF, CNPI and CNSPI
DCNF、CNPI、CNSPI的氨基酸组成如表1所示,并以FAO/WHO/UNU推荐儿童和成人标准作为参照,脱脂粉与分离蛋白的氨基酸组成表现出明显差异,DCNF各种氨基酸含量普遍偏低,CNPI和CNSPI的必需氨基酸含量较高,缬氨酸、异亮氨酸含量都能达到儿童标准,芳香族氨基酸、含硫氨基酸、亮氨酸和苏氨酸含量能满足成人需求,而DCNF中必需氨基酸含量仅能满足成人需求。谷氨酸、天冬氨酸和精氨酸占腰果蛋白氨基酸比例较高,这与许多植物种子储藏蛋白一致,赖氨酸是腰果蛋白的第一限制性氨基酸。有研究表明,精氨酸与赖氨酸比越高,越能降低心血管疾病的发生几率,CNSPI具有较高的精氨酸与赖氨酸比,有降低人体胆固醇含量、保护心血管的作用。从氨基酸含量来看,两种方法提取的腰果蛋白无明显差异,进一步说明提取方法不会对蛋白质组成造成显著影响。
2.5 腰果蛋白二级结构分析结果

表2 两种方法提取腰果蛋白与市售大豆分离蛋白的二级结构组成Table 2 Secondary structures of cashew nut protein prepared by different methods compared with SPI
CD用来估计腰果蛋白质的二级结构组成,并以研究较为成熟的市售大豆分离蛋白(soy protein isolate,SPI)作为对照,二级结构实验分析结果如表2所示。实验结果表明CNPI的二级结构由11.9% α-螺旋、35.0%的β-折叠、23.8%的β-转角和29.3%的无规卷曲组成,而CNSPI的α-螺旋含量高于CNPI,为15.8%,β-折叠含量为34.9%,与CNPI相当,β-转角和无规卷曲含量分别为22.3%和27.0%。实验数据表明β-折叠和无规卷曲是腰果蛋白的主要二级结构,这与大豆蛋白、荞麦种子蛋白和白木通蛋白等相似。与CNSPI相比酸碱处理后的CNPI在α-螺旋含量上呈显著性降低(p<0.05),无规卷曲含量呈显著性升高(p<0.05),说明CNPI结构发生了变化,失去了有序的二级结构,这可能是蛋白提取的环境所致[27]。CNPI和CNSPI在二级结构组成上的差异说明酸碱处理后的蛋白质结构发生了较大的变化,进而影响了功能性质。
2.6 腰果蛋白溶解度测定结果

图 4 两种方法提取腰果蛋白溶解度曲线Fig. 4 Solubility prof i les of cashew nut protein extracted by different methods
溶解度是蛋白质发挥功能性质的先决条件,蛋白质需形成溶液才能更好地表现出功能性质[28],起泡性、乳化性和凝胶性质都与溶解性密切相关,因此,探究不同pH值下的蛋白质溶解度对其功能性质的研究和应用具有指导意义。由图4可知,在pH 3~9之间,CNPI和CNSPI的溶解度呈“V”型曲线,CNPI和CNSPI的溶解度在pH 5.0左右都达到最小值,分别为4.02%和1.12%,这一结果与Ogunwolu等[9]报道的腰果蛋白在等电点处溶解度最低相同,这是由于等电点附近分子净电荷较低,分子之间作用力减弱,容易凝聚产生沉淀,由此造成了溶解度的降低。另外,CNSPI在pH 3和pH 9附近几乎接近完全溶解,pH 3时溶解度高达98.10%,在酸性环境中的溶解度优于碱性;CNPI在pH 10时获得最大溶解度为70.42%,低于CNSPI,但在中性pH值下CNPI的溶解度显著高于CNSPI(p<0.05),分别为35.36%和25.85%,这表明CNSPI对pH值更敏感,这一结果也与CNPI SEM图呈现出较多有利于蛋白质溶解的片状结构相对应。两种蛋白质在溶解性质上差异明显,与CNPI相比,CNSPI表现出更好的溶解性。CNSPI在pH 3和pH 9的状态下溶解度远高于CNPI,在蛋白提取过程中使用酸处理会降低蛋白溶解度,这与刘大川等[29]的发现一致,这种现象可被解释为在提取过程中,酸处理使蛋白分子展开,提高了表面疏水性。
2.7 腰果蛋白功能性质测定结果

表3 两种方法提取腰果蛋白的功能性质Table 3 Functional properties of CNPI and CNSPI compared with BSA
两种方法提取的蛋白质和脱脂粉起泡性和起泡稳定性差异如表3所示,并以起泡性质和乳化性质优良的BSA作为对照[27]。如表3所示,中性条件下BSA起泡性为249.00%,远高于CNPI(119.00%)、CNSPI(89.70%)和DCNF(23.33%),蛋白质的起泡性能表征蛋白质扩散、吸水和分子在空气-水相界面快速展开重排的能力,因此较好的溶解性和松散的蛋白质分子结构对蛋白质的起泡性质至关重要,CNPI在中性条件下具有较高的溶解度,蛋白与水相的相互作用较密集,提高了蛋白质分子包裹空气的能力[30],相对的其起泡性质也较好,CNSPI与DCNF中可能含有更多的非柔性球状蛋白,限制了它在空气-水相界面的展开重排,从而降低了起泡能力。这一推测与SEM显示的DCNF有明显的簇状球蛋白,CNSPI中蛋白质出现团聚现象相一致。起泡稳定性是由蛋白质溶液的流变学性质决定的,BSA的起泡稳定性最好,为169.00%,CNPI的起泡稳定性为86.70%,显著高于CNSPI(60.00%)(p<0.05)。在中性条件下,CNPI的溶解度大于CNSPI,溶液中CNPI的蛋白浓度较高,蛋白质间分子作用较强,溶液中黏度较大,因而呈现出较好的泡沫稳定性[31]。
2.8 腰果蛋白乳化性及乳化稳定性测定结果
蛋白的乳化性质主要包括乳化性和乳化稳定性,乳化性是衡量蛋白质帮助形成稳定乳液的能力,乳化稳定性是衡量乳液在一定时间内保持其结构的能力[17],腰果脱脂粉及分离蛋白在中性环境下的乳化性质如表3所示。用不同方法提取的腰果蛋白在中性环境下的乳化性和乳化稳定性具有显著性差异(p<0.05),CNSPI表现出显著较高的乳化性(30.14 m2/g),显著高于CNPI(20.21 m2/g)和BSA(22.67 m2/g)(p<0.05)。这一结果与盐溶法提取南非班巴拉花生蛋白一致[32]。蛋白质溶解性和疏水性是决定蛋白吸附能力和乳化性质的重要因素,较高的溶解度和较低的表面疏水性可能是CNSPI具有优良乳化性的原因。
CNSPI乳化稳定性最好,可达138 min,其次是CNPI,乳化稳定性为61 min,均远高于BSA的乳化稳定性(27 min)(p<0.05)。本研究中乳化能力和乳化稳定性呈正相关关系,相似的结论在紫苏分离蛋白中也有报道,减提酸沉蛋白出现这种相对的不稳定性可能是因为脆弱的界面膜引起了油滴间不利的交互作用,这种界面交互作用有助于减小两相间的接触面积,导致小油滴合并变大,最终两相分离[33]。
3 结 论
本研究对比了CNPI和CNSPI在结构(微观形貌、表面疏水性、氨基酸组成、亚基组成、二级结构)和功能特性(溶解性、起泡性及起泡稳定性、乳化性及乳化稳定性)方面的区别。研究结果表明,不同提取方法对腰果蛋白的结构和功能特性产生了显著性差异(p<0.05)。SEM结果表明提取过程中会使腰果蛋白的微观结构发生改变,CNPI呈现表面光滑的大片状结构,而CNSPI微观形貌呈现不规则形状,有较小的球状颗粒。通过SDS-PAGE和氨基酸组成分析发现不同提取方法得到的腰果蛋白在组成上无显著性差异。CD结果表明,CNPI相比CNSPI含有较少的α-螺旋和较多的无规卷曲。CNSPI纯度更高,乳化性及乳化稳定性更好。而在中性环境下,CNPI具有更好的溶解性、起泡性及起泡稳定性。综上所述,在提取蛋白时,碱提酸沉法比盐提法对腰果蛋白结构改变程度更大,CNPI变性程度更高,多肽链从球状展开为片状,暴露出较多的疏水基团,因此在功能性质上表现出差异。CNSPI作为功能性食品成分更适合应用于乳液、酸性饮料等食品中,而CNPI更适合应用于冰淇淋等对起泡性质要求高的食品中。
[1] 王健, 杨毅敏. 世界腰果研究综述[J]. 经济林研究, 2002, 20(2): 87-91. DOI:10.3969/j.issn.1003-8981.2002.02.013.
[2] 蔡东宏. 世界腰果业的历史与现状[J]. 世界热带农业信息, 1997(11):1-6.
[3] SATHE S K, SZE-TAO K W C, WOLF W J, et al. Biochemical characterization and in vitro digestibility of the major globulin in cashew nut (Anacardium occidentale)[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 2854-2860. DOI:10.1021/jf970153e.
[4] SATHE S K. Solubilization and electrophoretic characterization of cashew nut (Anacardium occidentale) proteins[J]. Food Chemistry,1994, 51(3): 319-324. DOI:10.1016/0308-8146(94)90033-7.
[5] 荣瑞芬. 几种重要坚果的营养特性比较[J]. 北京联合大学学报(自然科学版), 2010, 24(1): 12-16. DOI:10.3969/j.issn.1005-0310.2010.01.003.
[6] AREMU M O, OLONISAKIN A, BAKO D A, et al. Compositional studies and physicochemical characteristics of cashew nut (Anarcadium occidentale) fl our[J]. Pakistan Journal of Nutrition, 2006, 5(4): 328-333.
[7] AKINHANMI T F, ATASIE V N, AKINTOKUN P O. Chemical composition and physicochemical properties of cashew nut(Anacardium occidentale) oil and cashew nut shell liquid[J]. Journal of Agricultural, Food and Environmental Sciences, 2008, 2(1): 1-10.
[8] BORA P S, NETO V Q. Functionality of native and denatured cashew nut kernel protein isolates at isoelectric pH as a function of salt concentration[J]. Journal of the Science of Food and Agriculture, 2004,84(15): 2022-2027. DOI:10.1002/jsfa.1905.
[9] OGUNWOLU S O, HENSHAW F O, MOCK H P, et al. Functional properties of protein concentrates and isolates produced from cashew(Anacardium occidentale L.) nut[J]. Food Chemistry, 2009, 115(3):852-858. DOI:10.1016/j.foodchem.2009.09.007.
[10] SU M, VENKATACHALAM M, TEUBER S S, et al. Impact of γ-irradiation and thermal processing on the antigenicity of almond,cashew nut and walnut proteins[J]. Journal of the Science of Food and Agriculture, 2004, 84(10): 1119-1125. DOI:10.1002/jsfa.1748.
[11] 冯笑笑, 苏颖杰, 吴梦月, 等. 翅果油树种仁蛋白的提取工艺优化及其功能性质分析[J]. 食品科学, 2016, 37(16): 29-35. DOI:10.7506/spkx1002-6630-201616005.
[12] KARACA A C, LOW N, NICKERSON M. Emulsifying properties of canola and flaxseed protein isolates produced by isoelectric precipitation and salt extraction[J]. Food Research International, 2011,44(9): 2991-2998. DOI:10.1016/j.foodres.2011.07.009.
[13] 钟俊桢, 顿儒艳, 黄宗兰, 等. 腰果蛋白的提取工艺条件优化[J]. 食品科学, 2014, 35(16): 18-22. DOI:10.7506/spkx1002-6630-201416004.
[14] 刘成梅, 王芳, 钟俊桢, 等. 腰果蛋白的功能特性研究及其氨基酸组成分析[J]. 食品工业科技, 2016, 37(2): 88-92. DOI:10.13386/j.issn1002-0306.2016.02.009.
[15] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.DOI:10.1016/0003-2697(76)90527-3.
[16] LASSISSI T A, HETTIARACHCHY N S, RAYAPROLU S J, et al.Functional properties and angiotensin-I converting enzyme inhibitory activity of soy-whey proteins and fractions[J]. Food Research International, 2014, 64: 598-602. DOI:10.1016/j.foodres.2014.07.015.[17] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[18] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[19] CLEVELAND D W, FISCHER S G, KIRSCHNER M W, et al. Peptide mapping by limited proteolysis in sodium dodecyl sulfate and analysis by gel electrophoresis[J]. Journal of Biological Chemistry, 1977,252(3): 1102-1106.
[20] ZHANG Q T, TU Z C, XIAO H, et al. Inf l uence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J].Food and Bioproducts Processing, 2014, 92(1): 30-37. DOI:10.1016/j.fbp.2013.07.006.
[21] 毛晓英. 核桃蛋白质的结构表征及其制品的改性研究[D]. 无锡: 江南大学, 2012: 54-55.
[22] PAPALAMPROU E M, DOXASTAKIS G I, KIOSSEOGLOU V.Chickpea protein isolates obtained by wet extraction as emulsifying agents[J]. Journal of the Science of Food and Agriculture, 2010, 90(2):304-313. DOI:10.1002/jsfa.3816.
[23] MINE Y. Ef f ect of dry heat and mild alkaline treatment on functional properties of egg white proteins[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 2924-2928. DOI:10.1021/jf970158b.
[24] WANASUNDARA P, SHAHIDI F. Functional properties of acylated fl ax protein isolates[J]. Journal of Agricultural and Food Chemistry,1997, 45(7): 2431-2441. DOI:10.1021/jf9607829.
[25] 王镜岩, 朱圣庚, 徐长法. 生物化学教程[M]. 北京: 高等教育出版社,2002: 35-36.
[26] 田斌强, 邓乾春, 黄娟, 等. 燕麦分离蛋白疏水性及起泡性研究[J]. 食品研究与开发, 2015, 36(6): 1-5. DOI:10.3969/j.issn.1005-6521.2015.06.001.
[27] ZHU K X, SUN X H, CHEN Z C, et al. Comparison of functional properties and secondary structures of defatted wheat germ proteins separated by reverse micelles and alkaline extraction and isoelectric precipitation[J]. Food Chemistry, 2010, 123(4): 1163-1169.DOI:10.1016/j.foodchem.2010.05.081.
[28] HORAX R, HETTIARACHCHY N S, CHEN P, et al. Functional properties of protein isolate from cowpea (Vigna unguiculata L. Walp.)[J].Journal of Food Science, 2004, 69(2): 119-121.
[29] 刘大川, 张维农, 胡小泓. 花生蛋白制备工艺和功能特性的研究[J]. 武汉工业学院学报, 2001(4): 1-3. DOI:10.3969/j.issn.1009-4881.2001.04.001.
[30] PARAMAN I, HETTIARACHCHY N S, SCHAEFER C, et al.Hydrophobicity, solubility, and emulsifying properties of enzymemodified rice endosperm protein[J]. Cereal Chemistry, 2007, 84(4):343-349. DOI:10.1094/CCHEM-84-4-0343.
[31] LIU Y, ZHAO G L, ZHAO M M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chemistry, 2012, 131(3): 901-906.DOI:10.1016/j.foodchem.2011.09.074.
[32] ARISE A K, AMONSOU E O, IJABADENIYI O A. Influence of extraction methods on functional properties of protein concentrates prepared from South African bambara groundnut landraces[J].International Journal of Food Science & Technology, 2015, 50(5):1095-1101. DOI:10.1111/ijfs.12746.
[33] MUNDI S, ALUKO R E. Physicochemical and functional properties of kidney bean albumin and globulin protein fractions[J]. Food Research International, 2012, 48(1): 299-306. DOI:10.1016/j.foodres.2012.04.006.
Structure and Functional Characterization of Cashew Nut Protein Prepared by Salt Extraction Method and Alkaline Extraction and Subsequent Isoelectric Precipitation Method
PENG Qian, YAN Xiaoyan, LI Yuting, LIANG Lu, LIU Chengmei*, WANG Fang
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Proteins isolated from defatted cashew nut fl our by salt extraction method (CNSPI) and alkaline extraction and subsequent isoelectric precipitation method (CNPI) were evaluated to compare their structural (molecular weight, secondary structure, amino acid composition), micromorphological and functional (solubility, foaming capacity and foam stability,emulsifying activity index and emulsion stability) properties. The results showed CNSPI and CNPI dif f ered signif i cantly in structure, micromorphology, and functional properties. CNSPI exhibited significantly higher protein content, better solubility and emulsifying properties compared with CNPI, while the foaming properties were lower. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis revealed that the preparation methods had no impact on the primary structure of protein isolates. The nutritive value of protein isolates was evaluated by amino acid composition analysis. Scanning electron microscopy revealed that CNSPI exhibited a massive fl aky microstructure while CNPI appeared in an irregular shape as a combination of only a few globules and some fl aky plates. Circular dichroism (CD) spectroscopy demonstrated that β-sheet was the major secondary structure in CNSPI and CNPI. CNPI had relatively more random coil (29.3%) and less α-helix(11.9% vs. 27.0%) than CNSPI, which was possibly because alkaline treatment destroyed protein structure and consequently changed functional properties. Under neutral pH condition, the foaming capacity of CNPI was 119.00%, and the emulsion capacity could reach 30.14 m2/g.
cashew nut protein; functional properties; micromorphology; secondary structure; alkaline extraction and subsequent isoelectric precipitation method; salt extraction method
10.7506/spkx1002-6630-201723013
TS255.6
A
1002-6630(2017)23-0075-07
2016-10-08
公益性行业(农业)科研专项(201303077)
彭倩(1993—),女,硕士研究生,研究方向为食品工程。E-mail:pengqian_ncu@163.com
*通信作者:刘成梅(1963—),男,教授,博士,研究方向为食物资源利用与开发。E-mail:chengmeiliu@yahoo.com.cn
彭倩, 颜小燕, 李雨婷, 等. 盐提和碱提酸沉两种方法提取腰果蛋白的结构及其功能性质分析[J]. 食品科学, 2017,38(23): 75-81.
10.7506/spkx1002-6630-201723013. http://www.spkx.net.cn
PENG Qian, YAN Xiaoyan, LI Yuting, et al. Structure and functional characterization of cashew nut protein prepared by salt extraction method and alkaline extraction and subsequent isoelectric precipitation method[J]. Food Science, 2017, 38(23):75-81. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723013. http://www.spkx.net.cn
