IL-21单独及联合5-FU对人胃癌细胞迁移、凋亡的影响
2017-12-11吴申娄方方孙建超蒋红梅
吴申,娄方方,孙建超,蒋红梅
(1海港医院,山东烟台264000;2贵州省人民医院;3贵州省临床检验中心;4贵州医科大学检验学院)
IL-21单独及联合5-FU对人胃癌细胞迁移、凋亡的影响
吴申1,娄方方2,孙建超3,蒋红梅4
(1海港医院,山东烟台264000;2贵州省人民医院;3贵州省临床检验中心;4贵州医科大学检验学院)
目的探讨人白细胞介素21(IL-21)单独及联合氟尿嘧啶(5-FU)对人胃癌细胞SGC-7901迁移、凋亡的影响。方法取对数期人胃癌细胞SGC-7901,将其随机分为A、B、C、D组。A组加入IL-21 100 ng/mL,B组加入5-FU 25 μg/mL+IL-21 100 ng/mL,C组加入5-FU 50 μg/mL,D组加入5-FU 50 μg/mL+IL-21 100 ng/mL。划痕实验检测各组胃癌细胞迁移能力;TUNEL法检测各组胃癌细胞凋亡情况;Western blotting法检测各组凋亡相关蛋白Bcl-2及c-myc表达。结果A、B、C、D组人胃癌细胞SGC-7901的迁移能力均受到抑制,迁移距离按A、B、C、D组顺序递减(P均lt;0.001);D组与A、B、C组相比,24、48 h对肿瘤细胞迁移的抑制作用均增强(P均lt;0.05),IL-21和5-FU联用时,呈协同加强作用。A、B、C、D组凋亡细胞百分比依次递增;D组与C组相比,24、48 h凋亡细胞百分比均增高(P均lt;0.001);B、C、D组 c-myc蛋白表达呈递增趋势,Bcl-2蛋白表达呈递减趋势;与C组相比,D组24、48 h各凋亡蛋白表达差异有统计学意义(P均lt;0.001)。结论IL-21具有抑制SGC-7901细胞迁移、促进凋亡作用,且与5-FU常规剂量联用时,呈协同加强效应。
胃癌;白细胞介素21;氟尿嘧啶;Bcl-2蛋白;c-myc蛋白
研究表明,恶性肿瘤占人类所有死亡病因的1/4,仅次于心血管疾病,位居第2[1]。我国恶性肿瘤的病死率高于全球平均水平,其中,胃癌是第2位常见的恶性肿瘤死因。目前,手术、放疗和化疗仍是临床治疗胃癌的三大手段[2]。胃癌早期诊断率低,错过了手术治疗的最佳时机,加之Ⅱ期以上患者术后复发率高,长期生存率仍较低[3]。鉴于此,单一手术无法使胃癌患者达到理想的疗效,常需联合放疗和化疗进行综合治疗。目前,化疗药物种类繁多,氟尿嘧啶(5-FU)是治疗胃癌的基本药物及首选药物。进行抗肿瘤新药的研究时,常用5-FU作为阳性药物来评价新药的疗效[4],但其存在较多的不良反应及对正常细胞的杀伤作用,限制了其临床应用。近几年,分子靶向药物逐渐成为肿瘤治疗的研究热点。研究[5]显示,多种恶性肿瘤中存在细胞因子紊乱,并与肿瘤的发生发展、局部复发及远处转移有关。IL-21是一种具有免疫调节功能的细胞因子,随着研究的深入,IL-21的抗肿瘤作用逐渐被证实。2014年5月~2015年6月,我们观察了IL-21单独及联合5-FU对人胃癌细胞SGC-7901迁移能力及凋亡的影响。
1 材料与方法
1.1 材料 人胃癌细胞SGC-7901(ATCC细胞库);DMSO(Hyclone公司);RMPI1640培养基,胎牛血清(Gibco公司);IL-21(Peprotech公司);5-FU(Biotopped公司);TUNEL检测试剂盒(美国罗氏公司);兔源Bcl-2单克隆抗体,兔源c-myc单克隆抗体(美国Abcam公司);酶标仪(美国Bio-Rad公司);CO2培养箱(美国Thermo公司)。
1.2 细胞培养 将人胃癌细胞SGC-7901置于含10%胎牛血清的RMPI1640培养液中,37 ℃、5% CO2培养箱中饱和湿度下培养,待细胞生长至对数期时进行实验。将细胞随机分为A、B、C、D组及空白组。
1.3 人胃癌细胞SGC-7901迁移能力检测 按每孔约2×105个SGC-7901细胞接种于6孔板,培养24 h,细胞铺满孔底90%以上时,用10 μL移液器枪头垂直于孔底轻轻划线去除细胞,每孔划2~3条;磷酸盐缓冲液(PBS)轻轻洗去划落细胞,A组加入IL-21 100 ng/mL,B组加入5-FU 25 μg/mL+IL-21 100 ng/mL,C组加入5-FU 50 μg/mL,D组加入5-FU 50 μg/mL+IL-21 100 ng/mL,空白组不给予任何药物处理,继续培养24、48 h,利用Image J 软件测量不同时间划痕边缘距离。迁移距离=边缘距离(0 h)-边缘距离(24/48 h)。
1.4 人胃癌细胞SGC-7901凋亡检测 A、B、C、D组胃癌细胞分别加入同1.3药物,处理24、48 h,PBS清洗,4%多聚甲醛固定细胞30~60 min,PBS清洗,细胞通透液处理15 min,PBS清洗,4%多聚甲醛中浸洗5 min,PBS清洗,100 μL平衡液,在湿盒中平衡10 min,加100 μL TUNEL反应混合液,加盖玻片37 ℃暗湿盒中反应1 h,浸入2×SSC 15 min,用PBS洗涤2~3次,浸入0.3%H2O2中15 min,用PBS洗涤2~3次,加入100 μL Streptavidin标记的HRP孵育30 min,加入100 μL DAB混合液显色10 min,去离子水冲洗,苏木素复染3 s后用自来水冲洗,用梯度乙醇脱水(50%、70%、85%、95%、100%、100%各1 min),二甲苯透明1 min,2次,最后中性树胶封片。光学显微镜下观察凋亡细胞并拍照。
1.5 细胞内Bcl-2、c-myc蛋白表达检测 采用Western blotting法。A、B、C、D组胃癌细胞分别加入1.3中药物处理24、48 h,收集细胞,提取总蛋白,BCA法计算各组蛋白浓度,每组取等量蛋白变性处理后,进行聚丙烯酰胺凝胶电泳(PAGE),湿转PVDF膜上,5%牛血清白蛋白室温封闭1 h,兔源一抗Bcl-2(1∶1 000)、c-myc(1∶1 000)4 ℃孵育过夜,TBST洗3次,每次10 min,辣根过氧化物酶标记羊抗兔二抗(1∶2 500)室温孵育1 h,Tris-HCl缓冲盐溶液清洗后Millipore发光液显色、曝光,利用Image J软件分析,以目的条带和内参条带比值进行半定量分析。

2 结果
2.1 各组不同时点人胃癌细胞SGC-7901迁移距离比较 见表1。

表1 各组不同时点人胃癌细胞SGC-7901迁移距离比较
注: 与空白组相比,aPlt;0.001;与D组相比,bPlt;0.05。
2.2 各组不同时点SGC-7901凋亡细胞百分比比较 见表2。

表2 各组不同时点SGC-7901凋亡细胞百分比
注:与空白组相比,aPlt;0.05;与D组比较,bPlt;0.001;与同组24 h相比,cPlt;0.001。
2.3 各组不同时点SGC-7901细胞凋亡蛋白c-myc、Bcl-2表达比较 见表3。
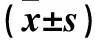
表3 各组不同时点SGC-7901细胞凋亡蛋白c-myc、Bcl-2表达比较
注:与C组相比,aPlt;0.001;与同组24 h相比,bPlt;0.001。
3 讨论
IL-21具有明确的抗肿瘤作用[6,7],且不良反应小[8],但对其抗肿瘤作用的免疫机制尚未完全阐明。目前普遍认为,IL-21可能通过刺激不同时期的NK细胞及T细胞增殖,促进IFN-γ的释放[9];上调CD8+T细胞、NK细胞颗粒酶和穿孔素的表达,介导细胞毒性T淋巴细胞的活化[10];直接抑制肿瘤细胞增殖[11]等多种途径发挥抗肿瘤作用。
本实验结果显示,A、B、C、D组人胃癌细胞SGC-7901迁移能力均受到抑制,且抑制作用依次增强;B组较之A组,在24 h时迁移距离缩短,差异有统计学意义,至48 h时,迁移距离仍短于A组。提示IL-21单独使用或与5-FU联合应用对人胃癌细胞SGC-7901的迁移都有明显抑制作用,但与5-FU联用效果更佳。
肿瘤细胞无限增殖是肿瘤发生发展的关键。本研究结果显示,A、B、C、D组人胃癌细胞SGC-7901凋亡细胞百分比依次递增;D组与C组相比,24、48 h凋亡细胞百分比均明显增加;B组在24、48 h与C组相比凋亡细胞百分比较低,但48 h时,两组之间差异较小。表明二者联合时可起到协同加强作用,这对临床减少5-FU毒性作用有积极作用。
细胞凋亡受多种基因调控,主要包括p53、Bcl-2及c-myc。其中c-myc为促细胞凋亡基因;Bcl-2为抑制细胞凋亡基因,高表达时可明显延长细胞的生长周期,抑制细胞凋亡。c-myc与Bcl-2协同作用时可封闭p53蛋白进入细胞核中,从而阻断p53诱导的细胞凋亡,导致肿瘤细胞向恶性表型进展,并使肿瘤细胞对治疗的抗性增加[12,13]。本研究结果显示,B、C、D组c-myc蛋白表达呈递增趋势,Bcl-2蛋白表达呈递减趋势;与C组相比,B组24、48 h两个时点各凋亡蛋白表达差异有统计学意义,但48 h时两组c-myc、Bcl-2蛋白表达量差异较24 h时已有所缩小。提示IL-21与5-FU联用对SGC-7901细胞的凋亡均有促进,可使胃癌细胞凋亡相关蛋白Bcl-2表达降低,c-myc表达增加;与单用 5-FU相比,IL-21联合5-FU对肿瘤细胞的凋亡呈协同促进作用。
综上所述,IL-21可抑制人胃癌细胞SGC-7901迁移,促进其凋亡;IL-21与5-FU常规剂量联用时,上述作用协同加强,有利于提高单纯使用5-FU的抗肿瘤效果。
[1] Herszényi L, Tulassay Z. Epidemiology of gastrointestinal and liver tumors[J]. Eur Rev Med Pharmacol Sci, 2010,14(4):249-258.
[2] Deng G, Chan Y, Sjoberg D, et al. Acupuncture for the treatment of post-chemotherapy chronic fatigue: a randomized, blinded, sham-controlled trial[J]. Support Care Cancer, 2013,21(6):1735-1741.
[3] Kohne CH, Bedenne L, Carrato A, et al. A randomised phase Ⅲ intergroup trial comparing high-dose infusional 5-fluorouracil with or without folinic acid with standard bolus 5-fluorouracil/ folinic acid in the adjuvant treatment of stage Ⅲ colon cancer:The Pan-European trial in adjuvant colon cancer 2 study[J]. Eur J Cancer, 2013,49(8):1868-1875.
[4] 罗兰,徐兴华,黄文静,等.氨氯地平及5-氟尿嘧啶联合应用对小鼠肝癌H22细胞的抑制作用[J].中国生物制品学杂志,2014,27(2):212-220.
[5] Peng B, Hu Q, Sun L, et al. Duchesnea phenolic fraction Inhibits tumor growth through restoring the Thl/Th2 balance in UI4 cervical cancer bearing mice[J]. Chin Med, 2012,3(1):42-45.
[6] Kesselring R, Jauch D, Fichtner-Feigl S. Interleukin 21 impairs tumor immunosurveillance of colitis-associated colorectal cancer [J]. Oncoimmunology, 2012,1(4):537-538.
[7] Elizabeth LM, Alena CJ, Kristan DG, et al. IL-21 Enhances Natural Killer Cell Response to Cetuximab-Coated Pancreatic Tumor Cells[J]. Clin Cancer Res, 2017,32(2):489-502.
[8] Petrella TM, Tozer R, Belanger K, et al. Interleukin-21 Has Activity in Patients With Metastatic Melanoma: A Phase Ⅱ Study[J]. J Clin Oncol, 2012,30(27):3396-3401.
[9] Spolski R, Wang I, Wan CK, et al. IL-21 promotes the pathologic immune response to pneumovirus infection[J]. J Immunol, 2012,18(8):1924-1932.
[10] Zoon CK, Wan W, Graham L, et al. Expansion of T Cells with Interleukin-21 for Adoptive Immunotherapy of Murine Mammary Carcinoma[J]. Int J Mol Sci, 2017,18(2):1-15.
[11] Kim N, Nam YS, Sun Y, et al. IL-21-Expressing Mesenchymal Stem Cells Prevent Lethal B-Cell Lymphoma Through Efficient Delivery of IL-21, Which Redirects the Immune System to Target the Tumor[J]. Stem Cells Dev, 2015,24(23):2808-2821.
[12] 李娜,高俊岩,刘敏.细胞凋亡和肿瘤的关系研究进展[J].当代医学,2009,15(16):13-14.
[13] 董雅洁,高维娟.bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系[J].中国老年学杂志,2012,11(32):4828-4830.
10.3969/j.issn.1002-266X.2017.41.013
R735.2
A
1002-266X(2017)41-0042-03
蒋红梅(E-mail:1933769985@qq.com)
2017-05-28)
