5-Aza-CdR联合5-FU对人结肠癌SW480和LS-174T细胞生长、凋亡的影响
2017-12-11祝丽丽朱家明韩爱民
祝丽丽,朱家明,韩爱民
(淮安市淮阴医院,江苏淮安 223300)
5-Aza-CdR联合5-FU对人结肠癌SW480和LS-174T细胞生长、凋亡的影响
祝丽丽,朱家明,韩爱民
(淮安市淮阴医院,江苏淮安 223300)
目的观察5-氮-2′-脱氧胞苷(5-Aza-CdR)联合氟尿嘧啶(5-FU)对人结肠癌SW480和LS-174T细胞生长、凋亡的影响。方法将SW480和LS-174T细胞各分为四组:对照组、DAC组、5-FU组、联合组,对照组以等量PBS液加入SW480或LS-174T细胞培养液中;5-FU组用100 μg/mL的5-FU干预SW480或70 μg/mL的5-FU干预LS-174T细胞24 h;DAC组用5 μmol/L的DAC干预SW480或LS-174T细胞48 h;联合组予5 μmol/L的DAC干预SW480或LS-174T细胞48 h,再用100 μg/mL的5-FU干预SW480或70 μg/mL的5-FU干预LS-174T细胞24 h。MTT法测算细胞增殖抑制率;实时荧光定量PCR法检测各组凋亡相关基因(Bax、Bcl-2)mRNA表达;免疫细胞化学法检测Bax、Bcl-2蛋白表达。结果DAC组和5-FU组细胞增殖抑制率高于对照组(P均lt;0.05),而联合组与其他三组相比细胞增殖抑制率亦升高(P均lt;0.01)。DAC组、5-FU组与对照组相比,Bax mRNA及蛋白表达增多(P均lt;0.05);与其他三组相比,联合组中Bax mRNA及蛋白表达增多(P均lt;0.01)。5-FU组、联合组与对照组相比,Bcl-2 mRNA及蛋白表达减少(P均lt;0.05),而联合组与5-FU组相比,Bcl-2 mRNA及蛋白表达差异无统计学意义(P均gt;0.05)。结论5-Aza-CdR和5-FU均能抑制人结肠癌SW480、LS-174T细胞生长,促进细胞凋亡,联合时作用更显著。
结直肠癌;5-氮-2′-脱氧胞苷;氟尿嘧啶;细胞凋亡;B细胞淋巴瘤/白血病基因伴随蛋白x;B细胞淋巴瘤/白血病-2基因
研究发现,晚期结肠癌患者术后行辅助化疗可提高15%~20%的长期生存率[1]。但多药耐药的产生及严重的不良反应成为化疗停止或中断的重要原因。5-氮-2′-脱氧胞苷(5-Aza-CdR)为甲基化抑制剂,可通过逆转DNA高甲基化,诱导沉默基因转录,使失活的抑癌基因恢复正常功能,从而抑制肿瘤细胞生长[4,5]。大剂量5-Aza-CdR有较强的细胞毒性,而小剂量5-Aza-CdR的不良反应较传统化疗药物小,用于治疗急性白血病、慢性髓性白血病和骨髓增生异常综合征的效果较好[6~8]。近年来有学者发现,5-Aza-CdR联合其他化疗药物能起到协同作用,从而加强抑瘤作用[9~11]。2015年6月,我们将5-Aza-CdR和5-FU单独及联合作用于人结肠癌细胞株SW480和LS-174T,观察两种药物对细胞生长及凋亡的影响。
1 材料与方法
1.1 材料 人结肠癌细胞株SW480和LS-174T均购自中科院上海细胞库,5-Aza-CdR购自美国Sigma公司,5-FU购自德国默克公司,MTT购自碧云天生物技术有限公司,RT-PCR逆转录试剂盒购自美国MBIFermentas公司,Bax、Bcl-2及β-actin引物购自上海基康生物技术有限公司,兔抗人Bax及Bcl-2多克隆抗体购自美国Santa Cruz公司,免疫组化二步法试剂盒购自北京中杉金桥生物有限公司。
1.2 细胞培养、分组及药物干预 将SW480和LS-174T细胞培养于含10%胎牛血清、1×105U/L青霉素、链霉素的RPMI1640培养液中,于37 ℃、5%CO2培养箱内常规传代培养。将SW480和LS-174T细胞各分为四组,对照组以等量PBS液加入SW480或LS-174T细胞培养液中;5-FU组用100 μg/mL的5-FU干预SW480或70 μg/mL的5-FU干预LS-174T细胞24 h;DAC组用5 μmol/L的5-Aza-CdR干预SW480或LS-174T细胞48 h;联合组予5 μmol/L的5-Aza-CdR干预SW480或LS-174T细胞48 h,再用100 μg/mL的5-FU干预SW480或70 μg/mL的5-FU干预LS-174T细胞24 h。
1.3 细胞增殖抑制率测算 采用MTT法。用0.25%胰酶消化对数生长期SW480和LS-174T细胞,配成单细胞悬液,使用细胞计数板计数,调整细胞悬液至适当浓度(OD值达0.8~1.2),每孔加入200 μL,每个浓度设5个复孔,并设置正常对照组(细胞、培养液、MTT、DMSO)和空白对照组(培养液、MTT、DMSO),边缘孔用无菌PBS填充以保持正常湿度。细胞经5%CO2、37 ℃孵育24 h贴壁后,弃原培养液,PBS漂洗3次,去除末贴壁的死细胞及表面残留的培养液,DAC组、5-FU组、联合组参照1.2处理,正常对照组和空白对照组中只加培养液,在培养箱中继续孵育,药物干预结束后,每孔均加入20 μL MTT溶液(5 mg/mL),继续培养4 h后小心吸净孔内培养液,每孔加入150 μL的DMSO,置摇床上低速振荡10 min。酶联免疫检测仪于490 nm波长处测定各孔光密度值(OD值)。计算细胞增殖抑制率(IR),IR=[1-(实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)]×100%,并确定药物的半数抑制浓度(IC50)。
1.4 凋亡相关基因Bax、Bcl-2 mRNA表达测定 采用实时荧光定量PCR法。分别选取对数生长期的SW480和LS-174T细胞,用0.25%胰酶消化制备单细胞悬液,用计数板计数后调整细胞浓度至2.5×106/mL,均匀接种至6孔板内,每孔加入细胞悬液2 mL,放置培养箱内24 h;待细胞完全贴壁后弃去各孔内原培养液,DAC组、5-FU组、联合组参照1.2处理。TRIzol法提取总RNA:药物干预后弃各孔原培养液,并每孔加入2 mL PBS液清洗2次,每孔加入1 mL TRIzol裂解液后混匀,冰上置5 min后用枪头反复吹打,将EP管放入高速冷冻离心机中离心3次,小心弃上清液,在超净工作台内自然风干RNA沉淀。加入RNase-free ddH2O 20~30 mL溶解RNA。取已溶解的RNA1 μL,加DEPC水99 μL(稀释100倍),用紫外分光光度仪于波长A260/A280下检测总RNA纯度,纯度在1.8~2.0表明纯度适宜;调整总RNA浓度,得出含总RNA 1 μg的样本体积量,用于逆转录反应,其余置-70 ℃超低温冰箱中保存。用RT-PCR逆转录试剂盒将RNA逆转录成cDNA。采用Lightcycle480荧光定量PCR仪分析软件自动分析、处理数据,以结果中的“Target/Reference”值及相对表达量值进行统计分析,实验重复3次。
1.5 Bax、Bcl-2蛋白表达测定 采用免疫细胞化学染色法。在6孔板内培养SW480和LS-174T细胞细,DAC组、5-FU组、联合组参照1.2处理。固定细胞后二步法免疫细胞化学染色、5%山羊血清37 ℃封闭20 min,弃血清,各组加入对应一抗(兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体,阴性对照组用PBS替代)、次日取出标本用PBS液浸洗5 min×3次、加入二抗(山羊抗兔IgG抗体-HRP多聚体)37 ℃孵育30 min、DAB工作液显色、苏木素复染30 s、梯度乙醇脱水(浓度分别为75%、85%、95%、100%、100%,各5 min)、二甲苯透明10 min、中性树脂封片。镜下观察,细胞质中棕色越深代表目的蛋白表达越明显。用ImagePro Plus4.5显微镜图像分析系统分析,200倍镜下每张图片随机检测5个视野,并计算出平均光密度,以该值作为Bax、Bcl-2蛋白表达的半定量参数。

2 结果
2.1 各组IR比较 对照组、DAC组、5-FU组和联合组中SW480细胞的IR分别为0、4.45%±0.17%、47.63%±0.37%、79.28%±0.56%,LS-174T细胞的IR分别为0、4.57%±0.23%、49.48%±0.41%、81.68%±0.74%,四组间比较,P均lt;0.05。
2.2 各组细胞中Bax、Bcl-2 mRNA表达比较 见表1。
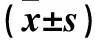
表1 各组细胞中Bax、Bcl-2 mRNA相对表达量比较
注:与对照组相比,*Plt;0.05;与联合组相比,△Plt;0.01。
2.3 各组Bax、Bcl-2 蛋白表达比较 见表2。
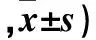
表2 各组细胞中Bax、Bcl-2 蛋白表达比较(平均光密度
注:与对照组相比,*Plt;0.05;与联合组相比,△Plt;0.01。
3 讨论
近年来,结直肠癌的发病率呈逐年上升趋势。据统计,2007年全球结直肠癌的新发病例约120万(比2000年增加27%,平均年增3.9%),死亡近63万(比2000年增加28%,平均年增4.0%)[12,13]。结直肠癌的发病机制目前尚未完全阐明。早期结直肠癌一般通过手术完全切除,预后较好;而中晚期结直肠癌常存在局部或远处转移,常采用以手术切除为主的综合治疗,其中化疗药物的使用是结直肠癌综合治疗的重要组成部分。目前,结直肠癌的化疗已从5-FU单药治疗时代进入新药联合化疗及分子靶向治疗新时期。表观遗传学异常与肿瘤发生发展密不可分,其通过抑癌基因失活、原癌基因激活、增加基因组的不稳定性及基因印记丢失等途径参与肿瘤形成[2,3]。DNA甲基化是表观遗传学的重要内容,尤其是基因启动子区的改变,低甲基化改变及高甲基化改变均能影响基因表达。
5-Aza-CdR是DNA甲基转移酶1(DNMT1)的抑制剂,在DNA复制过程中与DNA分子结合,并与DNMT1形成共价复合物,抑制该酶的甲基转移活性。最初开发时5-Aza-CdR作为大剂量治疗的细胞毒药物,因毒性大而临床应用较少,近年来研究主要针对于小剂量5-Aza-CdR的癌症治疗,通过不同的低甲基化治疗模式,逆转凋亡相关基因(如抑癌基因)启动子区的高甲基化状态,最终诱导肿瘤细胞凋亡。目前,Ishiguro等[14]发现,低剂量5-Aza-CdR可作为“生物致敏剂”恢复结肠癌细胞株HCT-15中P14ARF、P16INK4a等基因的重新表达,且联合用药时细胞凋亡较单独用药增加,推测5-Aza-CdR通过逆转细胞周期调控相关基因P14ARF、P16INK4a等表达,加速肿瘤细胞凋亡,从而提高HCT-15细胞对伊立替康的敏感性。
本实验发现,5-Aza-CdR组和5-FU组IR高于对照组,差异有统计学意义,而联合组与其他三组相比IR升高更明显,差异有统计学意义。说明5-Aza-CdR、5-FU均能抑制SW480和LS-174T细胞增殖,且两者联用效果更明显。DAC组、5-FU组与对照组相比,Bax mRNA及蛋白表达增多;与其他三组相比,联合组中Bax mRNA及蛋白表达增多更明显。5-FU组、联合组与对照组相比,Bcl-2 mRNA及蛋白表达减少,而联合组与5-FU组相比,Bcl-2 mRNA及蛋白表达差异无统计学意义。提示5-Aza-CdR能增强5-FU对结肠癌细胞的促凋亡作用,两者联合能协同促进凋亡抑制基因Bax表达,降低Bcl-2表达。
综上所述,5-Aza-CdR和5-FU均能抑制人结肠癌细胞生长,促进结肠癌细胞凋亡,二者联用时效果更显著。
[1] Hicks T, Boni C, Navarro M, et al. Improved overall survival with oxaliplatin, fluorouracil,and leucovorin as adjuvant treatment in stage Ⅱ or Ⅲ colon cancer in the MOSAIC trial[J]. Clin Oncol, 2009,27(19):3109-3116.
[2] Gronbaek K, Hother C, Jones PA. Epigenetic changes in cancer[J]. APMIS, 2007,115(10):1039-1059.
[3] Momparler RL, Bovenzi V. DNA methylation and cancer[J]. J Cell Physiol, 2000,183(2):145-154.
[4] Fujikane T, Nishikawa N, Toyota M , et al. Genomic screening for genes upregulated by demethylation revealed novel targets of epigenetic silencing in breast cancer[J]. Breast Cancer Res Treat, 2010,122(3):699-710.
[5] Mossman D, Kim KT, Scott RJ. Demethylation by 5-aza-2′-deoxycytidine in colorectal cancer cells targets genomic DNA whilst promoter CpG island methylation persists[J]. BMC Cancer, 2010,10:366.
[6] Petti MC, Mandelli F, Zagonel V, et al. Pilot study of 5-aza-2′ -deoxycytidine ( Decitabine) in the treatment of poor prognosis acute myelogenous leukemia patien ts : preliminary results[J]. Leukemia, 1993,7(Suppl 1):36-41.
[7] Schwartsmann G, Fernandes MS, Schaan MD, et al. Decitabine (5-aza-2'-deoxycytidine, DAC)plus daunorubicin as a first linetreatment in patients with acute myeloid leukemia: preliminary observations[J]. Leukemia, 1997,11(Suppl 1):28-31.
[8] Santos FP, Kantarjian H, Ravandi F, et al. Decitabine in the treatment of myelodysplastic syndromes[J]. Expert Rev Anticancer Ther, 2010,10(1):9-22.
[9] Gagnon J, Shaker S, Pnmeau M, et al. Interaction of 5-aza-2′-deoxycytidine and depsipeptide on antineoplastic activity and activation of 14-3-3 sigma,e-cadherin and tissue inhibitor of metalloproteinase 3 expression in human breast carcinoma cells[J]. Anticancer Drugs, 2003,14(3):193-202.
[10] Ishiguro M, Iida S, Uetake H, et al. Epigenetic combination therapy as a tumou-selective treatment approach for hepatocellular carcinoma[J]. Cancer, 2007,109(10):2132-2141.
[11] Cheetham S, Tang MJ, Mesak F, et al. Sparc promoter hypermethylation in colorectal cancers can be reversed by 5-aza-2-deoxycytidine to increase sparc expression and improve therapy response[J]. Br J Cancer, 2008,98(11):1810-1819.
[12] Garcia M, Jemal A, Ward EM, et al. Global Cancer Facts amp; Figures 2007[J]. Atlanta, GA:American Cancer Society, 2007:12-13.
[13] Steward BW, Kleihues P. World Cancer Report[M].Lyon:IARC Press, 2003:198-202.
[14] Ishiguro M, Iida S, Uetake H, et al. Effect of Combined Therapy With Low-Dose 5-Aza-2′-Deoxycytidine and Irinotecan on Colon Cancer Cell Line HCT-15[J]. Ann Surg Oncol, 2006,14(5):1752-1762.
10.3969/j.issn.1002-266X.2017.41.011
R735.35
A
1002-266X(2017)41-0036-03
韩爱民(E-mail: hyyyham@163.com)
2017-01-20)
