融合蛋白SMP30-IP10真核表达质粒的构建及其对肝癌细胞迁移、侵袭、增殖的影响
2017-12-11谢美玉郭顺利宾晓芸石明霞陈安宁陈思宇周素芳
谢美玉,郭顺利,宾晓芸,石明霞,陈安宁,陈思宇,周素芳
(广西医科大学基础医学院,南宁 530021)
融合蛋白SMP30-IP10真核表达质粒的构建及其对肝癌细胞迁移、侵袭、增殖的影响
谢美玉,郭顺利,宾晓芸,石明霞,陈安宁,陈思宇,周素芳
(广西医科大学基础医学院,南宁 530021)
目的构建融合蛋白SMP30-IP10真核表达质粒,并初步探究其对肝癌细胞株SK-hep1迁移、侵袭及增殖的影响。方法将肝癌细胞株SK-hep1分为两组,实验组转染pIRES-SMP30-IP10质粒,对照组转染空质粒pIRES;通过重叠PCR方法构建pIRES-SMP30-IP10真核表达质粒;采用脂质体转染法转染肝癌细胞SK-hep1;Western blotting法检测蛋白表达;Transwell法检测细胞的迁移和侵袭能力;CCK8法检测细胞增殖能力。结果通过PCR、双酶切及测序鉴定证实成功构建了真核表达质粒pIRES-SMP30-IP10,并在肝癌细胞株SK-hep1中正确表达。与对照组相比,实验组细胞迁移、侵袭能力下降(P均lt;0.05),但细胞形态及增殖能力均差异无统计学意义(P均gt;0.05)。结论成功构建了融合蛋白SMP30-IP10真核表达质粒,融合蛋白SMP30-IP10可抑制肝癌细胞的迁移、侵袭能力,但对细胞的增殖能力影响不明显。
肝肿瘤;融合蛋白;衰老标志蛋白30;干扰素诱导蛋白10;细胞迁移;细胞侵袭;细胞增殖
肝细胞癌(HCC)是世界范围内最常见的癌症,在癌症引起死亡中排名第三,晚期预后极差,具有高度转移性,中位生存期为6~9个月[1]。据研究发现,乙型肝炎病毒及丙型肝炎病毒是肝癌发生的一个危险因素,而发展中国家的肝炎病毒感染率较高[2]。其中我国广西地区是原发性肝癌的高发区,肝炎病毒的感染与肝癌的发生存在明显相关性[3]。而寻找有效的早期标志物及靶向治疗基因非常重要。干扰素诱导蛋白10(IP10,又名CXCL10)为ELR阴性的CXC亚家族的趋化因子,由INF-γ诱导树突状细胞、成纤维细胞、内皮细胞等多种细胞分泌,具有活化及趋化CXCR3阳性的NK细胞、T细胞等功能[4],在肿瘤组织中IP10表达增加可有效增强过继治疗的疗效[5]。此外IP10还能抑制血管生成,使肿瘤组织缺少营养而达到“饿死”肿瘤组织的功能[6]。人衰老标志蛋白30(SMP30,又名RGN)是本课题组早前研究较为深入的一个与肝癌发生发展有密切关系的抗肝癌基因。我们发现,SMP30在肝癌组织中的表达明显低于癌旁组织,且通过行为学发现过表达SMP30后的肝癌细胞株迁移及侵袭能力明显减弱[7]。为此我们考虑将两种兼具不同抗肝癌作用的基因融合成一个新的靶基因,制备兼具抑制肿瘤迁移侵袭、抑制肿瘤新生血管生成及活化募集免疫细胞等多方向联合抑制肝癌转移的抗癌因子,为肝癌的治疗提供新思路。
1 材料与方法
1.1 材料 肝癌SK-hep1细胞株、SMP30cDNA和IP10cDNA由本实验室保存,Trans1-T1 Phage Resistant Chemically Competent Cell购自北京全式金生物技术有限公司,真核表达载体pIRES2-Zs-Green1由黄元姣老师课题组惠赠。高保真PCR试剂盒、普通PCR试剂盒、实时定量荧光定量PCR试剂盒、DNA marker DL2000、DL5000、限制性内切酶EcoR Ⅰ、限制性内切酶XHO Ⅰ、T4连接酶等购自宝生物工程(大连)有限公司;无内毒素质粒小量提取试剂盒及胶回收试剂盒购自天根生化科技(北京)有限公司;无内毒素质粒大量提取试剂盒购自美国Omega Bio-Tek公司;琼脂粉购自生工生物工程(上海)股份有限公司;Lipofectamine3000 和Opti-MEM®Ⅰ购自美国 Invitrogen公司;DMEM高糖培养基购自美国HyClone公司;胎牛血清、含EDTA胰酶购自Gibco公司;鼠抗人α-Tublin 、HRP标记的山羊抗鼠二抗、HRP标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司;鼠抗人SMP30单抗购自美国Abcam;兔抗人IP10单抗购自美国CST公司;BeyoECL Plus、SDS-PAGE凝胶配制试剂盒、彩色预染蛋白质相对分子质量标准(10~180 kD)购自碧云天生物技术有限公司;Transwell 24孔板、Matrigel胶购自康宁公司;CCK8试剂盒购自日本同仁化学研究所。PCR仪购自德国 Biometra公司;荧光倒置显微镜购自奥林巴斯公司;全自动扫膜仪购自罗氏公司,FIRE READER 凝胶成像系统购自英国UVI公司;酶标仪购自伯乐公司。
1.2 实验分组 将肝癌细胞株SK-hep1分为两组,实验组转染pIRES-SMP30-IP10质粒,对照组转染空质粒pIRES。
1.3 SMP30-IP10真核表达质粒的构建 先分别扩增SMP30和Linker-IP10基因。SMP30正向引物:5′-CGCTCGAGATGTCTTCCATTAAGATTGA-3′,反向引物:5′-GGCTTCTGAGGCTTCGGCTTCTCCCGCATAGGAGTAGGG-3′;Linker-IP10正向引物:5′-CCCTACTCCTATGCGGGAGAAGCCGAAGCCTCAGA-AGCC-3′,反向引物:5′-GGAATTCTTAAGGAGATCT-TTTAGACCTTTCC-3′。其中在SMP30正向引物中加入酶切位点XHOⅠ,Linker-IP10反向引物中加入酶切位点EcoRⅠ,此外SMP30反向引物与IP10正向引物为互补序列。分别进行PCR,将PCR产物进行琼脂糖凝胶电泳后再进行切胶回收纯化,得到SMP30模板及Linker-IP10模板,进行overlap PCR以获得融合序列。具体实验步骤:第一步反应体系:SMP30和Linker-IP10各1 μL;PCR buffer:2.5 μL;NTP:2 μL;水:16.25 μL混匀后置于PCR反应仪中。95 ℃预变性5 min;95 ℃变性30 s;50 ℃退火30 s;72 ℃延伸30 s;共5个循环;72 ℃延伸5 min。第二步反应体系:在第一步反应体系基础上加入正、反向引物(SMP30正向引物及Linker-IP10反向引物)各1 μL;Taq酶:0.25 μL。95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s;共35个循环;72 ℃延伸5 min。PCR产物经XHOⅠ和EcoRⅠ双酶切后回收克隆入pIRES2-ZS-Green1的XHOⅠ和EcoRⅠ酶切位点间。转化入Trans T1感受态中,并让其在含50 μg/mL卡那霉素的琼脂平板中生长。挑选单克隆菌落扩大培养后进行菌液PCR及双酶切初步鉴定,接着将初步鉴定正确的菌液送测序。
1.4 表达融合蛋白SMP30-IP10的肝癌细胞株SK-hep1的构建 用含10%胎牛血清的DMEM培养SK-hep1细胞,并选取合适的G418筛选浓度。在转染前12 h用胰酶消化细胞,以4×105个细胞每孔接种于6孔板中,待细胞贴壁后用转染试剂Lipofectamine3000分别将空质粒pIRES2-ZS-Green1(以下简称pIRES)及重组质粒pIRES2-ZS-Green1-SMP30-IP10(以下简称pIRES-SMP30-IP10)转入SK-hep1细胞中。转染48 h后改用含400 μg/mL G418的培养基继续培养,以杀死未转染上质粒的细胞。
1.5 融合蛋白SMP30-IP10表达测定 用胰酶消化分别转染pIRES及pIRES-SMP30-IP10后的细胞,用PBS洗涤3次后用蛋白裂解液及蛋白酶抑制剂提取细胞中的总蛋白,冰上裂解30 min后,最高转速离心20 min,取上清,并用BCA试剂盒测定其蛋白浓度。配制12%分离胶及4%浓缩胶,每孔上样量为50 μg蛋白,进行SDS-PAGE电泳,选定所需区域蛋白转移至0.2 μm PVDF膜上。用0.5%脱脂奶粉封闭1 h后,用一抗SMP30-mAb(1∶1 500),一抗tublin-mAb(1∶5 000)4 ℃过夜孵育,TBST洗涤3次,每次10 min后用HRP标记的鼠二抗室温孵育1 h,再次洗涤3次后用ECL显影后进行扫膜观察,用膜再生液洗膜后再次封闭,以一抗IP10-mAb(1∶1 000)再次过夜孵育,再按以上步骤进行。
1.6 肝癌细胞迁移能力检测 采用Transwell法。SK-hep1-pIRES、SK-hep1-SMP30-IP10细胞用胰酶消化后用无血清DMEM重悬,进行细胞计数,将细胞密度调至1×105/mL,于Transwell上室中加入200 μL的细胞悬液,下室加入800 μL完全培养基放至细胞培养箱中培养24 h。24 h后去除上室中的液体,PBS洗涤3次,4%多聚甲醛中固定30 min风干,结晶紫染色30 min后用清水清洗2次,风干后于倒置显微镜下观察,随机选取5个100×视野,对细胞进行计数,计算平均值。
1.7 肝癌细胞侵袭能力检测 采用Transwell侵袭小室。SK-hep1-pIRES、SK-hep1-SMP30-IP10细胞胰酶消化后用无血清DMEM重悬,进行细胞计数,将细胞密度调至5×105/mL,于Transwell上室中加入Matrigel胶50 μL待其凝固后再加入的细胞悬液200 μL,下室加入完全培养基800 μL至细胞培养箱中培养24 h。去除上室中的液体,PBS洗涤3次,4%多聚甲醛中固定30 min风干,结晶紫染色30 min后用清水清洗2次,风干后于倒置显微镜下观察,随机选取五个100×视野,细胞计数取平均值。
1.8 肝癌细胞增殖能力检测 采用CCK8法。SK-hep1-pIRES、SK-hep1-SMP30-IP10细胞用胰酶消化后将细胞密度调至5×104/mL,于96孔板每孔加入细胞悬液100 μL,每组做5个复孔,并于96孔板边缘每孔加PBS 100 μL,分别培养24、48、72、96 h后每孔加入CCK8溶液10 μL,孵育2 h后用酶标仪于450 nm波长处测其吸光度值。

2 结果
2.1 重组真核表达质粒的鉴定 见图1。
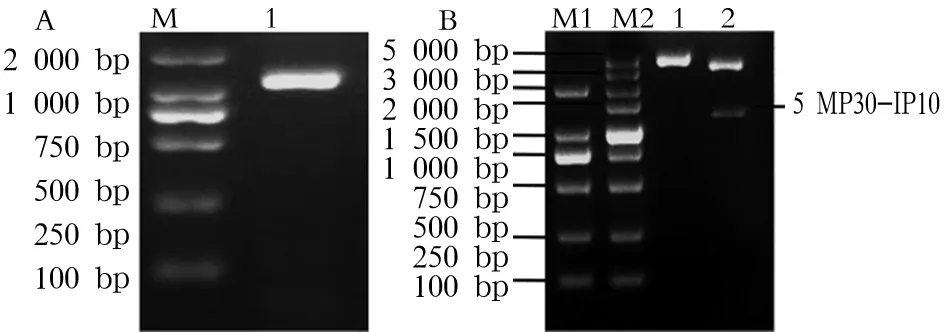
注:图1A:pIRES-SMP30-IP10 PCR鉴定结果。M:DNA Marker DL2000;1:SMP30-IP10 PCR产物。图1B:质粒酶切鉴定结果。M1:DNA Marker DL2000;M2:DNA Marker DL5000;泳道1:空质粒pIRES2-ZS-Green1;泳道2:被XHO Ⅰ和EcoR Ⅰ双酶切后的质粒pIRES-SMP30-IP10。
图1真核表达质粒pIRES-SMP30-IP10初步鉴定
2.2 稳定表达融合蛋白SMP30-IP10的肝癌细胞株构建 转染后SK-hep1细胞经含G418的培养基筛选7 d后,在荧光显微镜下观察到绿色荧光蛋白表达(图2),粗略计算转染效率约为80%。

注:A:转染空质粒pIRES后SK-hep1细胞荧光下图像(100×);B:转染pIRES后SK-hep1细胞白光下图像(100×);C:转染重组质粒pIRES-SMP30-IP10后SK-hep1细胞荧光下图像(100×);D:转染重组质粒pIRES-SMP30-IP10后SK-hep1细胞白光下图像(100×)。
图2细胞系构建图像
2.3 融合蛋白SMP30-IP10在SK-hep1细胞中的表达 对照组并未表达SMP30-IP10蛋白,而实验组有融合蛋白SMP30-IP10表达,相对分子质量约为43 kD,证明转染后能成功表达SMP30-IP10蛋白。
2.4 融合蛋白SMP30-IP10与肝癌细胞迁移、侵袭能力的关系 过表达融合蛋白SMP30-IP10后,肝癌细胞的迁移及侵袭能力下降,对照组、实验组迁移细胞数分别为(119.2±11)、(44.2±16.8)个/HP;对照组、实验组侵袭细胞数分别为(223.6±19.4)、(115±22.9)个/HP;两组比较,P均lt;0.05。
2.5 SMP30-IP10与肝癌细胞增殖能力的关系 0、24、48、72、96 h时点,实验组在450 nm处吸光度值分别为0.38±0.01、0.54±0.02、0.95±0.04、1.82±0.05、1.88±0.15,对照组分别为0.39±0.01、0.55±0.04、1.05±0.06、1.75±0.06、1.88±0.08,实验组与对照组相比,肝癌细胞的增殖能力并未下降,差异无统计学意义(P均gt;0.05)。
3 讨论
本研究构建了新型重组融合蛋白SMP30-IP10,为使两蛋白序列间起到充分的阻隔而不影响彼此间的蛋白功能,我们在序列间加入了一段柔性连接肽(Gly4Ser)3。构建融合蛋白有两种方法,其中之一是直接将两功能蛋白分子相连接,另一种则是通过在两分子间插入一段连接肽[8]。连接肽的选择在构建融合蛋过程中非常重要,其一可起到阻隔两多肽序列,使其不相互折叠缠绕而影响其彼此的蛋白活性;其二可使两者活性中心相远离,使其不易于形成空间位阻而影响蛋白活性。此外连接肽的长短,合适的氨基酸组成,柔性、疏水性等均与其阻隔两蛋白序列的功能有密切关系[9]。通过研究发现,Gly4Ser3得到较多实验者的青睐[10],而本次实验亦证实了(G4S)3起到了较好的阻隔作用,成功构建了真核表达载体pIRES2-ZSGreen1-SMP30-IP10,并在肝癌细胞株SK-hep1中成功表达融合蛋白SMP30-IP10。
本研究结果显示,实验组即过表达融合蛋白SMP30-IP10的SK-hep1细胞迁移、侵袭能力均较对照组下降,表明融合蛋白经连接肽的分隔后其中的SMP30蛋白活性并未受到影响,融合蛋白SMP30-IP10兼具抗肿瘤迁移、侵袭的功能,其抑制肿瘤迁移、侵袭可能与肿瘤微环境相关,但所涉及的相关通路尚未明确,仍需进一步研究。肝癌的发生发展与肿瘤细胞的免疫逃逸、肿瘤微环境、原癌基因与抑癌基因的稳态平衡相关。IP10是CXC家族中的一员,其受体是CXCR3,其中CXCR3分为两个亚型,分别是CXCR3A和CXCR3B,CXCR3B在人的血管内皮细胞中选择性表达,当IP10与血管上的CXCR3B结合后,通过其介导抑制IL-8和b-FGF诱导的新生血管生成,从而发挥抗血管生成作用[11]。此外,IP10作为趋化因子,其不仅能趋化淋巴细胞、自然杀伤细胞等至病灶区,且能刺激体内多种细胞因子(IL-12、IL-4、IL-10等)分泌,从而影响肿瘤微环境,影响肿瘤生长[12]。Wang等[13]研究发现,IP10能协同CTL细胞起到共同抑制肝癌的作用。在本实验中,融合蛋白对肝癌细胞株的增殖影响并不明显,我们考虑融合蛋白SMP30-IP10并非作用于自身的肝癌细胞中,而是通过影响肿瘤微环境的一个稳态,从而影响肝癌的发生发展。
近年来,越来越多的学者关注肿瘤微环境与肿瘤发生发展的关系。肿瘤微环境是由细胞外基质、肿瘤细胞、内皮细胞、免疫细胞、成纤维细胞等及其细胞因子共同构成的局部病理环境[14],其稳定性与肿瘤的增殖、凋亡、迁移、侵袭等密切相关。SMP30-IP10作为融合蛋白,兼具了IP10的趋化功能,通过影响肿瘤周围的细胞因子、抑制血管生成、募集免疫细胞等,从而达到抑制肿瘤转移的目的,但该功能仍需进一步验证。
[1] Song T, Zhang W, Wu Q, et al. A single center experience of sorafenib in advanced hepatocellular carcinoma patients: evaluation of prognostic factors[J]. Eur J Gastroenterol Hepatol, 2011,23(12):1233-1238.
[2] Sun C, Sun H, Zhang C, et al. NK cell receptor imbalance and NK cell dysfunction in HBV infection and hepatocellular carcinoma[J]. Cell Mol Immunol, 2015,12(3):292-302.
[3] Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014,60(6):2099-2108.
[4] Angiolillo AL, Sgadari C, Taub DD, et al. Human interferon-inducible protein 10 is a potent inhibitor of angiogenesis in vivo[J]. J Exp Med, 1995,182(1):155-162.
[5] Duan S, Song M, He J, et al. Folate-modified chitosan nanoparticles coated interferon-inducible protein-10 gene enhance cytotoxic T lymphocytes′ responses to hepatocellular carcinoma[J]. J Biomed Nanotechnol, 2016,12(4):700-709.
[6] Neville LF, Mathiak G, Bagasra O. The immunobiology of interferon-gamma inducible protein 10 kD (IP-10): a novel, pleiotropic member of the C-X-C chemokine superfamily[J]. Cytokine Growth Factor Rev, 1997,8(3):207-219.
[7] 庄园,李晓龙,郑顺心,等.SMP30对肝癌细胞行为学影响及其与糖代谢关系研究[J].基因组学与应用生物学,2017,(2):450-455.
[8] Argos P. An investigation of oligopeptides linking domains in protein tertiary structures and possible candidates for general gene fusion[J]. J Mol Biol, 1990,211(4):943-958.
[9] 闫璐颖,陈建华,张新国.融合蛋白连接肽的研究进展[J].生物技术,2008,18(3):92-94.
[10] Le GF, Reusch U, Little M, et al. Effect of linker sequences between the antibody variable domains on the formation, stability and biological activity of a bispecific tandem diabody[J]. Protein Eng Des Sel, 2004,17(4):357-366.
[11] Petrai I, Rombouts K, Lasagni L, et al. Activation of p38 MAPK mediates the angiostatic effect of the chemokine receptor CXCR3-B[J]. Int J Biochem Cell Biol, 2008,40(9):1764-1774.
[12] Wang P, Yang X, Xu W, et al. Integrating individual functional moieties of CXCL10 and CXCL11 into a novel chimeric chemokine leads to synergistic antitumor effects: a strategy for chemokine-based multi-target-directed cancer therapy[J]. Cancer Immunol Immunother, 2010,59(11):1715-1726.
[13] Wang X, Zhang FC, Zhao HY, et al. Human IP10-scFv and DC-induced CTL synergistically inhibit the growth of glioma in a xenograft mode[J]. Tumour Biol, 2014,35(8):7781-7791.
[14] Rarisardaa A, Melillo G. Role of the hypoxic tumor microenvironment in the resistance to anti-angiogenic therapies[J]. Drug Resist Updat, 2009,12(3):74-80.
ConstructionofeukaryoticexpressionplasmidcontainingfusionproteinSMP30-IP10anditseffectonmigration,invasion,andproliferationoflivercancercells
XIEMeiyu,GUOShunli,BINXiaoyun,SHIMingxia,CHENAnning,CHENSiyu,ZHOUSufang
(SchoolofPreclinicalmedicineofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo construct the eukaryotic expression plasmid of fusion protein SMP30-IP10, and to investigate its effects on migration, invasion, and proliferation of hepatoma cell line SK-hep1.MethodsThe SK-hep1 cells were divided into two groups: the experimental group which was transfected with pIRES-SMP30-IP10 plasmid, and the control group which was transfected with empty pIRES.The eukaryotic expression plasmid pIRES-SMP30-IP10 was constructed by overlapping PCR, and then we transfected the plasimd into hepatoma cell line SK-hep1 by liposome transfection; the protein expression of cells was detected by Western blotting; the migration and invasion of cells were detected by Transwell assay; the proliferation of cells was detected by CCK8.ResultsThe eukaryotic expression plasmid pIRES-SMP30-IP10 was successfully constructed and approved by PCR, double restriction enzyme digestion and DNA sequencing, and was expressed in hepatocellular carcinoma cell line SK-hep1. Compared with the control group, the migration and invasion were inhibited to some extent in the experimental group (bothPlt;0.05), but the morphology and proliferation had no significant change (bothPgt;0.05).ConclusionThe fusion protein SMP30-IP10 eukaryotic expression plasmid is successfully constructed, and it can inhibit the migration and invasion abilitiesof hepatoma cells, but has no effect on the cell proliferation.
liver neoplasms; fusion protein; senescence marker protein-30; interferon-inducible protein 10; cell migration; cell invasion; cell proliferation
10.3969/j.issn.1002-266X.2017.41.002
R735.7
A
1002-266X(2017)41-0005-04
国家自然科学基金项目(81460432,81572994);广西自然科学基金项目(2015GXNSFDA139017);广西科学研究与技术开发计划项目(15104001-7);广西南宁青秀区科学研究与技术开发计划项目(2014S03)。
谢美玉(1990-),女,研究生,主要研究方向为肝癌的早期诊断及其靶向治疗。E-mail:xiemeiyu113@126.com
周素芳(1964-),女,博士,教授,主要研究方向为肿瘤相关抗原分子生物学研究。E-mail:zsf200000@163.com
2017-08-10)
