1,2,4-噻二唑的合成及其在药物化学中的应用
2017-12-11夏强强袁江培边启龙詹宇鹏徐元清
柴 岭,夏强强,袁江培,边启龙,詹宇鹏,徐元清,徐 浩,陈 威
(河南大学 化学化工学院,河南 开封 475004)
1,2,4-噻二唑的合成及其在药物化学中的应用
柴 岭,夏强强,袁江培,边启龙,詹宇鹏,徐元清,徐 浩*,陈 威
(河南大学 化学化工学院,河南 开封 475004)
1,2,4-噻二唑是一类重要的杂环化合物. 独特的生物和生理活性使其在药物化学领域有着非常广泛的应用. 从简单底物出发,该类化合物的合成方法被不断报道. 其中,碘催化、光催化等合成方法以原料易得、简单高效、绿色无污染等优势,已经广泛地被应用于1,2,4-噻二唑的合成. 本文对1,2,4-噻二唑的合成方法以及在药物化学上的应用做了简要介绍.
1,2,4-噻二唑;杂环;合成;药物化学
1,2,4-噻二唑是一类重要的杂环化合物,具有独特的生物活性. 近年来,该类化合物在药物化学中的许多重要应用引起了人们的广泛关注. 虽然抗生素头孢唑兰[1]是唯一的商品化1,2,4-噻二唑类药物,但是具有生物活性的相关化合物远不止这一种[2-3]. 例如:2001年,FAWZI和MACDONALD等发现,噻二唑衍生物SCH-202676是一种很有前景的G-蛋白偶联受体变构调剂[4]. 1998年,DECKING和HARTMANN等发现 KC 12291 具有心脏保护作用[5-6]. 2002年,MARTINEZ和ALONSO等发现,噻二唑啉二酮(TDZD)可以作为ATP竞争性糖原合成酶激酶3β抑制剂[7]. 为了改善这些有趣的先导化合物的药理活性,研究者们合成出了许多1,2,4-噻二唑衍生物(见图1).
1,2,4-噻二唑在药物化学领域中作为药效团的应用,促进了该类杂环化合物合成方法学的发展. 本文总结了1,2,4-噻二唑类化合物较为实用的合成方法,并阐述了该类化合物在药物化学中的应用,最后对其合成方法学的发展作了进一步的展望.
1 1,2,4-噻二唑的合成方法
1.1 用腈和硫直接合成1,2,4-噻二唑
腈是一种重要的化工原料,广泛用于制造药物、合成纤维和塑料. 在三乙胺等碱的催化下,芳香腈1和硫在封管中加热反应可以得到对称取代的二芳基-1,2,4-噻二唑2[8]. 该反应原料简单. 但严苛的反应条件和过长的反应时间使该反应不适合大规模的制备(见图2).
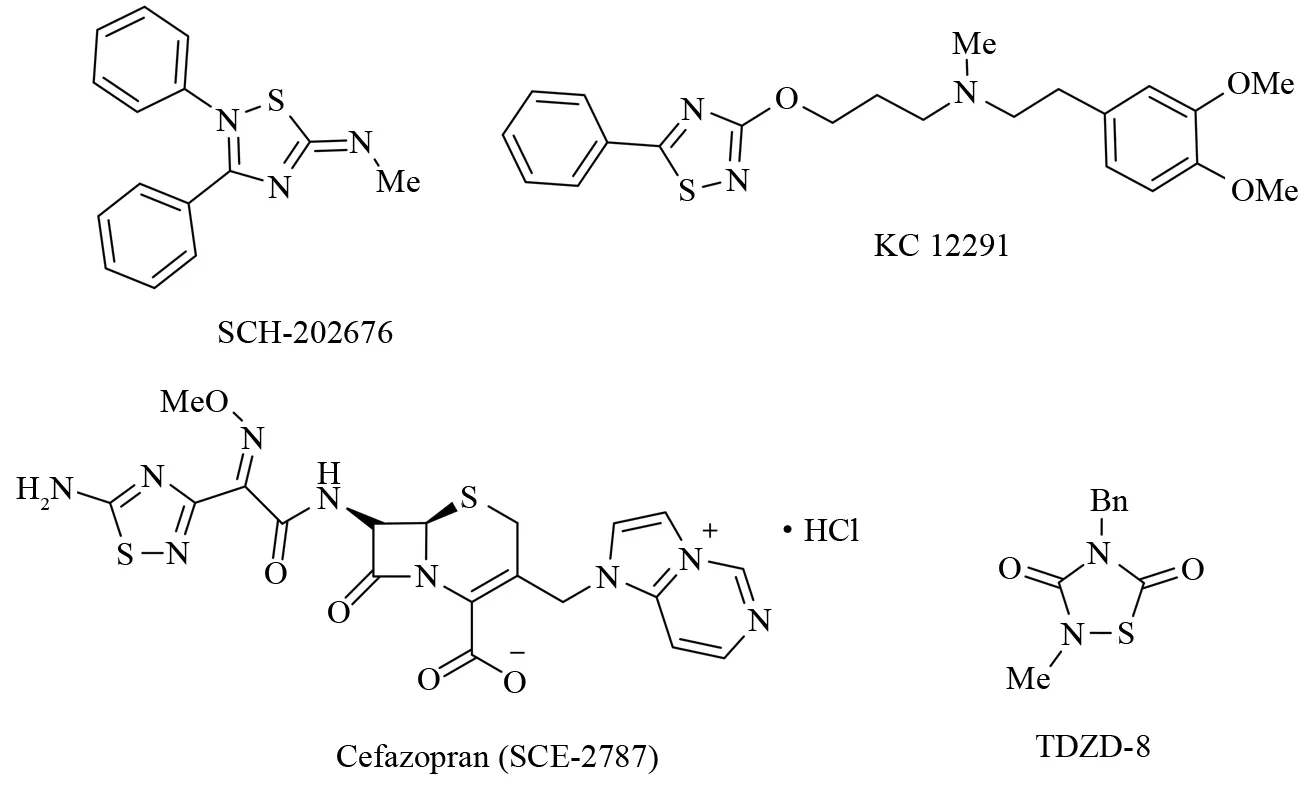
图1 一些含有1,2,4-噻二唑结构的化合物Fig.1 Some relevant structures with the 1,2,4-thiadiazole moiety
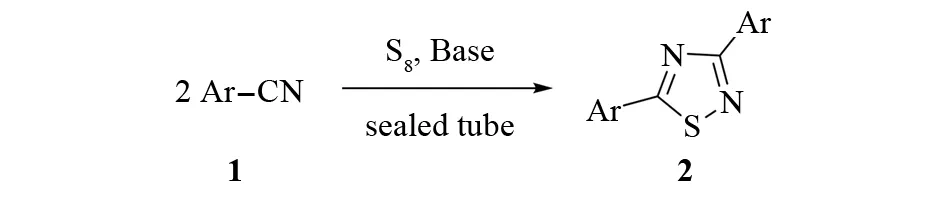
图2 用腈和硫直接合成3,5-二芳基噻二唑Fig. 2 Direct synthesis of 3,5-diaryl-1,2,4-thiadiazoles from nitriles and sulfur
1.2 硫代酰胺氧化二聚
硫代酰胺3氧化二聚作为1,2,4噻二唑合成的经典方法已经得到了广泛应用. 在一定条件下,用氧化剂如α-氯氰乙酸甲酯、二氯二氰基苯醌、硝酸铈铵、N-溴代丁二酰亚胺等,作用于硫代酰胺可以高效地得到对称取代的产物1,2,4-噻二唑(见图3). 这种方法条件温和,反应快,产率高. 近年来,不断有更加绿色、温和的反应条件被报道. 但是这类合成方法一般只能合成对称取代的3,5-二芳基-1,2,4-噻二唑,产物的类型比较单一.
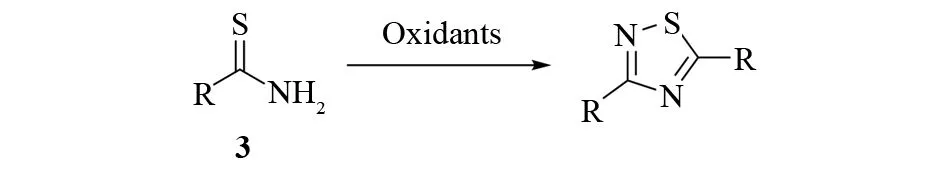
图3 硫代酰胺的氧化二聚Fig.3 Oxidative dimerization of thioamides
1.2.1 DMSO/亲电体体系实现的硫代酰胺氧化二聚
1985年,TAKIKAWA、SHIMADA等报道,在1-甲基-2-氯吡啶碘化物的作用下,用DMSO和硫代酰胺反应,可以高效地合成1,2,4-噻二唑[9](见图4). 进一步的研究发现,其他亲电试剂如苯甲酰氯、乙酰氯、盐酸、三甲基氯硅烷等,都可以催化这个反应.

图4 DMSO/亲电体介导的氧化环化Fig.4 DMSO/electrophiles mediated oxidative cyclization of thioamides
为了了解这个反应的机理,他们做了机理验证实验. 首先,他们分离出了该反应涉及的中间体硫酰胺硫氧化物. 然后他们发现,硫酰胺硫氧化物和NBS反应,发现同样可以生成1,2,4-噻二唑. 基于此,他们认为,这类反应首先由亲电试剂和DMSO反应生成一个关键的中间体硫鎓离子4,4再和硫代酰胺发生一系列反应得到目标产物(见图5).
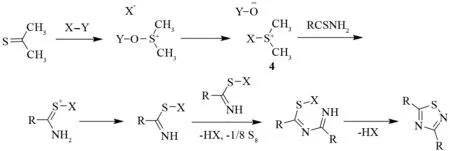
图5 DMSO/亲电体氧化硫代酰胺二聚的可能机理Fig.5 Plausible mechanism of oxidative dimerization of thioamides by DMSO/eletrophiles
1.2.2 曙红Y催化的氧化反应
曙红Y5是一种价廉又能很好吸收可见光的染料,常用于可见光驱动的光氧化还原反应. 2013年, SRIVASTAVA、ARVIND等报道了可见光催化的1,2,4-噻二唑的合成方法[10]. 他们向硫代酰胺的DMF溶液中加入催化量的曙红Y,然后用18 W家用复合荧光灯(CFL)照射反应混合物,室温下在空气中搅拌4~6 h,得到了1,2,4-噻二唑,并且产率都在70%以上(见图6). 温和的反应条件使这个反应具有更高的官能团容忍度. 该反应以廉价易得的氧气为氧化剂,以可见光为能源,与传统的合成方法相比具有更大的应用价值.
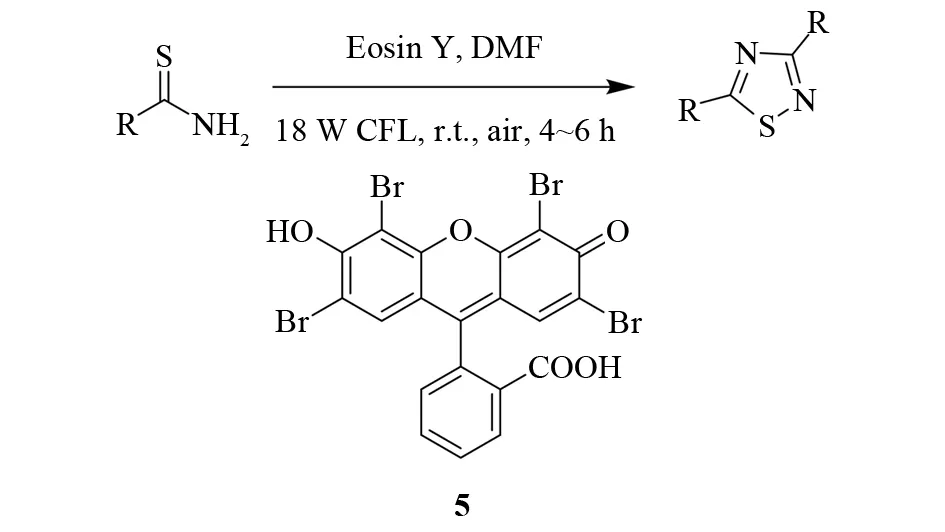
图6 曙红Y催化的氧化反应Fig.6 Eosin Y catalyzed oxidative reaction
1.2.3 磷钼钒杂多酸催化的硫酰胺二聚
杂多酸是由杂原子(P、Si、Fe、Co等)和金属原子(如Mo、W、V、Nb、Ta等)按特定的结构通过氧原子配位桥联组成的一类含氧多酸,是具有酸性和氧化还原性的绿色多功能催化剂,近年来开始被应用于有机合成. 2014年,YAJIMA、YAMAGUCH等首次报道了用磷钼钒杂多酸(H6PV3Mo9O40)催化的硫代酰胺二聚关环反应[11](见图7).
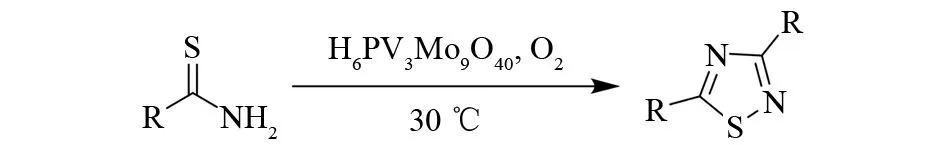
图7 磷钼钒杂多酸催化的硫酰胺二聚Fig.7 Heteropoly acid catalyzed dimerization of thioamides
该反应成功地将杂多酸用于催化1,2,4-噻二唑的合成,是一种新颖的杂环合成反应. 与上述反应相同的是,该反应也使用廉价易得的氧气做氧化剂. 另外,该反应除了硫之外,不会生成其他的副产物,几乎不会造成环境污染,是一种绿色合成方法.
1.3 硫脲的氧化二聚
像硫代酰胺一样,N-取代硫脲在一定条件下也会发生自聚. 实际上,二元硫脲混合物的氧化是通过分子内杂环化反应制备不对称1,2,4-噻二唑衍生物的通用方法[12]. 最近,3,5-二氨基-1,2,4-噻二唑7已经可以用更加绿色、温和的氧化剂二酰氧基碘苯氧化硫脲6得到[13](见图8).
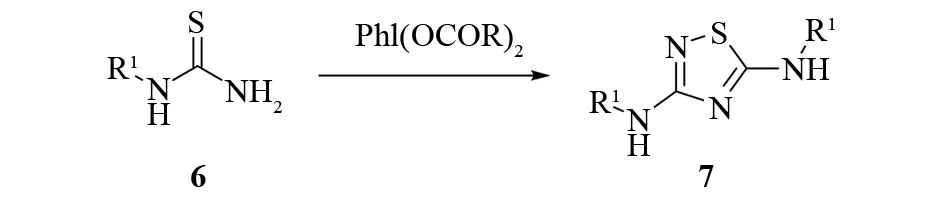
图8 3,5-二氨基-1,2,4-噻二唑的合成Fig.8 Synthesis of 3,5-diamino-1,2,4-thiadiazoles
1.4 N-硫代酰基脒及其衍生物的氧化关环
N-硫代酰基脒及其衍生物的氧化关环是合成不对称取代1,2,4-噻二唑的重要方法. 这类反应速度快、没有副反应,并且底物上的取代基变化多样,因此可以合成更加多样性的1,2,4-噻二唑衍生物[14]. 这类底物主要有三种类型:N-硫代酰基脒8、N-硫代酰基胍9和N-硫代氨甲酰基脒11.
1.4.1 N-硫代酰基脒
N-硫代酰基脒8的氧化关环是合成带有氨基取代基的1,2,4-噻二唑的重要方法(见图9). 首先,由腈和硫代酰胺在酸性条件下反应生成N-硫代酰基脒8,然后在特定的条件下发生氧化关环. 所使用的氧化剂包括溴、硝酸、过氧化氢/高氯酸等[15]. 该反应速率快,无副反应,并且具有很高的收率,是一种很实用的1,2,4-噻二唑合成方法.
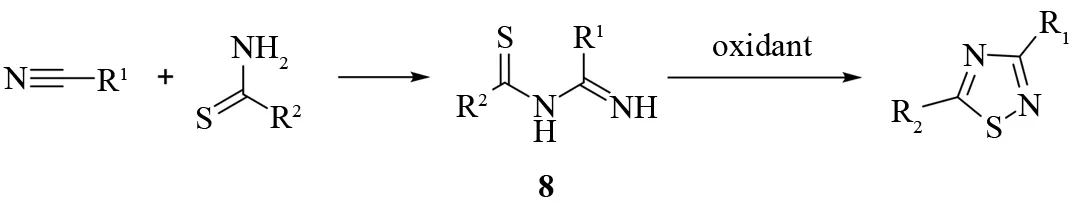
图9 N-硫代酰基脒的氧化关环Fig.9 Oxidative cyclization of N-thioacylamidines
1.4.2 N-硫代酰基胍
1970年GOERDELER和MERTENS报道,在吡啶中用五硫化磷处理酰基胍,生成硫代酰基胍9后,向产物的乙醇溶液中加入溴的氯仿溶液,可以得到一系列3-氨基1,2,4-噻二唑10[16]. 但这种方法的底物范围较窄,只对5位是苄基或芳基的噻二唑有制备意义(见图10).
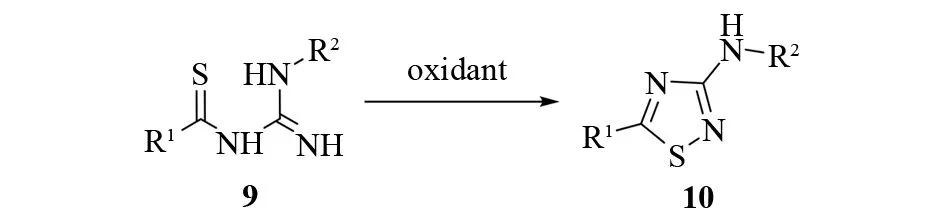
图10 N-硫代酰基胍的氧化关环Fig.10 Oxidative cyclization of N-thioacylguanidines
1.4.3 N-硫代氨基甲酰基脒
N-硫代氨甲酰基脒11一般由取代硫脲和氨基腈或碳二亚胺反应得到. 在一定的条件下,用合适的氧化剂氧化这个中间体,可以合成对称和不对称取代的3,5-二氨基-1,2,4-噻二唑12(见图11). 有多种氧化剂可供选择,如过氧化氢、溴、DEAD等[17-19]. 其中,过氧化氢和溴的使用要在酸性条件下进行. DEAD可以在中性的醇溶液中将脒代硫脲氧化,减少了副产物的生成,是一种更温和的试剂.
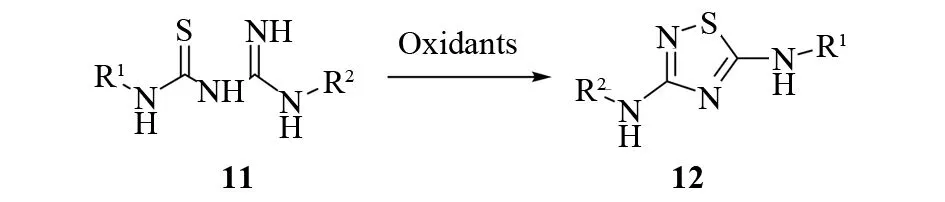
图11 N-硫代氨甲酰基脒的氧化关环Fig.11 Oxidation cyclization of N-aminothioformylamidines
1.4.4 铜催化的硫代氨基甲酰基脒的氧化
使用传统的氧化剂如溴分子、DEAD、DIAD、NBS、过氧化氢等合成氨基噻二唑时,不可避免地会造成原料的浪费、生成较多的副产物或者需要麻烦的后处理. HA-YOUNG KIM、SE HUN KWAK 等报道的铜催化氧化避免了上述问题. 在铜的催化下,仅用氧气就可以顺利实现从硫代氨基甲酰基脒到1,2,4-噻二唑的转化且具有较广的底物范围[20](见图12).
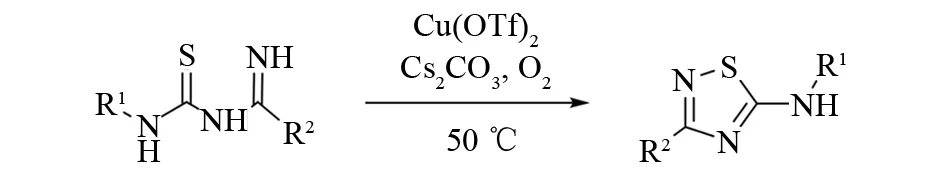
图12 铜催化合成1,2,4-噻二唑Fig.12 Copper catalyzed synthesis of 1,2,4-thiadiazoles
该反应还能以一锅煮的方式进行(见图13). 为了合成1,2,4-噻二唑,可以直接将盐酸脒13、异硫氰酸酯14和碳酸铯加入到溶剂中,再缓慢地加入催化量(5%)的Cu(OTf)2,然后在氧气气氛中加热反应. 用一锅怼的方法,不仅大大提高了总产率(45%~83%),并且使本来不能生成产物的盐酸乙脒顺利地发生了反应.
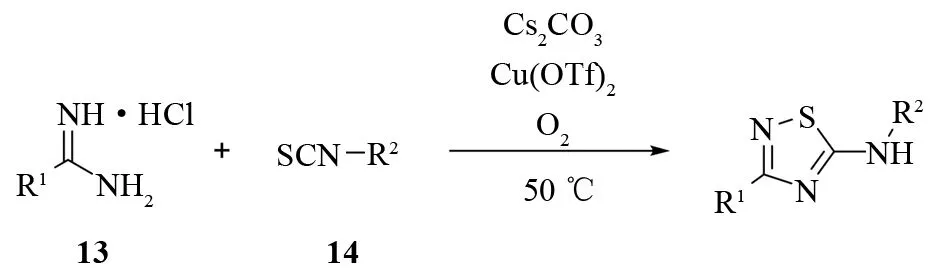
图13 铜催化1,2,4-噻二唑的一锅合成Fig.13 Copper catalyzed one-pot synthesis of 1,2,4-thiadiazoles
1.4.5 N-硫代酰基-N′,N′-二甲基脒
YANG和LANG等报道了一种以N-硫代酰基N′,N′-二甲基脒为底物合成1,2,4-噻二唑的方法[21]. 他们首先用N,N-二甲基酰胺15合成中间体N′-硫代芳酰基N,N-二甲基脒16,然后中间体在0 ℃和MSH或HSA反应生成1,2,4-噻二唑(见图14).
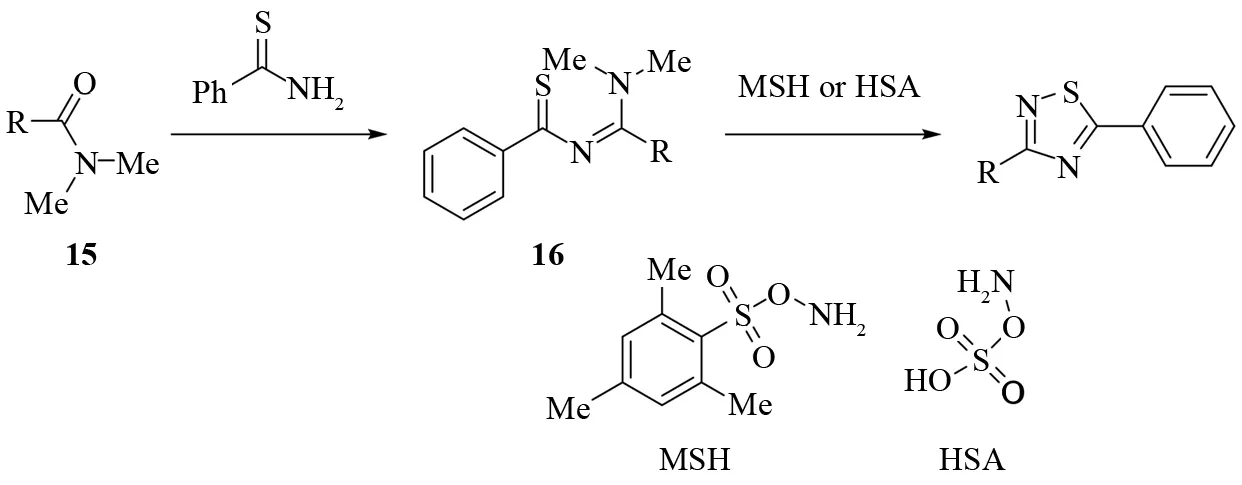
图14 由N-硫代酰基-N′,N′-二甲基脒合成1,2,4-噻二唑Fig.14 Synthesis of 1,2,4-thiadiazoles from N-thioacyl-N′,N′-dimethylamidines
使用这个方法不仅可以合成二烃基取代的噻二唑,而且可以以硫代氨基甲酰基为前体合成5-氨基噻二唑,并且产率都在75%以上,该方法是一种很实用的不对称取代1,2,4-噻二唑的合成方法.
1.5 由脒直接合成1,2,4-噻二唑
脒和二硫化碳在甲醇钠的催化作用下,在甲醇中回流可以得到5-巯基-1,2,4-噻二唑[22]. 硫对这个反应是关键的,没有硫则会生成硫代酰胺和硫氰酸脒. 以苯甲脒为例,将苯甲脒、二硫化碳、硫、甲醇钠的混合物加热回流6 h可以以88%的收率生成5-巯基-3-苯基-1,2,4-噻二唑17(见图15).
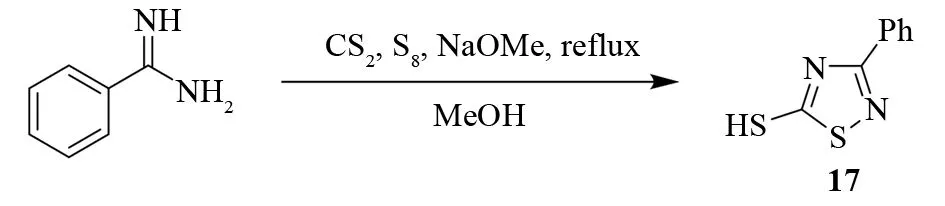
图15 由苯甲脒合成3-苯基-5-巯基-1,2,4-噻二唑Fig.15 Synthesis of 5-mercapto-3-phenyl-1,2,4-thiadiazole from benzamidine
GOERDELER和GROSCHOPP报道,盐酸脒和四氯甲硫醇18在氢氧化钠的存在下可以高效地合成5-氯-1,2,4-噻二唑19(见图16),产率在40%~70%之间[23]. 通过芳香亲核取代反应,可进一步合成一系列1,2,4-噻二唑衍生物.
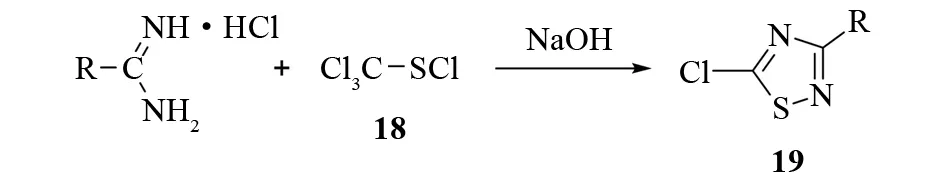
图16 由盐酸脒和四氯甲硫醇合成5-氯-1,2,4-噻二唑Fig.16 Synthesis of 5-choro-1,2,4-thiadiazoles from amidine chlorides and perchloro Methyl mercaptan
该反应在氮杂环合成上得到了广泛的应用,是制备5-卤代-1,2,4-噻二唑衍生物的重要方法. 1974年,HOWE和FRANZ等[24]通过这种方法,以醋酸脒和四氯甲硫醇为底物反应合成了3-(2,2-二氯-1,1-二氟)-5氯-1,2,4-噻二唑20(见图17).
EUGENE和HANS等发明了一种用四氯乙脒21和黄原酸盐合成3-三氯甲基-5-烷氧基-1,2,4-噻二唑的方法[25]. 例如:冰浴下,在四氢呋喃中将四氯乙脒和等当量的黄原酸钾22混合后搅拌过夜,能以85%的产率合成3-三氯甲基-5-乙氧基-1,2,4-噻二唑23(见图18).
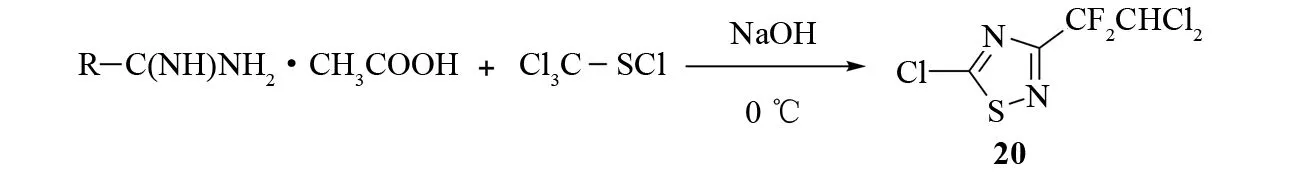
图17 由醋酸脒合成3-(2,2-二氯-1,1-二氟)-5氯-1,2,4-噻二唑Fig.17 Synthesis of 5-chloro-3-(2,2-dichloro-1,1-difluoroethyl)-1,2,4-thiadiazole from amidine acetate
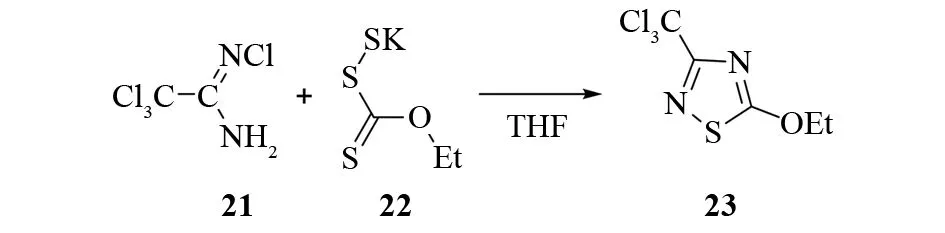
图18 由N-氯代三氯乙脒和黄原酸钾合成3-三氯甲基-5-乙氧基-1,2,4-噻二唑Fig.18 Sythesis of 5-ethoxy-3-(trichloromethyl)-1,2,4-thiadiazole
1.6 由二硫代亚胺基碳酸盐合成1,2,4-噻二唑
硫代碳酸盐也是一种重要的噻二唑合成前体. 用N-氰基或N-乙氧羰基硫代亚胺基碳酸盐分别和卤化试剂、氯胺反应可以制备3-卤、3-氨基和3-羟基-1,2,4-噻二唑[25-27].
1.6.1 亚胺基二硫代碳酸盐
亚氨基二硫代碳酸盐24和卤化剂如氯、溴、磺酰氯、五氯化磷等作用会发生关环反应,生成3-卤代-5-硫基-1,2,4-噻二唑25. 反应溶剂通常是卤代烃、水、醇等[26](见图19). 硫代-1,2,4-噻二唑26在适当氧化剂的作用下,如过氧化氢的乙酸酐或冰乙酸溶液,可以很容易地转化为5-亚磺酰基或5-磺酰基噻二唑27(见图20).
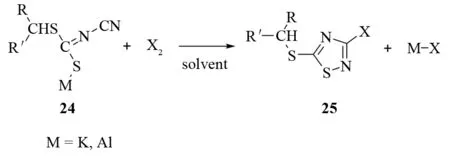
图19 由亚胺基二硫代碳酸盐合成3-卤代-5-硫基-1,2,4-噻二唑Fig.19 Synthesis of 3-choro-5-organothio-1,2,4-thiadiazoles from imino-dithiocarboxylates
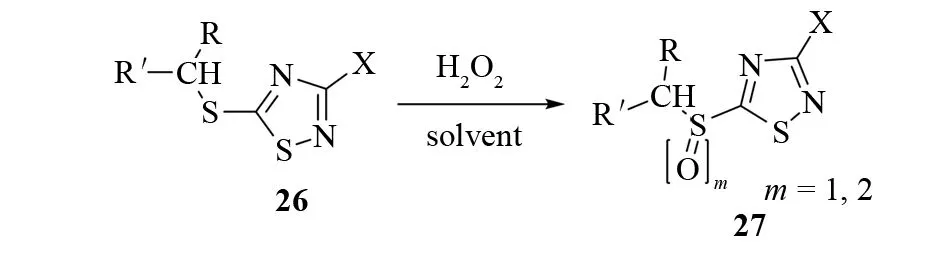
图20 过氧化氢氧化5-硫基-1,2,4-噻二唑生成5-亚磺酰基或5-磺酰基-1,2,4-噻二唑Fig.20 Transformation from 5-organothio-1,2,4-thiadiazoles to 5-sulfinyl of 5-sulfonyl-1,2,4-thiadiazoles under oxidation of hydrogen peroxide
1.6.2 N-乙氧羰基亚胺基硫代碳酸盐
N-乙氧羰基亚胺基硫代碳酸盐29是一种重要的有机合成中间体,可用于合成多种含硫杂环. 以N-乙氧羰基亚胺基硫代碳酸盐为底物合成1,2,4-噻二唑,主要有两种方法:一种是Delitsch报道的由氯甲酸乙酯、硫氰酸铵在醇溶液中的反应. 另一种更简单的合成方法是N-乙氧羰基异硫氰酸酯和醇的缩合[28].
LAURENT 和 JACQUES首先用甲醇钠的甲醇溶液处理N-乙氧羰基亚胺基硫代碳酸酯或酰胺28得到相应的钠盐. 然后再和氯胺发生缩合关环反应得到3-羟基-1,2,4-噻二唑30[29]. 该方法可以合成5位是烷氧基、烷硫基、二甲氨基等多种取代类型的1,2,4-噻二唑(见图21).
1.7 1,3-偶极环加成反应
硫化腈31是一种线性的高反应活性的1,3-偶极体,由含有C=N-S键的杂环化合物在热解、微波辅助热解和光解等反应中产生(见图22)[30]. 由于硫化腈很不稳定,所以该类化合物作为有机合成中间体通常不分离直接参加下一步反应.
1976年,ROBERT、TERRY等报道了一种合成3-芳基-1,2,4-噻二唑-5-羧酸酯32的高效方法[31]. 他们通过加热回流使1,3,4-恶噻唑就地产生1,3-偶极体31. 然后偶极体被过量的腈捕获发生1,3-偶极环加成反应. 通过使用不同的底物,他们合成了包括3-烷氧羰基-1,2,4-噻二唑、5-烷氧羰基-1,2,4-噻二唑在内的一系列杂环化合物(见图23). 另外,硫化腈和酰基腈之间的偶极环加成为5-酰基-1,2,4-噻二唑33的合成提供了一个实用的制备方法[32]. 硫化腈参与的1,3-偶极环加成反应一般需要高活性的亲1,3-偶极体,如氰乙酸乙酯、对甲苯磺酰腈或酰基腈[33](见图24).
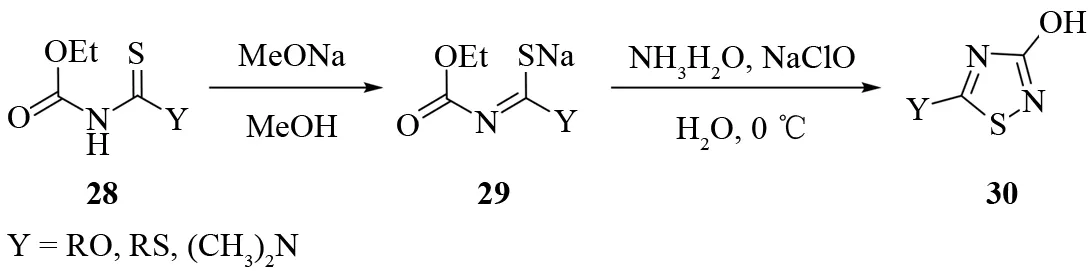
图21 由N-乙氧羰基亚胺基硫代碳酸盐合成3-羟基-1,2,4-噻二唑Fig.21 Synthesis of 3-hydroxy-1,2,4-thiadiazoles from N-ethoxycarbonyliminothiocarboxylates
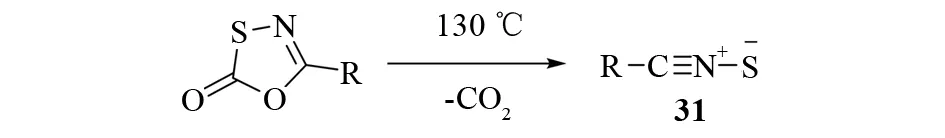
图22 杂环裂解生成1,3-偶极体Fig.22 Formation of 1,3-dipoles by cleavage of heterocycles

图23 1,3-偶极环加成反应合成1,2,4-噻二唑Fig.23 Synthesis of 1,2,4-thiadiazoles by 1,3-cycloaddition reaction
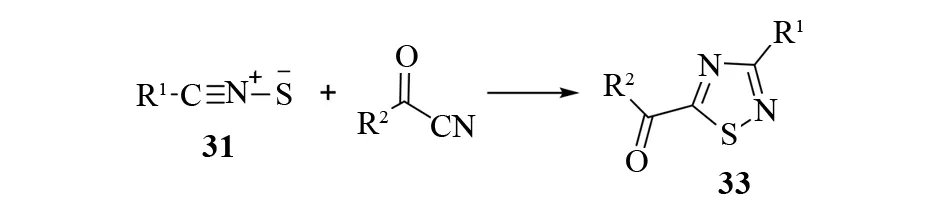
图24 1,3-偶极环加成反应合成1,2,4-噻二唑Fig.24 Synthesis of 5-acyl-1,2,4-thiadiazoles by 1,3-cycloaddition reaction
1.8 三组分串联反应
合成不对称的二芳基-1,2,4-噻二唑一直都是一个难题. 2016年,XIE等报道了通过三组分串联反应构建不对称1,2,4-噻二唑的方法[34]. 起初,他们以2-甲基喹啉34、盐酸苯甲脒、硫为底物,碱性条件下,在DMSO中加热反应,以较高的产率合成了一系列3-苯基-5-喹啉-2-基-1,2,4-噻二唑35,产率最高达到92%(见图25). 后来,他们将底物2-甲基喹啉换为芳香醛,在相同条件下同样可以生成1,2,4-噻二唑,虽然收率不是很理想(见图26).
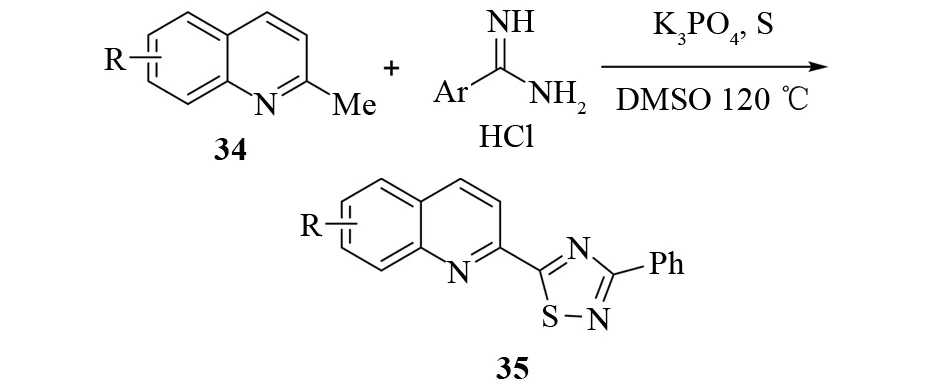
图25 2-甲基喹啉、脒和硫的一锅串联反应Fig.25 Domino reaction of 2-methylquinolines, amidines, and sulfur
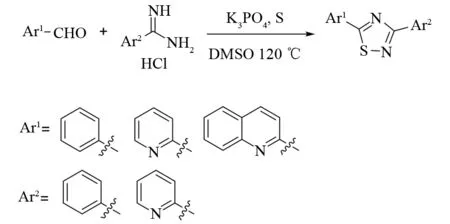
图26 醛、脒和硫的一锅串联反应Fig.26 Domino reaction of aldehydes, amidines, and sulfur
他们提出了如图27所示的反应机理. 首先,2-甲基喹啉在硫和碱的作用下脱氢产生自由基中间体36.36和苯甲脒偶联形成中间体37.37亲核进攻硫生成38.38重排后,接着发生分子内亲核进攻反应生成噻二唑啉39. 最后,噻二唑啉被硫氧化而得到1,2,4-噻二唑.
1.9 碘催化或碘辅助的氧化反应
氧化N-H键和S-H键生成N-S键是一种原子经济性较高的1,2,4-噻二唑合成方法. 氧化剂主要包括铜催化的脱氢环化、PIFA、过氧化氢、溴等. 与传统的氧化条件比较,碘催化的氧化反应具有环境友好、较弱的氧化力、廉价易得、便于处理等优势,近年来在有机合成中得到了广泛的应用.
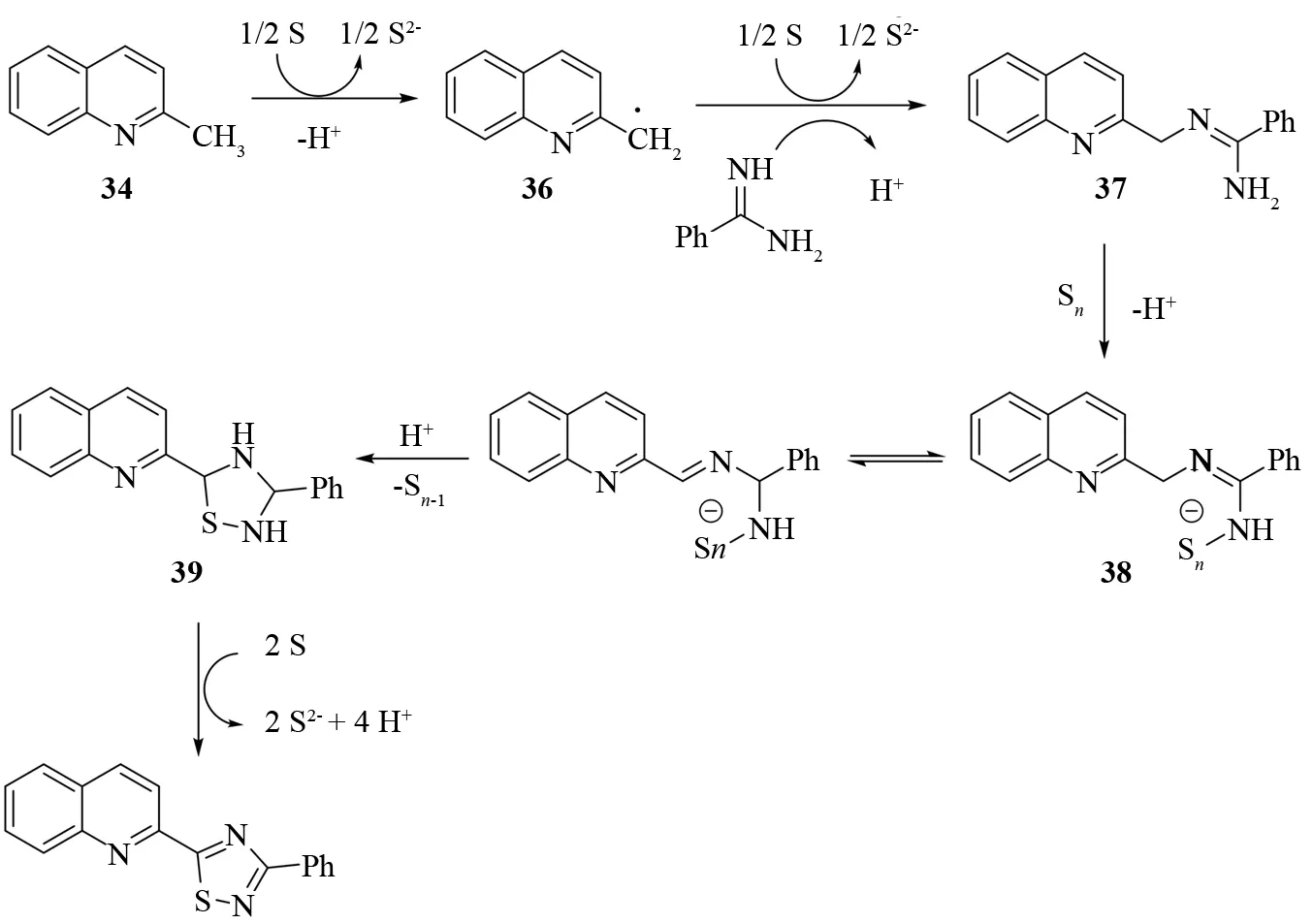
图27 2-甲基喹啉、脒和硫的一锅串联反应的反应机理Fig.27 Mechanism of domino reaction of 2-methylquinolines, amidines, and sulfur
2017年,NAGARAJU和NAGESH等报道了碘催化下,以脒或2-氨基吡啶和异硫氰酸酯为底物,合成5-亚胺基-苯并-1,2,4-噻二唑40或3,4,5-三取代-1,2,4-噻二唑41的方法[35](见图28). 该方法具有宽广的底物范围和较高的官能团容忍度:带有卤素、三氟甲基、甲氧基、硝基等的底物都能顺利发生反应. 碘催化反应用催化量的碘作为催化剂,氧化条件温和,并且避免了过渡金属的使用,是一种非常实用的三取代-1,2,4-噻二唑合成方法.
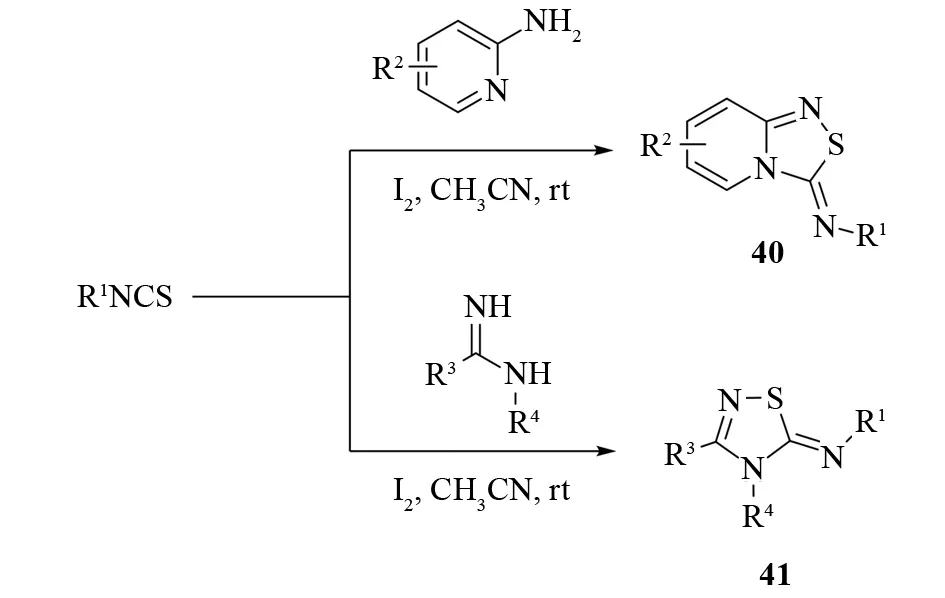
图28 碘催化合成5-亚胺基-1,2,4-噻二唑Fig.28 Iodine catalyzed synthesis of 5-imino-1,2,4-thiadiazoles
基于对反应机理的研究和已有的研究报道,他们提出了如图29所示的反应机理. 首先,2-氨基吡啶在碘的作用下被活化,然后活化的2-氨基吡啶对异硫氰酸酯亲核进攻得到中间体42,最后,NH基团对硫原子进行分子内亲核进攻得到相应的1,2,4-噻二唑衍生物.
同年,WANG等报道了一个碘辅助合成氨基取代的1,2,4-噻二唑的反应[36](见图30). 他们发现,N-硫代氨基甲酰基脒或N-硫代氨基甲酰基胍在1.2个当量碘的作用下会脱氢形成N-S键,而碳酸钾的加入能大幅度的提高反应收率. 该反应条件温和、操作简便、反应快(15 min). 通过该方法,不仅可以合成5-氨基-1,2,4-噻二唑43,而且还能合成N3和N5-对称取代或N3和N5-不对称取代的1,2,4-噻二唑44. 该方法为氨基噻二唑提供了一个更具通用性和可调控性的合成方法,对药物化学研究有重要意义.
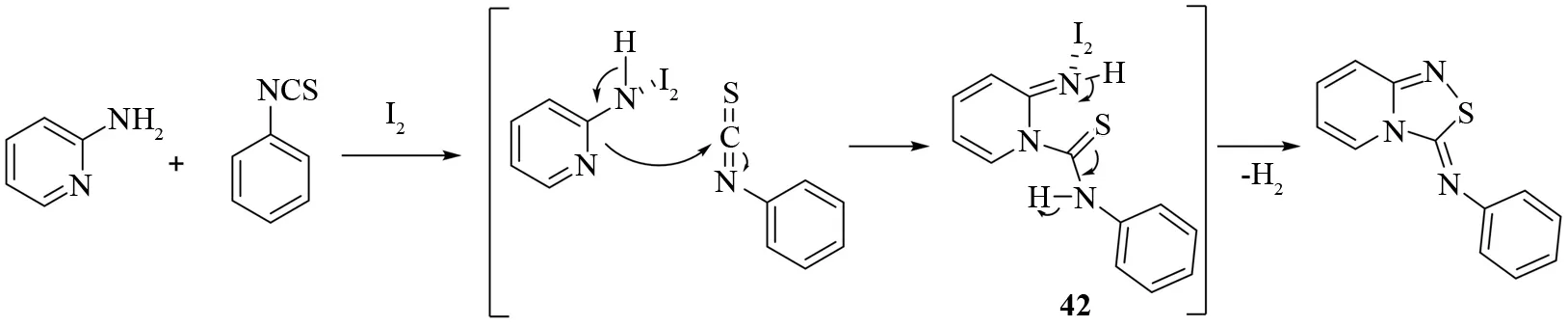
图29 碘催化合成5-亚胺基1,2,4-噻二唑的反应机理Fig.29 Mechanism of iodine catalyzed synthesis of 5-imino-1,2,4-thiadiazoles
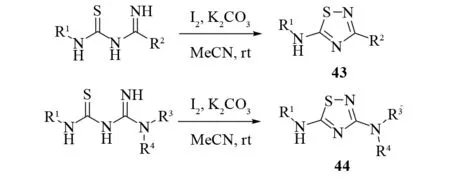
图30 碘辅助合成1,2,4-噻二唑Fig.30 Iodine meadiated synthesis of 1,2,4-thiadiazoles
可能的反应机理如图31所示. 底物在碱的作用下发生碘代生成碘代物种45. 然后在碘代物中的S-I键裂解的同时,发生分子内SN2′亲核取代反应,继而生成季铵离子46. 最后,季铵离子在碱的作用下脱氢生成目标产物.
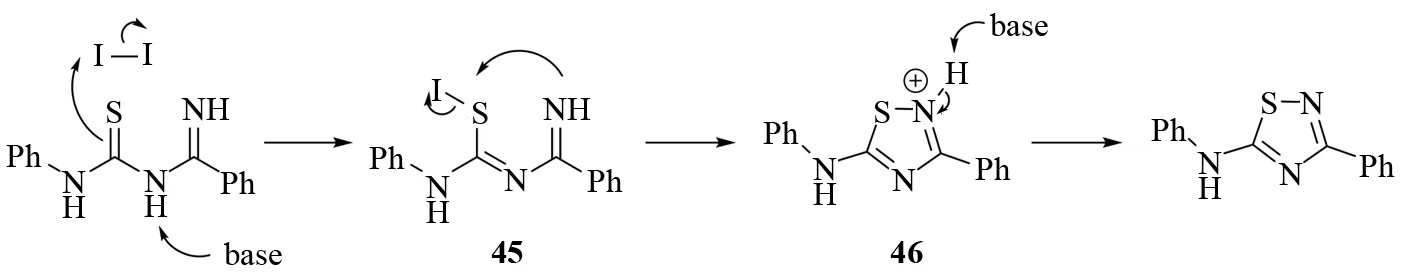
图31 碘辅助合成1,2,4-噻二唑的反应机理Fig.31 Mechanism of iodine meadiated synthesis of 1,2,4-thiadiazoles
1.10 热解和重排
氮杂五元环发生热重排反应可以得到一系列3-烷基-5-氨基-1,2,4-噻二唑衍生物. 硫化腈和对甲苯磺酰腈反应首先会生成一个关键的中间体47. 然后用氨基取代对甲苯磺酰基即可得到5-氨基-3取代-1,2,4-噻二唑48(见图32)[33]. 另一种合成1,2,4-噻二唑的类似方法是1-硫代氨基甲酰基-5-苯基-四氮唑49加热裂解重排(见图33)[37].
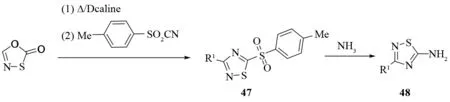
图32 恶噻二唑热解合成5-氨基-1,2,4-噻二唑Fig.32 Synthesis of 5-amino-1,2,4-thiadiazoles by thermolysis of oxathiadiazole
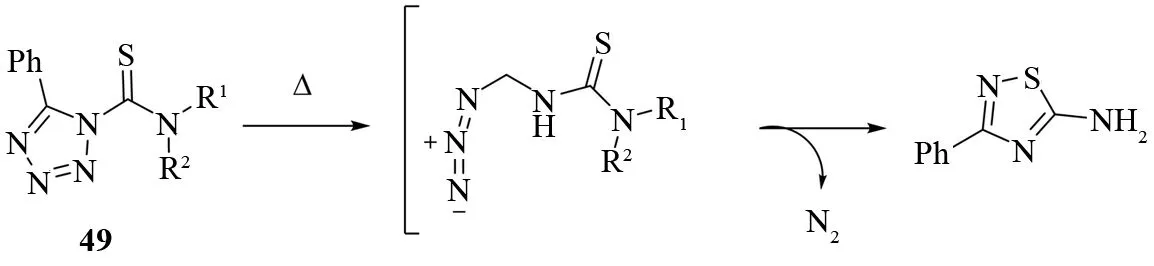
图33 四氮唑裂解合成5-氨基-1,2,4-噻二唑Fig.33 Synthesis of 5-amino-1,2,4-thiadiazoles by thermolysis of terazoles
用异恶唑50和就地生成的异硫氰酸酯反应可以制备2-[5-(烷氧羰基)氨基-1,2,4-噻二唑-3-基]乙酸甲酯52. 异恶唑和异硫氰酸酯先反应生成中间体硫脲衍生物51,然后发生重排反应生成终产物52[38](见图34).
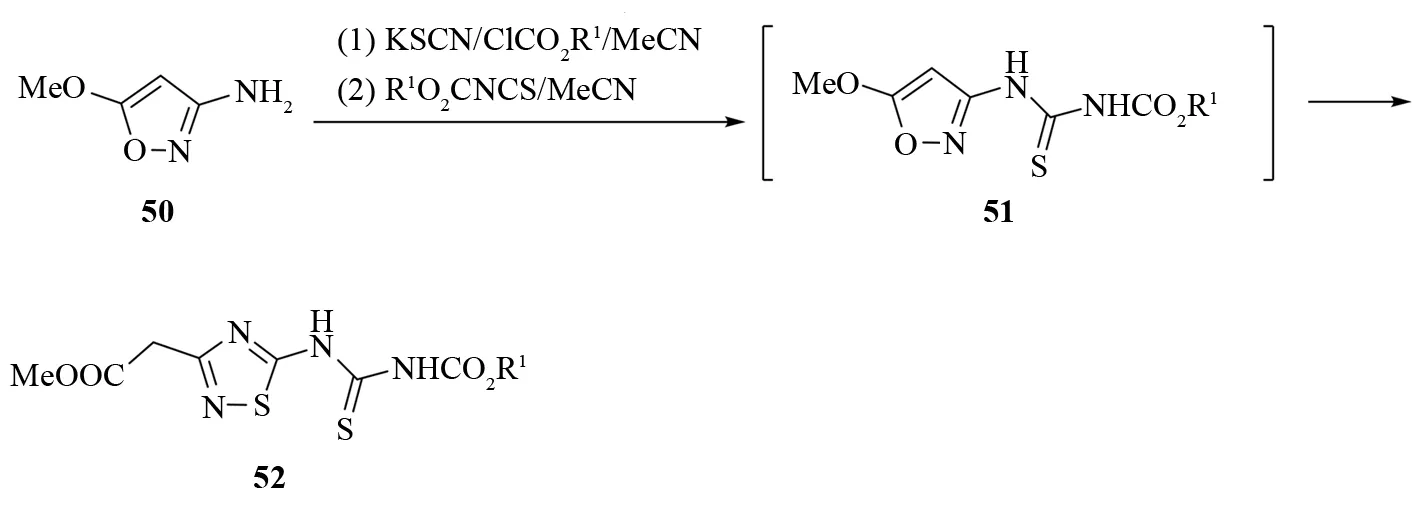
图34 通过重排反应合成2-[5-(烷氧羰基)氨基-1,2,4-噻二唑-3-基]乙酸甲酯Fig.34 Synthesis of methyl 2-(5-alkoxycarbonylamino-1,2,4-thiadiazol-3-yl)acetates through skeletal rearrangement
MOLOTOV等报道,在质子性溶剂中加热回流4-氨基-1,2,5-恶二唑-2-氧化物53和乙氧羰基异硫氰酸酯的混合物,会生成3-乙氧羰基硫脲基-1,2,5-恶二唑-2-氧化物54.54会立即发生重排反应生成5-氨基-(α-硝基烷基)-1,2,4-噻二唑55[39](见图35).
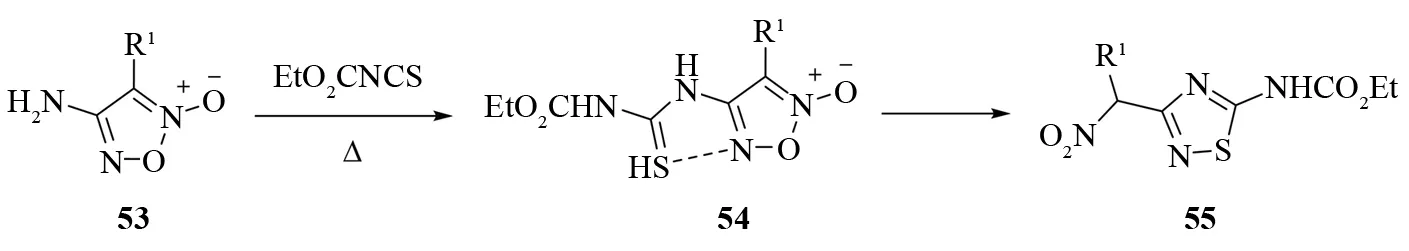
图35 3-乙氧羰基硫脲基-1,2,5-恶二唑-2-氧化物的重排Fig.35 Thermal rearrangement of 3-substituted 4-(3-ethoxycarbonylthioureido)-1,2,5-oxadiazole 2-oxides
含N-O键的五元杂环的光诱导分子重排反应为5-苯基-3-取代-1,2,4-噻二唑的合成提供了有趣的合成方法学. 光照5-氨基-3-苯基-1,2,4-恶二唑56和硫脲的混合物可以得到化合物57(见图36)[40]. 反应的可能机理是1,2,4-恶二唑在光照下发生裂解,然后裂解产物和硫试剂反应形成N-S键.
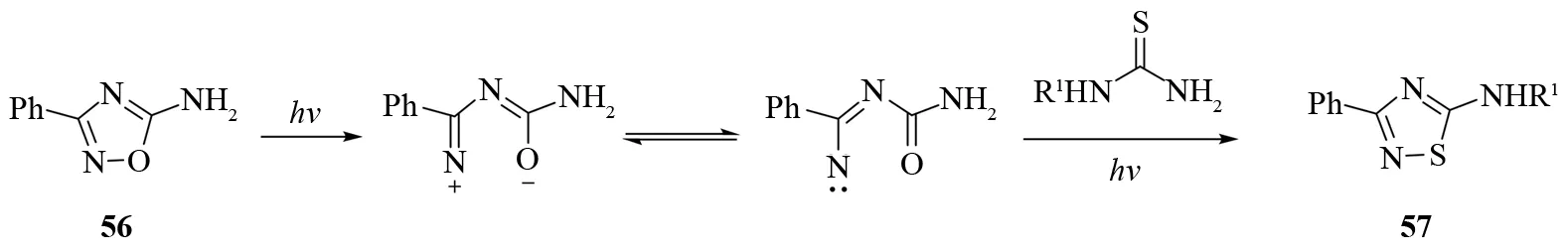
图36 光诱导分子重排合成1,2,4-噻二唑Fig.36 Synthesis of 1,2,4-thiadiazole by photoinduced molecular rearrangement
2 1,2,4-噻二唑在药物化学中的应用
近年来,研究者们发现了1,2,4-噻二唑体系在药物化学中有很有趣的应用. 这种杂环结构是许多具有生物活性的化合物的基本组成部分,如中枢神经系统药物、G-蛋白偶联受体调节剂、消炎药、心血管系统药物或抗菌药.
2.1 中枢神经系统药物
老年痴呆症是中枢神经系统障碍之一,是一种多方面的蔓延性疾病. 主要特征是认知功能和运动能力的逐渐降低. 形成老年痴呆症的生物学机制是异常复杂的,这种疾病存在多种神经病理学因素. 1,2,4-噻二唑类药物作为抗老年痴呆症药物有巨大的应用潜力. 3-噻二唑基吡啶-1-氧化物的抗氧化物58能特异性结合毒蕈碱受体[41]. 含有N-苄基哌啶片段的1,2,4-噻二唑啉二酮衍生物59具有乙酰胆碱酯酶抑制活性[42]. 另外,在C5位带有单环或双环胺取代基的1,2,4-噻二唑类化合物60中的环结构可以模拟毒蕈碱配体中的酯基,而对相关受体具有很高的亲和力[43]. 最近,ALONSO和MARTINEZ报道,噻二唑啉-3,5-二酮衍生物61是糖原合成酶激酶3β(GSK-3β)的非ATP竞争性抑制剂. 这种酶的选择性抑制剂的研发对于治疗老年痴呆症、中风、躁郁症、慢性炎症、癌症、Ⅱ型糖尿病等疾病有重要意义(见图37)[44].
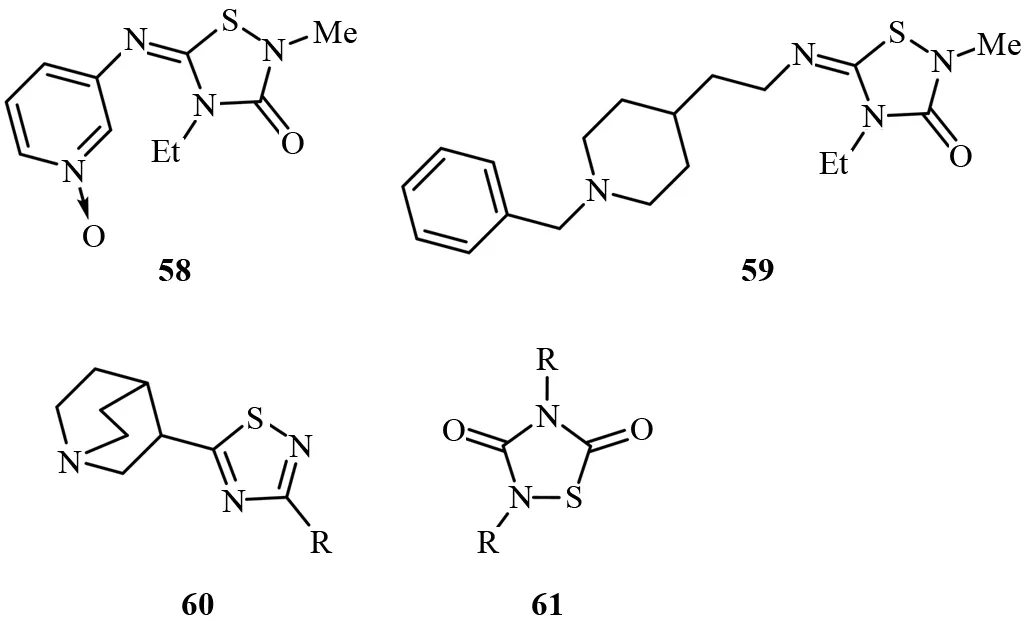
图37 具有中枢神经系统活性的1,2,4-噻二唑衍生物Fig.37 1,2,4-Thiadiazole derivatives with activity in the central nervous system
2.2 G-蛋白偶联受体
G-蛋白偶联受体是在激素和神经递质的识别和信号转导中发挥核心作用的一类膜结合蛋白. 2001年,研究者发现, 一种新型的1,2,4-噻二唑化合物SCH-202676可以作为多种G-蛋白偶联受体(GPCRs)的变构调节剂,如人体μ-、δ-、κ-阿片受体,α和β-肾上腺素受体,毒蕈碱M1、M2受体,多巴胺D1、D2受体等[4,45]. G蛋白偶联受体是在激素和神经递质的识别和信号转导中发挥核心作用的一类膜结合蛋白. G蛋白偶联受体的变构调节是一个新颖的药理概念,所以较少被研究.
腺苷受体是G-蛋白偶联受体家族中的一员,通过激活这些特定的细胞膜受体,可以调节多种生理功能. 有趣的是,化合物LUF 579是一种高活性的人体A1受体激动剂变构调节抑制剂[46],而SCH-202676对腺苷A1,A2和A3受体都具有调节作用[47]. 最近,GOEBLYOE A和DEVRIES合成了一系列新型的带有亚胺基取代基的1,2,4-噻二唑衍生物SCH-202676. 受体-配体结合实验和稳定性实验表明该类化合物是高活性巯基修饰剂而不是变构抑制剂[48].
此外,VAN MUIJLWIJK-KOEZEN等发现,腺苷A3受体在生理活动中发挥着重要的作用. 该受体的拮抗剂可用于治疗哮喘、青光眼等炎性疾病. 噻二唑酰胺类衍生物如LUF 5417对腺苷受体具有明显的拮抗作用[49],2004年,JUNG等发现了对腺苷A3受体具有更高亲和力和选择性的化合物[50](见图38).

图38 腺苷受体变构调节剂Fig.38 Allosteric modulators of adenosine receptors
2.3 消炎作用
非甾体抗炎药(NSAIDs)是广泛使用的炎症治疗药物. 然而,它们在治疗上的应用常常受到胃肠道副作用的限制. 非甾体抗炎药的主要作用机制是通过抑制在前列腺素合成中起关键作用的酶——环氧化酶(COX)的活性来降低前列腺素的合成. 环氧化酶存在两种异构体:COX-1和COX-2. 选择性抑制COX-2的抗炎药将会有更低的胃肠道副作用. 在COX的两种异构体被发现之前,研究者发现了大量的环氧化酶和5-脂肪氧化酶双重抑制剂,该类抑制剂都是含有2,6-二叔丁基苯酚基取代基的1,2,4-噻二唑衍生物62[51]. 1999年,人们发现这些化合物确实对COX-2有选择性抑制作用[52](见图39).
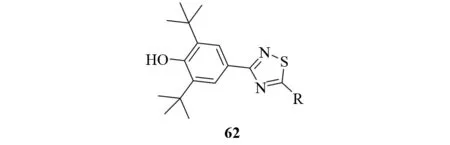
图39 环氧化酶和5-脂肪氧化酶双重抑制剂Fig.39 Dual cyclooxygenase and 5-lipoxygenase inhibitor
2.4 心血管系统
1,2,4-噻二唑类心血管药物——KC 12291通过抑制门控钠离子通道而具有心肌保护作用[53]. 3,3′-苯-双-1,2,4噻二唑亚胺63具有显著的抗血小板和抗凝血活性. 这种活性强烈依赖于1,2,4-噻二唑结构的2-位取代基. 此外,5-氧代-1,2,4-噻二唑64还具有血管紧张素II受体拮抗活性,并且这些衍生物表现出了高效的口服生物利用度[54](见图40).
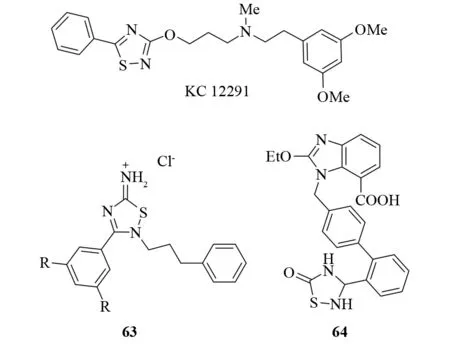
图40 具有心血管系统活性的1,24-噻二唑衍生物Fig.40 Relevant 1,2,4-thiadiazole derivatives with activity in the cardiovascular system
2.5 抗生素活性
甲氧西林金黄色葡萄球菌(MRSA)和铜绿假单胞菌是造成人类严重感染和大量死亡的主要病原菌. 虽然广谱头孢菌素类抗生素已被用于预防各种传染病,但是对MRSA没有活性. 为了发展广谱的头孢菌素,很多种带有各种稠杂环的新型β-内酰胺类抗生素被相继报道. 在β-内酰胺的C-7位引入一个5-胺基-1,2,4-噻二唑-3-基结构和羟亚胺基可以提高抗假单胞菌和抗-MSRA活性[55-56]. 含有噻二唑结构的头孢菌素S-3587对包括MRSA在内的革兰氏阳性细菌和包括P. aeruginosa在内的革兰氏阴性细菌均表现出极强的抑制活性[57](见图41).
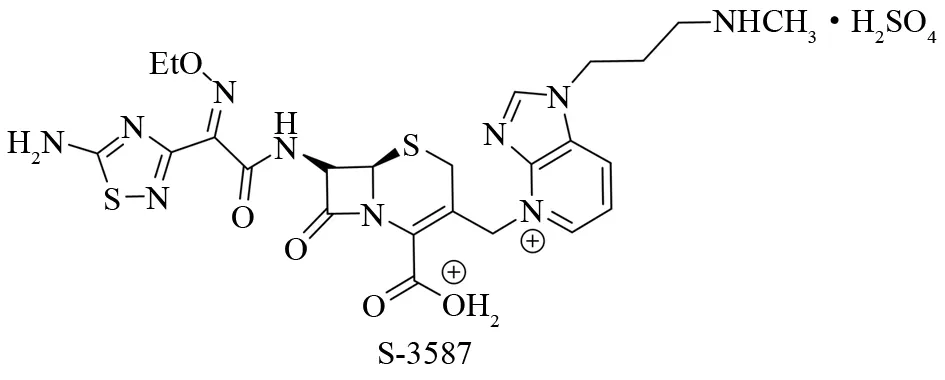
图41 1,2,4-噻二唑类抗生素Fig.41 Novel antibiotic-based 1,2,4-thiadiazole compound
3 结论与展望
综上所述,1,2,4-噻二唑作为一类重要的杂环化合物,其所具有的独特的生物和生理活性,逐渐引起了人们的关注. 许多含有1,2,4-噻二唑类药物分子的发现证明该类化合物在疾病治疗上具有广阔的应用前景. 近年来,随着有机合成方法学的发展,发现了1,2,4-噻二唑更加新颖、绿色的合成方法如碘催化、光催化、杂多酸催化等. 但是,1,2,4-噻二唑合成方法学仍然很不成熟. 更加复杂的1,2,4-噻二唑类药物分子的合成需要的不仅仅是对传统合成方法的改进,更需要的是新途径、新反应. 我们相信,随着1,2,4-噻二唑类化合物合成方法学的发展,1,2,4-噻二唑类化合物在药物化学上将会得到更广泛的应用.
[1] IIZAWA Y, OKONOGI K, HAYASHI R, et al. Therapeutic effect of cefozopran (SCE-2787), a new parenteral cephalosporin, against experimental infections in mice [J]. Chemother Antimicrob Agents, 1993, 37(1): 100-105.
[2] Kurzer F. Advances in hetero-cyclic chemistry [M]. Oxford: Elsevier Press, 1965: 285-398.
[3] FRANZ J E, DHINGRA O P, KATRITZKY A R, et al. Comprehensive heterocyclic chemistry. five membered rings with two or more O, S or N atoms [M]. Oxford: Pergamon Press, 1984: 463-511.
[4] FAWZI A B, MACDONALD D, BENBOW L L, et al. SCH-202676: An allosteric modulator of both agonist and antagonist binding toG-protein-coupled receptors [J]. Molecular Pharmacology, 2001, 59(1): 30-37.
[5] DECKING U K M, HARTMANN M, ROSE H, et al. Cardioprotective actions of KC 12291 I. Inhibition of voltage-gated Na+channels in ischemia delays myocardial Na+overload [J]. Naunyn-Schmiedebergs Archives of Pharmacology, 1998, 358(5): 547-553.
[6] HARTMANN M, DECKING U K M, SCHRADER J. Cardioprotective actions of KC 12291. II. Delaying Na+overload in ischemia improves cardiac function and energy status in reperfusion [J]. Naunyn-Schmiedebergs Archives of Pharmacology, 1998, 358(5): 554-560.
[7] MARTINEZ A, ALONSO M, CASTRO A, et al. First non-ATP competitive glycogen synthase kinase 3β(GSK-3β) inhibitors: thiadiazolidinones (TDZD) as potential drugs for the treatment of alzheimer’s disease [J]. Journal of Medicinal Chemistry, 2002, 45(6): 1292-1299.
[8] MACK W. Synthesis of 1,2,4-thiadiazoles from nitriles and sulfur [J]. Angewandte Chemie International Edition in English, 1967, 6(12): 1084-1084.
[9] TAKIKAWA Y, SHIMADA K, SATO K, et al. Convenient preparations of 3,5-disubstituted 1,2,4-thiadiazoles by oxidative dimerization of thioamides [J]. Bulletin of the Chemical Society of Japan, 1985, 58(3): 995-999.
[10] SRIVASTAVA V, YADAV A, YADAV L. Eosin Y Catalyzed visible-light-driven aerobic oxidative cyclization of thioamides to 1,2,4-thiadiazoles [J]. Synlett, 2013, 24(4): 465-470.
[11] YAJIMA K, YAMAGUCHI K, MIZUNO N. Facile access to 3,5-symmetrically disubstituted 1,2,4-thiadiazoles through phosphovanadomolybdic acid aatalyzed aerobic oxidative dimerization of primary thioamides [J]. Chemical Communications, 2014, 50(51): 6748-6750.
[12] JOSHUA C P, SUJATHA T S. Oxidation of mixtures of thioureas. Part X. A study of the steric and inductive effects of alkyl groups [J]. Indian Journal of Chemistry, 1990, 29B(6): 575-577.
[13] MAMAEVA E A, BAKIBAEV A A. Oxidative azacyclization of 1-monosubstituted thioureas in reaction with [bis(acyloxy) iodo] arenes to form 1, 2, 4-thiadiazole deri-vatives [J]. Tetrahedron, 2003, 59(38): 7521-7525.
[14] Kurzer F. Advances in Heterocyclic Chemistry [M]. Elsevier: Oxford, UK, 1965, 5: 119-204.
[15] JOACHIM G, HERBERT P. Über N-thioacyl-amidine, II [J]. Chemische Berichte, 1962, 95: 627-631.
[16] JOACHIM G, MERTENS P. Über 1.2.4-thiadiazole, XX. Zur kenntnis der 3-amino-thiadiazole [J]. Chemische Berichte, 1970, 103(6): 1805-1814.
[17] KURZER F. Thiadiazoles. Part II. 3,5-Diamino-1,2,4-thiadiazole and its 5-alkyl homologues [J]. Journal of the Chemical Society (Resumed), 1955, 2288-2295.
[18] KURZER F. Thiadiazoles. Part V. The oxidation of N-(arenesulphonamidino)thioureas [J]. Journal of the Chemical Society (Resumed), 1957, 2999-3004.
[19] KIHARA Y, KABASHIMA S, UNO K, et al. Oxidative heterocyclization using diethyl azodicarboxylate [J]. Synthesis, 1990, 1990(11): 1020-1023.
[20] HA-YOUNG K, SE H K, GEE-HYUNG L, et al. Copper-catalyzed synthesis of 3-substituted-5-amino-1,2,4-thiadiazoles via intramolecular N-S bond formation [J]. Tetrahedron, 2014, 70(45): 8737-8743.
[21] LIN Y, LANG S A, PETTY S R. New synthesis of 1,2,4-thiadiazoles [J]. The Journal of Organic Chemistry, 1980, 45(19): 3750-3753.
[22] BASF A G. Production of 5-mercapto-1,2,4-thiadiazole derivatives: DE 1116198A [P]. 1968-06-06.
[23] GOERDELER J, GROSCHOPP H, Sommerlad U. Über 1,2,4-thiodiazole, VIII. Synthese von 5-chlor-1,2,4-thiodiazolen aus perchlormethylmercaptan und Amidinen [J]. Chemische Berichte, 1957, 90(2): 182-187.
[24] HOWE R K, GRUNER T A, FRANZ J E. Nitrile sulfides. Synthesis of 5-aryl-1,2,4- thiadiazole-3-carboxylates [J]. The Journal of Organic Chemistry, 1977, 42(10): 1813-1814.
[25] RÖCHLING R, HÖRLEIN H. Heterocyclen aus 3,3-dichlor-2,2-difluorpropionimidsäure-methylester[J]. Justus Liebigs Annalen der Chemie, 1974, 1974(3): 504-522.
[26] AUGUSTIN, GÖTYSCHEL, PALLAS, et al. Verfahren zur herstellung von 1,2,4-thiadiazoldervaten: DE, 119791A1 [P]. 1976-05-12.
[27] WITTENBROOK L, TIMMONS R. Certain 3-halo-1,2,4-thiadiazoles and synthesis: USP 3825551A [P]. 1974-07-23.
[28] BARANY G, BRITTON D, CHEN L, et al. Unexpectedly stable (shlorocarbonyl)(N-ethoxycarbonylcarbamoyl)disulfane, and related compounds that model the zumach-weiss-kühle (ZWK) reaction for synthesis of 1,2,4-dithiazolidine-3,5-diones [J]. The Journal of Organic Chemistry, 2015, 80(22): 11313-11321.
[29] TALIANI L, PCRRONNET J. Action des réartif’s électrophiles sur les hydroxy-3 thiadiazoles-1,2,4 [J]. Journal of Heterocyclic Chemistry, 1979, 16(5): 961-971.
[31] HOWE R K, GRUNER T A, FRANZ J E. Nitrile sulfides. synthesis of 5-aryl-1,2,4-thiadiazole-3-carboxylates [J]. The Journal of Organic Chemistry, 1977, 42(10): 1813-1814.
[32] MCKIE M C, PATON R M. Nitrile sulfides. Part 13. Synthesis of 5-acyl-1,2,4-thiadiazoles by cycloaddition of nitrile sulfides to acylcyanides [J]. Arkivoc, 2002, 6: 15.
[33] UNANGST P C, SHURUM G P, CONNOR D T. Preparation of novel 1,2,4-thiadiazoles by cyclization with 4-methylbenzenesulfonyl cyanide (tosyl cyanide) [J]. Journal of Heterocyclic Chemistry, 1993, 30(2): 357-359.
[34] XIE H, CAI J, WANG Z, et al. A three-component approach to 3,5-diaryl-1,2,4-thiadiazoles under transition-metal-free conditions [J]. Organic Letters, 2016, 18(9): 2196-2199.
[35] NAGARAJU T, NAGESH J, RADHA K P, et al. I2catalyzed oxidative N-S bond formation: metal-free regiospecific synthesis of N-fused and 3,4-disubstituted 5-imino-1,2,4-thiadiazoles [J]. The Journal of Organic Chemistry, 2017, 82(10): 5310-5316.
[36] WANG B N, MENG Y G, ZHOU Y M, et al. Synthesis of 5-amino and 3,5-diamino substituted 1,2,4-thiadiazoles by I2-mediated oxidative N-S bond formation [J]. The Journal of Organic Chemistry, 2017, 82: 5898-5903.
[37] ROSENBAUM K, GOLDENBERG S, WEBER G. Thermolysis of 1-thiocarbamoyl-5-phenyltetrazoles-A new way of synthesis of 5-amino-3-phenyl-1, 2, 4-thiadiazoles [J]. Journal fur Praktische Chemie-Chemiker-Zeitung, 1992, 334(3): 283-284.
[38] TATSUTA K, MIURA S, GUNJI H, et al. Practical pre-paration of (Z)-2-(5-amino-1,2,4-thiadiazol-3-yl)-2-methoxyiminoacetic acid: A side-chain of the fourth gene-ration of cephem antibiotics [J]. Bulletin of the Chemical Society of Japan, 1994, 67(6): 1701-1707.
[39] MOLOTOV S I, KULIKOV A S, MAKHOVA N N, et al. Thermal rearrangements of 3-substituted 4-(3-ethoxycarbonylthioureido)-1, 2, 5-oxadiazole-2-oxides [J]. Mendeleev Communications, 2003, 4: 188-190.
[40] VIVONA N, BUSCEMI S, ASTA S, et al. Photoinduced molecular rearrangements: The photochemistry of 1, 2, 4-oxadiazoles in the presence of sulfur nucleophiles. Synthesis of 1, 2, 4-thiadiazoles [J]. Tetrahedron, 1997, 53(37): 12629-12636.
[41] MARTINEZ A, ALONSO D, CASTRO A, et al. Synthesis and potential muscarinic receptor binding and antioxidant properties of 3-(thiadiazolyl) pyridine 1-oxide compounds [J]. Archiv der Pharmazie, 1999, 332(6): 191-194.
[42] MARTINEZ A, FERNANDEZ E, CASTRO A, et al. N-benzylpiperidine derivatives of 1, 2, 4-thiadiazolidinone as new acetylcholinesterase inhibitors [J]. Journal of Medicinal Chemitry, 2000, 35(10): 913-922.
[43] MACLEOD A M, BAKER R, FREEDMAN S B, et al. Synthesis and muscarinic activities of 1, 2, 4-thiadiazoles [J]. Journal of Medicinal Chemitry, 1990, 33(7): 2052-2059.
[44] ALONSO M, MARTINEZ A. GSK-3 inhibitors: discove-ries and developments [J]. Current Medicinal Chemistry, 2004, 11(6): 755-163.
[45] LANZAFAME A, CHRISTOPOULOS A. Investigation of the interaction of a putative allosteric modulator, N-(2, 3-diphenyl-1, 2, 4-thiadiazole-5-(2H)-ylidene) methanamine hydrobromide (SCH-202676), with M1 muscarinic acetylcholine receptors [J]. Journal of Pharmacology amp; Experimental Therapeutics, 2004, 308(3): 830-837.
[46] VAN D N, PIETRA D, HEITMAN L, et al. Synthesis and biological evaluation of 2, 3, 5-substituted [1, 2, 4] thiadiazoles as allosteric modulators of adenosine receptors [J]. Journal of Medicinal Chemistry, 2004, 47(3): 663-672.
[47] GAO Z G, GROSS A S, JACOBSON K A. Effects of the allosteric modulator SCH-202676 on adenosine and P2Y receptors [J]. Life Sciences, 2004, 74(25): 3173-3180.
[48] GOEBLYOE A, DEVRIES H, BRUSSEE J, et al. Synthesis and biological evaluation of a new series of 2, 3, 5-substituted [1, 2, 4]-thiadiazoles as modulators of adenosine A1 receptors and their molecular mechanism of action [J]. Journal of Medicinal Chemistry, 2005, 48(4): 1145-1151.
[49] MUIJLWIJKKOEZEN J E, TIMMERMAN H, VOLLINGA R C, et al. Thiazole and thiadiazole analogs as a novel class of adenosine receptor antagonists [J]. Journal of Medicinal Chemistry, 2001, 44(5): 749-762.
[50] JUNG K Y, KIM S K, GAO Z G, et al. Structure-activity relationships of thiazole and thiadiazole derivatives as potent and selective human adenosine A3 receptor antagonists [J]. Bioorganic amp; Medicinal Chemistry, 2004, 12(3): 613-623.
[51] UNANGST P C, SHRUM G P, CONNOR D T, et al. Novel 1, 2, 4-oxadiazoles and 1, 2, 4-thiadiazoles as dual 5-lipoxygenase and cyclooxygenase inhibitors [J]. Journal of Mecicinal Chemistry, 1992, 35(20): 3691-3698.
[52] SONG Y T CONNOR D T, SERCEL A D, et al. Synthesis, structure-activity relationships, and in vivo evalu-ations of substituted di-tert-butylphenols as a novel class of potent, selective, and orally active cyclooxygenase-2 inhibitors. 2. 1, 3, 4- and 1, 2, 4-Thiadiazole series [J]. Journal of Mecicinal Chemistry, 1999, 42(7): 1161-1169.
[53] REHSE K, MARTENS A. Platelet aggregation inhibiting and anticoagulant effects of oligoamines. XXII. Bisoxazol-, bisimidazol-, bisthiazol- and oligo-1, 2, 4-thiadiazolimines [J]. Archiv der Pharmazie, 1993, 326(7): 399-404.
[54] KOHARA Y, KUBO K, IMAMIYA E, et al. Synthesis and angiotensin II Receptor antagonistic activities of ben-zimidazole derivatives bearing acidic heterocycles as novel tetrazole bioisosteres [J]. Journal of Mecicinal Chemistry, 1996, 39(26): 5228-5235.
[55] HARA R, SAKAMOTO K, HISAMICHI H, et al. Structure-activity relationships of cephalosporins having a (dimethylisoxazolidinio) vinyl moiety at their 3-position [J]. Journal of Antibiotics, 1996, 49(11): 1162-1171.
[56] ISHIKAWA T, IIZAWA Y, OKONOGI K, et al. Studies on anti-MRSA parenteral cephalosporins. I. Synthesis and antibacterial activity of 7β-[2-(5-amino-1, 2, 4-thiadiazol-3-yl)-2(Z)-hydroxyiminoacetamido]-3-(substituted imidazo[1, 2-b] pyridazinium-1-yl) methyl-3-cephem-4-carboxylates and related compounds [J]. Journal of Antibiotics, 2000, 53(10): 1053-1070.
[57] YOSHIZAWA H, KUBOTA T, ITANI H, et al. New broad-spectrum parenteral cephalosporins exhibiting potent activity against both methicillin-resistant Staphylococcus aureus (MRSA) and Pseudomonas aeruginosa. Part 2: Synthesis and structure-activity relationships in the S-3578 series [J]. Bioorganic amp; Medicinal Chemistry, 2004, 12(15): 4211-4219.
[责任编辑:张普玉]
Synthesisof1,2,4-thiadiazolesanditsapplicationsinmedicinalchemistry
CHAI Ling, XIA Qiangqiang, YUAN Jiangpei, BIAN Qilong, ZHAN Yupeng, XU Yuanqing*, XU Hao*, CHEN Wei
(CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
1,2,4-Thiadiazoles are important heterocyclic compounds which have significant applications in the field of medicinal chemistry. The synthetic methods for these compounds have been reported constantly. Among them, iodine catalysis and photocatalysis have been widely used in the synthesis of 1,2,4-thiadiazoles because of the advantages including easy availability of starting materials, high efficiency, and free of pollution. In this paper, the synthetic methods of 1,2,4- thiadiazoles reported in recent years and their applications in medicinal chemistry are briefly introduced.
1,2,4-thiadiazole; heterocycle; synthesis; medicinal chemistry
O621.3
A
1008-1011(2017)06-0671-15
2017-09-17.
河南省教育厅科学技术研究重点项目(15A150041),河南大学科研基金项目(2013YBZR008, ZZJJ20140007).
柴 岭(1991-), 男, 硕士生, 研究方向为有机合成方法学.*
, E-mail:18937822307@163.com; xuhao@henu.edu.cn.
