超高效液相色谱-串联质谱同时测定茶叶中高氯酸盐和氯酸盐
2017-12-11宋正规张书芬周子焱张爱芝沈坚傅晓李和生邢家凓满正印赵春玲曹丽丽
宋正规,张书芬,周子焱,张爱芝,沈坚*,傅晓,李和生,邢家凓,满正印,赵春玲,曹丽丽
1. 宁波大学海洋学院,浙江 宁波 315211;2. 宁波市食品检验检测研究院,浙江 宁波 315048
超高效液相色谱-串联质谱同时测定茶叶中高氯酸盐和氯酸盐
宋正规1,张书芬2,周子焱2,张爱芝2,沈坚2*,傅晓2,李和生1,邢家凓2,满正印2,赵春玲2,曹丽丽2
1. 宁波大学海洋学院,浙江 宁波 315211;2. 宁波市食品检验检测研究院,浙江 宁波 315048
建立了超高效液相色谱-串联质谱同时测定茶叶中高氯酸盐和氯酸盐的分析方法。选用ProElut C18固相萃取柱对茶叶提取液进行净化、亲水性的Click Xion色谱柱分离,流动相A为水(含5 mmol·L-1甲酸铵),流动相B为V甲醇︰V水=9︰1(含5 mmol·L-1甲酸铵),甲酸调节pH至3.2,梯度洗脱分离,UPLC-MS/MS多反应监测(MRM)模式检测。该方法适用于茶叶中高氯酸盐和氯酸盐检测,平均回收率在60.5%~85.8%,RSD在 4.9%~7.7%,高氯酸盐检出限为 3 μg·kg-1,氯酸盐检出限为 5 μg·kg-1。方法操作简单、快速、灵敏度高,可以满足茶叶中高氯酸盐和氯酸盐的检测要求。
超高效液相色谱-串联质谱;茶叶;高氯酸盐;氯酸盐
高氯酸盐和氯酸盐是一类无机含氯化合物,成年人每天摄入0.072~0.200 μg,可破坏红细胞,影响血液运输氧气,造成矿物质流失,内环境紊乱[1]。高氯酸盐是一种持久性、极易溶于水、流动性极强的全球污染物[2]。它可以干扰甲状腺素的合成与分泌,影响人体正常的新陈代谢,阻碍人体生长发育,对儿童影响尤为严重,体内的高氯酸盐过量,儿童会出现智商偏低、学习障碍、发育迟缓、多动症、注意力分散,甚至会出现弱智等症状[3]。为此,2005年2月,美国科学院宣布高氯酸盐参考剂量为0.7 μg·kg-1·d-1[4]。氯酸盐是饮用水消毒过程中产生的副产品,可直接通过饮用进入人体,也可经过自然界含氯化合物的分解产生氯酸盐,通过降水,进入动植物的体内,通过食物消化吸收进入人体。氯酸盐具有较强的氧化性,进入人体对内环境造成影响,造成饮用水中对人体有用的矿物质流逝,氯酸盐也会阻碍甲状腺吸收碘[3]。
茶叶作为一种大众喜爱的传统饮品,目前全国饮茶人数达到4.7亿,长期以来在中国饮品市场中占有重要地位,同时大量出口国外。2016年,全国茶园面积共计 293.33万 hm2,全国干毛茶产量243万t,产值近1900亿元,茶叶出口总量32.5万t,出口额13.8亿美元[4]。但随着烟花行业、工业和航空业的发展,大量的氯酸盐和高氯酸盐排入环境中,不易分解,并易于流动,是一种持久性污染物,茶叶中氯酸盐最大残留标准目前各国尚未做规定。欧盟有关组织根据茶叶中高氯酸盐的合理含量研究,正在就拟定茶叶中实施高氯酸盐 0.75 mg·kg-1限量标准事宜进行商讨[5-6],而欧洲食品安全局2015年编订的《食品中氯酸盐对公共健康风险评估》指出应按照欧盟396/2005号法规附件一中规定的没有具体残留标准规定的按照 0.01 mg·kg-1默认标准执行。2016年农业部对江西、安徽两省的茶叶样品进行安全评估,结果显示,高氯酸盐平均检出值为 0.239 mg·kg-1,其中六安市为0.341 mg·kg-1,其余都为 0.100 mg·kg-1[6]。同时我国也在进行积极协商,目前我国茶叶中高氯酸盐暴露性风险评估尚未有报道,但从水源监测结果显示多地水源受到污染,推断茶叶中污染状况不容乐观,如果该标准一旦实施,中国茶叶出口业或将遭受重大冲击[7-9]。目前,高氯酸盐和氯酸盐的检测方法主要有分光光度法[10-11],离子色谱法[12],离子色谱-质谱联用法[13-14]。离子色谱法检测饮用水中的高氯酸盐[15],液相色谱检测茶叶中的高氯酸盐[16],离子色谱-质谱联用法同时检测水中、碳酸饮料中的高氯酸盐和氯酸盐已有报道[17-18],但运用高效液相色谱-质谱联用法同时检测茶叶中的高氯酸盐和氯酸盐尚未见报道,相比离子色谱同时检测高氯酸盐和氯酸盐,氯酸盐检出限有所提高,检测时间大大缩短。
本研究利用 LC-MS/MS检测手段,建立了同时检测茶叶中的高氯酸盐和氯酸盐的超高效液相色谱-串联质谱方法。通过对净化、色谱、质谱条件进行优化,样品前处理过程简单,准确度高,方法可用于茶叶中高氯酸盐和氯酸盐的检测和监控。
1 材料与方法
1.1 仪器与试剂
LC-MS-6470型液相串联质谱联用仪器(美国Agilent公司),Click Xion色谱柱(2.1 mm×100 mm,5 μm,100 Å,中国科学院大连化学物理研究院研制);ZORBAX SB-Aq Rapid Resolution HD(2.1 mm×100 mm,1.8 μm,美国 Agilent公司);Infinity Poroshell 120 Hilic(4.6 mm×150 mm,2.7 μm,美国 Agilent公司),OnGuard ⅡRP固相萃取小柱(500 mg,6 mL,美国Dionex公司),ProElut CARB固相萃取柱(500 mg,6 mL,迪马科技),ProElut C18固相萃取柱(500 mg,6 mL,迪马科技),0.2 μL水系滤膜(美国Agilent公司)。
高氯酸盐标准溶液:(1 000 mg·mL-1,美国Inorganic Ventures公司),氯酸盐标准浓度:(1 000 mg·mL-1,美国 Inorganic Ventures 公司),甲醇(色谱纯,德国默克股份两合公司),甲酸(分析纯,天津市光复精细化工研究所),甲酸铵(分析纯,天津市光复精细化工研究所),硫酸氢钠(分析纯,天津市光复精细化工研究所),磷酸氢钾(分析纯,权宇化工),实验用水均为超纯水(法国 Millipore公司超纯水器制备),其他试剂及其设备。
1.2 液相色谱与质谱条件
1.2.1 色谱条件
色谱柱:Click Xion色谱柱,耐受pH 2~8;柱温:35℃;流动相A:水(5 mmol·L-1甲酸铵),流动相B:甲醇和水(V甲醇∶V水=9∶1)含 5 mmol·L-1甲酸铵,流速 0.2 mL·min-1。流动相梯度洗脱程序:0~2 min,5%A;2~6 min,5%A~60%A;6~6.5 min,60%A~5%A;6.5~8.0 min,5%A;进样量 10 μL。
1.2.2 质谱条件
ESI-离子源模式,离子源温度 250℃,电喷雾电压:3 000 V,采集时间200 ms,高氯酸盐碎裂电压120 V,碰撞能量分别为:29 V、45 V,监测离子对:m/z:83/99、67.1/99。氯酸盐质谱碎裂电压50 V,碰撞能量分别25 V、41 V,监测离子对:m/z:67.1/83,51.1/83。
1.3 样品的前处理
称取茶叶样品粉末1 g于50 mL聚丙烯离心管中,加入20 mL 0.1%(V/V)乙酸水溶液,涡旋2 min,40℃提取时间为25 min。以8 000 r·min-1离心5 min,取上清液于离心管中待用,取色谱纯甲醇 5 mL和去离子水 5 mL活化ProElut C18固相萃取小柱,吸取2 mL上清液过固相萃取小柱,并弃去流出液,再上样2 mL,滴入10 mL玻璃离心管中,上机分析。
2 结果与讨论
2.1 质谱条件的优化
试验选择 ESI-离子源模式,常用离子源温度250℃,电喷雾电压:3 000 V,采集时间200 ms。500 ng·mL-1标准高氯酸盐和氯酸盐标准溶液直接通过两通进入质谱,分别给定80 V、40 V碎裂电压对高氯酸盐和氯酸盐进行全扫描,通过全扫描质谱图确定高氯酸盐和氯酸盐即目标化合物母离子的质荷比,质荷比为99,质荷比为83。小分子化合物碎裂电压一般都在200 V以下,一般小分子化合物碰撞池加速电压设为3 V,根据高氯酸盐和氯酸盐响应手动调节确定高氯酸盐和氯酸盐碎裂电压分别为120 V、50 V。另外发现氯酸盐的响应信号低,通过调节流动相pH以增强其响应信号,实验后续通过甲酸调节流动相pH 3.2增强了响应信号。因碰撞能量低于碎裂电压,采用四分法逐段调节碰撞能量,最终选择高氯酸盐最佳定性和定量碰撞能量分别为:29 V、45 V,氯酸盐最佳定性和定量碰撞能量分别为:25 V、41 V。
2.2 色谱条件的优化
2.2.1 色谱柱的选择
试验比较了 Infinity Poroshell 120 Hilic,ZORBAX SB-Aq Rapid Resolution HD,Click Xion 3种色谱柱对高氯酸盐和氯酸盐的保留效果,流动相采用甲醇-水。
Infinity Poroshell 120 Hilic色谱柱在工作条件下,固定相表面首先建立一个富集水的液体层,极性和亲水性物质易于溶解,待分析物在流动相和该亲水层之间分配,对分离亲水性化合物有一定效果,高氯酸盐和氯酸盐都为极易溶于水的极性化合物。但结果显示,高氯酸盐和氯酸盐在Infinity Poroshell 120 Hilic柱上0.7 min出峰,没有保留,该色谱柱对高氯酸盐和氯酸盐没有分离效果。
ZORBAX SB-Aq Rapid Resolution HD在液相色谱仪中较为常用,该柱属亲水性分离色谱柱,对有机分子和无机离子有一定分离效果,可分离大部分待分析物质。高氯酸盐和氯酸盐在ZORBAX SB-Aq Rapid Resolution HD色谱柱上出峰时间为 1.2 min,对高氯酸盐和氯酸盐有一定的保留效果。
Click Xion色谱柱为两性柱子,硅胶表面键合有半胱氨酸,电荷相反的离子平行键合在硅胶表面,两性离子材料同时存在正负电荷中心,亲水性好,对离子吸附分离具有显著效果。Click Xion色谱柱出峰时间为1.5 min,对加标相同浓度的样品进行前处理,Click Xion色谱柱分离后目标物响应最高。实验选择 Click Xion色谱柱作为分析色谱柱。
2.2.2 流动相的选择
试验比较了乙腈-水,甲醇-水两种常用流动体系。结果表明乙腈-水做流动相高氯酸盐和氯酸盐响应较高,但乙腈-水流动体系出峰为 0.7 min,出峰较早,且出现明显分叉和拖尾现象,难以完成茶叶中高氯酸盐和氯酸盐的分析。甲醇-水流动相体系出峰为1.5 min,但峰型出现拖尾现象。为进一步优化分离效果,调节流动相体系甲酸铵浓度为5 mmol·L-1,峰型得以改善,但相比乙腈作流动相响应有所降低,用甲酸调节流动相 pH为 3.2,响应有所增加。因此最终选择流动相 A为水(含 5 mmol·L-1甲酸铵),流动相 B 为 V甲醇︰V水=9︰1(含 5 mmol·L-1甲酸铵),pH 3.2,出峰时间1.5 min。图1为该方法下5 ng·mL-1高氯酸盐与氯酸盐标样MRM扫描图。

图1 5 ng·mL-1高氯酸盐与氯酸盐标样MRM扫描图Fig. 1 Mass spectrum of standard solution containing 5 ng·mL-1 of perchlorate and chlorate ion
2.3 固相萃取柱的优化
2.3.1 固相萃取柱的选择
考虑到 ProElut C18对茶汤中的大部分有机物质吸附能力强,且较为常用,决定选择ProElut C18固相萃取柱对茶汤进行净化处理。ProElut CARB固相萃取柱对茶叶中的叶绿素、叶黄素、胡萝卜素、黄酮类物质、茶多酚等干扰物质保留作用显著,常作为茶叶中萃取除杂过程的吸附剂[19]。OnGuard ⅡRP固相萃取小柱对于去除茶叶提取液中的大分子和小分子物质都有明显吸附作用[20]。因此试验选择ProElut C18固相萃取柱,ProElut CARB固相萃取柱,OnGuard ⅡRP 固相萃取小柱进行考察。
试验分别用色谱纯甲醇5 mL和去离子水5 mL进行活化,用高氯酸盐和氯酸盐标准溶液配制含、均为 200 ng·mL-1混合标准溶液,分别流过准备好的固相萃取小柱,标样过柱,弃去前2 mL流出液,对其在萃取过程回收率进行研究(表1)。

表1 3种固相萃取小柱对高氯酸盐和氯酸盐回收率的影响Table 1 The recoveries of perchlorate and chlorate purified by different solid phase extraction columns %
分别用 200 ng·mL-1标准溶液对 3种固相萃取小柱上样,弃去前2 mL流出液,收集所得溶液与 200 ng·mL-1标准溶液一同上机。试验结果显示 OnGuard ⅡRP、ProElut C18、ProElut CARB相比标准溶液响应都有降低,标准液流过ProElut CARB固相萃取柱所得响应与标准溶液响应相比降低了约16%,氯酸盐响应降低19%,OnGuard ⅡRP固相萃取小柱响应降低较小。同时考虑到3种固相萃取小柱的价格,ProElut C18固相萃取柱最便宜,成本低,只有ProElut CARB固相萃取柱的一半,OnGuard ⅡRP固相萃取小柱为进口小柱,价格昂贵。综合考虑,ProElut C18对高氯酸盐和氯酸盐回收率尚好,且价格较低,试验选用ProElut C18固相萃取柱作为净化柱。
2.3.2 ProElut C18固相萃取柱净化体积的优化
选择同种茶叶1 g,分别加标200 ng,进行提取。所得溶液分别通过 ProElut C18固相萃取小柱,每间隔 0.5 mL分别收集流出液,涡旋,以高氯酸盐峰面积响应值为纵坐标,流出体积为横坐标,绘制高氯酸盐流过 ProElut C18固相萃取柱的洗脱曲线图,由图2可知,用2 mL提取液稳定固相萃取柱后,收集2 mL进行测定,其高氯酸盐测定结果基本稳定。
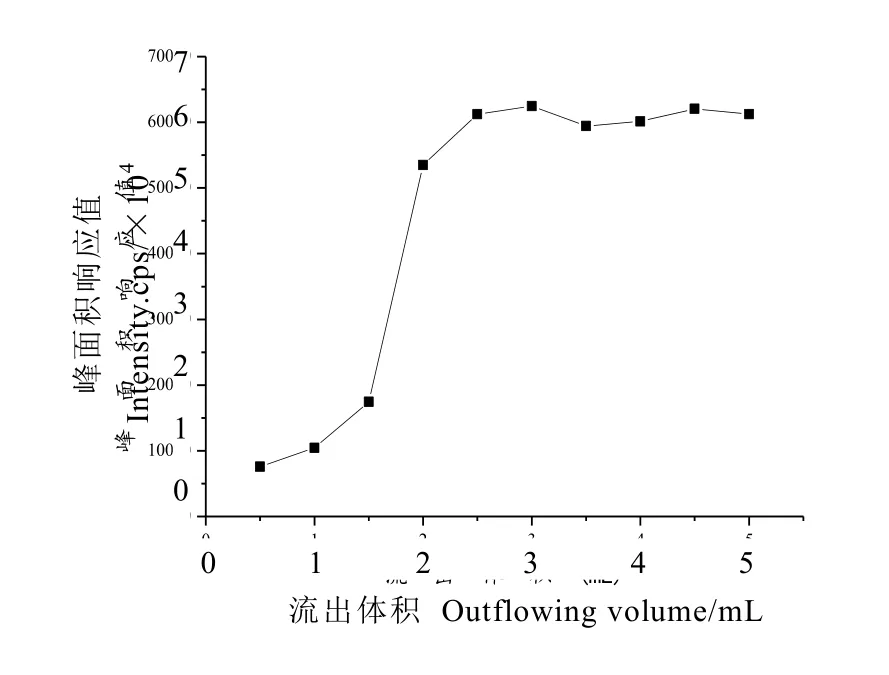
图2 ProElut C18固相萃取小柱净化后高氯酸盐流出曲线Fig. 2 Outflow of perchlorate in tea extract by ProElut C18
2.4 样品的线性关系、回收率和相对偏差
选择茶叶样品 3份,用 ProElut C18固相萃取柱进行高氯酸盐和氯酸盐的方法学考察。取3种不同茶叶进行加标回收率试验,分别添加 20、40、100 μg·kg-1按照前处理方法操作,每个浓度水平进行6次平行试验,外标法定量。结果如表2,3种茶叶的平均回收率在60.5%~85.8%之间,RSD在4.9%~7.7%,方法具有较好的精密度。图 3为空白基质、5 ng·mL-1标准混合工作液、空白白茶基质加标100 μg·kg-1的MRM图。时间稳定,空白基质对茶叶中高氯酸盐与氯酸盐的测定无干扰作用。

表2 测定3种茶叶中高氯酸盐和氯酸盐的平均回收率和相对偏差Table 2 Spiked recoveries and RSDs of perchlorate and chlorate in 3 kinds of tea

图3 空白基质、标准工作液、空白白茶基质加标的MRM图Fig. 3 Mass spectrum of blank tea, standard solutions and blank white tea matrix labeling
前期实验过程中,在上机超纯水及配制的乙酸提取液中检测到微量的高氯酸盐和氯酸盐,根据相关文献[20-22],不同地区地下水受到不同程度的污染,存在干扰,但根据多次试验最终确定污染来源于样品瓶和试剂瓶的洗涤残留,试验更换新的试验容器未检出高氯酸盐和氯酸盐。
2.5 实验干扰分析
实验存在m/z99的磷酸氢根和硫酸氢根的同位素离子(和)的干扰,实验提取了 10 ng·mL-1硫酸氢钠和磷酸氢钾的MRM扫描图,结果显示磷酸氢根出峰时间为 0.8 min,硫酸氢根出峰时间2.4 min,Click Xion色谱柱实现、和分离,10 ng·mL-1磷酸氢钠和硫酸氢钠相比同浓度高氯酸盐响应较低,同时验证了在超纯水中添加 10 ng·mL-1Ba(OH)2溶液,响应未有降低,综上分析,磷酸氢根和硫酸氢根的同位素离子未对实验造成干扰。
3 结论
本研究建立了同时分析茶叶中高氯酸盐和氯酸盐的检测方法,优化了色谱条件、质谱条件和固相萃取技术,并考察实际茶叶样品中高氯酸盐和氯酸盐的检测效果,其中部分茶叶中检测出低含量的高氯酸盐和氯酸盐存在。该研究根据2.4章节测定的高氯酸盐和氯酸盐标准曲线,在不含目标化合物的阴性茶叶中添加不同浓度的高氯酸盐和氯酸盐混合溶液,测定后以高氯酸盐和氯酸盐信噪比不低于 3(S/N≥3)确定检出限(LOD),以S/N≥10确定定量限(LOQ),确定了超高效液相色谱-串联质谱测定茶叶中高氯酸盐检出限为3 μg·kg-1,定量限为 10 μg·kg-1,氯酸盐检出限为 5 μg·kg-1,定量限为15 μg·kg-1。方法灵敏度高。检测效率高、简单快捷、无拖尾现象、前处理过程简单,可满足茶叶中高氯酸盐和氯酸盐的检测要求。
[1]Parma. Scientific opinion on risks for public health related to the presence of chlorate in food [J]. EFSA Journal, 2015,13(6): 4135. DOI: 10.2903/j.efsa.2015.4135.
[2]Veschetti E, Cittadini B, Maresca D. Inorganic by-products in waters disinfected with chlorine dioxide [J].Microchemical Journal, 2005, 79(1): 165-170.
[3]蔡亚岐, 史亚利, 张萍, 等. 高氯酸盐的环境污染问题[J].化学进展, 2006, 18(11): 1554-1564.
[4]梅宇, 王智超. 2016全国茶叶产销形势分析报告[J]. 茶世界, 2016, 12(6): 40-52.
[5]Pisarenko A N, Stanford B D, Quinones O, et al. Rapid analysis of perchlorate, chlorate and bromate ions in concentrated sodium hypochlorite solutions [J]. Analytica Chimica Acta, 2010, 659(1/2): 216-223.
[6]邓家军, 张莉, 廖健, 等. 茶叶中高氯酸盐健康风险研究[J]. 乡村科技, 2016(36): 42.
[7]Parma. Scientific opinion on the risks to public health related to the presence of perchlorate in food, in particular fruits and vegetables [J]. EFSA Journal, 2014, 12(10): 3869.DOI:10.2903/j.efsa.2014.3869.
[8]金军, 常瀛月. 超高效液相色谱-电喷雾离子源-串联三重四极杆质谱分析饮用水中的高氯酸盐[J]. 分析测试学报,2010, 9(29): 974-977.
[9]肖振华, 王汉青. 南京市溧水区 2013—2014年农村生活饮用水中氯酸盐超标的情况分析[J]. 医药前沿, 2016,12(34): 94-98.
[10]MOTZER W E. Perchlorate: problem, detection, and solutions [J]. Environmental Forensics, 2001, 2: 301-311.
[11]SORIAL G A. The perchlorate dilemma in drinking water [J].Journal of Environmental Engineering, 2004(1): 1-2.
[12]BORGES R, MIGUEL E C, JANICE M R. Physiological and biochemical analysis of chlorate toxicity on rice seedlings[J]. Plant Science, 2004, 166: 1057-1062.
[13]York R G, LEWIS E, BROWN W R, et al. Refining the effects observed in a developmental neurobehavioral study of ammonium perchlorate administered orally in drinking water to rats [J]. International Journal of Toxicology,2005(24): 403-418.
[14]TING D, STEINMAUS C. Perchlorate: Human toxicity [J].Encyclopedia of Environmental Health, 2011, 45(1):364-370.
[15]钱蜀, 谢永洪, 杨坪. 离子色谱-串联质谱测定地表水中高氯酸盐[J]. 中国环境监测, 2014, 30(3): 125-130.
[16]冯德建, 邹燕, 史谢飞. 茶叶中高氯酸盐的液相色谱-串联质谱测定方法研究[J]. 中国测试, 2016, 42(4): 1-4.
[17]王会霞. 离子色谱法测定水中亚氯酸盐、氯酸盐和高氯酸盐[J]. 中国卫生检验杂志, 2015, 20(19): 3250-3254.
[18]高峰, 刘岩, 孔维恒. 离子色谱-质谱测定碳酸饮料中的亚氯酸盐、氯酸盐和高氯酸盐[J]. 食品科学, 2013, 34(22):261-264.
[19]杨丽萍, 纪英, 赫元萍. 茶叶中除虫菊酯农药残留快速测定法[J]. 化学分析计量, 2005, 14(5): 28-40.
[20]刘小芳, 方从容, 刘慧, 等. 离子色谱-串联质谱法检测茶叶中的高氯酸盐[J]. 色谱, 2016, 10(2): 986-988.
[21]黄雨榴, 李小倩, 方玲, 等. 改进离子色谱法测定水样中高氯酸盐、氯酸盐和亚氯酸盐[J]. 环境科学与技术, 2017,40(5): 126-130.
[22]方齐乐, 陈宝梁. 新型环境污染物高氯酸盐的环境化学行为、食品安全及健康风险[J]. 科学通报, 2013, 58(26):2626-2642.
Simultaneous Determination of Perchlorate and Chlorate in Tea by Ultra-peryethylene Liquid Chromatography-tandem Mass Spectrometry
SONG Zhenggui1, ZHANG Shufen2, ZHOU Ziyan2, ZHANG Aizhi2, SHEN Jian2*, FU Xiao2,LI Hesheng1, XING Jiali2, MAN Zhengyin2, ZHAO Chunling2, CAO Lili2
1. Ocean College of Ningbo University, NingBo 315211, China; 2. Ningbo Institute For Food Control, Ningbo 315048, China
A method using ultra high performance liquid chromatography-tandem mass spectrometry was developed for the determination of perchlorate and chlorate in tea. Tea extracts were purified by ProElut C18, separated by Click Xion column. The mobile phases were 5 mmol·L-1ammonium formate/water (A) and methanol: 5 mmol·L-1ammonium formate/water =9︰1 (B). The pH was adjusted to 3.2 by formic acid and the samples were then analyzed by UPLC-MS/MS with multiple reaction monitoring mode (MRM). The method was applied to detect perchlorate and chlorate in tea. The average recovery and relative standard deviations were in the range of 60.5%-85.8% and 4.9%-7.7%,respectively. The detecting limits of perchlorate and chlorate were 3 μg·kg-1and 5 μg·kg-1, respectively. The method is simple, quick and high sensitive, which is suitable for the determination of perchlorate and chlorate in tea.
ultra high performance liquid chromatography-tandem mass spectrometry, tea, perchlorate, chlorate
TS272.5;O657.63
A
1000-369X(2017)06-597-08
2017-07-19
2017-10-18
浙江省食品药品监管系统科技计划项目(SP201617)
宋正规,男,硕士研究生,主要从事食品安全检测研究。*通讯作者:13805841749@163.com
