茶树△12-脂肪酸去饱和酶基因FAD2和FAD6的克隆与表达分析
2017-12-11陈丹俞滢岳川王鹏杰陈静陈桂信叶乃兴
陈丹,俞滢,岳川,王鹏杰,陈静,陈桂信,叶乃兴
福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州 350002
茶树△12-脂肪酸去饱和酶基因FAD2和FAD6的克隆与表达分析
陈丹,俞滢,岳川,王鹏杰,陈静,陈桂信*,叶乃兴*
福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州 350002
本研究在茶树转录组测序的基础上,以铁观音茶树的芽叶为材料,采用 RT-PCR技术,克隆了茶树不饱和脂肪酸合成途径中的关键限速酶—△12-FAD(△12-脂肪酸去饱和酶)基因的包含完整ORF的cDNA序列(CsFAD2和CsFAD6)。生物信息学分析结果表明,CsFAD2的全长为1 184 bp,其开放阅读框(ORF)长度1 149 bp,编码 382个氨基酸,定位于内质网上,其氨基酸序列与油茶FAD2的同源性最高达 97%;CsFAD6的全长为1 425 bp,其ORF长度为1 311 bp,编码436个氨基酸,定位于叶绿体上,其氨基酸序列与葡萄FAD6同源性达81%。荧光定量PCR结果表明,铁观音茶树幼苗在4℃低温胁迫处理72 h过程中,这两个基因的表达均受低温的诱导,其表达量随着处理时间的延长而升高,在处理48 h时,表达量水平最高;在100 g·L-1的PEG胁迫处理12 h过程中,这两个基因的表达均受PEG胁迫处理的诱导;在ABA(100 μmol·L-1)胁迫处理72 h过程中,在处理 6~24 h期间,CsFAD2的表达量显著升高,而CsFAD6的表达不受 ABA处理的影响,CsFAD6的表达量在处理72 h时显著降低;在NaCl(250 mmol·L-1)胁迫72 h过程中,CsFAD2的表达量全程降低,而CsFAD6在处理24~72 h期间表达量显著升高。
茶树;△12-脂肪酸去饱和酶;非生物胁迫;基因表达
在逆境下,植物细胞中的不饱和脂肪酸的含量及其组成发生改变,以维持细胞膜的流动性和稳定性,降低逆境对膜结构的损害,增强植物的抗逆性,因此,调控植物细胞中不饱和脂肪酸的代谢,对于研究植物的抗逆机制具有重要意义。前人研究结果表明[1-3],催化不饱和脂肪酸合成的酶基因发生突变,植物细胞中不饱和脂肪酸的含量减少,植物的抗逆性(抗寒性等)减弱。
在植物不饱和脂肪酸的合成代谢途径中,△12-不饱和脂肪酸合成酶(FAD),是催化油酸脱氢形成亚油酸的关键限速酶,FAD是一种膜结合蛋白,存在于植物的内质网膜、质体膜及蓝细菌的类囊体膜上,在单不饱和脂肪酸油酸(Oleic acid,18: 1△9)的第 12和 13位碳原子之间插入1个双键,形成2个双键的多不饱和脂肪酸亚油酸(Oleic acid,18:2△9,12)[4]。根据电子供体和细胞定位不同,有 FAD2和FAD6两种类型,FAD2以细胞色素b5为电子供体,位于植物细胞的内质网上,FAD6以铁氧还蛋白为电子供体,是 FAD2质体型同工酶,存在于植物细胞的质体中,因此,FAD2和FAD6具有相同的生理功能,但亲缘关系较远[5]。
目前已经在多种植物上分离了△12-FAD基因全长cDNA,研究表明该基因表达受多种逆境胁迫的诱导,并采用转基因手段验证了该基因的功能。荧光定量PCR研究结果表明,在低温胁迫下,佛手香橼叶的FAD2[6]、棉花叶的FAD2-3和FAD2-4[7]、油橄榄果实的FAD2-1和FAD2-2[8-9]及马齿苋叶的FAD2-2[10]的表达量随着温度的降低而显著升高;在冷冻胁迫下,白杨PtFAD2过表达转基因株系的存活率明显比非转基因株系和转基因下调株系要高[11]。油橄榄FAD2和FAD6受光的调节,FAD2表达还受机械损伤的诱导[9,12],利马豆FAD2的表达受到NaCl和PEG的诱导[13]。
在茶树上,仅在龙井43上克隆了2个不饱和脂肪酸合成酶基因(FAD7和FAD8)[14],并研究了这 2个基因在非生物胁迫下表达量的变化,其他有关茶树不饱和脂肪酸合成酶基因与逆境胁迫关系的研究甚少,因此,揭示茶树FAD的功能及其对逆境胁迫响应的分子机制,对于茶树抗逆性育种具有重要的理论意义和实践价值。本研究在茶树转录组分析的基础上,以铁观音茶树芽叶为材料,采用RT-PCR技术,获得铁观音不饱和脂肪酸合成代谢关键限速酶——△12-FAD的包含完整ORF的cDN A,并对该基因进行生物信息学分析,采用实时荧光定量PCR(qRT-PCR)技术,检测该基因在低温、干旱、高盐胁迫和ABA处理下,其表达量的变化,初步揭示△12-FAD基因在逆境胁迫下的表达调控机制。
1 材料与方法
1.1 材料
取生长良好、大小一致的两年生盆栽铁观音品种茶树为材料,茶苗的种植、生长均在露天茶园。
分子生物学试剂:pEASYT®-T1载体、T1感受态细胞、TransTaq HiFi DNA Polymerase、Easyscript One-step gDNA Removal and cDNA synthesis superMix和Transstart® Tip Green qPCR superMix 试剂盒购自全式金生物技术(北京)有限公司;多糖多酚植物总RNA提取试剂盒购于天根生化科技(北京)有限公司。
1.2 方法
1.2.1 总RNA提取及cDNA合成
茶树芽叶总RNA提取方法按天根多糖多酚植物总RNA提取试剂盒方法进行,对RNA进行浓度、完整性等质量检验。参照全式金Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒的说明合成 cDNA用于RT-PCR。
1.2.2 基因ORF全长克隆
在前期铁观音茶树芽叶转录组测序的数据库中,根据序列注释的信息,从中筛选出相关的FAD编码的EST序列,通过序列比对获得与其他植物中报道的FAD2和FAD6高度同源的片段序列,DNAstar软件拼接,分别获得含有两个基因包含完整 ORF的 cDNA序列,它们均具有完整开放阅读框。为了进一步验证序列在铁观音品种中的准确性,在起始密码子上游和终止密码子下游设计RT-PCR引物(表 1),进行PCR扩增,RT-PCR反应体系和程序参照姚雪倩等[15]的方法;反应条件为 94℃,30 s;60℃,30 s;72℃,2 min,35个循环,后续克隆试验参照俞滢等[16]的方法进行。PCR产物回收、连接、转化、测序后,得到这两个基因包含完整ORF的cDNA序列。
1.2.3 生物信息学分析
用 DNAstar软件包对序列进行拼接;用DNAMAN 软件进行开放阅读框查询;核酸序列及氨基酸序列分别在 NCBI数据库中用BLAsTn和BLAsTx分析;在 MEGA5.0软件中用邻近相连法构建系统进化树;在EXPASY(http://expasy.org/tools)中用 ProtParam 及TargetP、singalP、TMHMM、Wolf Psort等工具对氨基酸序列进行生物信息学分析;用SOPMA模拟蛋白质二级结构。

表1 试验引物及其序列Table1 Primer Sequences of this study
1.2.4 茶树逆境胁迫实验
露天茶园中取生长健壮的2年生盆栽茶树分别用于低温(4℃)、ABA(100 μmol·L-1)、高盐(250 mmol·L-1NaCl)和干旱(100 g·L-1PEG)处理。低温处理:调节气候箱温度,维持在(4±1)℃,将整株茶树迅速置于气候箱中,进行低温胁迫处理,根据前期的研究结果[14],在处理后的 0、1、3、6、12、24、48、72 h取样。ABA处理参考曹红利等[17]的方法,用100 μmol·L-1ABA 溶液喷洒茶树,进行 ABA胁迫处理,分别在处理后的0、6、12、24、48、72 h取样;NaCl和PEG处理方法参考岳川等[18]方法,用 250 mmol·L-1NaCl溶液喷洒茶树,进行盐胁迫处理,分别在处理后的0、6、12、24、48、72 h取样;将茶树从花盆中取出,用自来水洗净根上泥土后浸入纯净水中平衡约15 min,将茶树移入提前配制好的 100 g·L-1PEG溶液中处理12 h,分别在处理后的0、6、12 h取样。在每个时间点上分别从至少3个枝条上取顶端第二、三片成熟叶混合为试验材料,用锡箔纸包裹并标记,所有样品采摘后液氮速冻,于-80℃保存用于提取茶树总RNA。每个处理每个时期取样设置3个生物学重复。
1.2.5 实时荧光定量PCR表达分析
以4种逆境胁迫处理的样品总RNA为模板,按照全式金的Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒的说明合成cDNA作为荧光定量PCR模板。采用Bio-Rad的CFX96 Touch荧光定量PCR仪进行 qRT-PCR检测基因表达,以茶树TATA-box binding protein gene(TBP)作为内参基因[19],荧光定量引物列于表1,设置3个生物学重复。反应体系参照 Transstart®Tip Green qPCR superMix试剂盒的方法。反应程序及数据处理参考陈静等[20]的方法:94℃,30 s;94℃,5 s;60℃,30 s,40个循环;试验数据釆用2-ΔΔCT法进行定量分析。
2 结果与分析
2.1 CsFAD2和CsFAD6克隆及序列分析
通过实验室前期的转录组数据库分析,筛选出茶树中可能的FAD基因序列,用DNAstar软件包对序列进行拼接,经NCBI BLASTx比对,从中获2条具有完整开放阅读框(ORF)的茶树FAD基因序列,分别在开放阅读框上下游设计引物RT-PCR扩增出1 184 bp和1 524 bp的条带(图1),测序验证其序列正确性。分别对它们进行BLASTn和BLASTx比对分析,结果显示在获得的序列中均具有完整的ORF,且均编码完整的△12-不饱和脂肪酸合成酶,分别与其他植物中的FAD2和FAD6具有较高的相似性,因此将它们分别命名为CsFAD2和CsFAD6。CsFAD2序列全长 1 184 bp,包含1 149 bp的ORF,编码382个氨基酸;CsFAD6序列全长1 524 bp,包含1 311 bp的ORF,编码436个氨基酸。
2.2 CsFAD2和CsFAD6的蛋白质理化性质及结构预测分析
Protparam在线软件预测CsFAD2蛋白分子式为C2074H3062N532O536S13,相对分子质量为44.44 kDa,理论等电点为 8.51。该蛋白的不稳定系数为 39.69,推测该蛋白为稳定蛋白。CsFAD6蛋白分子式为C2376H3571N613O603S17,相对分子质量为 50.92 kDa,理论等电点为9.33。该蛋白的不稳定系数为 52.52,推测该蛋白为不稳定蛋白。

图1 CsFAD2和CsFAD6 RT-PCR产物电泳图Fig. 1 Electrophoresis of RT-PCR products of CsFAD2 and CsFAD6
TMHMM server V.2.0对CsFAD2和CsFAD6氨基酸序列的跨膜结构域进行预测。结果显示 CsFAD2蛋白的 53~75、82~104、114~136、173~195、222~244、249~271 位氨基酸之间形成 6个典型的跨膜螺旋区,预测CsFAD2蛋白是膜蛋白。CsFAD6蛋白的138~160、264~283、287~306位氨基酸之间形成3个典型的跨膜螺旋区,预测CsFAD6蛋白是膜蛋白(图2)。
singalP进行信号肽预测显示 CsFAD2和CsFAD6蛋白N端不存在信号肽,属于非分泌性蛋白。Wolf Psort亚细胞定位预测显示CsFAD2定位在内质网上,CsFAD6定位在叶绿体上。SOPMA分析显示,CsFAD2和CsFAD6蛋白主要以α-螺旋、无规则卷曲、延伸链和 β-转角构成,CsFAD2中分别占32.98%、30.10%、26.18%、10.73%;CsFAD6中分别占28.90%、43.81%、22.48%、4.82%。
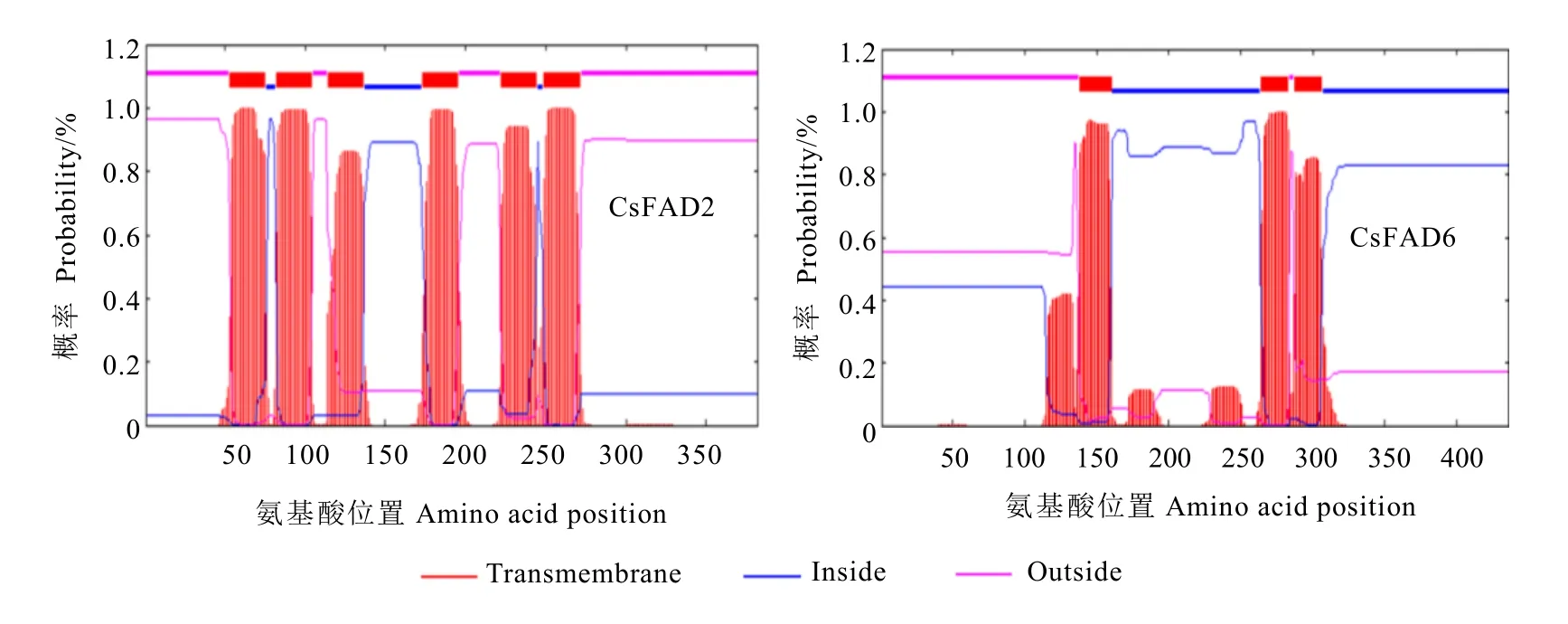
图2 CsFAD2和CsFAD6蛋白跨膜结构预测Fig. 2 Predicted transmembrane helices in proteins of CsFAD2 and CsFAD6
2.3 CsFAD2和CsFAD6的同源比对和蛋白系统进化分析
在 NCBI中对获得的核苷酸序列进行BLASTx同源比对,结果显示,CsFAD2与油茶(AIN52150.1)、珙桐(ABZ05022.1)、芝麻(XP_011080226.1)、水黄皮(AGZ02022.1)和油橄榄(AAW63040.1)等植物的FAD2的相似性分别达到 97%、84%、81%、81%和82%;CsFAD6与葡萄(XP_003634863.1)、枣(XP_015892777.1)、橙(XP_006488208.1)、可可(XP_017983888.1)、麻风树(ABU96742.1)FAD6的氨基酸序列相似性分别达到81%、79%、77%、78%和77%。序列保守结构域分析和氨基酸序列同源比对结果显示CsFAD2和CsFAD6蛋白与其他植物中的相应FAD序列同源性较高(图3)。
选取不同植物中的FAD2和FAD6构建系统进化树分析(图 4),结果显示茶树 FAD2与油茶的亲缘关系最近聚为一类;从进化树中可以看出内质网CsFAD2和CsFAD6各聚为一类,CsFAD2属于内质网型FAD2一类,CsFAD6聚在叶绿体型FAD6中。根据亚细胞定位预测、同源性比对和进化树结果分析推测,本研究获得的两条茶树△12-FAD分别属于内质网型FAD2和叶绿体型FAD6。
2.4 逆境胁迫下CsFAD2和CsFAD6的表达分析
CsFAD2和CsFAD62个基因对低温(4℃)的响应模式相同(图 5-A)。在 1~24 h低温处理期间,CsFAD2和CsFAD6的表达受低温抑制,表达量均被下调,但差异不显著。在24~48 h低温处理期间,CsFAD2相对表达量开始上升,在低温处理 48 h时CsFAD6相对表达量开始上升。在处理48 h时CsFAD2和CsFAD6相对表达量被诱导表达达到最高,显著高于低温处理的其他时期基因的相对表达量。在处理 72 h时CsFAD2和CsFAD6相对表达量下调。
ABA诱导CsFAD2和CsFAD6的表达(图5-B)。ABA(100 μmol·L-1)处理后,CsFAD2的表达显著上调,在6 h时相对表达量达到最高为 5.73,后随着处理时间的延长到 72 h,CsFAD2的相对表达量仍处于上调,在处理时间达 24 h之前均显著高于处理前的相对表达量。然而,ABA对CsFAD6的表达诱导作用没有对CsFAD2的显著,在处理 12 h时CsFAD6被诱导相对表达量最高至1.79,其他处理阶段除了 72 h时的相对表达量下调,相对表达量均上调,但差异不显著,说明 ABA对CsFAD6的表达影响较小。
CsFAD2和CsFAD6受高盐(250 mmol·L-1NaCl)胁迫的调控,但其表达模式不相同(图5-C),CsFAD2在72 h内的处理过程中表达受抑制,而CsFAD6在处理后的表达显著上调,在72 h时相对表达量达到最高为391.81。
100 gL·-1的PEG处理12 h过程中,CsFAD2和CsFAD6均被诱导表达,6 h的相对表达量分别为 2.06和1.83,12 h的相对表达量分别达到了4.65和1.96(图5-D)。

图3 CsFAD2和CsFAD6与其他植物FAD2、FAD6同源比对Fig. 3 Alignment of the deduced CsFAD2, CsFAD6 proteins and homologous proteins from other plants

图4 CsFAD2和CsFAD6与其他植物FAD2和FAD6氨基酸序列的系统进化分析Fig. 4 Phylogenetic analysis of CsFAD2, CsFAD6 and homologous proteins from other plants

图5 逆境胁迫下CsFAD2和CsFAD6的表达分析Fig. 5 Expression analysis of CsFAD2 and CsFAD6 in the leaves of tea plants under stresses
3 讨论
脂肪酸去饱和作用是植物防御系统中的一个重要组成部分,FAD是参与此调控的关键酶,在植物体中由多基因家族编码。所有已知的 ω-3和 ω-6FAD以位于高度保守区的HXXXH,HXX(X)HH和HXXHH 3个组氨酸簇为特征。这些面向细胞质一侧的组氨酸簇可能和铁原子构成了酶的活性中心[3]。本研究克隆得到 2个茶树△12-脂肪酸去饱和酶酶基因,CsFAD2和CsFAD6分别编码382和 436个氨基酸。通过亚细胞定位预测、同源比对、保守结构域预测和进化树等分析表明,CsFAD2在氨基酸序列高度保守区具有3个保守的组氨酸簇HECGHH、HRRHH和HVAHH,分别位于此序列的第 105~110、140~144和314~318位氨基酸残基;并在进化树中与其他植物FAD2聚为一类;亚细胞定位预测位于内质网上,因此推测CsFAD2属于内质网型FAD2基因。而CsFAD6在氨基酸序列高度保守区同样具有3个保守的组氨酸簇;在进化树中与叶绿体型FAD6聚为一类;亚细胞定位预测位于叶绿体上,因此推测CsFAD6属于叶绿体型FAD6基因。
本研究结果表明,茶树CsFAD2和CsFAD6在低温、ABA、高盐和干旱逆境胁迫处理下均有表达且表达受到不同程度的诱导。在4℃低温胁迫下,CsFAD2和CsFAD6的表达先下调,在24~48 h低温处理期间,CsFAD2表达量开始上升;在低温处理 48 h时CsFAD6表达量开始上升。在处理48 h时,CsFAD2和CsFAD6表达量被诱导表达达到最高,与前人的研究结果相近,表明茶树中CsFAD2和CsFAD6与低温逆境胁迫响应密切相关。Ma等[14]研究表明,在茶树中FAD7和FAD8的表达量在4℃低温处理1 h时表达量先下降,后上升,处理24 h时达到最高,后又下降。目前已经有多种脂肪酸去饱和酶基因分别从不同种植物中分离出来,并进行了功能的验证,表明植物脂肪酸去饱和酶基因在抵抗低温逆境胁迫中具有重要作用。Wada等[21]从抗寒蓝藻(Anacystis nidulans)中克隆了△12-脱饱和酶基因,并将其导入寒敏感的蓝藻,结果不饱和脂肪酸含量大为增加,受体对低温的抗性明显增强。Matos等[22]研究表明,在 22℃下拟南芥FAD2突变体的线粒体表现出多不饱和脂肪酸含量较低,而且比野生型具有更高的膜微粘度。在低温逆境胁迫前期,CsFAD2和CsFAD6的表达变化较小,后期对低温胁迫处理更敏感。茶树在低温胁迫处理达到一定程度时,茶树中不饱和脂肪酸的含量发生相应变化,以维持膜的流动性和稳定性,降低逆境对膜结构和功能的损害,从而增强植物的抗逆性。由此推测茶树CsFAD2和CsFAD6在相应低温逆境胁迫中可能发挥重要作用。
在高盐胁迫下,本研究中CsFAD2和CsFAD6均被诱导,但其表达模式不相同(图5),CsFAD2在72 h内的处理过程中表达受负调控,均被下调。CsFAD6在处理后的表达显著上调,在 72 h时表达量达到最高为391.81,在处理 48~72 h期间,CsFAD6的表达量显著高于未处理前。Zhang等[23]结果表明,与野生型相比,缺乏FAD2功能的拟南芥突变体液泡和质膜的多不饱和水平较低,液泡和质膜囊泡中的 Na+/H+交换活性降低。根细胞的细胞质中积累更多的Na+,在种子萌发和幼苗生长早期对盐胁迫比较敏感,说明了FAD2介导的高水平液泡和质膜的脂肪酸去饱和对于膜附着的 Na+/H+交换器的正常功能是必需的。在酵母中转入向日葵的FAD2-1、FAD2-3,提高了对NaCl胁迫的耐受性[24]。由此可以推测茶树在高盐逆境胁迫下,影响了细胞膜系统的脂肪酸多不饱和水平,而CsFAD2和CsFAD6在参与植物盐胁迫响应中起到了调节细胞膜系统脂肪酸不饱和水平的重要作用。
在干旱胁迫下,CsFAD2和CsFAD6表达量在100 g·L-1PEG处理0~12 h过程中被诱导表达,与前人研究结果一致,说明CsFAD2和CsFAD6能响应茶树干旱逆境胁迫。Paula等[25]研究表明,干旱胁迫影响豇豆脂肪酸合成及造成不饱和脂肪酸的降解。Zhang等[26]检测过表达的 ω-3FAD番茄植株,能够提高对干旱(PEG)胁迫的耐受性。利马豆的FAD2在干旱(PEG)胁迫下表达量显著提高[13],这些研究说明植物对干旱的耐受性与植物膜脂的去饱和化存在关系[27]。
ABA(100 μmol·L-1)胁迫处理 72 h 过程中,CsFAD2在处理6~24 h期间表达量被显著上调,而CsFAD6的表达在此期间不受 ABA影响,但在 72 h时显著降低,表明CsFAD2和CsFAD6可能参与ABA胁迫诱导反应。目前尚未有FAD基因与激素胁迫响应相关性的研究,有待后续试验探究。
本研究在茶树中克隆并分析了CsFAD2和CsFAD6在不同胁迫中的表达模式,初步确定CsFAD2和CsFAD6参与的不饱和脂肪酸代谢在茶树抵御逆境胁迫中起到重要作用。CsFAD2和CsFAD6对逆境不同程度的响应表达,可能与茶树细胞膜中不饱和脂肪酸的含量发生相应变化,以维持膜的流动性和稳定性,降低逆境对膜结构和功能的损害,从而增强植物的抗逆性有关,为后续研究不饱和脂肪酸代谢在茶树抗逆中的作用提供了基础。目标基因抵抗逆境胁迫的功能有待通过转基因技术将其转入杨树等模式植物中作深入研究。同时,FAD2可能还受光、植物生长激素和还原性辅酶的调控并参与植物对逆境的应答,因此,对△12-脂肪酸脱氢酶基因的研究不应局限于植物组织中脂肪酸组成的变化,以及不饱和脂肪酸改变所引起的生物膜的变化,应拓展到激素调控、光调控、电子传递和逆境应答等更广泛的领域。高等植物中FAD2基因是以多拷贝形式存在的,不同FAD2基因拷贝具有不同的序列特征、编码区、内含子、5′UTR 和 3′UTR长度、表达特性和功能,后续可通过克隆茶树上的FAD2基因家族的其他基因来全面研究不饱和脂肪酸合成酶基因在茶树抵御逆境胁迫中的作用。
[1]年洪娟, 陈丽梅. 不饱和脂肪酸在逆境胁迫中的作用[J].中国微生态学杂志, 2012(8): 760-762.
[2]于超. 温度胁迫下番茄内质网ω-3脂肪酸去饱和酶基因的表达和功能研究[D]. 泰安: 山东农业大学, 2009.
[3]叶静, 胡海涛, 王长春, 等. 植物脂肪酸去饱和酶与抗冷性研究进展[J]. 广东农业科学, 2011(12): 131-134.
[4]李金金, 张晶晶, 年洪娟. △12-脂肪酸去饱和酶 FAD2的基本特性及其在胁迫中的功能[J]. 生命科学研究, 2013(2):174-178.
[5]刘永红, 张丽静, 张洪荣, 等. △12-脂肪酸脱氢酶及其编码基因研究进展[J]. 草业学报, 2011(3): 256-267.
[6]Yang L, Ye J, Guo W, et al. Differences in cold tolerance and expression of two fatty acid desaturase genes in the leaves between fingered citron and its dwarf mutant [J]. Trees, 2012,26(4): 1193-1201.
[7]Kargiotidou A, Deli D, Galanopoulou D, et al. Low temperature and light regulate delta 12 fatty acid desaturases(FAD2) at a transcriptional level in cotton (Gossypium hirsutum) [J]. Journal of ExperiMental Botany, 2008, 59(8):2043-2056.
[8]Matteucci M, D'Angeili S, Errico S, et al. Cold affects the transcription of fatty acid desaturases and oil quality in the fruit of Olea europaea L. genotypes with different cold hardiness [J]. Journal of Experimental Botany, 2011, 62(10):3403-3420.
[9]Hernández ML, Padilla MN, Sicardo MD, et al. Effect of different environmental stresses on the expression of oleate desaturase genes and fatty acid composition in olive fruit [J].Phytochemistry, 2011, 72(2): 178-187.
[10]Teixeira MC, Coelho N, Olsson ME, et al. Molecular cloning and expression analysis of three omega-6 desaturase genes from purslane (Portulaca oleracea.L) [J]. Biotechnology Letters, 2009, 31(9): 1089-1101.
[11]Zhou Z,Wang M,Zhao S,et al. Changes in freezing tolerance in hybrid poplar caused by up-and down-regulation of PtFAD2 gene expression [J]. Transgenic Research, 2010,19(4): 647-654.
[12]Hernandez M L, Mancha M, Martinez-Rivas J M, et al.Molecular cloning and characterization of genes encoding two microsomal oleate desaturases (FAD2) from olive [J].Phytochemistry, 2005, 66(12): 1417-1426.
[13]Zhang YM, Wang CC, Hu HH, et al. Cloning and expression of three fatty acid desaturase genes from cold-sensitive lima bean (Phaseolus lunatus.L) [J]. Biotechnology Letters, 2011,33(2): 395-401.
[14]Ma QP,You E,Wang J,et al. Isolation and expression of CsFAD7 and CsFAD8, two genes encoding ω-3 fatty acid desaturase fromCamellia sinensis[J]. Acta Physiologiae Plantarum, 2014, 36(9): 2345-2352.
[15]姚雪倩, 岳川, 杨国一, 等. 茶树牻牛儿基牻牛儿基焦磷酸合成酶基因CsGGDPS的克隆及表达分析[J]. 茶叶科学,2017, 37(1): 86-96.
[16]俞滢, 陈丹, 孙君, 等. 茉莉花萜类合成酶基因 JsTPS的克隆及其表达分析[J]. 园艺学报, 2016, 43(2): 356-364.
[17]曹红利, 岳川, 郝心愿, 等. 茶树胆碱单加氧酶CsCMO的克隆及甜菜碱合成关键基因的表达分析[J]. 中国农业科学, 2013, 46(15): 3087-3096.
[18]岳川, 曹红利, 周艳华, 等. 茶树谷胱甘肽还原酶基因CsGRs的克隆与表达分析[J]. 中国农业科学, 2014, 47(16):3277-3289.
[19]Wu ZJ, Tian C, Jiang Q, et al. Selection of suitable reference genes for qRT-PCR normalization during leaf development and hormonal stimuli in tea plant (Camellia sinensis) [J].Scientific Reports, 2016: 1-10. DOI: 1038/srep19748.
[20]陈静, 俞滢, 张丹丹, 等. 白茶萎凋过程中儿茶素合成关键酶基因表达分析[J]. 南方农业学报,2016(8): 1364-1369.
[21]Wada H, Gombos Z, Murata N, et al. Enhancement of chilling tolerance of a cyanobacterium by genetic manipulation of fatty acid desaturation [J]. Nature, 1990,347(9): 200-203.
[22]Matos AR, Hourton-Cabassa C, Ciçek D, et al. Dominique ciçek.alternative oxidase involvement in cold stress response of arabidopsis thaliana fad2 and FAD3+ cell suspensions altered in membrane lipid composition [J]. Plant Cell Physiology, 2007, 48(6): 856-865.
[23]Zhang JT, Liu H,Sun J, et al. Arabidopsis fatty acid desaturase FAD2 is required for salt tolerance during seed germination and early seedling growth [J]. Plos One, 2012,7(1): e30355.
[24]Sonia RV, Alicia SG, Jose Manuel MR, et al. Fluidization of membrane lipids enhances the tolerance of saccharomyces cerevisiae to freezing and salt stress [J]. Applied amp;Environmental Microbiology, 2007, 73(1): 110-116.
[25]Paula FMD, Thi ATP, Zuily-Fodil Y, et al. Effects of water stress on the biosynthesis and degradation of polyunsaturated lipid molecular species in leaves ofVigna unguiculata[J]. Plant Physiology amp; Biochemistry, 1993,31(5): 707-715.
[26]Zhang M, Barq R, Yin M, et al. Modulated fatty acid desaturation via overexpression of two distinct ω-3 desaturases differentially alters [J]. Plant Journal, 2005,44(3): 361-371.
[27]RG Upchurch. Fatty acid unsaturation, mobilization, and regulation in the response of plants to stress [J].Biotechnology Letters,2008, 30(6): 967-977.
Cloning and Expression Analysis of △12-fatty Acid Desaturase in Tea Plants
CHEN Dan, YU Ying, YUE Chuan, WANG Pengjie, CHEN Jing, CHEN Guixin*, YE Naixing*
College of Horticulture,Fujian Agriculture and Forestry University/Key Laboratory of Tea Science at Universities in Fujian, Fuzhou 350002, China
Based on the transcriptome database of tea plants, the cDNAs (CsFAD2 and CsFAD6) including full ORFs of the key rate-limiting enzyme-FAD (△12-fatty acid desaturase) in the unsaturated fatty acid synthesis pathway were cloned from the buds and leaves of tea cultivar Tieguanyin by RT-PCR .The full length of cDNA ofCsFAD2was 1 184 bp, which contained a 1 149 bp ORF encoding 382 amino acids with 97% homologous to theCoFAD2.Subcellular localization prediction showed thatCsFAD2was localized to the endoplasmic reticulum. The full length of cDNA ofCsFAD6was 1 425 bp and contained a 1 311 bp ORF encoding 436 amino acids, which was 81%homologous toVvFAD6. It was predicted to be located on the chloroplast. Quantitative PCR analysis showed that the expression ofCsFAD2andCsFAD6were induced by cold stress (4℃), which had the highest expression levels at 48 h.Similarly,CsFAD2andCsFAD6were induced by 100 g·L-1PEG treatment for 12 h. The expression ofCsFAD2was significantly up-regulated under the treatment of ABA(100 μmol·L-1) for 6-24 h. While the expression ofCsFAD6was not affected by ABA during this period and dramatically down-regulated at 72 h. The expression ofCsFAD2was repressed under NaCl (250 mmol·L-1) treatment. Inversely, the expression ofCsFAD6was significantly induced by NaCl treatment from 24 to 72 h.
Camellia sinensis, △12-fatty acid desaturase enzyme, abiotic stresses, gene expression
TS272.5+1;Q946.84+1
A
1000-369X(2017)06-541-10
2017-03-27
2017-06-13
国家自然科学基金项目(31270735,31600555)、福建省“2011协同创新中心”中国乌龙茶产业协同创新中心专项(闽教科〔2015〕75号)、福建省自然科学基金(2017J01616)、国家现代农业(茶叶)产业技术体系建设专项资金项目(CARS-19)
陈丹,女,在读硕士生,研究方向为茶树栽培育种与生物技术。*通信作者:ynxtea@126.com,guixinchen@126.com
