利用木糖产油脂酵母的筛选、鉴定及发酵条件优化
2017-12-11马素梅宋春艳李珍益江南大学工业生物技术教育部重点实验室江苏无锡141江南大学生物工程学院江苏无锡141
马素梅,曹 钰,宋春艳,罗 炜,李珍益(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 141; .江南大学 生物工程学院 ,江苏 无锡 141)
利用木糖产油脂酵母的筛选、鉴定及发酵条件优化
马素梅1,2,曹 钰1,2,宋春艳2,罗 炜2,李珍益2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122; 2.江南大学 生物工程学院 ,江苏 无锡 214122)
采用磷酸香兰素比色法从环境中筛选分离得到1株能够利用木糖产油脂的114号酵母菌株,通过生理生化特性实验及分子生物学实验对该菌株进行鉴定,并对该菌株的发酵条件进行优化,考察了培养时间、接种量、装液量和发酵温度对菌株产油能力的影响,通过GC-MS对该菌株最优发酵条件下所产油脂进行脂肪酸组成分析。结果表明:该菌株为胶红酵母(Rhodotorulamucilaginous),在啤酒糟酶解液中培养状况良好;最优发酵条件为培养时间5 d,接种量12%,装液量30 mL/250 mL,培养温度32℃。在最优发酵条件下,生物量、油脂产量和油脂含量分别为16.92、4.44 g/L和26.22%。所产油脂中不饱和脂肪酸含量76.923%,油酸含量59.087%,与植物油类似。
胶红酵母;木糖;鉴定;微生物油脂;优化
伴随着世界范围内原油储量的日益下降,全球气候变暖效应日趋严重,迫切需要一种能够再生的清洁能源来取代化石燃料[1]。生物柴油具有较高的热值,且污染小,较化石燃料安全性高,已经成为当前最有潜力的替代能源。目前,市场上70%~75%的生物柴油的原料都来自餐饮业废弃油、植物油、动物脂肪,生产成本较高,可行性较差[2]。微生物具有生长周期短、不受气候限制、易于实现大规模生产等优点,所以通过产油微生物积累微生物油脂是过去利用大豆等油料作物生产生物柴油的良好替代品。美国国家可再生能源实验室的报告特别指出微生物油脂将是生物柴油产业和生物经济的重要研究方向[3]。中国科学院大连化物所生物技术部也进行了产油菌种培育和筛选方面的研究工作,并取得了一定的效果[4-5]。目前,已知的多种产油微生物都只能利用葡萄糖生产油脂,通过这种方式生产生物柴油增加了经济成本,限制了微生物油脂的发展[6]。能否釆用廉价的原料降低成本是油脂生产能否规模化、产业化的关键因素之一[7]。天然木质纤维素主要由纤维素、半纤维素和木质素组成,在大米草、甘蔗渣和啤酒糟这些生物质中半纤维素含量高于纤维素[8-10],D-木糖作为半纤维素水解的主要产物,若能加以利用,必然会增加经济效益。近年来,关于产油脂微生物如微藻、红酵母、丝状真菌等的研究主要侧重葡萄糖作为碳源的研究[11-13],也有一些利用木糖的研究报道[4,8-9]。开发微生物油脂作为生物柴油的生产原料,特别是采用来源广泛的木质纤维素作为碳源生产微生物油脂,将具有一定的现实意义。
本研究旨在筛选1株能利用木糖产油脂的酵母,并利用预处理啤酒糟的水解糖发酵生产微生物油脂,对该菌株的发酵条件进行了优化,为啤酒糟酶解液发酵生产油脂奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
菌种:实验室保藏的产色素酵母及环境中筛选所得的酵母菌株共计138株;啤酒糟:青岛啤酒提供,并经过一定预处理后备用;纤维素酶:白银赛诺生物科技有限公司提供,酶活156 U/g。
1.1.2 培养基
YPD培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母膏10 g/L, pH自然;
限氮培养基[14]:葡萄糖40 g/L,酵母膏1 g/L,(NH4)2SO42 g/L,K2HPO47 g/L,NaH2PO42 g/L,MgSO4·7H2O 1.5 g/L,pH自然;
YPX培养基:蛋白胨20 g/L,D-木糖20 g/L,酵母膏10 g/L,自然pH;
发酵培养基:葡萄糖50 g/L,酵母膏0.5 g/L,(NH4)2SO42 g/L,KH2PO42 g/L,Na3C6H5O70.5 g/L,MgSO4·7H2O 1.5 g/L,pH自然。
1.1.3 仪器与设备
TCL-16G型台式高速离心机,上海医用分析仪器厂;DHG-9123A型电热恒温鼓风干燥箱;PYX-DHS-50×65-B隔水式电热恒温培养箱;HH-S4数显恒温水浴锅;STARTER3100实验室pH计;ZQZY-70B振荡培养箱;PA2014N型电子天平0429;TU-1810型紫外可见分光光度计;BME显微镜;SW-CJ-ZFD洁净工作台;酵母基因组DNA快速抽提试剂盒,上海生物工程有限公司;Tracems气相色谱质谱联用仪,美国Finnigan质谱公司。
1.2 实验方法
1.2.1 菌种的筛选
1.2.1.1 初筛
从环境中采样,于YPD液体培养基中富集过夜,稀释适当倍数涂布于YPD固体培养基,28℃培养2 d,挑取红色菌落,镜检观察是否为酵母菌。分离到的酵母菌接种于限氮培养基,28℃,180 r/min,培养72 h,测定生物量、油脂含量和油脂产量。
1.2.1.2 木糖利用实验
所筛酵母接种于D-木糖质量浓度为20 g/L的YPX培养基,28℃,180 r/min,培养72 h,进行木糖利用实验,筛选能利用木糖的酵母菌株。
1.2.1.3 啤酒糟酶解液发酵实验
将啤酒糟以50 U/g(以底物质量计)的比例加入纤维素酶液,缓冲液为0.05 mol/L的柠檬酸-柠檬酸钠,pH 4.8,加入适量青霉素抑制杂菌生长。在50℃,120 r/min 条件下酶解48 h,灭酶过滤得到啤酒糟酶解液,121℃灭菌20 min,接种产油效果较好且能利用木糖的几株待测菌株32℃,180 r/min,培养5 d进行发酵实验。再次筛选,最终选出性能较好的实验菌株。
1.2.2 菌株鉴定
1.2.2.1 形态观察
显微形态:挑取酵母菌培养液稀释一定倍数,吸取1滴在洁净的载玻片上,盖上盖玻片,用高倍镜观察酵母细胞的形态、大小和繁殖方式。
菌落形态:将新鲜培养的酵母菌在YPD平板上划线,30℃培养3 d,观察菌落的颜色、质地、形状等特征。
1.2.2.2 生理生化实验
根据《酵母菌的特征与鉴定手册》[15]所述方法,对菌株进行糖发酵、碳/氮源同化和生长温度实验。
1.2.2.3 26S rDNA分析
使用酵母基因组DNA快速抽提试剂盒提取酵母的总DNA,使用通用引物NL-1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL-4(5′-GGTCCGTGTTTCAAGACG G-3′)对菌株26S rDNA近5′端的D1/D2区域进行PCR扩增,目标产物的长度大约为600 bp。PCR反应条件为:94℃变性1 min,53℃退火1 min,72℃延伸1 min,30个循环。
1.2.3 种子液的制备
从斜面挑1环酵母到YPD培养基中,28℃,180 r/min振荡培养24 h,无菌水离心洗涤2次重悬制备种子液。
1.2.4 菌株在不同pH条件下的生长状况
将YPD培养基分别用盐酸调pH为2.0~9.5,间隔0.5个单位,装液量30 mL/250 mL,取新鲜制备的种子液以8%的接种量接种于不同pH的YPD培养基中,28℃,180 r/min,振荡培养3 d,测定生物量、油脂产量及油脂含量。
1.2.5 菌株发酵条件的优化
取新鲜制备的种子液,以不同的接种量接种于发酵培养基,在不同的发酵温度、装液量条件下,培养不同的时间,通过测定生物量、油脂产量和油脂含量确定最佳发酵条件。
1.2.6 GC-MS分析油脂脂肪酸组成
将最优发酵条件下得到的油脂去除培养基组分,洗涤、离心,重复操作,直到菌泥颜色均匀无杂质,真空冷冻干燥24 h,得到冻干菌粉。
油脂提取[16]:每克菌体加5 mL 4 mol/L的盐酸,室温放置30 min,沸水浴3 min,-20℃冷却,加2倍体积的甲醇-氯仿(体积比1∶1)溶液,充分振荡萃取,8 000 r/min,离心5 min。下层转移至新的离心管,加等体积的0.1 mol/L 的氯化钠溶液,振荡离心,弃上清,蒸干得油脂。
脂肪酸甲酯化[17]:得到的干燥油脂,加2 mL 0.6 mol/L的氢氧化钾-甲醇溶液,2 mL正己烷,剧烈振荡2 min,30℃水浴15 min,加饱和氯化钠溶液5 mL,静置分层,取正己烷层用于GC-MS分析[18]。
1.2.7 生物量和油脂含量的测定
生物量:发酵液在8 000 r/min 条件下离心5 min,蒸馏水洗涤2次后收集菌体,105℃烘干至恒重,称量并记录数据;油脂含量:磷酸香兰素比色法[19]。
2 结果与讨论
2.1 菌株的筛选
2.1.1 初筛
将实验室保藏和分离自不同环境的酵母菌138株,接种限氮培养基,28℃,180 r/min,摇瓶培养72 h,测定菌株的生物量、油脂含量和油脂产量。产油能力较好的10株菌株结果见表1。从表1可以看出,10株菌株油脂含量均大于20%,其中70号菌株油脂含量最高,达到30.29%。
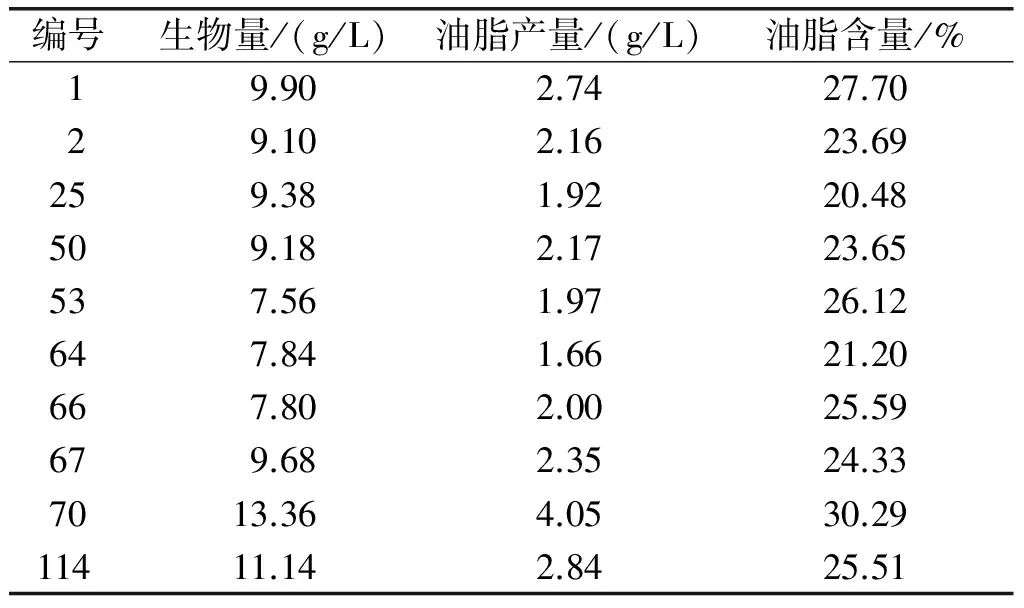
表1 初筛部分结果
2.1.2 木糖的利用(见表2)

表2 木糖利用实验结果
注:“-”表示阴性;“+”表示阳性。下同。
从表2可以看出,之前产油效果较好的1、2号和70号酵母在木糖作唯一碳源的YPX培养基中均不能正常生长,而编号25、50、53、64、66、67、114号酵母可以较好利用木糖,但这些菌株在YPX培养基中油脂含量显著低于以葡萄糖为碳源的限氮培养基,油脂含量仅为6.61%~12.19%。综合表1、表2的结果可知,67、114号两株酵母的性能相对较好。
2.1.3 啤酒糟酶解液中的复筛
选择产油效果较好且能利用木糖的67号和114号酵母菌株,此外考虑到在限氮培养时70号酵母油脂产量和油脂含量都是最高,将这3株酵母接种啤酒糟酶解液进行发酵实验,再次筛选,最终选出性能较好的实验菌株。结果见表3。
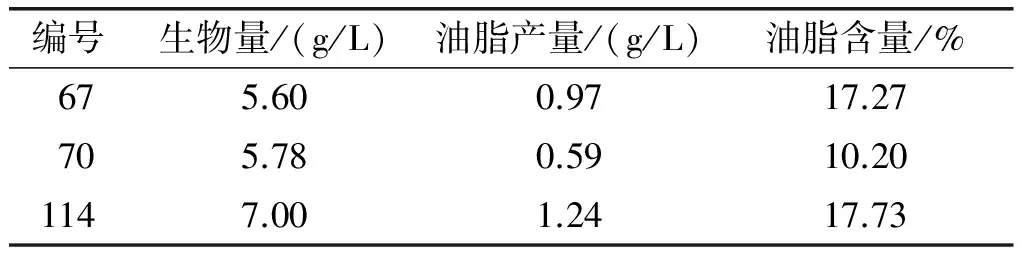
表3 啤酒糟酶解液发酵实验结果比较
对啤酒槽酶解液中糖的分析显示,其中含有约40%葡萄糖和60%木糖。由表3结合表1和表2可以看出,70号酵母菌虽然在葡萄糖为碳源的培养基中的生长和油脂含量明显优于67号和114号酵母菌,但由于其不能利用木糖,67号和114号酵母菌株油脂含量达到17%以上,而70号菌株在啤酒槽酶解液中的油脂含量显著低于其他两株酵母菌,只有10.20%。从生物量结果可以看出,114号菌株生物量最高,达到7.00 g/L,故选择114号作为实验菌株进行进一步研究。
2.2 菌种鉴定
2.2.1 形态观察
114号菌株菌落呈浅红色,表面湿润有光泽,边缘较平滑,菌落易挑起。菌体细胞呈椭球形,大小为(3.6~6.6 μm)×(2~ 3.6 μm),以出芽方式进行繁殖,见图1,左图为114号菌株的平板菌落形态,右图为细胞显微形态(100×10)。
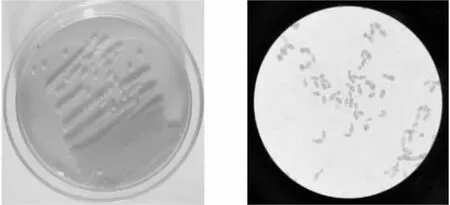
图1114号菌株的平板菌落形态和细胞显微形态(100×10)
2.2.2 生理生化实验(见表4~表6)
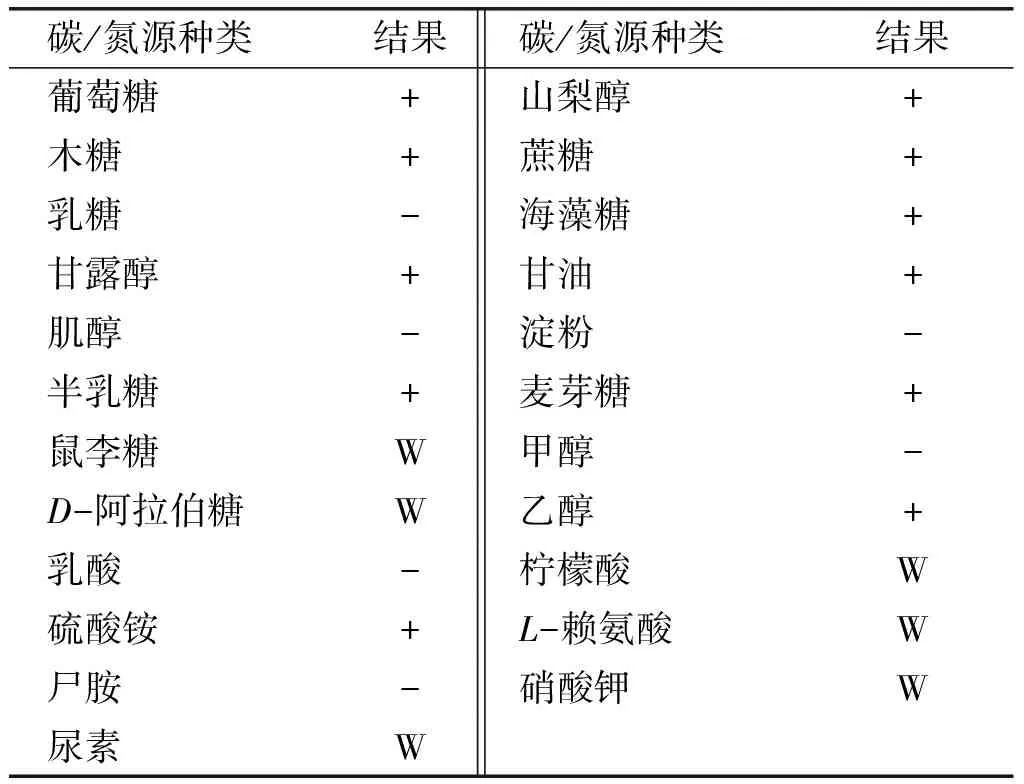
表4 114号菌株的碳/氮源同化实验结果
注:W为弱阳性反应。

表5 114号菌株的生长温度实验结果

表6 114号菌株的糖发酵实验结果
注:“-”表示不发酵该糖。
从表4可以看出,114号酵母能利用组成啤酒糟中的多种单糖,木糖、阿拉伯糖、半乳糖等,是一株能利用啤酒糟半纤维素多种水解单糖组分的产油酵母。
通过比对《酵母菌的特征与鉴定手册》,根据表4、表5和表6结果可初步确定114号菌株为胶红酵母(Rhodotorulamucilaginous)。
2.2.3 分子生物学鉴定
以通用引物NL-1和NL-4扩增114号菌株26S rDNA近5′端的D1/D2区,其PCR产物经体积分数1%的琼脂糖凝胶电泳,得到片段大约为600 bp的条带,见图2。

图2 114号菌株的26S rDNA的PCR产物电泳图
PCR产物回收后纯化,由上海生物工程有限公司进行序列测定。根据测序结果,在NCBI上用BLAST对扩增序列进行同源性比较,发现114号菌株与Rhodotorulamucilaginous具有99%以上的同源性,亲缘关系最近,与生理生化结果一致,由此可确定114号菌株为Rhodotorulamucilaginous(胶红酵母)。
2.3 胶红酵母菌株在不同pH条件下的生长状况
将胶红酵母菌株种子液以8%的接种量接种于不同pH的YPD培养基中,28℃,180 r/min,振荡培养3 d,测定生物量、油脂含量和油脂产量,结果见图3。
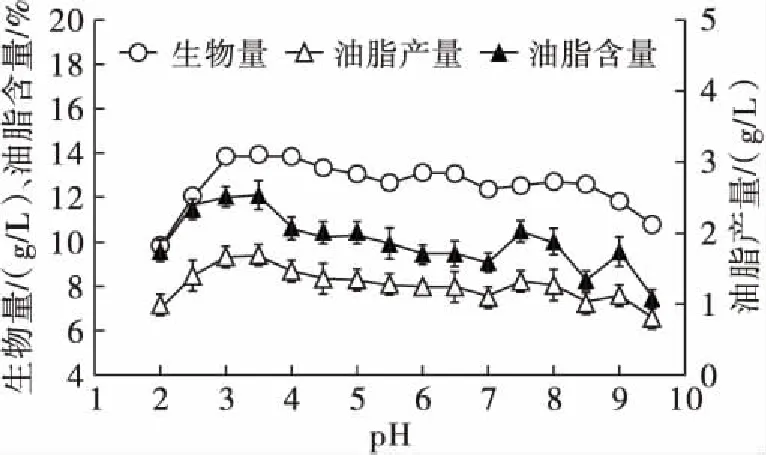
图3 不同pH条件下的生长结果
从图3可以看出,胶红酵母菌株的耐酸性较强,在pH 2.0的环境下依然可以生长良好,生物量达到近10 g/L,同时胶红酵母菌株可生长的pH范围很大,在pH 2.0~9.5的范围内均可生长,生物量都在9.5 g/L以上。与偏碱性环境相比,胶红酵母菌株在偏酸性pH 4.0左右环境中生长较旺盛,油脂含量也较碱性条件高,这一特性对后期利用木质纤维酶解液的发酵十分有利。
2.4 胶红酵母菌株发酵条件优化
2.4.1 培养时间的优化
取新鲜制备的种子液,以10%的接种量接种到发酵培养基中,装液量30 mL/250 mL,28℃,180 r/min 分别培养2、3、4、5、6 d,测定生物量、油脂含量和油脂产量,结果见图4。
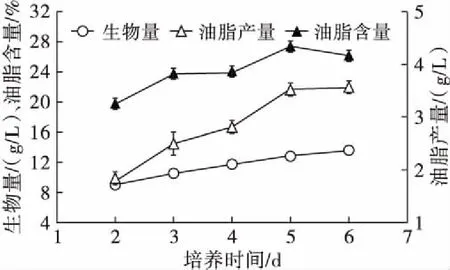
图4 培养时间的优化
从图4可以看出,随着培养时间的延长,生物量、油脂含量、油脂产量均呈现上升趋势,当培养时间达到5 d时,生物量达到一个较高水平,油脂产量和油脂含量均达到最大值,所以选择5 d为最佳培养时间进行进一步实验。
2.4.2 接种量的优化
取新鲜制备的种子液,分别以5%、8%、10%、12%、15%的接种量接种到发酵培养基中,装液量30 mL/250 mL,28℃,180 r/min培养5 d,测定生物量、油脂含量和油脂产量,结果见图5。
从图5可以看出,随着接种量的升高,生物量、油脂产量及油脂含量呈现上升趋势,当接种量达到12%时,生物量及油脂产量达到一个最大值,之后开始下降,所以选择12%的接种量进行进一步实验。

图5 接种量的优化
2.4.3 装液量的优化
取新鲜制备的种子液,以12%接种量接种到发酵培养基中,装液量分别为20、30、40、50 mL/250 mL,28℃,180 r/min培养5 d,测定生物量、油脂含量和油脂产量,结果见图6。
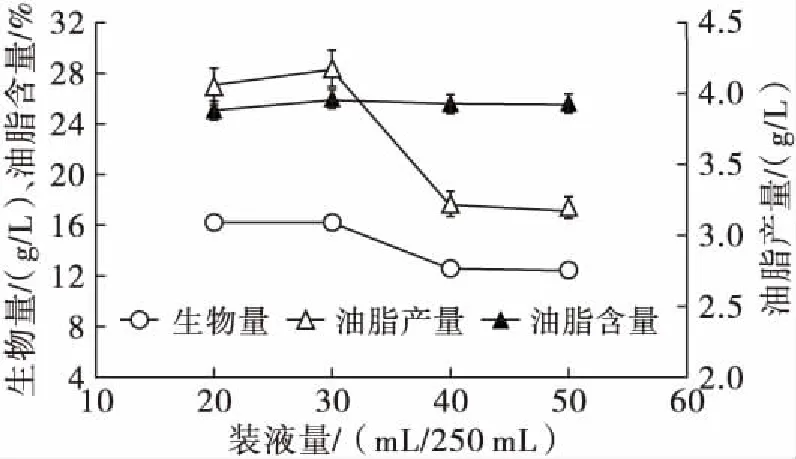
图6 装液量的优化
从图6可以看出,装液量较低时,生物量、油脂产量及油脂含量均表现良好,呈现上升趋势,装液量达到30 mL/250 mL时,生物量、油脂产量及油脂含量达到最大。在恒定的转速下装液量少时供氧较好,对于好氧菌来说生长较好。可以选择装液量30 mL/250 mL为最适装液量。
2.4.4 发酵温度的优化
取新鲜制备的种子液,以12%接种量接种到发酵培养基中,装液量为30 mL/250 mL,发酵温度分别为25、28、30、32、35℃,180 r/min培养5 d,测定生物量、油脂含量和油脂产量,结果见图7。

图7 发酵温度的优化
从图7可以看出,随着发酵温度的升高,生物量、油脂产量及油脂含量呈现上升趋势,发酵温度30℃时,生物量达到最大值,为17.18 g/L,而油脂产量及油脂含量较低,32℃时,油脂产量和油脂含量均有所升高,分别为4.44 g/L和26.22%,生物量也维持在一个较高水平,达到16.92 g/L,继续升高发酵温度,生物量下降,这与表5中生理生化特性相一致,因而选择32℃为最适发酵温度。
2.5 油脂脂肪酸组成分析(见表7)
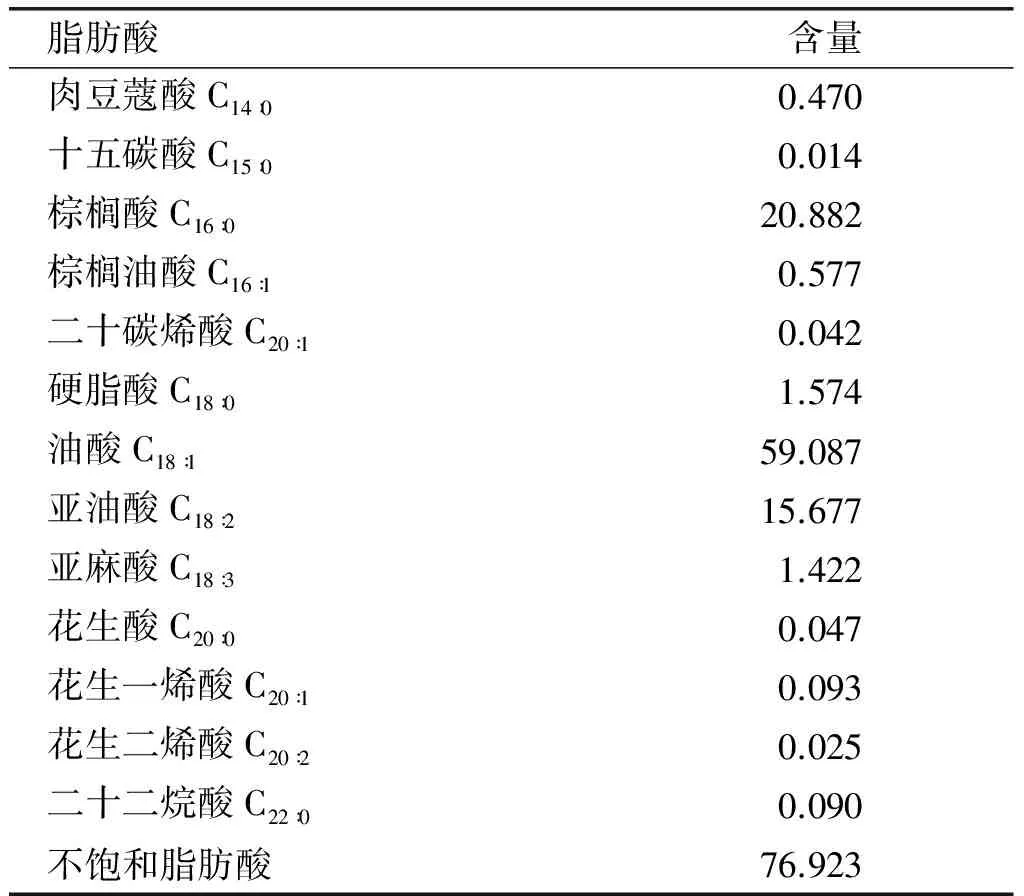
表7 胶红酵母菌株所产油脂脂肪酸组成及含量 %
从表7可以看出,胶红酵母菌株所产油脂脂肪酸组成中不饱和脂肪酸含量较高,达到76.923%,不饱和脂肪酸中油酸含量最高,达到59.087%。较高的不饱和脂肪酸含量与植物油类似,可作为油料作物的替代品用于生产生物柴油。
3 结 论
从环境中筛选得到1株能够利用木糖产油脂的114号酵母菌株,经过经典的形态和生理生化特性鉴定和26S rDNA分析,鉴定为胶红酵母(Rhodotorulamucilaginous)。胶红酵母114号菌株能利用啤酒槽中的多种糖组分进行生长,对pH具有较强耐受性,可在pH 2.0~9.5范围内良好生长。对该菌株发酵条件进行优化,得到最优发酵条件为培养时间5 d,接种量12%,装液量30 mL/250 mL,培养温度32℃。在最优发酵条件下,生物量、油脂产量和油脂含量分别为16.92、4.44 g/L和26.22%。对胶红酵母114号菌株所产油脂经GC-MS分析,其不饱和脂肪酸含量76.923%,与植物油类似。由于该菌株能不同程度地利用啤酒糟酶解液里的主要单糖(葡萄糖、木糖和阿拉伯糖)转化为油脂贮存在胞内,具备在生物质转化过程中进行全糖利用的潜力,为啤酒糟酶解液发酵生产油脂奠定了基础。
[1] TOQUERO C,BOLVIA S. Effect of four pretreatments on enzymatic hydrolysis and ethanol fermentation of wheat straw. Influence of inhibitors and washing[J]. Bioresour Technol,2014,157(2): 68-76.
[2] LI S L, FENG S L, LI Z T, et al. Isolation,identification and characterization of oleaginous fungi from the soil of Qinghai Plateau that utilizeD-xylose[J]. Afric J Microbiol Res,2011,5(15): 2075-2081.
[3] TYSON K S,BROZELL J,WALLACE R,et al. Biomass oil analysis: research needs and recommendations[R]. Golden: National Renewable Energy Laboratory,2004.
[4] 李永红,刘波,孙艳,等. 广谱碳源产油酵母菌的筛选[J]. 中国生物工程杂志,2005,25(12): 39-44.
[5] 林金涛,沈宏伟,张泽会,等. 圆红冬孢酵母两阶段培养法生产微生物油脂[J]. 生物工程学报,2010,26(7): 997-1002.
[6] LI Y H,ZHAO Z B,BAI F W. High-density cultivation of oleaginous yeastRhodosporidiumtoruloidesY4 in fed-batch culture[J]. Enzyme Microb Technol,2007,41(3): 312-317.
[7] YUSUF N,KAMARUDIN S K,YAAKUB Z. Overview on the current trends in biodiesel production[J]. Energ Convers Manage,2011,52(7): 2741-2751.
[8] 沈珺珺,李富超,杨庆利,等. 皮状丝孢酵母利用大米草水解液发酵生产微生物油脂[J]. 海洋科学,2007,31(8): 38-41.
[9] 潘丽霞,杨登峰,邵利,等. 利用蔗渣半纤维素水解液产油酵母的筛选、鉴定及发酵实验[J]. 微生物学通报,2008,35(8): 1176-1181.
[11] WU S,ZHAO X,SHEN H,et al. Microbial lipid production byRhodosporidiumtoruloidesunder sulfate-limited conditions[J]. Bioresour Technol,2011,102(2): 1803-1807.
[12] PENG X W,CHEN H Z. Microbial oil accumulation and cellulase secretion of the endophytic fungi from oleaginous plants[J]. Ann Microbiol,2007,57(2): 239-242.
[13] KATTNER G,HAGEN W,LEE R F,et al. Perspectives on marine zooplankton lipids[J]. Can J Fish Aquat Sci,2007,64(11): 1628-1639.
[14] 叶思特,郭丽琼,刘晓蓉,等. 产油微生物的筛选[J]. 华南农业大学学报,2012,33(3): 384-388.
[15] 巴尼特. 酵母菌的特征与鉴定手册[M]. 山东 青岛:青岛海洋大学出版社,1991.
[16] 孙晓璐,孙玉梅,曹芳,等. 对产油脂酵母的细胞破碎方法及油脂提取效果的比较[J]. 河南工业大学学报(自然科学版),2007,28(4): 67-69.
[17] 马占军,蔡冠竟,杨旭俊,等. 一株高效产油脂真菌的选育及其油脂成分分析[J]. 厦门大学学报(自然科学版),2012,51(6): 1079-1084.
[18] 孙士勇. 黄酒米浆水培养锁掷酵母及废水回用的研究[D]. 江苏 无锡: 江南大学, 2016.
[19] 王美珠. 产油皮状丝孢酵母耐高温菌株的诱变筛选及发酵调控[D]. 上海:华东理工大学,2013.
Screening,identificationandoptimizationoffermentationconditionofoleaginousyeastusingxylose
MA Sumei1,2, CAO Yu1,2, SONG Chunyan2, LUO Wei2, LI Zhenyi2
(1.The Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,Jiangsu, China; 2.School of Biotechnology,Jiangnan University,Wuxi 214122, Jiangsu, China)
An oleaginous yeast (strain 114) utilizing xylose was screened and isolated from nature environment by the phosphoric acid-vanillin reaction. This strain was identified based on physiological and biochemical characterization and 26S rDNA sequence analysis. The fermentation conditions of strain 114 were optimized, and the effects of culture time, inoculation amount, fermentation temperature and media amount on oil production capacity of the strain were investigated. The fatty acid composition of the obtained oil was analyzed by GC-MS. The results showed that the strain was identified asRhodotorulamucilaginous, and it grew well in enzymolysis liquid of pretreated brewer’s spent grain. The optimal fermentation conditions were obtained as follows: culture time 5 d, inoculation amount 12%, fermentation temperature 32℃ and media amount 30 mL/250 mL. Under these conditions, the biomass, oil yield and oil content were 16.92, 4.44 g/L and 26.22% respectively. The contents of unsaturated fatty acid and oleic acid were 76.923% and 59.087% respectively, which were similar to vegetable oil.
Rhodotorulamucilaginous; xylose; identification; microbial oil; optimization
2016-12-25;
2017-05-22
国家高技术研究发展863资助项目(2013AA102109);江苏高校优势学科建设工程资助项目
马素梅(1992),女,硕士研究生,研究方向为木质纤维素预处理及单细胞油脂(E-mail)m_susie@163.com。
曹 钰,副教授(E-mail)tsaoy5@jiangnan.edu.cn。
生物工程
Q935;TQ920.1
A
1003-7969(2017)10-0115-06
