血清激光拉曼光谱在非小细胞肺癌分期中的作用
2017-12-11张少鸿
王 虹 张少鸿
(广东药学院附属第一医院呼吸科,广东 广州 510080)
血清激光拉曼光谱在非小细胞肺癌分期中的作用
王 虹 张少鸿1
(广东药学院附属第一医院呼吸科,广东 广州 510080)
目的探讨血清激光拉曼光谱在非小细胞肺癌分期中的作用。方法收集非小细胞肺癌Ⅰ期患者23例,Ⅱ期24例,Ⅲ期19例,Ⅳ期11例和健康对照组14例的静脉血清,每个血清样品测3个点,将同一样品的3条光谱平均,以此代表该样品的血清拉曼光谱信号,将5组拉曼光谱信号数据采用单因素方差分析、主成分分析(PLA)、线性判别分析(LDA)、交叉检验进行统计学处理。结果平均拉曼光谱谱峰强度由健康对照组、非小细胞肺癌Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期逐渐减弱。在848 cm-1、999 cm-1、1 152 cm-1、1 446 cm-1及1 658 cm-1处以健康对照组峰强最强,Ⅲ期、Ⅳ期最弱,除Ⅲ期、Ⅳ期两组间无统计学差异外,余各组两两比较均有统计学差异(Plt;0.05)。健康对照组、Ⅰ期、Ⅱ期和Ⅲ、Ⅳ期血清拉曼光谱诊断灵敏度分别为85.71%、65.21%、75%和86.67%,特异性分别为88.73%、100%、96.27%和91.91%,判别总准确性为92.21%(71/77)。结论血清拉曼光谱分析可有效区分Ⅰ、Ⅱ期和Ⅲ、Ⅳ期非小细胞肺癌患者。
激光拉曼光谱;非小细胞肺癌
非小细胞肺癌的分期影响其后续治疗方案。激光拉曼光谱技术是一种分子振动光谱技术,具有分子水平的肿瘤检测和诊断能力。已有研究认为应用激光拉曼光谱可鉴别肺癌及健康人〔1〕。本文应用激光拉曼光谱检测非小细胞肺癌患者血清,观察其在肺癌分期的作用。
1 资料与方法
1.1一般资料 选取2013年10月至2014年12月在广东药学院附属第一医院呼吸科、肿瘤科及胸外科住院经病理明确诊断的非小细胞肺癌患者77例,按国际肺癌研究学会公布的肺癌分期系统进行分期〔2〕,Ⅰ期23例,平均年龄(65.00±10.92)岁,男15例,女8例,鳞癌12例,腺癌10例,黏液表皮癌1例;Ⅱ期24例,平均年龄(64.71±8.61)岁,男13例,女11例,腺癌13例,鳞癌9例,腺鳞癌1例,黏液表皮癌1例;Ⅲ期19例,平均年龄(62.63±11.88)岁,男14例,女5例,腺癌11例,鳞癌7例,腺鳞癌1例;Ⅳ期11例,平均年龄(70.45±12.86)岁,男6例,女5例,腺癌8例,鳞癌3例。选择同期健康体检者14例作为健康对照组,平均年龄(64.07±11.41)岁,男10例,女7例。5组年龄及性别构成比无统计学差异(Pgt;0.05),具有可比性。
1.2指标检测 受试者抽取清晨空腹静脉血2 ml,分离血清冻存待测。取血清5点至玻片上,略干。使用激光共聚焦拉曼光谱仪(Labram HR 800,法国Horiba Jobin Yvon),波长532 nm,50倍物镜,曝光60 s,取谱区间为500~1 800 cm-1,每样测3个点,3条光谱平均代表该样品的血清拉曼光谱信号。
1.3统计学方法 采用SPSS17.0软件进行单因素方差分析及LSD检验。
2 结 果
2.1血清平均拉曼光谱图形比较 对比经过平滑和归一化的健康对照组、非小细胞肺癌Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期组的平均拉曼光谱,拉曼谱峰强度逐渐减弱,见图1。在848 cm-1、999 cm-1、1 152 cm-1、1 446 cm-1及1 658 cm-1处比较5组峰强,以健康对照组峰强最强,Ⅲ期、Ⅳ期组最弱,除Ⅲ期、Ⅳ期两组无统计学差异外,余各组两两比较均有统计学差异(Plt;0.05),见表1。
2.2血清拉曼光谱主成分分析结果 将众多血清拉曼光谱进行主成分分析,共得出特征值大于1的6个主成分,累计贡献率为81.06%。第1、2、3和5主成分得分5组比较有差异,见表2。取第1、2和3主成分得分制作散点图,结果提示5组第1、2和3主成分有较好的聚类作用,见图2、图3。

图1 血清平均拉曼光谱图

组别n848cm-1999cm-11152cm-11446cm-11658cm-1健康对照组141521.87±231.297622.99±1394.904911.49±2272.074572.21±1253.994617.46±910.73肺癌Ⅰ期组231174.80±178.251)5832.27±804.961)2141.93±713.831)3842.62±824.201)3901.66±536.121)肺癌Ⅱ期组24835.05±239.451)2)4439.07±623.641)2)955.07±869.081)2)3242.77±434.461)2)3389.31±435.841)2)肺癌Ⅲ期组19659.56±159.861)2)3)3602.65±599.661)2)3)487.67±323.441)2)3)2539.01±733.041)2)3)2580.97±700.571)2)3)肺癌Ⅳ期组11608.91±330.401)2)3)3297.83±788.191)2)3)531.32±511.661)2)3)2668.49±363.481)2)3)2534.32±412.751)2)3)F/P值37.884/0.00066.307/0.00020.097/0.00013.925/0.00035.189/0.000
与健康对照组比较:1)Plt;0.05;与Ⅰ期组比较:2)Plt;0.05;与Ⅱ期组比较:3)Plt;0.05,下表同
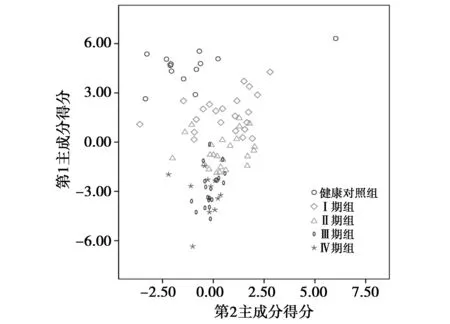
图2 5组血清拉曼光谱主成分得分二维散点图

图3 5组血清拉曼光谱主成分得分三维散点图

组别n第1主成分第2主成分第3主成分第4主成分第5主成分第6主成分健康对照组143.96±2.25-0.70±1.18-0.78±2.39-0.24±2.610.58±1.970.13±2.04Ⅰ期组231.97±1.271)-0.28±1.030.34±1.570.03±1.05-0.27±1.32-0.16±1.15Ⅱ期组24-0.51±1.011)2)1.20±3.820.45±1.060.24±1.14-0.46±0.56-0.02±1.15Ⅲ期组19-2.81±1.191)2)3)-0.34±1.15-0.16±0.43-0.03±1.110.38±0.463)0.12±0.73Ⅳ期组11-3.17±1.371)2)3)-0.56±0.61-0.42±0.75-0.23±0.660.18±0.503)0.00±1.10F/P值78.304/0.0002.709/0.0353.35/0.0130.362/0.8353.540/0.0100.2170/0.028
2.3血清拉曼光谱的判别分析结果 利用主成分分析(PCA)结果进行判别分析,并作交叉检验,结果显示健康对照组、Ⅰ期、Ⅱ期血清拉曼光谱诊断灵敏度分别为85.71%、65.21%、75%,特异性分别为88.73%、100%、96.27%,见表3。而肺癌Ⅲ、Ⅳ期未能区分开,故将2期合为1期,诊断肺癌Ⅲ~Ⅳ期判别灵敏度为86.67%(26/30),特异性为91.91%(43/47),血清拉曼光谱诊断健康对照组、Ⅰ期、Ⅱ期和Ⅲ~Ⅳ期总体准确性为92.21%(71/77)。

表3 交叉检验判别分析结果(n)
3 讨 论
肺癌是全球癌症相关死亡的首位原因,而非小细胞癌占所有肺癌病例的85%〔2〕。目前对非小细胞肺癌患者往往需行众多辅助检查才能做出临床分期。激光拉曼光谱可以分辨生化分子的组成和空间结构,对生物材料具有优良的分子水平指纹图谱式的分辨技术〔3〕。其以非侵入性方法、对所检测标本无破坏性,能减少有创检查带给患者的痛苦,并可以提供一种快速筛选的检测方法,故临床应用前景广阔〔4〕。已有研究应用拉曼技术通过辨识组织的脂质、核酸和蛋白质结构和组成的特征变化,鉴别诊断正常组织、不典型增生(癌前病变)组织和癌症组织,包括皮肤癌〔5〕、肺癌〔6〕、口腔癌〔7〕、胃肿瘤〔8〕、食管癌〔9〕、肝癌〔10〕、结肠癌〔11〕、前列腺癌〔12〕、肾癌〔13〕、宫颈癌〔14〕和乳腺癌〔15〕等。有研究应用唾液拉曼光谱鉴别肺癌患者和正常人〔16〕。也有研究结果表明利用拉曼光谱可有效对支气管哮喘〔17〕等慢性炎症性疾病进行临床分期。但上述多数研究均采用表面增强拉曼技术〔18〕,需对所测标本进行表明增强处理,增加了检测的技术过程。本研究只需检测少许血清标本,标本易获得,不增加患者痛苦,且未经表面增强处理。
本研究提示血清激光拉曼未能有效区别Ⅲ期和Ⅳ期非小细胞肺癌患者,考虑原因,本文样本量小,可能未能反映全貌;另外,随肺癌进展,晚期患者血液与肺癌早期不同,其生物分子构成已相似,达“天花板效应”,故Ⅲ期和Ⅳ期肺癌患者血清拉曼光谱难以区别;再者,本文Ⅲ期、Ⅳ期非小细胞肺癌患者构成均以腺癌居多,导致结果相似。然而,本文结果表明血清激光拉曼已能有效区分正常人、Ⅰ、Ⅱ期和晚期非小细胞肺癌,对早期识别肺癌和选择合理的治疗方案具重要意义。
1王 虹,张少鸿.应用血清激光拉曼光谱鉴别肺癌患者、慢性阻塞性肺疾病患者及健康人〔J〕.广东医学,2015;36(6):884-7.
2Sica GL,Gal AA.Lung cancer staging:pathology issues〔J〕.Semin Diagn Pathol,2012;29(3):116-26.
3Kong K,Kendall C,Stone N,etal.Raman spectroscopy for medical diagnostics-from in-vitro biofluid assays to in-vivo cancer detection〔J〕.Adv Drug Deliv Rev,2015;89:121-34.
4Wang W,Zhao J,Short M,etal.Real-time in vivo cancer diagnosis using raman spectroscopy〔J〕.J Biophotonics,2015;8(7):527-45.
5Fox SA,Shanblatt AA,Beckman H,etal.Raman spectroscopy differentiates squamous cell carcinoma (SCC) from normal skin following treatment with a high-powered CO2 laser〔J〕.Lasers Surg Med,2014;46(10):757-72.
6Xu X,Cheng J,Thrall MJ,etal.Multimodal non-linear optical imaging for label-free differentiation of lung cancerous lesions from normal and desmoplastic tissues〔J〕.Biomed Opt Express,2013;4(12):2855-68.
7Sahu A,Nandakumar N,Sawant S,etal.Recurrence prediction in oral cancers:a serum Raman spectroscopy study〔J〕.Analyst,2015;140(7):2294-301.
8Chen Y,Dai J,Zhou X,etal.Raman spectroscopy analysis of the biochemical characteristics of molecules associated with the malignant transformation of gastric mucosa〔J〕.PLoS One,2014;9(4):e93906.
9Almond LM,Hutchings J,Lloyd G,etal.Endoscopic Raman spectroscopy enables objective diagnosis of dysplasia in Barrett's esophagus〔J〕.Gastrointest Endosc,2014;79(1):37-45.
10Taleb I,Thiéfin G,Gobinet C,etal.Diagnosis of hepatocellular carcinoma in cirrhotic patients:a proof-of-concept study using serum micro-Raman spectroscopy〔J〕.Analyst,2013;138(14):4006-14.

12Del Mistro G,Cervo S,Mansutti E,etal.Surface-enhanced Raman spectroscopy of urine for prostate cancer detection:a preliminary study〔J〕.Anan Bioanal Chem,2015;407(12):3271-5.
13Zhuang Z,Li N,Guo Z,etal.Study of molecule variations in renal tumor based on confocal micro-Raman spectroscopy〔J〕.J Biomed Opt,2013;18(3):31103.
14Rashid N,Nawaz H,Poon KW,etal.Raman microspectroscopy for the early detection of pre-malignant changes in cervical tissue〔J〕.Exp Mol Pathol,2014;97(3):554-64.
15Surmacki J,Brozek-Pluska B,Kordek R,etal.The lipid-reactive oxygen species phenotype of breast cancer.Raman spectroscopy and mapping,PCA and PLSDA for invasive ductal carcinoma and invasive lobular carcinoma.Molecular tumorigenic mechanisms beyond warburg effect〔J〕.Analyst,2015;140(7):2121-33.
16Li X,Yang T,Lin J.Spectral analysis of human saliva for detection of lung cancer using surface-enhanced Raman spectroscopy〔J〕.J Biomed Opt,2012;17(3):037003.
17Sahu A,Dalal K,Naglot S,etal.Serum based diagnosis of asthma using Raman spectroscopy:an early phase pilot study〔J〕.PLoS One,2013;8(11):e78921.
18Butler HJ,Fogarty SW,Kerns JG,etal.Gold nanoparticles as a substrate in bio-analytical near-infrared surface-enhanced Raman spectroscopy〔J〕.Analyst,2015;140(9):3090-7.
〔2016-04-29修回〕
(编辑 苑云杰/曹梦园)
R734.2
A
1005-9202(2017)22-5626-03;
10.3969/j.issn.1005-9202.2017.22.064
1 中国科学院广州能源研究所 中国科学院广州生命科学大型仪器区域中心
张少鸿(1965-),男,高级工程师,主要从事仪器分析研究。
王 虹(1968-),女,副主任医师,主要从事呼吸疾病研究。
