硼替佐米诱导间充质干细胞治疗大鼠骨质疏松实验研究
2017-12-09邹敏君刘锐锋
邹敏君,刘锐锋
(广东省中山市人民医院药学部,广东 中山 521403)
硼替佐米诱导间充质干细胞治疗大鼠骨质疏松实验研究
邹敏君,刘锐锋
(广东省中山市人民医院药学部,广东 中山 521403)
目的 探讨硼替佐米诱导间充质干细胞分化治疗大鼠骨质疏松的疗效。方法 选取75只健康雌性大鼠,建立大鼠去卵巢骨质疏松模型,并随机分为5组,测定5组大鼠的骨钙素水平。再选取75只健康大鼠,获取骨髓间充质干细胞,并按分组进行体外干细胞培养至形成集落。将形成的骨髓间质干细胞分别注入 1~5组大鼠的骨髓腔中,并分别给予 1~5组大鼠 0,0.1,0.3,0.5,1.5 mg/kg硼替佐米4周,每日抽取大鼠的外周血测定骨钙素水平。4周后处死大鼠,取其长骨做切片,检测大鼠的骨密度、骨髓间充质干细胞增殖指数和凋亡指数。结果 治疗前,5组大鼠骨钙素水平比较无明显差异(P>0.05),治疗后,5组大鼠骨钙素水平由高至低为1组、2组、3组、4组、5组;第5组大鼠的长骨骨密度和骨髓间充质干细胞增殖指数均高于其他4组大鼠(P<0.05),凋亡指数低于其他4组大鼠(P<0.05)。结论 硼替佐米诱导间充质干细胞治疗大鼠去卵巢骨质疏松效果确切,在绝经后骨质疏松患者的临床治疗中应用可行。
硼替佐米;间充质干细胞;骨质疏松;增殖指数;凋亡指数;骨钙素水平;骨密度
骨质疏松(osteoporosis,OP)是由多种原因导致的骨密度下降、骨脆性增加的疾病,发病群体以绝经后妇女为主,随着病程的延长,患者丢失骨量不断增多,发生全身性骨病的风险也会不断增加[1-3]。但目前的治疗办法主要集中于维持治疗,用药时间长且药物具有一定毒性,因此临床需要积极治疗手段。骨髓间充质干细胞是一种多向分化的干细胞,能有效分化成骨骼细胞、脂肪、肌肉细胞,当其分化为骨骼细胞后可有效并安全地治疗骨质疏松[4]。目前,使用骨髓间充质干细胞治疗骨质疏松遇到的一个棘手问题是间充质干细胞分化的无序性,如何能成功促使间充质干细胞向成骨细胞分化,是改善干细胞治疗临床疗效的主要方向[5]。近年来的研究发现,通过药物靶向作用于干细胞促进干细胞定向分化,可有效提高骨质疏松患者的临床治疗有效率[6]。使用蛋白质抑制剂硼替佐米能影响多发性骨髓瘤患者成骨细胞分化[7]。本研究中探讨了硼替佐米诱导间充质干细胞联合治疗大鼠骨质疏松的疗效,旨在为临床制订骨质疏松的有效治疗方案提供参考。为避免大剂量硼替佐米导致骨髓间充质干细胞加速凋亡[8],本试验选用小剂量硼替佐米梯量上升给药方案。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
动物:150只 SPF级健康 SD大鼠(许可证号为SCXK2012-0001),雌性,8~10周龄,体质量 229~262g,平均(242.1 ± 3.6)g,均由北京维通利华实验动物技术有限公司提供,由实验动物质量检测中心质检合格,且均符合试验要求。其中75只大鼠用于制作大鼠去卵巢骨质疏松模型[9],另外75只大鼠用于获取骨髓间充质干细胞。
仪器:EK-8800 C型全数字彩色超声波骨密度仪(北京泽澳医疗科技有限公司,误差不超过±1.5%);HF-220型全自动生化仪(泰安市康宇医疗器械有限公司);PinAAcle 900型原子吸收光谱(珀金埃尔默企业管理<上海>有限公司);CHK-2561AB型紫外分光光度计(北京昌科仪自动化科技有限公司);BN 0100型电子分析天平(温州百恩仪器有限公司,最小分度值0.01~0.000 1);WS70型红外线干燥箱(上海高致精密仪器有限公司);HH-4型恒温水浴锅(江苏省金坛市友联仪器研究所)。
试药:硼替佐米(商品名万珂,西安杨森制药有限公司,国药准字 J20050042,规格为每瓶3.5 mg);葡萄糖酸钙注射液(济南利民制药有限责任公司,国药准字H37021227,规格为每支 10 mL ∶1 g);维生素 C 片(浙江瑞新药业股份有限公司,国药准字H33021139,规格为每片0.1 g);酒石酸锑钾(武汉远成共创科技有限公司)。
1.2 方法
1.2.1 大鼠去卵巢骨质疏松模型制备
取75只大鼠用于制作大鼠去卵巢骨质疏松模型,随机分为 1,2,3,4,5 组,各 15 只。根据大鼠体质量进行腹腔内麻醉→备毛→手术(暴露腹腔,沿着子宫下角找到卵巢并摘除)→术后护理(为防止感染,每天注射20万U的青霉素)。取另外75只健康雌性大鼠的骨髓间充质细胞,进行体外培养。5组大鼠均自由进食、饮水,5组大鼠从术后第7天算起,灌胃至3个月,末次给药后24 h,麻醉大鼠,股动脉收集血液采集标本进行各项试验。
1.2.2 大鼠骨质疏松治疗及指标检测方法
将培养至形成集落的骨髓间充质干细胞注入到1~5组大鼠的骨髓腔内,并分别给予1~5组大鼠0,0.1,0.3,0.5,1.5 mg/kg 硼替佐米,腹腔注射给药,连续给药4周。实施治疗前后分别采集5组大鼠外周血,测定骨钙素水平,计算平均值。4周后处死5组大鼠,取长骨做切片,检测骨密度及骨髓间充质干细胞增殖指数和凋亡指数,并对比治疗前后的骨钙素水平[10-11]。
1.3 统计学处理
采用SPSS 21.0统计学软件分析。计量资料采用均数 ±标准差(±s)表示,行 t检验。P<0.05为差异有统计学意义。
2 结果
2.1 骨钙素水平
治疗前,5组大鼠的骨钙素水平无统计学差异(P>0.05);使用硼替佐米后,4组大鼠的骨钙素水平均降低,与治疗前比较存在明显差异(P<0.05),第5组大鼠的骨钙素水平明显低于其他组。详见表1。
表1 5组大鼠骨钙素水平比较(± s, g/L,n=15)
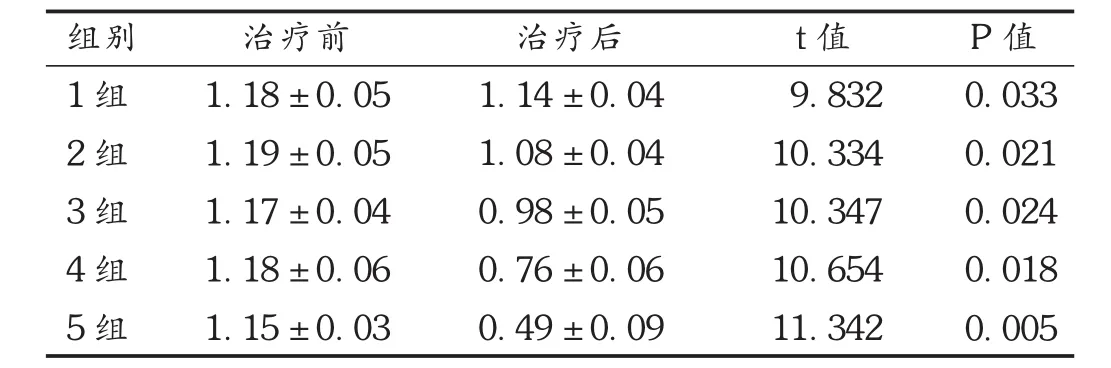
表1 5组大鼠骨钙素水平比较(± s, g/L,n=15)
注:与其他 4 组比较, P <0.05。下表同。
组别1组2组3组4组5组治疗前1.1 8 ± 0.0 5 1.1 9 ± 0.0 5 1.1 7 ± 0.0 4 1.1 8 ± 0.0 6 1.1 5 ± 0.0 3治疗后1.1 4 ± 0.0 4 1.0 8 ± 0.0 4 0.9 8 ± 0.0 5 0.7 6 ± 0.0 6 0.4 9 ± 0.0 9 t值9.8 3 2 1 0.3 3 4 1 0.3 4 7 1 0.6 5 4 1 1.3 4 2 P值0.0 3 3 0.0 2 1 0.0 2 4 0.0 1 8 0.0 0 5
2.2 骨密度
治疗后,第5组大鼠的骨密度明显高于其他组(t=11.230,P =0.21),其中 1组大鼠最低。详见表 2。
表2 5组大鼠骨密度比较(± s,g/cm2,n=15)

表2 5组大鼠骨密度比较(± s,g/cm2,n=15)
组别1组2组3组4组5组t值P值骨密度0.1 3 ± 0.0 7 0.1 7 ± 0.0 9 0.2 5 ± 0.0 8 0.3 2 ± 0.0 6 0.4 1 ± 0.0 8 1 1.2 3 0 0.0 2 1
2.3 骨髓间充质干细胞增殖指数、凋亡指数
经检测发现,第5组大鼠的干细胞增殖指数高于其他4组大鼠(P<0.05),凋亡指数明显低于其他4组大鼠(P <0.05)。详见表 3。
3 讨论
女性绝经后5年内的丢失骨量为1.5% ~2.5%,绝经后10年,每年丢失骨量可达5%,因此25% ~50%的60岁以上老年女性患有骨质疏松[12]。女性绝经后易发生骨质疏松的原因为,女性进入更年期后,卵巢开始萎缩,体内雌激素分泌水平急剧降低,导致骨代谢出现明显的负平衡,新生的骨组织开始减少[13],丢失的骨质开始增多,最终对骨组织结构产生影响,使骨脆性增加,引起疼痛,增加患者发生骨折的风险[14]。绝经后骨质疏松的发生不仅严重危害患者的身体健康,影响患者生活质量,还会增加国家及家庭财力与人力负担。现阶段,我国临床治疗该疾病的主要手段为激素和阿伦磷酸钠等药物维持治疗,尚无积极有效的治疗手段。
表3 5组大鼠的骨髓间充质干细胞增殖指数、凋亡指数比较(± s,%,n=15)

表3 5组大鼠的骨髓间充质干细胞增殖指数、凋亡指数比较(± s,%,n=15)
组别1组2组3组4组5组t值P值增殖指数2 7.3 6 ± 4.2 9 3 5.2 4 ± 5.2 2 4 2.1 1 ± 5.1 3 4 9.1 6 ± 4.9 8 5 6.3 0 ± 5.0 2 1 1.4 4 5 0.0 1 7凋亡指数4.2 1 ± 0.0 9 3.5 4 ± 0.2 9 3.0 6 ± 0.3 1 2.7 1 ± 0.3 3 2.2 1 ± 0.3 4 1 1.3 3 2 0.0 1 9
1996年,骨髓间充质干细胞为Friedenstein所发现。间充质干细胞是一种能够多向分化的干细胞[15],能有效分化成骨骼细胞,脂肪,肌肉细胞,因此发现后被移植领域作为研究热点,采用干细胞分化成为骨骼细胞,具有安全、低毒、取材方便等优势。硼替佐米是哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性的可逆抑制剂。26S蛋白酶体是一种大的蛋白质复合体,具有降解蛋白和维持细胞内环境稳定的作用。基于骨髓间充质干细胞和硼替佐米所具有的作用机制,该药物通过作用于Runx-2受体来抑制骨髓间充质干细胞向破骨细胞分化,从而提高间充质细胞治疗骨质疏松的成功率[16-17]。
本研究结果显示,治疗后硼替佐米用药剂量最大的第5组大鼠的骨钙素水平明显低于其他4组大鼠,骨密度明显高于其他4组大鼠,同时在使用该剂量硼替佐米所诱导的骨髓间充质干细胞增殖指数较其他4组大鼠高,凋亡指数较其他4组大鼠低。表明骨髓间充质干细胞联合硼替佐米治疗骨质疏松大鼠疗效确切,且与硼替佐米的用药剂量呈正相关。由于本次研究为动物试验研究,因此所得结果的客观性仍需通过大量临床研究进行验证。
[1]李 军,李炳宗,陈 萍,等.硼替佐米对多发性骨髓瘤患者间充质干细胞自噬活性和成骨分化潜能的影响[J].中华内科杂志,2012,51(2):140 - 142.
[2]杲 丽,胡成虎,金 岩,等.骨髓间充质干细胞在小鼠早衰性骨质疏松中的细胞生物学功能研究[J].中国病理生理杂志,2013,29(4):707 - 712.
[3]Giuliani N,Morandi F,Tagliaferri S,et al.The proteasomeinhibitor bortezomib affects osteoblast differentiation in vitroand in vivo in multiple myeloma patients[J].Blood,2007,110(1):334 - 338.
[4]张冬华,孙建群.硼替佐米联合吡柔比星、地塞米松治疗初治多发性骨髓瘤14例临床分析 [J].中国药业,2015,24(1):78-80.
[5]王 云,鲍小明,侯永新,等.去卵巢骨质疏松大鼠骨髓间充质干细胞的体外成骨诱导[J].中国组织工程研究,2013,17(36):6423-6429.
[6]邵秉一,于 洋,付 欣,等.雌激素缺乏导致的骨质疏松发病过程中骨髓间充质干细胞FasL表达降低对CD4+T淋巴细胞凋亡的影响[J].中国病理生理杂志,2013,29(3):515-520.
[7]于 洋,邵秉一,尚冯青,等.雌激素缺乏致骨质疏松症小鼠骨髓间充质干细胞通过分泌MCP-1影响T淋巴细胞趋化及凋亡[J].细胞与分子免疫学杂志,2014,30(1):19-22.
[8]徐展望,李念虎.柚皮苷对体外培养骨髓间充质干细胞Runx-2和Osterix表达及骨质疏松模型大鼠骨强度的影响[J].中医正骨,2013,25(12):7 -10.
[9]Chen D,Frezza M,Schmitt S,et al.Bortezomib as the first proteasome inhibitor anticancer drug:current status and future perspectives[J].Curr Cancer Drug Targets,2011,11(3):239 - 253.
[10]Broijl A,Kersten MJ,Alemayehu WG,et al.Phase Ⅰ/Ⅱtrial of weekly bortezomib with lenalidomide and dexametha-sone in first relapse or primary refractory myeloma[J].Haema-tologica,2016,101(4):e149 - e152.
[11]Herck JLV,Meyer GRYD,Martinet W,et al.Protea-some inhibitor bortezomib promotes a rupture-prone plaque phe-notype in ApoE - deficient mice[J].Basic Res Cardiol,2010,105(1):39 - 50.
[12]Tamura D,Arao T,Tanaka K,et al.Bortezomib potentiallyinhibits cellular growth of vascular endothelial cells throughsuppression of G2 /M transition[J].Cancer Sci,2010,101(6):1403 - 1408.
[13]朱虎虎,孙 炜,孙建新,等.维甲酸诱导雌性大鼠骨质疏松模型建立的效果观察[J].当代医学,2013,19(14):24-26.
[14]王 翔,郭海玲,赵咏芳,等,阿仑膦酸钠改善去卵巢大鼠的骨基质结构[J].中国组织工程研究,2013,17(50):8621-8628.
[15]王振恒,赵建宁,王 瑞.骨质疏松动物模型研究进展[J].中国骨质疏松杂志,2012,18(7):656 -662.
[16]余萍萍,潘晶晶,闫 璇,等.大鼠卵巢去势骨质疏松模型的制作[J].滨州医学院学报,2010,33(5):353 -355.
[17]李 明,吕厚辰,尹鹏滨,等.两种卵巢切除术式建立大鼠骨质疏松模型的优势比较[J].解放军医学院学报,2015,36(4):383-387.
Experimental Study of Mesenchymal Stem Cells Induced by Bortezomib in the Treatment of Osteoporosis in Rats
Zou Minjun,Liu Ruifeng
(Department of Pharmacy,Zhongshan People′s Hospital,Zhongshan,Guangdong,China 521403)
Objective To investigate the clinical effect of mesenchymal stem cells induced by bortezomib in the treatment of osteoporosis in rats.Methods Totally 75 healthy female rats were selected to establish the ovariectomized osteoporosis model of rats and randomly divided into 5 groups.The osteocalcin levels of the 5 groups were measured.Another 75 healthy experimental rats were selected to obtain bone marrow mesenchymal stem cells,which were cultured in vitro until form a colony.The bone marrow mesenchymal stem cells were injected into the bone marrow cavity of the rats in the 5 groups,rats in group 1 - 5 were given 0,0.1,0.3,0.5,1.5 mg /kg bortezomib for 4 weeks,the peripheral blood of rats was extracted daily and osteocalcin levels were measured.After 4 weeks,the rats were killed,and the long bones of the rats were taken for sections,the bone mineral density,proliferation index and apoptosis index of bone marrow mesenchymal stem cells were measured.Results There was no significant difference in osteocalcin levels between the 5 groups before treatment(P > 0.05),after treatment,the osteocalcin levels of the 5 groups were from high to low as follows:group 1,group 2,group 3,group 4,group 5.The bone density of the long bone and the proliferation indexes of bone and marrow mesenchymal stem cells in group 5 were significantly higher than those in the other 4 groups(P < 0.05),and the apoptotic index in group 5 was lower than those in the other 4 groups(P < 0.05).Conclusion Mesenchymal stem cells induced by bortezomib is effective in the treatment of ovariectomized osteoporosis in rats,and it is feasible in the clinical treatment of postmenopausal osteoporosis.
bortezomib;mesenchymal stem cell;osteoporosis;proliferation index;apoptosis index;osteocalcin level;bone density
R965.2;R979.1
A
1006-4931(2017)23-0014-03
10.3969 /j.issn.1006 - 4931.2017.23.004
邹敏君(1982-),女,硕士研究生,主管药师,研究方向为医院药学,(电子信箱)25194130@qq.com。
2017-08-29;
2017-10-12)
