藜麦皂苷提取及萌芽对皂苷含量的影响
2017-12-07秦礼康石庆楠文安燕
黄 金 秦礼康 石庆楠 文安燕
(贵州大学酿酒与食品工程学院,贵阳 550025)
藜麦皂苷提取及萌芽对皂苷含量的影响
黄 金 秦礼康 石庆楠 文安燕
(贵州大学酿酒与食品工程学院,贵阳 550025)
利用响应面分析法对藜麦籽粒皂苷的提取条件进行探索,并研究萌芽对藜麦皂苷含量的影响。在单因素试验的基础上,选取乙醇提取分数、料液比和浸提温度进行三因素三水平的Box-Behnken试验设计,通过响应面分析法对提取条件进行了优化;同时在优化条件下测定萌芽144 h藜麦中的皂苷含量变化。结果表明,在560 nm波长下,最佳提取条件为乙醇体积分数65%,料液比1:40,浸提温度60 ℃,皂苷提取量为5.56 mg/g。萌芽试验结果表明,萌芽初期(6 h内)皂苷含量迅速下降,在6~42 h期间含量保持平稳,42 h后逐渐升高直至96 h时达最高值7.80 mg/g,萌芽120 h后皂苷含量开始下降。
藜麦 萌芽 皂苷 响应面分析
藜麦(ChenopodiumquinoaWilld.)不仅富含优质蛋白质,而且含有钙、铁、锌和维生素E等微量营养素,具有提高人群健康,预防癌症、过敏、炎症以及降低心血管疾病等疾病发生的潜在功效[1-2]。古代印加人称其为“粮食之母”和“安第斯山的真金”[3-4]。国际营养学家称其为“营养黄金”、“超级谷物”或“未来食品”[5]。FAO将藜麦评为“高营养价值的食物”[6]。联合国粮农组织(FAO)认为藜麦是唯一一种可满足人体基本营养需求的单体植物,并正式推荐藜麦为最适宜人类的全营养食品,将2013年设立为“国际藜麦年”[7]。
藜麦具有丰富的营养价值,但藜麦中存在的抗营养因子-皂苷,略有苦涩味且具有潜在毒性[8],阻碍了藜麦在食用、加工和推广等方面的运用。藜麦皂苷主要以三萜皂苷的形式存在,质量分数在0.14%~2.30%[9],随着对皂苷的进一步了解,人们更加关注皂苷的生物活性及其对健康的作用。具已有研究表明,皂苷是一类具有抗炎[10]、抗过敏[11]、抗氧化[12]、抗糖尿病[13]、降胆固醇[14]等生物活性的物质,是许多中药的有效成分。藜麦皂苷的去除、提取及再利用一直是困扰研究者的难题。传统的流动水冲洗方法会造成大量的水资源浪费,同时也损失了皂苷的药用价值。种皮打磨30%[15],浸泡水洗[16]亦可有效降低种皮皂苷含量。种子萌发是高等植物生命活动最强烈的一个时期,涉及一系列形态和生理、生化的变化。通过发芽处理谷物可以改善它们的口感,提高营养成分的含量和利用率,以及降低抗营养成分的含量[17~18]。澳大利亚学者在处理藜麦皂苷时发现,长时间的浸泡会导致藜麦发芽[19]。Ren S等[20]人发现苦荞种子萌芽处理期间总酚、总黄酮、芦丁含量逐渐增加,并在第9天到最大值。这些现象在开发芽类食品方面受到了人们密切关注[21]。
目前,藜麦商品粮皂苷含量标准及其检测方法尚不统一,提取工艺及条件各不相同。赵文婷[22]在乙醇浓度72%、提取温度71.5 ℃、料液比1:20.8、提取时间147 min、吸收波长546 nm条件下测得藜麦麸皮的平均皂苷得率为1.685%。任卓伟等[16]在乙醇体积分数70%、料液比1:30、提取温度50 ℃、吸收波长560 nm条件下测得藜麦的皂苷含量为10.709 mg/g。杜静婷等[23]在料液比39:1、乙醇体积分数74%、超声时间33 min、吸收波长550 nm条件下测得藜麦糠皂苷得率为23.371 mg/g。
本研究在目前通用的藜麦皂苷提取方法的基础上,运用响应面法探索适宜的提取条件,对萌芽144 h内的藜麦皂苷含量的变化进行动态监测,旨在为藜麦皂苷的综合利用提供参考。
1 材料和方法
1.1 试剂与材料
齐墩果酸标准品:Sigma;藜麦:甘肃省农业科学院。
1.2 仪器与设备
Spectra Max 190酶标仪:Molecular Devices;MK-C315豆芽培育箱:MEIKONG;HYG-A全温摇瓶机:大仓市实验设备厂;FD-1A-50冷冻干燥机:北京博医康实验仪器有限公司;HC-700型超高速粉碎机:永康市天祺盛世工贸有限公司。
1.3 方法
1.3.1 标准溶液的制备
参考任卓伟等[16]、赵文婷[22]的方法,选用齐墩果酸为标准品。准确称取齐墩果酸标准品50 mg,加少量无水乙醇溶解后定容于50 mL的容量瓶中,制成1 mg/mL标准溶液。
1.3.2 标准曲线的绘制[16]
用移液枪准确地吸取0、50、100、200、400 μL的标准溶液,分别置于干燥的蒸发皿中,60 ℃水浴蒸干取出;依次加入0.8 mL 5%的香草醛冰醋酸溶液和3.2 mL高氯酸,摇匀;用冰水浴冷却20 min,加入20 mL冰醋酸,摇匀,静置15 min。取400 μL的标准品用酶标仪于500~600 nm处进行扫描,选定最大吸收波长。以最大吸收波长处各浓度标准品的吸光度值(Abs)为横坐标,以相应齐墩果酸标准品浓度(mg/mL)为纵坐标,绘制标准曲线。皂苷提取量根据标准曲线按公式计算:
皂苷提取量/mg/g=CV/m
式中:C为根据标准曲线求得的皂苷质量浓度/mg/mL;V为提取液总体积/mL;m为藜麦总质量/g;
1.3.3 响应面试验设计
1.3.3.1 单因素试验
每次试验准确称取5 g过60目筛的粉碎藜麦粉(未萌芽),分别以乙醇体积分数、料液比、提取温度3个因素进行单因素试验,以皂苷含量为衡量指标,具体方案见表1。
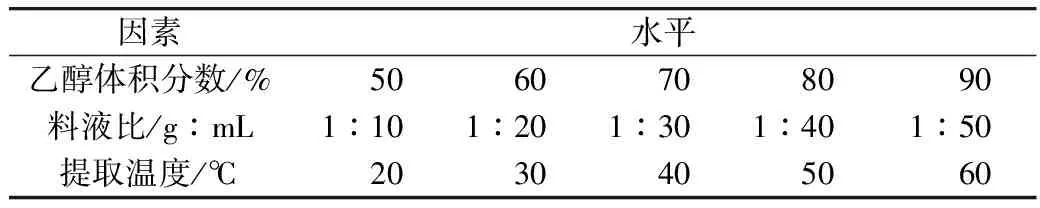
表1 藜麦皂苷提取单因素试验表
1.3.3.2 提取工艺的优化
根据单因素试验结果,结合Box-Behnken中心组合试验设计原理,确定了以乙醇体积分数、料液比、提取温度3个因素为自变量,皂苷提取量为响应值,采用三因素三水平的响应面分析设计试验,对高氯酸比色法测定藜麦皂苷条件进行优化,见表2。
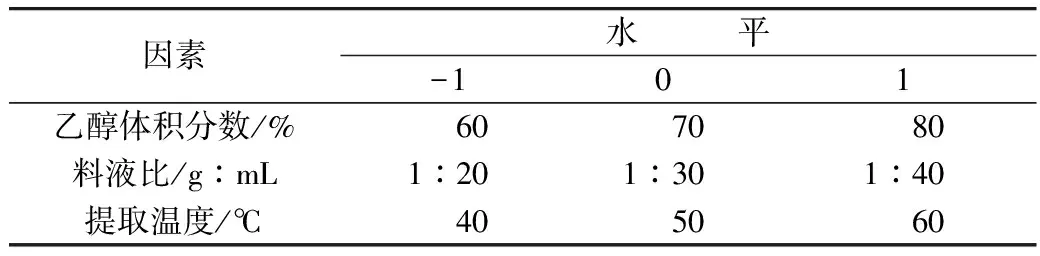
表2 响应面分析因素与水平
1.3.3.3 萌芽藜麦的制备
粗藜麦(未脱壳)过筛,除杂后选取饱满完好的藜麦粒,用0.1%次氯酸钠溶液浸泡20 min后用去离子水冲洗2~3次[24]。然后将藜麦米平铺于铺有四层纱布的培芽箱上,喷晒去离子水,放入恒温培芽箱于25 ℃、间隔6 h淋水、间隔6 h臭氧杀菌条件下发芽。每隔6 h取样1次,分别制得发芽6、12、18、24、30、36、42、48,60、72、96、120、144 h的发芽藜麦。然后将收集的发芽藜麦于冰箱预冻待收集齐全后冷冻干燥,粉碎,过100目筛,得到发芽藜麦粉。
2 结果与分析
2.1 齐墩果酸标准曲线
由图1可知,齐墩果酸标准品在500~600 nm处的最大吸收波长为560 nm,此结果与任卓伟等[16]的研究结果一致。因此,选用560 nm为检测波长。

图1 齐墩果酸标准品不同波长的吸光度值
以吸光度值为横坐标(x),以齐墩果酸浓度/mg/mL为纵坐标(y)绘制标准曲线如图2,并采用线性拟合求得标准方程为y=2.863 1x+0.011 2;相关系数:R2=0.997 4,显示在此范围内有良好的线性关系(图2)。
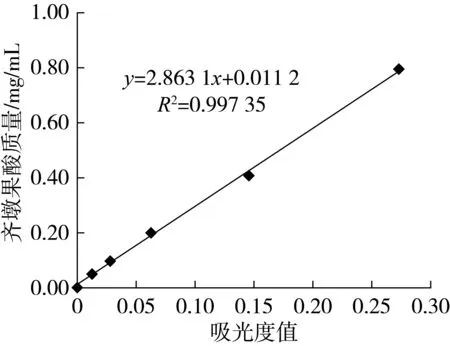
图2 齐墩果酸标准曲线
2.2 单因素试验结果
2.2.1 乙醇体积分数对提取藜麦总皂苷的影响
大多数皂苷极性较大,多具有吸湿性,易溶于水、热甲醇和乙醇,难溶于丙酮和乙醚。结合实验室条件及安全性,故选择乙醇为溶剂。从图3可以看出,藜麦籽粒皂苷含量在一定范围内随着乙醇体积分数的增加而增加,当乙醇体积分数为70%时,提取出的皂苷含量最大,为5.35 mg/g。之后随体积分数的增大含量反而减少,可能是因为当乙醇体积较大时,抑制了溶剂向物料的渗透,影响了皂苷的浸出,导致藜麦籽粒皂苷不能很好的提取出来[13]。因此选择70%的乙醇为藜麦籽粒总皂苷的最佳提取条件。
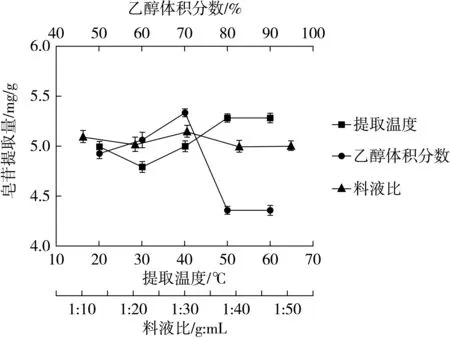
图3 单因素试验结果
2.2.2 料液比对提取藜麦总皂苷的影响
由图3可知,当料液比为1:30时,提取的皂苷含量最大,为5.14 mg/g。当料液比合适时,提取皂苷的效果才是最佳。太低时,提取不充分;太高,虽能完全提取,但提取液浪费较多。因此,由单因素试验结果显示,藜麦皂苷提取的最佳料液比为1:30。
2.2.3 提取温度对提取藜麦总皂苷的影响
从图3可以看出,温度从20 ℃升高到50 ℃,提取出的皂苷含量先缓慢降低再匀速升高。50~60 ℃时的皂苷提取含量相差不大。可能是因为温度升高加速了溶质的扩散及溶剂的渗透,从而使得提取含量的升高;而温度过高时也加快了杂质的溶出,从而与黎麦皂苷的溶出产生了竞争,影响了皂苷的溶出效果[22]。基于实验室条件限制及实验安全性,故选用50 ℃为最佳提取温度。
2.3 响应面试验设计及结果
2.3.1 响应面提取藜麦皂苷模型及显著性检验
应用Box-Behnken模型的中心组合试验设计原理,根据单因素试验结果进行三因素三水平的试验设计,其中自变量为乙醇体积分数70%;料液比为1:30;提取温度为50 ℃,以总皂苷含量为响应值,进行响应面分析,试验设计及结果见表3。
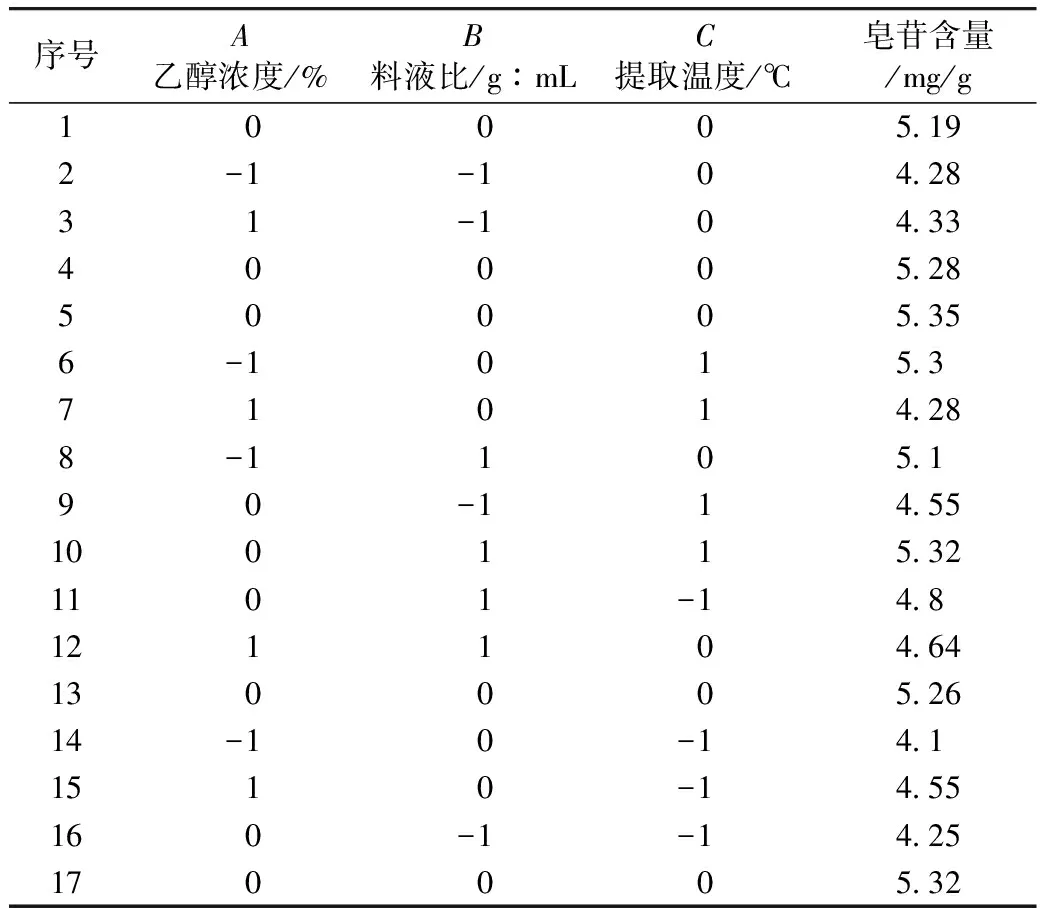
表3 响应面试验设计及结果
在17个试验中,有12组析因试验,12个析因点为自变量在A、B、C所构成的三维定点。以及5组中心零点试验,用于估计试验误差。对表中的试验结果进行多次拟合回归分析,得到模型的二次多项回归方程为:
Y=5.28-0.12A+0.31B+0.22C-0.13AB-0.37AC+0.055BC-0.43A2-0.26B2-0.29C2
其中对该模型进行方差分析,结果见表4。

表4 响应面试验结果的方差分析
由表4可看出,本试验选用模型P<0.000 1,表明模型达到极显著;失拟项P=0.546 7>0.05,表明失拟不显著;相关系数R2=0.993;信噪比=26.957,远大于4,这说明该回归方程的拟合度和可信度均很高。因此,此模型可用于预测高氯酸法测藜麦皂苷及工艺优化。由方差分析表中对回归方程系数显著检测可知,藜麦皂苷提取的乙醇体积分数、料液比、提取温度的一次项、二次项,乙醇体积和料液比、乙醇体积和温度的交互作用均达到极显著水平(P<0.01),料液比和提取温度的交互作用不显著。由回归方程分析可知,影响藜麦皂苷提取的因素主次顺序为:料液比(B)>提取温度(C)>乙醇体积分数(A)。
2.3.2 响应面分析及最佳条件确定
在方差分析的基础上,利用Design Expert绘制交互项乙醇体积分数,料液比,提取温度交互作用的曲面图和等高线图,如图4、图5和图6所示。
由于等高线的形状可以反映交互项的强弱,等高线图呈椭圆形表示两者交互作用显著,圆形则与之相反。由图6的响应面等高线图可以看出,图6呈现出的形状没有其他图的明显。结合方差分析表的数据,因素间的交互作用对提取率的影响效果为:AC>AB>BC通过Design Expert软件对非线性回归模型进行求解,得出最优的因素水平分别为:乙醇体积分数63.74%,料液比1:38.33 g/mL,提取温度58.52 ℃,在此条件下皂苷含量预测值为5.54 mg/g。由于操作可行性,将最佳条件修正为:乙醇体积分数65%,料液比1:40 g/mL,提取温度60 ℃。在此条件下进行3次平行验证试验,测得藜麦皂苷含量均值为5.56 mg/g,结果与预测值相近。
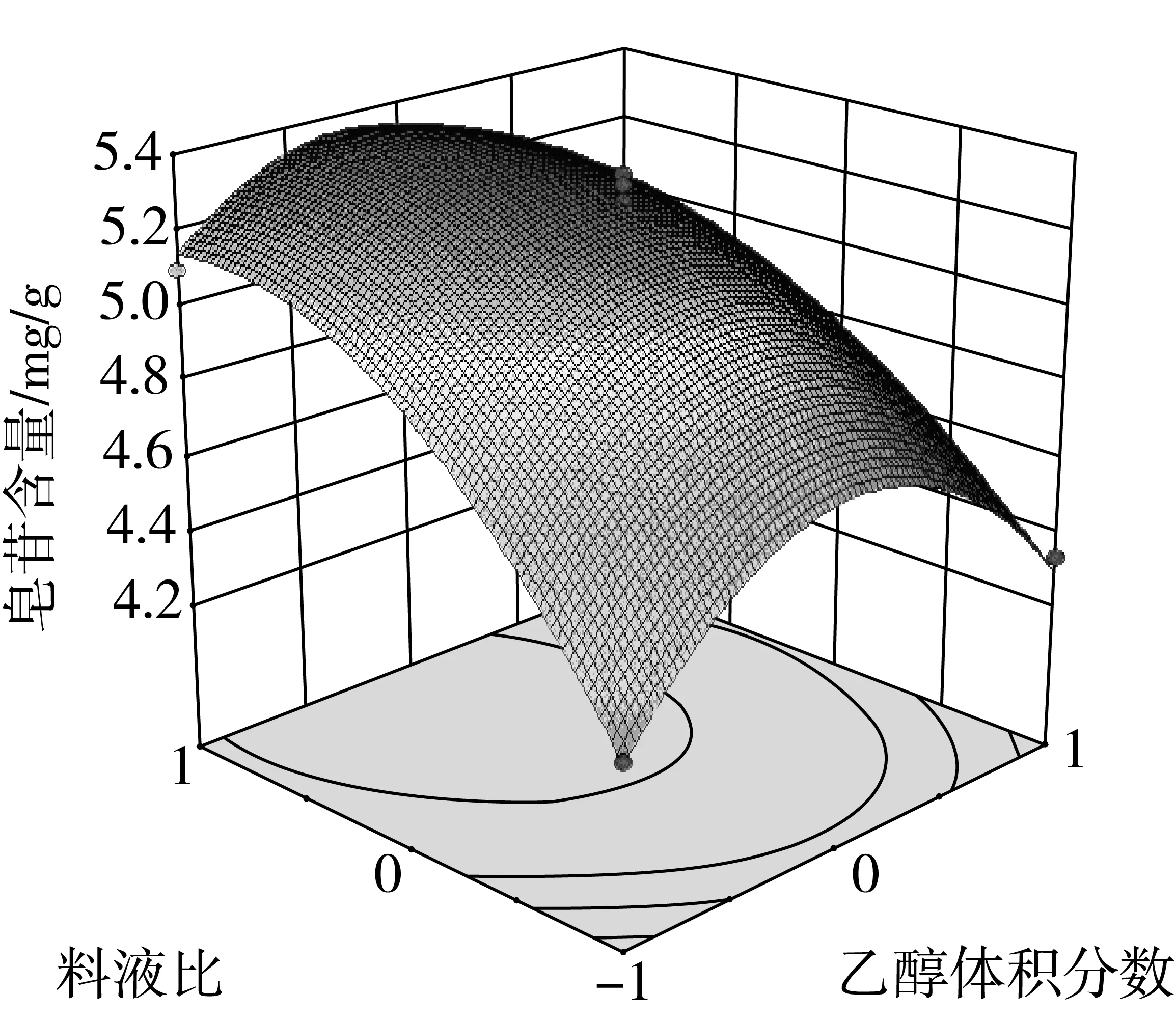
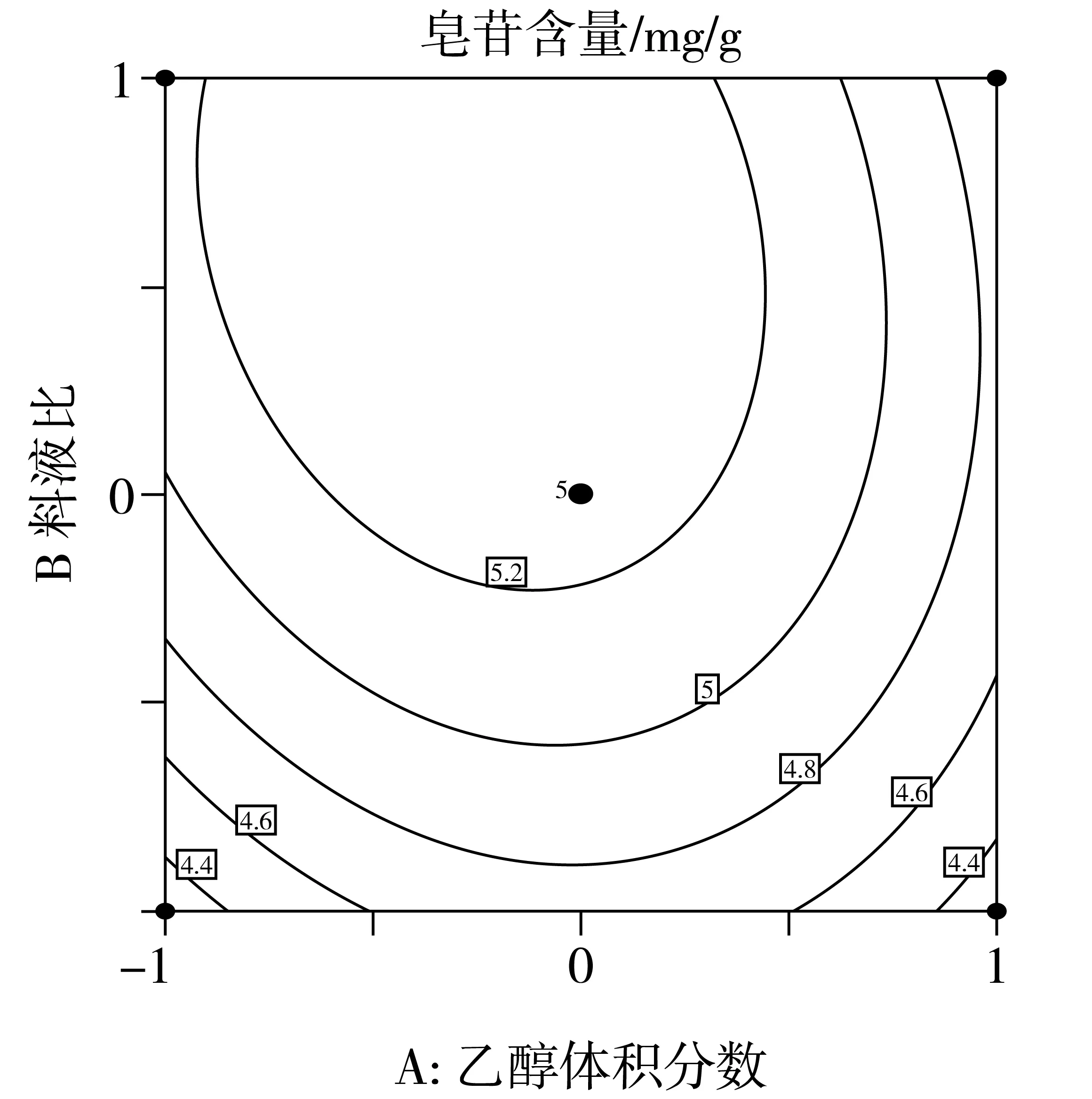
图4 Y=f(A,B)响应面与等高线图
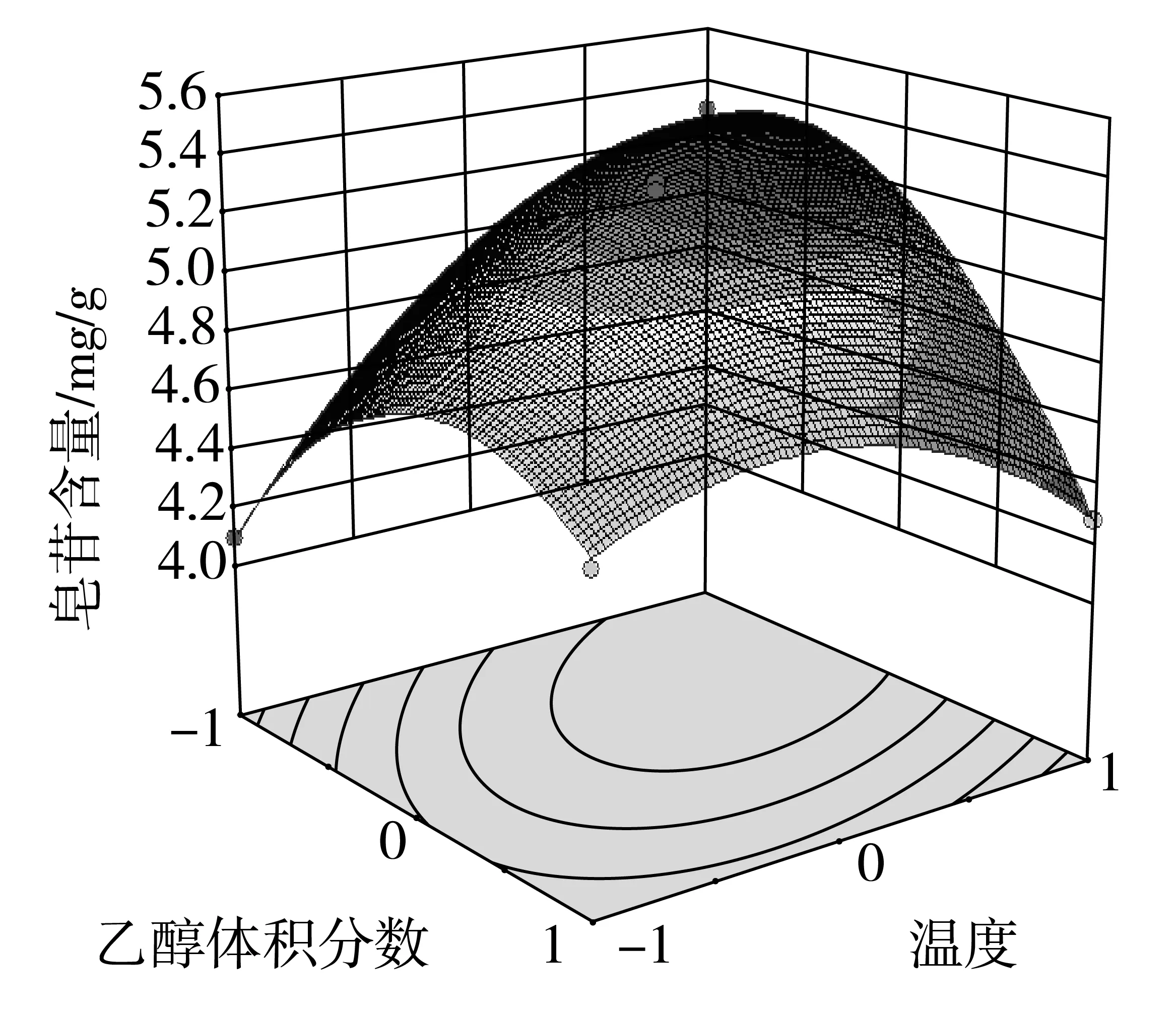
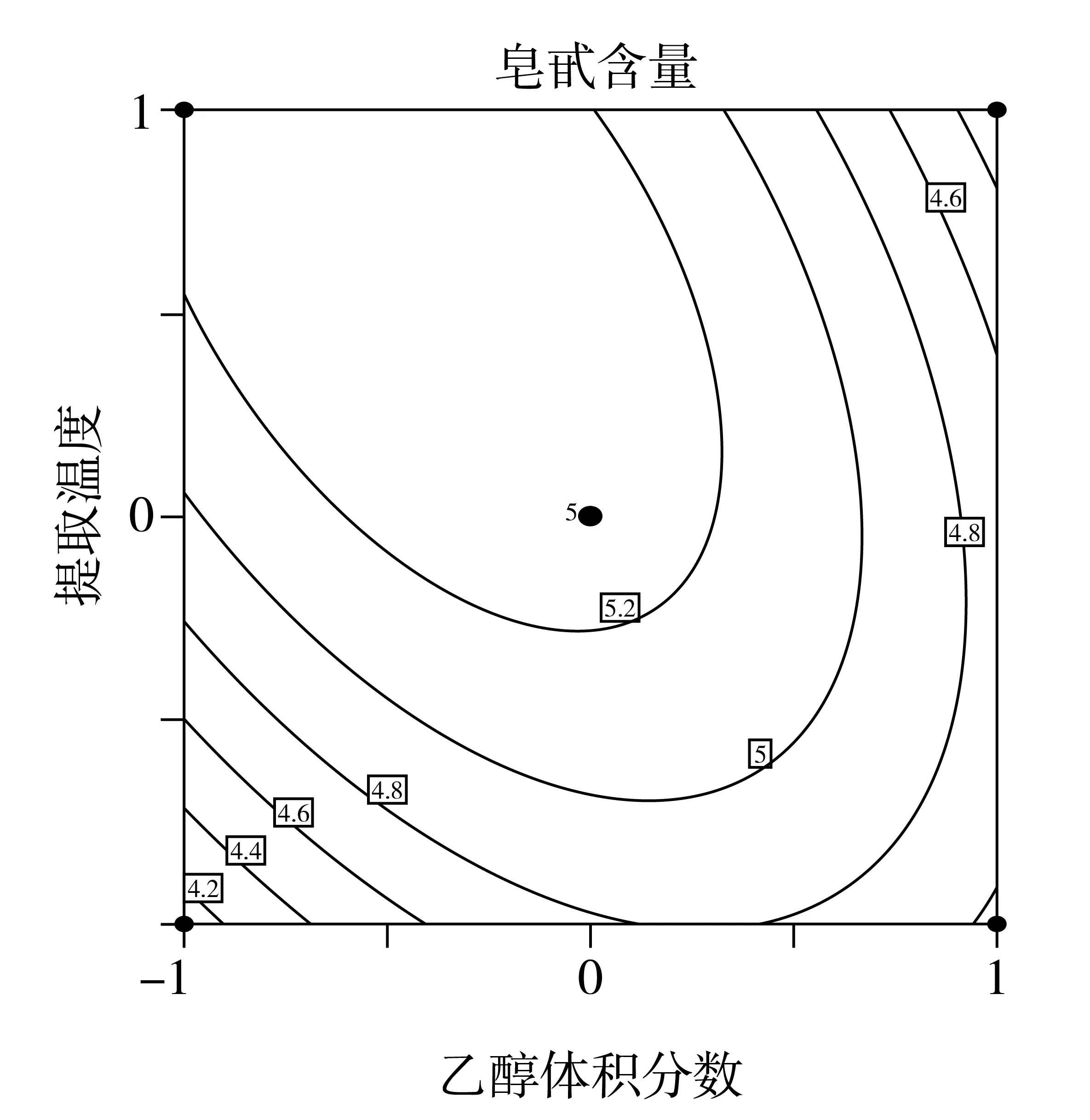
图5 Y=f(A,C)响应面与等高线图
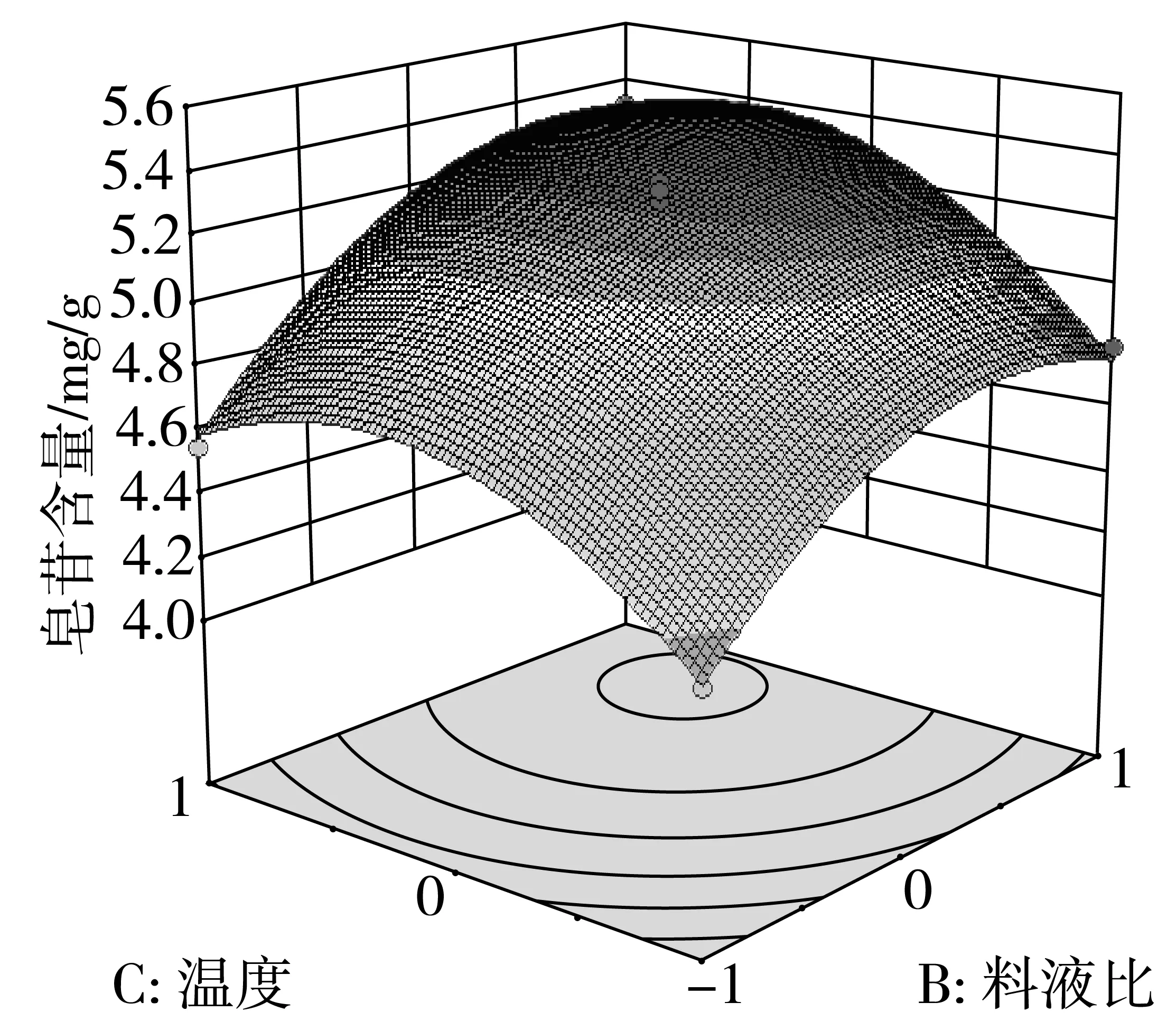
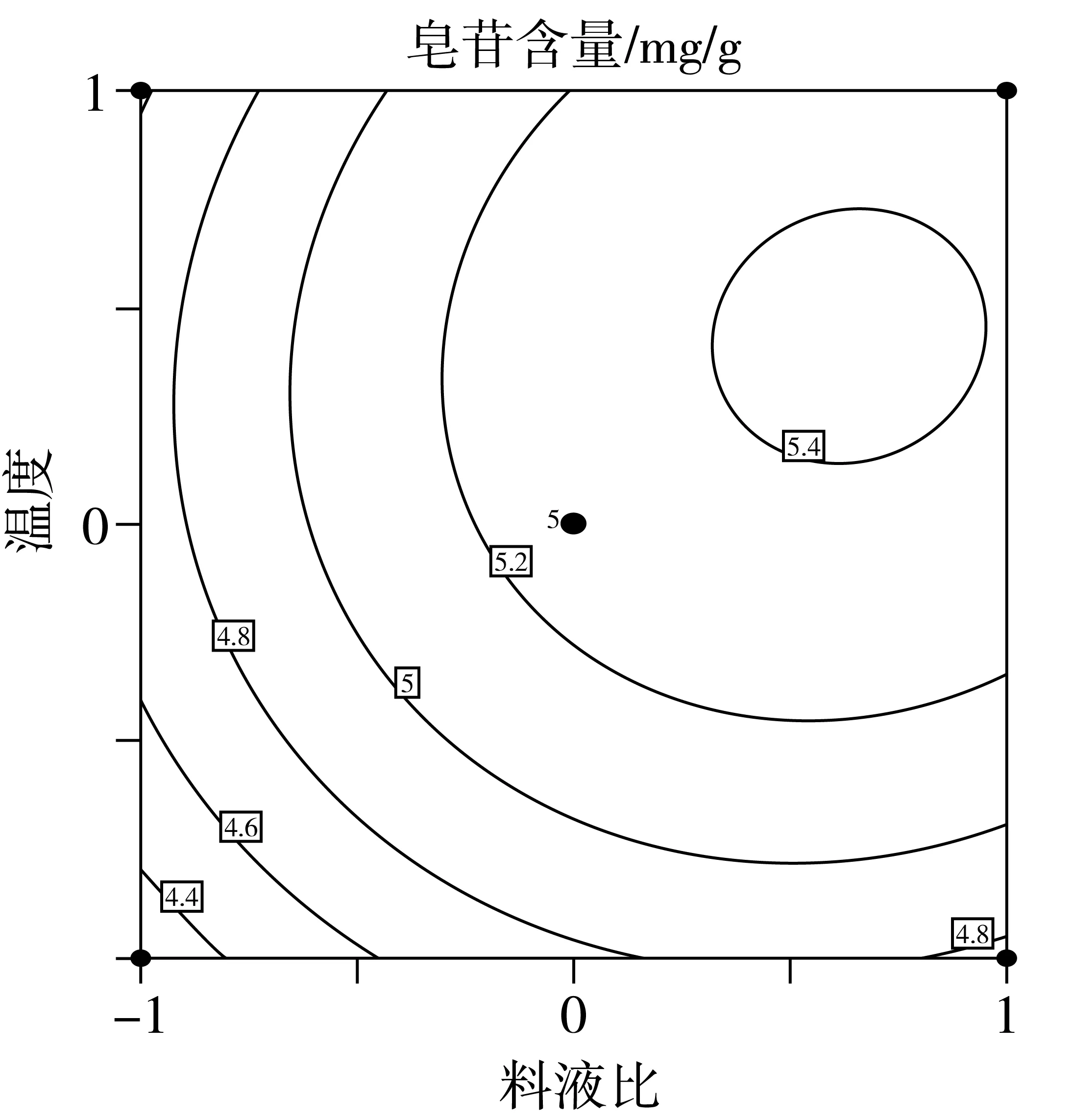
图6 Y=f(B,C)响应面与等高线图
2.4 萌芽藜麦皂苷含量测定
经过单因素试验及响应面优化试验,得到修正的藜麦皂苷最佳制备条件为:乙醇体积分数65%,料液比1:40 g/mL,提取温度60 ℃。在此条件下测得萌芽藜麦皂苷含量,结果如表5和图7。
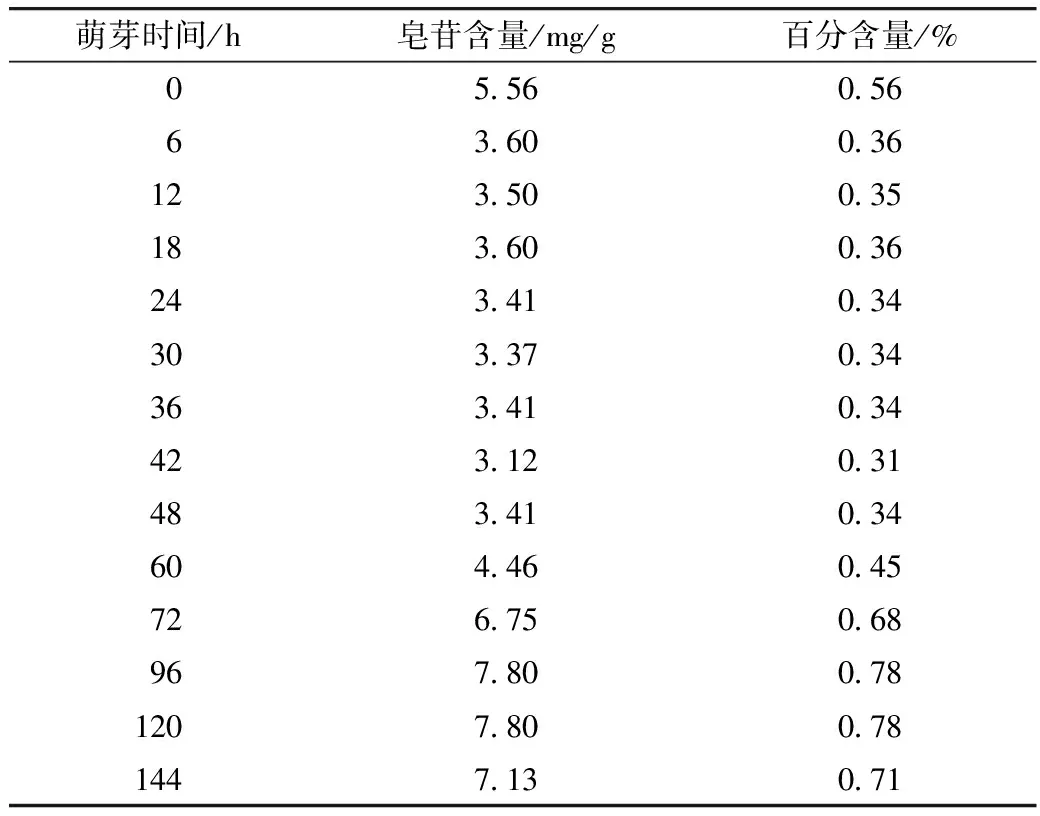
表5 萌芽藜麦皂苷含量
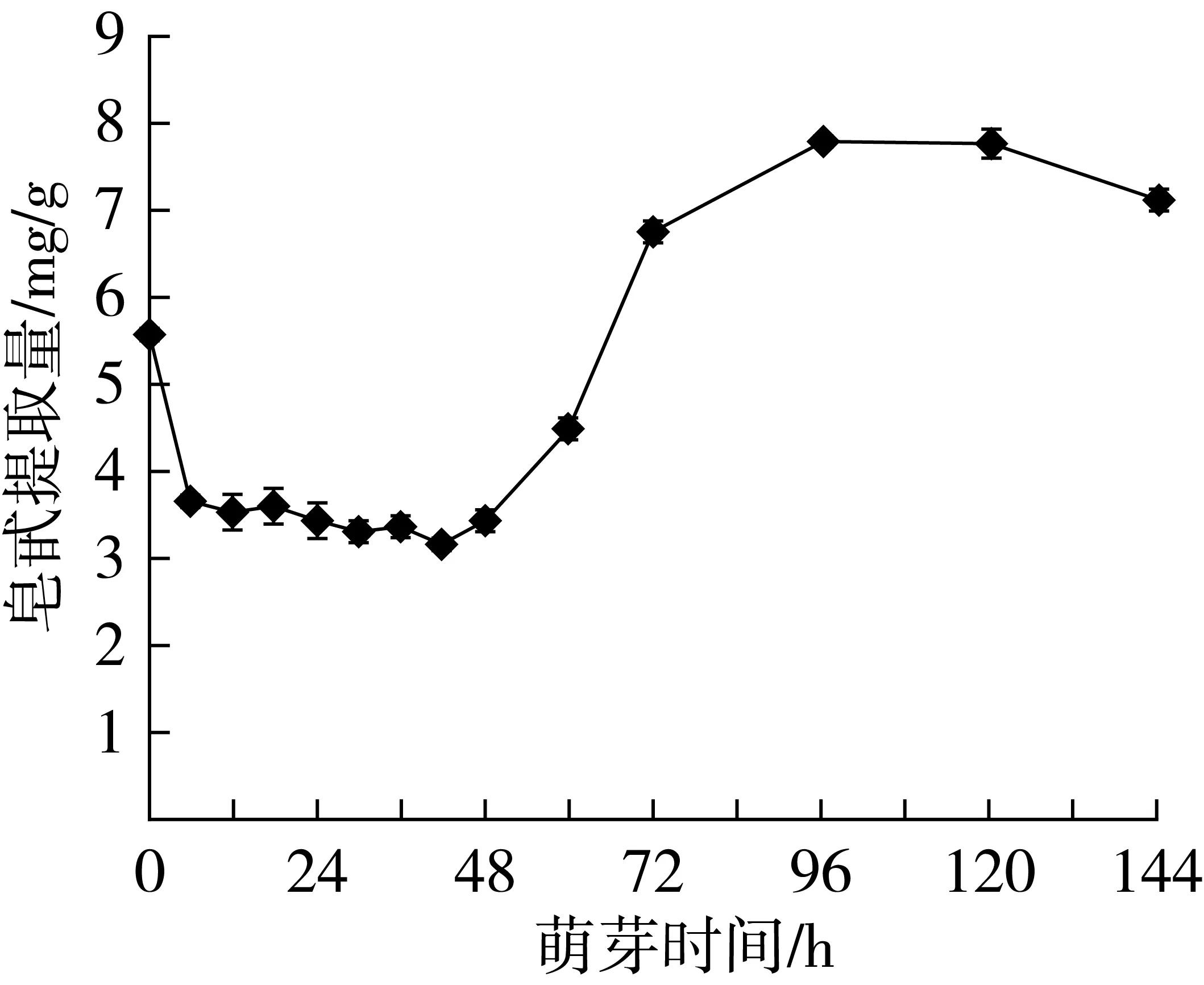
图7 萌芽藜麦皂苷含量
从图7可看出,萌芽6 h内的藜麦皂苷含量极速下降。藜麦籽粒皂苷80%集中于种皮[7],且藜麦属于易发芽的种子[25]。在萌芽初期,种皮吸水膨胀掉落,皂苷随淋水而流走,从而导致皂苷含量的骤降。之后在6~42 h之间,皂苷含量变化不大,保持3.5 mg/g上下小幅度浮动。从42 h开始,皂苷含量逐渐升高,48~72 h期间萌芽藜麦皂苷含量增长速度高于72~96 h。王莘等[26]对萌芽期绿豆功能性营养成分的研究发现,萌芽39 h后,异黄酮和皂苷含量出现最大值,分别增加54.8%和138%。萌芽96 h后,藜麦皂苷含量出现缓慢下降趋势。萌芽后期,皂苷含量增加的原因及机理,目前还没有相关报道。据PawelPasko等[27]对萌芽藜麦抗氧化性的研究表明,萌芽藜麦抗氧化活性的明显增高是因为萌芽过程使多酚、花青素及其他未知成分含量的增加。L.Alvarea-J等[28]认为萌芽过程中某些内源性水解酶的产生及其活性的增加导致萌芽期间抗氧化活性增加。
3 结论
本试验采用响应面法对藜麦籽粒中皂苷的提取条件进行探索,得出最佳调提取条件为:乙醇体积分数65%,料液比1:40 g/mL,提取温度60 ℃。影响藜麦皂苷提取的因素主次顺序为:料液比(B)>提取温度(C)>乙醇体积分数(A)。在此条件下,观察萌芽144 h的藜麦皂苷含量的变化,发现萌芽初期(6 h内)皂苷含量较未萌芽状态下降了约40%,6~42 h保持约3.5 mg/g,42 h后开始增加直至96 h时达最高值0.78 mg/g。萌芽后期(120 h后)皂苷含量缓慢减少。至于皂苷含量增加的原因及机理、萌芽藜麦抗氧化活性的增高是否与皂苷含量的增加有关待进一步的研究。
[1]DiniI,Tenore G C,Dini A.Antioxidantcompound contents and antioxidant activities before and after cooking in sweet and bitter Chenopodium quinoa seeds[J].Food Science and Technology,2010,43:447-451
[2]Han X,Shen T,Lou H.Dietary polyphenols and their biological significance[J].International Journal of Molecular Sciences,2007,8:950-988
[3]Jacobsen S E.The worldwide potential for quinoa(Chenopodium quinoa Wild.)potential[J].Food Reviews International,2003,19:167-177
[4]Atul B,Sudhir S,Deepak O.Chenopodium quinoa-An International perspective[J].Industrial Crops and Products,2006,23:73-87
[5]Stikic R,Glamoclija D,Demin M,et al.Agronomical and nutritional evaluation of quinoa seed(Chenopodium quinoa Wild)as an ingredient in bread formulations[J].Journal of Cereal Science,2012,55:132-138
[6]FAO.Quinoa:An ancient crop to contribute to world food security[EB/OL].Santiago,FAO Regional Office for Latin American and the Caribbean[2011]http://www.fao.org/alc/file/media/pubs/2011/cultivo_quinoa_en.pdf
[7]FAO.Home-international year of quinoa 2013[EB/OL][2014-2-21].http://www.fao.org/quinoa-2013/en/
[8]Estrada A,Li B,LaarryeldB.Adjuvant action of Chenopodium. quinoa saponins on the induction of antibody responses to intragastric and intranasal administered antigens in mice[J].Comp Immunol Microbiol Infect Dis,1998,21(3):225-236
[9]Ozlem G,Gluseppe M.Saponins:properties,applications and processing[J].Food Science and Nutrition,2007,47:231-258
[10]Ma W W,Heinstein P,Mclaughlin J,et al.Additional toxic,bittersaponins from the seeds of Chenopodium quinoa[J].Journal of Natural Products,1989,52(5):1132-1135
[11]Abdou A M,Abdallah H M,Mohamed MA,et al.A new anti-inflammatory triterpenesaponin isolated from Anabasis setifera[J].Archives of Pharmacal Research,2013:1-8
[12]María E,Carmen R R,Sebastián S J,et al.Surfactant and antioxidant properties of an extract from Chenopodium quinoa Willd seed coat[J].Journal of Cereal Science,2011,53:239-243
[13]Brittany L G,Alexander P,Peter K,et al.Quinoa seeds leach phytoecdysteroids and other compounds with anti-diabetic properties[J].Food Chemistry,2014,163:178-185
[14]Meyer B N,Heinstein P F,Burnouf R M,et al.Bioactivity-directed isolation and characterization of quinoside A:one of the toxic/bitter principles of quinoa seeds(Chenopodium quinoa Willd.)[J].Agriculture Food Chemistry,1990,38:205-208
[15]Ana M G C,GinvannaI,Vito V,et al.Influence of pearling process on phenolic and saponin content in quinoa(Chenopodium quinoa Wild)[J].Food Chemistry,2014(157):174-17
[16]任卓伟,倪文杰,刘森.藜麦皂苷的测定研究[J].山西农业科学,2015,43(8):932-935
Ren Z W,Ni W J,Liu S.Determination of quinoa saponins[J].Journal of Shanxi Agriculture Science,2015,43(8):932-935
[17]Rimsten L,Haradsson A K,Andesson R,et al.Effects of malting on ß-glucanase and phytase activity in barley grain[J].Journal of the Science and Food Agriculture,2002,82(8):904-912
[18]Yang T K,Basu B O,Oraikul F.Studies on germination conditions and antioxidant contents of wheat grain[J].International Journal of Science and Nutrition,2001,52(4):319-330
[19]Kuljanabhagavad T,Thongphasuk P,Chamulitrat W,et al.Triterpenesaponins from chenopodium quinoa wild[J].Phytochemistry,2008,69(9):1919-1926
[20]Ren S,Sun J.Changes in phenolic content,phenylalanine ammonia-lyase(PAL)activity and antioxidant capacity of two buckwheat sprouts in relation to germination[J].Journal of Functional Foods,2014,7:298-304
[21]Chavan J K,Kadam S S,Beuchat L R.Nutritional improvement of cereals by sprouting[J].Critical Reviews in Food Science and Nutrition,1989,28(5):401-437
[22]赵文婷.藜麦麸皮总皂苷的提取纯化及其抗氧化和免疫增强作用[D].山西:山西农业大学,2015
Zhao W T.The extraction,purification,antioxidant and immunoenhancement in chenopodium quinoa wild bran total saponins[D].Shanxi:Shanxi Agriculture University,2015
[23]杜静婷,陈超,范三红.响应面法优化藜麦糠皂苷的提取及抗氧化活性[J].山西农业科学,2016,44(7):932-937
Du J T,Chen C,Fan S H.Optimization of extraction conditions for saponins from Chenopodium quinoa bran by Response Surface and its antioxidant activities[J].Journal of Shanxi Agriculture Science,2016,44(7):932-937
[24]吴凤凤.发芽对糙米主要营养成分,功效和加工特性的影响[D].无锡:江南大学,2013
Wu F F.Effect of germination on nutritional components physiological functions and processing characteristics of brown rice[D].Wuxi:Jiangnan University,2013
[25]Repo C R,Espinoza C,Jacobsen S E.Nutritional value and use of the andean crops quinoa(chenopodium quinoa)and kafliwa(chenopodiumpallidicaule)[J].Food Reviews International,2003,19(1/2):179-189
[26]王莘,王艳梅,等.绿豆萌芽期功能性营养成分的测定和分析[J].中国食品学报,2004(4):48-50
Wang X,Wang Y M,et al.Analysis and determination of functional nutrition composition in Mung beans during sprouting period[J].Journal of Chinese Institute of Food Science and Technology,2004(4):48-50
[27]Pawel P,Henryk B,Pawet Z,et al.Anthocyanins,total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry,2009(115):994-998
[28]Alvarez-Jubete L,Wijingaard H,Arendt E K,et al.Polyphenol composition and in vitro antioxidant activity of amaranth,quinoa buckwheat and wheat as affected by sprouting and baking[J].Food Chemistry,2010(119):770-778.
Effect of Quinoa Saponins Extraction and Sprouting on Saponins Content
Huang Jin Qin Likang Shi Qingnan Wen Anyan
(School of Liquor and Food Engineering,Guizhou University,Guiyang 550025)
Response surface design was applied to optimize the extraction process of quinoa seed saponin.And then the effect of sprouting on saponin content was investigated.On the basis of single factor experiments,alcohol concentration,solid-liquid ratio and extraction temperature were selected for a three-factor-three-level Box-Behnken experimental design and the response surface methodology was applied to optimize the extraction conditions.The desired amount of saponin was 5.56 mg/g under the condition:65% ethanol,solid-liquid ratio of 1:40 and extraction temperature at 60 ℃.The germinating test results showed that the saponin was quickly decreased in the early bud(within 6 h),kept steady during 6~42 h and then increased gradually with sprouting after 42 h.The peak value(7.80 mg/g)was reached on the fourth day,after that,it declined slowly with germinating after 120 h.
quinoa,germinated,saponins,response surface design
S512.9
A
1003-0174(2017)11-0034-07
六盘水市级科技计划(52020-2015-02)
2016-10-31
黄金,女,1991年出生,硕士,食品科学
秦礼康,男,1965年出生,教授,食品科学
