小麦醇溶蛋白自组装纳米粒子负载白藜芦醇的性质研究
2017-12-07孔祥珍周治彤吴炜豪
孔祥珍 黄 飞 周治彤 吴炜豪
(江南大学食品学院;食品科学与技术国家重点实验室,无锡 214122)
小麦醇溶蛋白自组装纳米粒子负载白藜芦醇的性质研究
孔祥珍 黄 飞 周治彤 吴炜豪
(江南大学食品学院;食品科学与技术国家重点实验室,无锡 214122)
小麦醇溶蛋白是谷朊粉的主要成分之一,用小麦醇溶蛋白包埋白藜芦醇以达到稳定白藜芦醇的目的。用反溶剂法制得其自组装纳米粒子,对乙醇浓度、蛋白浓度、分散液pH、分散液盐浓度等因素对纳米粒子的粒径以及Zeta电位的影响做出了探究。发现在乙醇浓度为65%,蛋白质浓度4%,分散液pH为4.5,分散液盐浓度为0.00 mol/L时,得到理想的纳米粒子,其粒径约为(185.1±8.5) nm,Zeta电位为(19.36±1.03) mV。而后在最佳条件下用小麦醇溶蛋白纳米粒子负载白藜芦醇,发现该复合物在芯壁比为1:40时包埋率最高,此时粒径(166.7±3.7) nm,Zeta电位(15.68±0.74) mV,包埋率为55.0%,载药率为1.5%。小麦醇溶蛋白纳米粒子可以用来稳定白藜芦醇。
小麦醇溶蛋白 纳米粒子 自组装 白藜芦醇
谷朊粉是小麦加工的副产品,主要由醇溶蛋白和麦谷蛋白组成[1-2]。小麦醇溶蛋白为单链蛋白,分子量约为28~55 ku,通过键内二硫键、疏水相互作用、氢键等形成球状结构[3]。小麦醇溶蛋白作为靶向载体材料前景广阔。李崇达[4]采用小麦醇溶蛋白通过戊二醛交联制备小麦醇溶蛋白微球,并在微球的制备过程中引入磁性纳米粒子。Ezpeleta等[5]用小麦醇溶蛋白制备荆豆凝集素-小麦醇溶蛋白纳米粒子,并且使荆豆凝集素在体内活性和特性得到保留。
白藜芦醇是一种非黄酮类多酚化合物,分子式C14H12O3,难溶于水,易溶于乙醇乙醚等有机试剂[6]。天然白藜芦醇主要来自于葡萄、虎杖等植物。研究表明,白藜芦醇具有抗菌[7]、抗氧化[8]等功效,对鼠的肝癌[9]、胃癌[10]、白血病[11]等都有明显的抑制作用。白藜芦醇还具有延长秀丽隐形线虫和黑腹果蝇寿命[12]的作用。但是白藜芦醇的不稳定性限制了它的应用。
本研究以小麦醇溶蛋白为原料,通过反溶剂法制备小麦醇溶蛋白纳米粒子,并以其为载体进行荷载白藜芦醇的研究,以期获得荷载白藜芦醇的纳米粒子,提高白藜芦醇的稳定性,扩大其应用领域。文章首先考察工艺条件对纳米粒子粒径、Zeta电位等的影响,在此基础上,制备负载白藜芦醇的小麦醇溶蛋白纳米粒子,并对其微观结构及红外光谱的变化进行了表征。
1 材料与方法
1.1 试验材料
小麦醇溶蛋白:实验室自制,由谷朊粉提取,纯度92%;白藜芦醇:生工生物工程(上海)股份有限公司,纯度≥98%;乙醇、盐酸、氢氧化钠等均为国产分析纯。
1.2 试验仪器
纳米粒度及Zeta电位仪:英国马尔文公司;紫外可见分光光度计:翱艺仪器(上海)有限公司;场发射扫描电子显微镜:日本日立株式会社;傅里叶红外光谱仪:美国Nicolet公司;冷冻干燥机:北京四环科学仪器厂有限公司。
1.3 试验方法
1.3.1 白藜芦醇的紫外吸收波长扫描
取一定质量的白藜芦醇,采用乙醇搅拌溶解,配制成白藜芦醇质量分数约为0.01%(m/V)的乙醇溶液,波长范围200~500 nm扫描。发现在306 nm处有最大吸收峰。
1.3.2 白藜芦醇分解动力学方程
操作过程中难免要使白藜芦醇暴露在光下,测定白藜芦醇的分解速率方程以消除计算过程中的误差。取一定量白藜芦醇(精确到0.01 mg)采用乙醇搅拌溶解,稀释至合适浓度,在波长306 nm下测定吸光度随时间的变化值,并拟合出白藜芦醇分解速率方程。
1.3.3 小麦醇溶蛋白自组装纳米粒子的制备
采用反溶剂法制备小麦醇溶蛋白自组装纳米粒子。小麦醇溶蛋白以一定质量浓度分散于一定浓度的乙醇溶液,待其完全溶解。随后吸取一定量的醇溶蛋白溶液,逐滴滴入到漩涡搅拌的分散液(一定pH、盐浓度的去离子水溶液),滴加完毕后继续搅拌5~10 min,即获得小麦醇溶蛋白自组装纳米粒子。分散液通过1 mol/L HCl溶液进行pH值的调节,及1.00 mol/L NaCl溶液进行盐浓度的调节。此处分别考察溶剂乙醇浓度、蛋白浓度、分散液pH、分散液离子强度对纳米粒子的性质的影响,具体设置条件如下:乙醇浓度(35%、45%、55%、65%、75%),蛋白浓度(1%、2%、4%、6%、8%),分散液pH(2.5、4.5、6.5、8.5、10.5),分散液盐浓度(0.00、0.25、0.50、0.75 mol/L)。
1.3.4 负载白藜芦醇自组装纳米粒子的制备
制备流程同1.2.3小麦醇溶蛋白纳米粒子的制备方法。在最佳条件下制备负载白藜芦醇自组装纳米粒子。在溶解有小麦醇溶蛋白的乙醇溶液中,分别按白藜芦醇、小麦醇溶蛋白质量比为0、1:5、1:10、1:20、1:40的比例加入白藜芦醇,磁力搅拌至白藜芦醇完全溶解。
1.3.5 负载白藜芦醇自组装纳米粒子的包埋率及载药率
取负载白藜芦醇自组装纳米粒子的悬浊液1 mL,去离子水定容至25 mL。取5 mL定容后的液体超滤(超滤管分子截留量为10 ku)离心(4 000 r/min,20 min),收集滤液。采用5 mL水洗涤超滤管截留物,上述条件离心,收集滤液。继续重复洗涤2次,将所有滤液转移至50 mL容量瓶,定容。在波长306 nm处测定吸光度值。计算白藜芦醇包埋率及载药率,计算公式:
1.3.6 纳米粒子表征
采用纳米粒度及ZETA电位仪测定反溶剂法制备的小麦醇溶蛋白纳米粒子的粒度、Zeta电位以及PDI。PDI是指多分散性系数,PDI越小,代表体系粒径越均匀,一般认为小于0.4较好。采用场发射扫描电子显微镜对纳米粒子形貌观察,及傅里叶红外光谱仪对纳米粒子进行红外光谱分析。
2 结果与讨论
2.1 白藜芦醇的最大吸收峰
用紫外可见分光光度计对白藜芦醇的稀溶液进行吸收波长扫描,得到如图1所示的谱图,在306 nm处有最大吸收峰,这与Shi等[13]的研究结果类似。试验过程需测定白藜芦醇紫外吸光度时,均在306 nm处测定。

图1 白藜芦醇溶液的紫外吸收曲线
2.2 白藜芦醇的分解动力学方程
为了考察在将白藜芦醇包埋到小麦醇溶纳米粒子期间,白藜芦醇的稳定性,因此考察了150 min以内,白藜芦醇的自身稳定性。分别测定不同时间点样品吸光度值,整个测定过程未避光。根据白藜芦醇溶液标准曲线:y=0.104 5x-0.000 7,R2=0.999 8(y,吸光度;x,白藜芦醇浓度,μg/mL),计算出对应浓度。以白藜芦醇浓度(y,μg/mL)对时间(x,min)作图(见图2),拟合出一条回归曲线:y=-0.005 3x+6.248 7,R2=0.997 7。由于纳米粒子的制备过程在60 min以内,测定的白藜芦醇分解速率在这个时间段内有较好的线性关系,故用作计算白藜芦醇自身不稳定所造成的分解量。
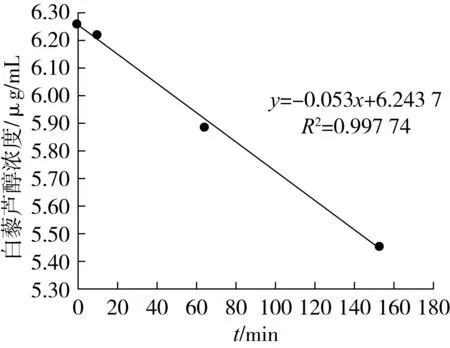
图2 白藜芦醇的分解速率曲线
2.3 小麦醇溶蛋白纳米粒子制备的条件优化
2.3.1 分散液pH对自组装纳米粒子的粒径、电位、多分散性系数的影响
试验所用去离子水的pH为6.5,当分散液pH偏离6.5时,粒径呈现变小的趋势(见表1),这是因为小麦醇溶蛋白的等电点恰好在6.5附近,利于反溶剂过程中蛋白质的析出,所以粒径在此pH较大。在pH 4.5时平均粒径最小,电位较大,乳液较稳定,故选择pH 4.5。
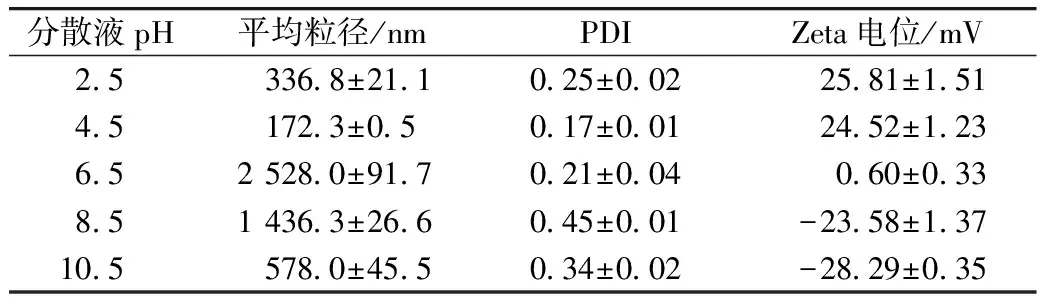
表1 分散液pH对自组装纳米粒子的粒径、电位、多分散性系数的影响
2.3.2 乙醇浓度对纳米粒子粒径、多分散性系数及Zeta电位的影响
乙醇溶液溶解小麦醇溶蛋白后的体系呈浅黄色透明澄清溶液,随着乙醇浓度的递增,溶液的黄色越深,无肉眼可见的沉淀。说明在此系列的乙醇溶液中,小麦醇溶蛋白都能完全溶解。如表2所示,随着乙醇浓度的增大,小麦醇溶蛋白自组装纳米粒子的平均粒径呈现减小的趋势。当溶解醇溶蛋白的乙醇浓度越高,滴入分散液后,相应的分散体系中乙醇含量也越高,醇溶蛋白分子在越高的乙醇浓度下溶解度越大,故不易析出,粒径越小。乙醇浓度为65%时,Zeta电位最大。选择溶剂乙醇浓度为65%。
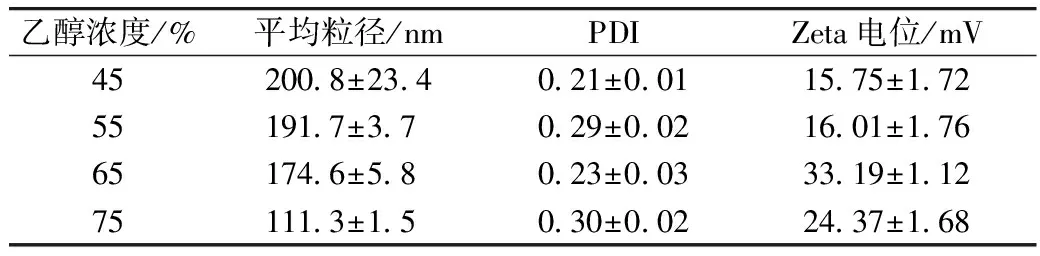
表2 不同浓度的乙醇对自组装纳米粒子的粒径、电位、多分散性系数的影响
2.3.3 蛋白质浓度对纳米粒子粒径、多分散性系数及Zeta电位的影响
各组随着蛋白质浓度的增加,粒径有变大的趋势(见表3),醇溶蛋白浓度为4%时电位最高,说明粒子间相互作用的排斥力最大,体系最稳定。综合粒径、PDI和电位因素,选择小麦醇溶蛋白浓度为4%。
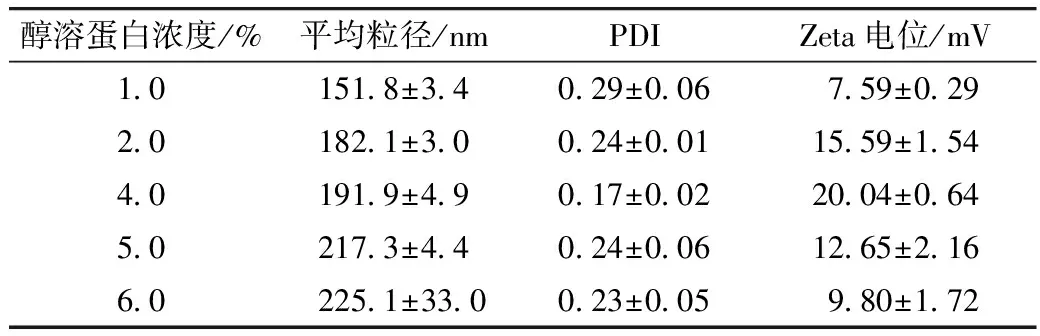
表3 蛋白浓度对自组装纳米粒子的粒径、电位、多分散性系数的影响
2.3.4 分散液盐浓度对自组装纳米粒子的粒径、电位、多分散性系数的影响
离子的存在使得蛋白质的表面形成一层静电屏蔽层,离子强度对蛋白质的影响取决于蛋白质表面的性质。由于醇溶蛋白含有高比例的非极性区域,因此电荷屏蔽效应使其溶解度下降。如表4所示,随着盐浓度的增大,形成的纳米粒子的粒径增大。选择分散液盐浓度为0.00 mol/L即去离子水。
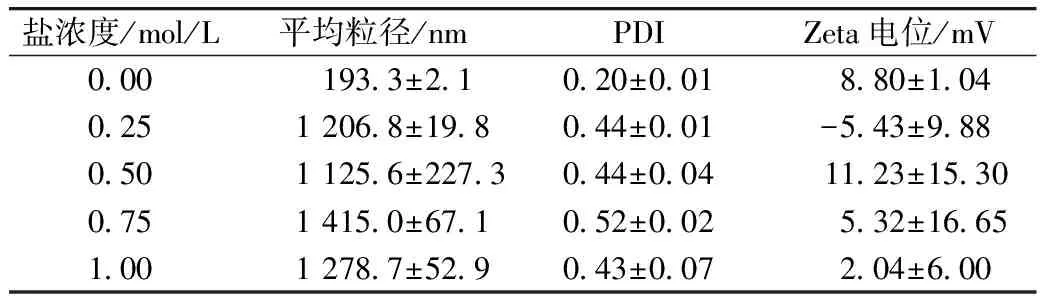
表4 分散液盐浓度对自组装纳米粒子的粒径、电位、多分散性系数的影响
2.4 负载白藜芦醇自组装纳米粒子的研究
最终确定采用分散液pH 4.5,乙醇浓度65%,蛋白浓度4%,分散液盐浓度为0.00 mol/L制备负载白藜芦醇的自组装纳米粒子。如表5所示,随着芯材比例的减小,包埋率有所波动,最高为55.0%。随着芯壁材比例的减小,载药率自最大值9.1%依次减小。这与殷婷等[14]用大麦醇溶蛋白包埋白藜芦醇的载药率相比偏低。这可能与小麦醇溶蛋白和大麦醇溶蛋白与白藜芦醇的相互作用不同有关。大麦醇溶蛋白与白藜芦醇的相互作用主要是氢键、范德华力、疏水相互作用,白藜芦醇与大麦醇溶蛋白的疏水相互作用体现在对色氨酸残基的疏水性上[15]。目前小麦醇溶蛋白与白藜芦醇的相互作用还在研究中。
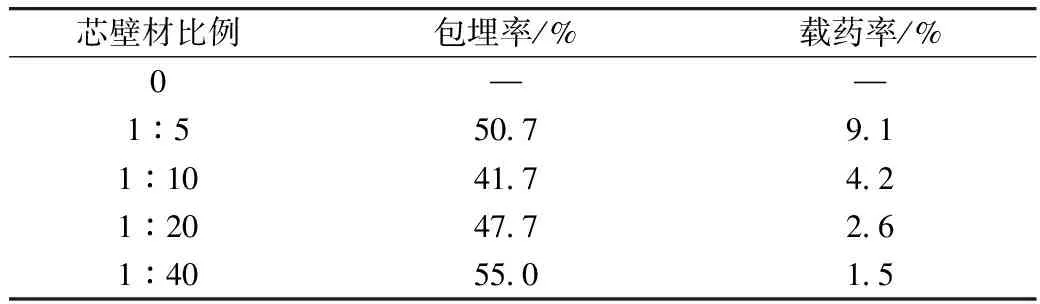
表5 白藜芦醇的包埋率及载药率
表6所示为负载白藜芦醇纳米粒子的粒径及电位结果,由表可知,在所考察的芯壁材比例范围内,平均粒径在146.8~193.65 nm,Zeta电位变化范围10.23~21.28 mV。
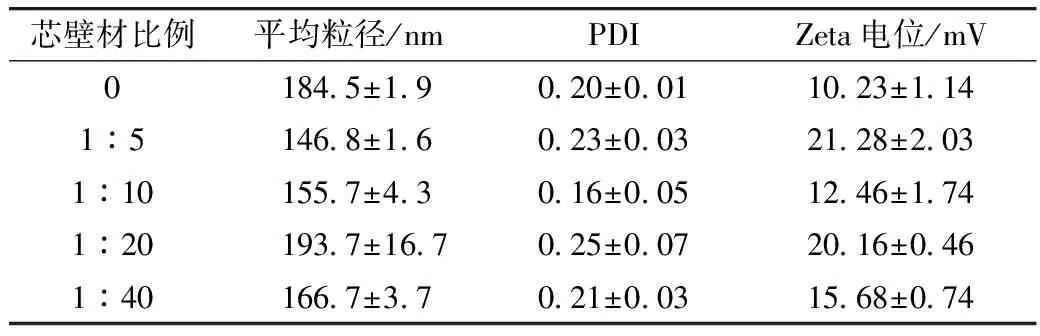
表6 负载白藜芦醇纳米粒子的粒径、多分散性系数及电位
2.5 扫描电子显微镜对纳米粒子形貌观察
对冷冻干燥后的纳米粒子进行场发射扫描电镜形貌观察。当不加入白藜芦醇时,如图3a所示,除了个别较大的粒子外,绝大多数为极小的纳米粒子,而且较为均匀,粒子与粒子之间相互有所黏连。当芯壁材比为1:5时,如图3b所示,粒子粒径变大,大颗粒的狭缝中夹杂许多小颗粒(如图3c),这说明当加入白藜芦醇后,芯材被包裹,粒子的粒径变大,还有未包埋到芯材的蛋白质则像空白组一样析出,粒径不变化。当芯壁材比例为1:40时,与空载相比,较大的颗粒数量增多,但体积增加并不明显(如图3d),这是由于加入芯材后有部分芯材被包埋,但是由于芯壁材比例小,所以粒子粒径并不像图3b中那么大。
注:a小麦醇溶蛋白自组装纳米粒子,b芯壁材1:5负载白藜芦醇纳米粒子宏观图,c芯壁材1:5负载白藜芦醇纳米粒子微观图,d芯壁材1:40负载白藜芦醇纳米粒子。图3 小麦醇溶蛋白纳米粒子及其负载白藜芦醇纳米粒子的SEM图
各组电镜图片可以看出,粒子表面光滑,没有孔洞,没有凸凹,说明本方法制备的纳米粒子具有良好的包埋性,可以很好地将芯材包封在粒子内部。
2.6 傅里叶红外变换光谱分析
对小麦醇溶蛋白、小麦醇溶蛋白纳米粒子以及包埋白藜芦醇的小麦醇溶蛋白纳米粒子进行傅里叶红外变化光谱分析,得到如图4所示的红外吸收光谱。波数在3 300 cm-1处的吸收峰代表—O—H的伸缩振动,比较A与C发现,C在此处峰宽较之窄,说明蛋白质的羟基分子间缔合形成了氢键,形成纳米粒子后,氢键的缔合作用减弱,这是由于反溶剂法制成纳米粒子后,羟基亲水被暴露在纳米粒子的外表面,分子间的缔合被减弱。比较B、C发现,蛋白纳米粒子比负载白藜芦醇的纳米粒子缔合效果强,并且B在3 300 cm-1处的峰没有向低波数移动的迹象,说明白藜芦醇与蛋白质没有明显的氢键缔合作用,进一步提示白藜芦醇与蛋白质之间的作用力由疏水相互作用主导。
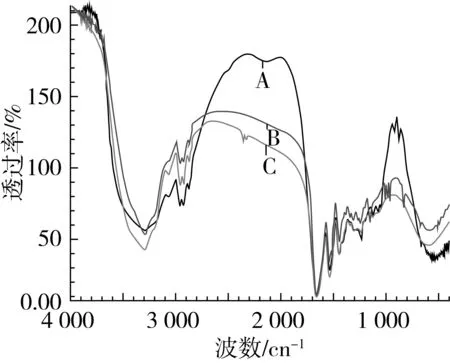
注:A小麦醇溶蛋白;B小麦醇溶蛋白负载白藜芦醇纳米粒子(芯壁比1:5);C小麦醇溶蛋白纳米粒子。图4 傅里叶红外变换谱图
3 结论
用反溶剂法制备小麦醇溶蛋白自组装纳米粒子,确定在乙醇浓度为65%,蛋白质浓度4%,分散液pH为4.5,分散液盐浓度为0.00 mol/L时,得到理想的纳米粒子,其粒径约为(185.1±8.5) nm,Zeta电位约为(19.36±1.03) mV。而后用该方法包埋白藜芦醇,发现芯壁比为1:40时,包埋率最佳为55.0%,载药率为1.5%,小麦醇溶蛋白负载白藜芦醇后粒径(166.7±3.7) nm,Zeta电位(15.68±0.74) mV。扫描电镜显示负载白藜芦醇后的纳米粒子表面光滑,颗粒较小,具有较好的包埋特性。傅里叶红外变换光谱显示将小麦醇溶蛋白制备成纳米粒子后分子间的氢键发生了变化,同时羧羟基多了一种面外弯曲的振动方式。
[1]陶海腾,王文亮,程安玮,等.小麦蛋白组分及其对加工品质的影响[J].中国食物与营养,2011,17(3):28-31
Tao H T,Wang W L,Cheng A W,et al.Wheat protein components and their effects on process quality[J].Food and Nutrition in China,2011,17(3):28-31
[2]贾光锋,范丽霞,王金水.小麦面筋蛋白结构、功能性及应用[J].粮食加工,2004(2):11-13
Jia G F,Fan L X,Wang J S.The structure,functional properties and using of wheat gluten protein[J].Grain Processing,2004(2):11-13
[3]马永强,韩春然,石忠志.小麦醇溶蛋白的研究进展[J].食品科学,2006(12):813-817
Ma Y Q,Han C R,Shi Z Z.Advance on the study of wheat gliadins[J].Food Science,2006(12):813-817
[4]李崇达.小麦醇溶蛋白的提取及其磁性微球的制备与性能研究[D].郑州:河南工业大学,2011
Li C D.Abstraction of gliadin and preparation and characterization of magnetic nanoparticles[M].Zhengzhou:Henan Polytechnic University,2011
[5]Ezpeleta I,Arangoa M A,Irache J M,et al.Preparation of Ulex europaeus lectin-gliadin nanoparticle conjugates and their interaction with gastrointestinal mucus[J].International Journal of Pharmaceutics,1999,191(1):25-32
[6]李洁,熊兴耀,曾建国,等.白藜芦醇的研究进展[J].中国现代中药,2013(2):100-108
Li J,Xiong X H,Zeng J G,et al.Current situation and progress of resveratrol research[J].Modern Chinese Medicine,2013(2):100-108
[7]张瑞,李永军,王鑫.白藜芦醇抗菌作用的研究进展[J].河北医科大学学报,2010(9):1151-1154
Zhang R,Li Y J,Wang X.Current situation and progress of the antibacterial properties of resveratrol[J].Journal of Hebei Medical University,2010(9):1151-1154
[8]Ndiaye M,Philippe C,Mukhtar H,et al.The grape antioxidant resveratrol for skin disorders:Promise,prospects,and challenges[J].Archives of Biochemistry and Biophysics,2011,508(2):164-70
[9]Wu S L,Sun Z J,Yu L,et al.Effect of resveratrol and in combination with 5-FU on murine liver cancer[J].World Journal of Gastroenterology,2004,10(20):3048-3052
[10]Atten M J,Godoy-Romero E,Attar B M,et al.Resveratrol regulates cellular PKC alpha and delta to inhibit growth and induce apoptosis in gastric cancer cells[J].Investigational New Drugs,2005,23(2):111-119
[11]Horvath Z,Saiko P,Illmer C,et al.Resveratrol,an ingredient of wine,acts synergistically with Ara-C and tiazofurin in HL-60 human promyelocytic leukemia cells[J].Nucleosides Nucleotides and Nucleic Acids,2006,25(9-11):1019-1024
[12]Valenzano D R,Terzibasi E,Genade T,et al.Resveratrol prolongs lifespan and retards the onset of age-related markers in a short-lived vertebrate[J].Current Biology,2006,16(3):296-300
[13]Shi G,Rao L,Yu H,et al.Stabilization and encapsulation of photosensitive resveratrol within yeast cell[J].International Journal of Pharmaceutics,2008,349(1-2):83-93
[14]殷婷,管骁.大麦醇溶蛋白负载白藜芦醇自组装纳米颗粒及其性质研究[J].分析测试学报,2015(1):67-72
Yin T,Guan X.Preparation and characterization of hordein self-assesbled nanoparticles loadedresveratrol[J].Journal of Instrumental Analysis,2015(1):67-72
[15]Guan X,Liu J,Yin T,et al.Study on the Interaction in Resveratrol-Hordein Nanoparticle[J].Spectrosc Spectr Anal,2016,36(1):163-168.
Characterization of Gliadin Self-Assembly Nanoparticles Loaded with Resveratrol
Kong Xiangzhen Huang Fei Zhou Zhitong Wu Weihao
(State Key Laboratory of Food Science and Technology; School of Food Science and Technology,Jiangnan University,Wuxi 214122)
Gliadin is an important fraction of wheat gluten.Resveratrol was buried in the gliadin nanoparticles to stabilize the resveratrol.In this paper,gliadin nanoparticles were self-assembled by anti-solvent method.Effects of ethanol concentration,protein concentration,pH and salt concentration of the dispersion solution on the particle size and Zeta potential of the prepared nanoparticles were systematically studied.The desired nanoparticles,of which the mean diameter was(185.1±8.5) nm and the mean Zeta potential was(19.36±1.03) mV,were prepared under the condition of 65% ethanol concentration,4% protein concentration,pH 4.5 and 0.00 mol/L salt concentration.Under the optimum conditions,the gliadin nanoparticles loaded with resveratrol have best encapsulation efficiency when prepared with 1:40 core/wall ratio.The result showed that the prepared nanoparticles have 55.0% encapsulation efficiency and 1.5% drug loading rate with mean diameter of (166.67±3.7) nm,and mean Zeta potential of (15.68±0.74) mV.Gliadin nanoparticles can stabilize resveratrol.
gliadin,nanoparticle,self-assembly,resveratrol
TQ218
A
1003-0174(2017)11-0021-05
国家级大学生创新创业训练计划(201510295018)
2016-10-25
孔祥珍,女,1980年出生,副教授,植物蛋白科学与技术
