苹果酒优良酵母菌剂的制备
2017-12-06赵娟娟吴荣荣
赵娟娟,吴荣荣,李 琳
(1.衡水学院 生命科学系,河北 衡水 053000;2.衡水市疾病预防控制中心,河北 衡水 053000)
苹果酒优良酵母菌剂的制备
赵娟娟1,吴荣荣1,李 琳2
(1.衡水学院 生命科学系,河北 衡水 053000;2.衡水市疾病预防控制中心,河北 衡水 053000)
该研究对制备苹果酒菌剂的培养基配方、培养条件以及冷冻保护剂配方进行了研究。结果表明,最适的培养基组成为在YPD基础培养基上,加入葡萄糖2.5%,KNO31.5%,MgSO40.1%。菌剂最适培养条件为:发酵温度20℃,接种量1.0%,培养时间为14 h,pH5.0。保护剂为脱脂奶粉12%,甘油2%,谷氨酸钠1%,吐温80为0.5%。在此最佳条件下,冷冻干燥后菌剂的活菌数能达到6.12×1011CFU/g。
酿酒酵母;培养基;培养条件;冷冻保护剂
苹果酒又叫西打酒(cider),是一类以纯果汁为原料发酵而成的低度饮料酒。苹果酒产量仅次于葡萄酒,为世界第二大果酒,是国际饮料酒市场的一大热点[1]。它处于果汁与酒的过度状态,有苹果的果香和果酒的醇香,还可使大量非商品苹果转化增值,符合饮料酒的未来发展方向。同时苹果酒富含多种维生素、氨基酸、钙、铁、钾等营养成分,以及其他酒类所没有的苹果酸、丙酮酸等有机酸。经常饮用苹果酒能降低血脂、软化血管、促进人体新陈代谢,还具有美容功效[2-4]。
在我国缺少专用苹果酒发酵酵母是制约苹果酒发展的一个重要方面。现在苹果酒生产中大多使用葡萄酒酵母,葡萄酒酵母的特性是为适应葡萄酒的生产而研发的,在苹果酒生产中,并不很适宜。用发酵能力好,繁殖能力高、抗二氧化硫的酵母启动发酵,可以提高发酵速率,酿造出的苹果酒具有较好的品质[5-7]。因此,选择起酵迅速、降糖和沉降性能好、产酒量大、酒香协调高品质的苹果酒酿酒酵母很有必要[8]。
本实验拟对实验室保藏的苹果酒专用酿酒酵母(Saccharomyces cerevisiae)Z1菌剂的制备关键技术进行研究,主要从菌株生长培养基的组成[9-11],发酵条件[12-14]以及冷冻干燥保护剂几个方面进行研究[15-17],以酿酒酵母的生长情况为指标进行测定,以期能制备工业化生产用的苹果酒专用酵母,获得高数量和活性的酿酒酵母菌剂,促进苹果酒产业的快速发展。
1 材料与方法
1.1 材料与试剂
菌株:衡水学院实验室保藏的苹果酒专用酿酒酵母(Saccharomyces cerevisiae)Z1。培养基:酵母膏胨葡萄糖培养基(yeast extract peptone dextrose,YPD),蛋白胨10 g,萄萄糖20 g,蒸馏水1 L,酵母膏10 g,121℃灭菌20 min。
1.2 仪器与设备
SW-CJ-2FD超净工作台:上海博迅实业有限公司;SPX-150B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;TU-1901紫外-可见分光光度计:北京普析通用仪器有限责任公司;PHB-4便携式pH计:上海三信仪表厂;MLS-3750高压蒸汽灭菌器:日本三洋集团。
1.3 方法
1.3.1 培养基的优化
(1)单因素试验
将酵母菌接入不同碳源(葡萄糖,蔗糖、淀粉、玉米粉)、氮源(蛋白胨、尿素、硫酸铵、硝酸钾)、无机盐(硫酸镁、硫酸锰、硫酸亚铁、硫酸锌)的培养基,28℃、120 r/min振荡培养24 h,通过对吸光度值的测定,确定最佳培养基组成。
(2)正交试验
根据参考文献[10-11],以葡萄糖为碳源、添加无机氮源硝酸钾,无机盐硫酸镁为评价因素,采用4因素3水平的L9(34)正交试验,在YPD基础培养基中设计发酵试验,确定培养基的最佳组成。

表1 培养基配方条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for medium formula optimization
1.3.2 培养条件的优化
(1)单因素试验
通过对在不同温度(10℃、15℃、20℃、25℃)、pH(4.0、4.5、5.0、5.5)、接种量(1.0%、1.5%、2.0%、2.5%)和培养时间(7 h、11 h、14 h、18 h、22 h、24 h)条件下,进行发酵液OD560nm的测定,确定最佳培养条件。
(2)正交试验
采用4因素3水平的L9(34)正交试验,以发酵温度、pH、接种量,培养时间为考核因素,发酵液OD560nm为评价指标,确定最佳培养条件。正交试验因素与水平见表2。

表2 培养条件优化正交试验因素与水平Table 2 Factors and levels of orthogonal experiments for fermentation conditions optimization
1.3.3 冷冻保护剂组成的优化
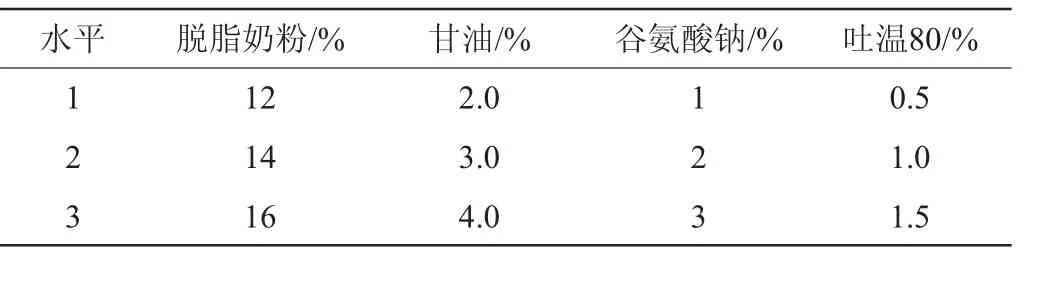
表3 冷冻保护剂配方优化正交试验因素与水平Table 3 Factors and levels of orthogonal experiments for cryoprotectant formula optimization
将菌液预冷至-40℃维持2 h,然后将温度上升至-10℃维持2 h,解除降温措施,继续在真空状态下维持18 h。以脱脂奶粉、甘油、谷氨酸钠和吐温80添加量为考核因素,活菌数为评价指标,采用4因素3水平的L9(34)正交试验。确定冷冻保护剂对酵母Z1的影响[16-17],因素与水平见表3。
1.3.4 活菌数测定
按“GB 4789.15—2016《食品微生物学检验霉菌和酵母计数》规定执行。
2 结果与分析
2.1 培养基的优化
2.1.1 单因素试验结果
(1)碳源对酵母菌生长的影响
YPD培养基中的葡萄糖,分别以等量的蔗糖、淀粉、玉米粉替换,按接种量2%接入菌株Z1,在28℃、120 r/min振荡培养24 h,测得波长560 nm处的OD560nm值如图1所示。

图1 碳源对酵母菌生长的影响Fig.1 Effect of carbon sources onSaccharomyces cerevisiae growth
酵母菌营养方式属于化能异养型微生物,能够直接吸收利用多种单糖分子。由图1可知,菌株Z1在碳源为葡萄糖的培养基中生长的最好,其次为蔗糖、淀粉,在玉米粉中生长的最差。因此,选择葡萄糖为最适碳源。
(2)氮源对酵母菌生长的影响
YPD培养基中的蛋白胨分别以尿素、硫酸铵和硝酸钾代替,按接种量2%接入菌株Z1,在28℃、120 r/min振荡培养24 h,测得波长560 nm处的OD560nm值如图2所示。

图2 氮源对酵母菌生长的影响Fig.2 Effect of nitrogen sources onSaccharomyces cerevisiaegrowth
由图2可以看出,菌株Z1在氮源为硝酸钾及硫酸铵的培养基中生长相当,OD值较高分别为1.05和1.03,菌株的生长量大。其次为蛋白胨,在尿素中生长量最少。因此,选择硝酸钾为最适氮源。
(3)无机盐对酵母菌生长的影响
YPD培养基中的MgSO4·7H2O分别用硫酸锰、硫酸亚铁、硫酸锌代替,按接种量2%接入菌株Z1,在28℃、120r/min振荡培养24 h,测得波长560 nm处的OD560nm值如图3所示。

图3 无机盐对酵母菌生长的影响Fig.3 Effect of inorganic salt onSaccharomyces cerevisiaegrowth
由图3可以看出,菌株在无机盐为MgSO4和FeSO4的培养基中生长的最好,OD560nm值分别为0.674、0.663,其次为MnSO4,在ZnSO4中长成情况最差,OD560nm值为0.329。因此,选择硫酸镁为最适无机盐。
2.1.2 培养基正交试验结果
菌株Z1的培养基配方优化正交试验结果见表4。
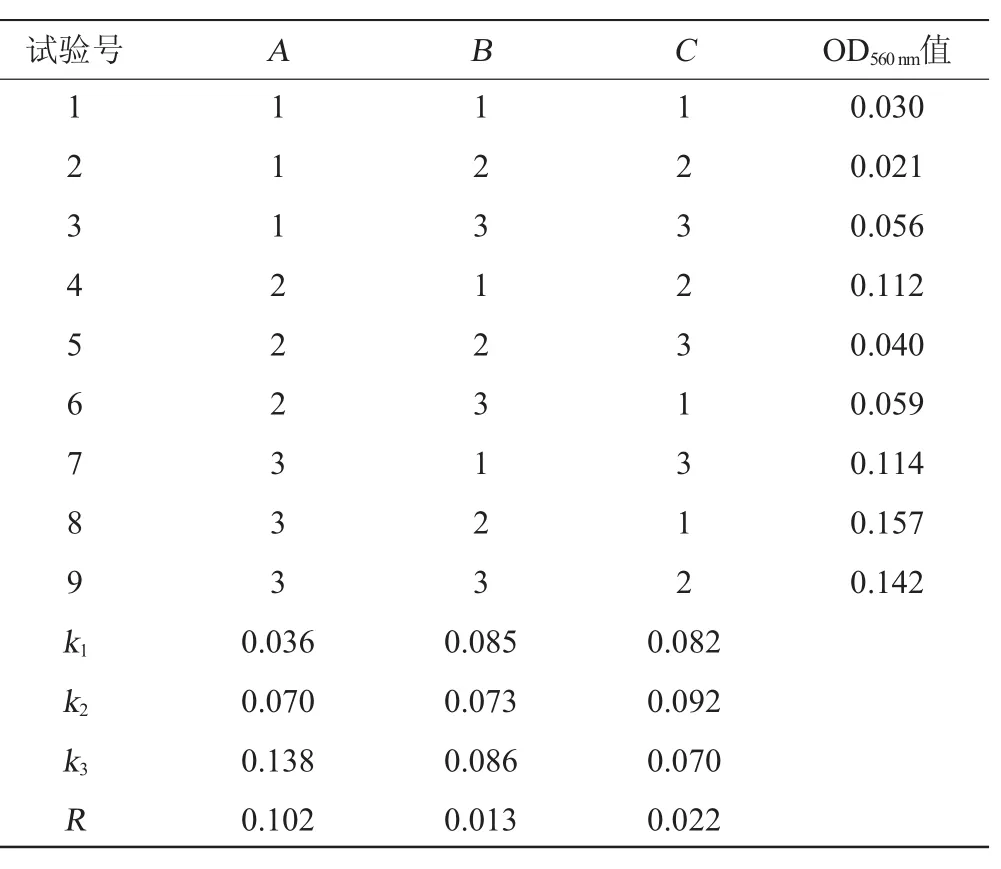
表4 培养基配方条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal experiments for medium formula optimization
由表4可以看出,葡萄糖影响较大,其次为无机盐,硝酸钾的影响最小。实验最佳发酵培养基配方为8号组合,OD560nm值为0.157,极差分析结果为A3B3C2。按A3B3C2进行验证试验,结果3次平行测定的OD560nm值为0.145,低于8号组合。因此培养基成分的最佳组合为碳源2.5%、氮源1.5%、无机盐0.1%。
2.2 培养条件的优化
2.2.1 单因素试验结果
(1)发酵温度对酵母的影响
将菌株Z1按3%接种量接入YPD液体培养基中,分别在10℃、15℃、20℃和25℃条件下,120 r/min振荡培养16 h,波长560 nm下测定OD560nm值,试验结果如图4所示。

图4 发酵温度对酿酒酵母生长的影响Fig.4 Effect of fermentation temperature onSaccharomyces cerevisiaegrowth
发酵温度是酵母菌最为敏感的因素之一。由图4可知,菌株Z1的培养温度从10℃到20℃随着温度的升高,生长量增加,在20℃时,达到最大值0.898。随后随着温度的升高,生长量开始下降。且在低温条件下,酵母发酵平稳,不进入明显的旺盛发酵阶段,虽发酵周期长,但可以使许多构成苹果酒特殊的风味物质得以最大程度的保存。所以发酵温度选择20℃。
(2)生长pH对酵母的影响
将菌株Z1按3%接种量接入YPD液体培养基中,分别在不同pH值4.0、4.5、5.0和5.5,28℃条件下,120 r/min振荡培养16 h,波长560 nm下测定OD560nm值,试验结果见图5。

图5 pH值对酿酒酵母生长的影响Fig.5 Effect of pH value onSaccharomyces cerevisiaegrowth
由图5可知,随着发酵液pH的逐渐升高,菌体密度逐步升高,在pH为4.5时菌体吸光度值达到峰值为0.88,菌株具有较高的生长表达量,然后随着pH的继续升高,生长量下降。所以选择菌株Z1的最适pH值为4.5。
(3)接种量对酵母的影响
将菌株Z1按1.0%、1.5%、2.0%、2.5%接种量分别接入YPD液体培养基中,在28℃、120 r/min振荡培养16 h后,波长560 nm下测吸光度值,试验结果见图6。

图6 接种量对酿酒酵母生长的影响Fig.6 Effect of inoculum onSaccharomyces cerevisiaegrowth
由图6可知,菌株Z1最适接种量为1.5%,OD560nm值为0.849,后随着接种量的增加,菌株生长量减小,OD560nm值下降。接种量适当,酵母菌生长良好。从经济效益上看,接种量为1.5%对酵母菌生长的影响既经济,又实用。
(4)培养时间对酵母的影响
将菌株Z1按3%接种量接入YPD液体培养基中,在28℃、120 r/min条件下分别振荡培养7 h、11 h、14 h、18 h、22 h和24 h后,波长560 nm下测吸光度值,试验结果见图7。
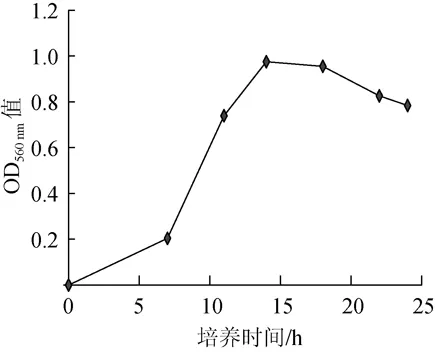
图7 培养时间对酿酒酵母生长的影响Fig.7 Effect of culture time onSaccharomyces cerevisiaegrowth
由图7可知,菌株Z1生长较快,在培养7 h后就进入对数生长期,菌体密度急剧上升,14~18 h后菌株处于稳定期,其吸光度值最大达到0.975,22 h后菌株逐渐进入衰亡期,吸光度值逐渐降低。菌株Z1在14~18 h时菌体密度最高。
2.2.2 培养条件优化正交试验结果
菌株Z1的发酵条件优化试验结果见表5,方差分析见表6。

表5 培养条件优化正交试验结果与分析Table 5 Results and analysis of orthogonal tests for culture conditions optimization

表6 培养条件优化正交试验结果方差分析Table 6 Variance analysis of orthogonal tests results for culture conditions optimization
由表5、表6可知,培养温度对OD560nm值影响最大,其次是培养时间,pH和接种量的影响较小。方差分析结果显示,在95%的置信区间内,温度和培养时间对OD560nm值影响显著(P<0.05)。其最佳培养参数为4号组合,OD560nm值达到1.22,极差分析最优组合为A2B3C2D3。按A2B3C2D3进行验证试验,3次平行测定的OD560nm值为1.17,小于4号组合。因此培养条件的最佳组合为温度20℃、接种量1.0%、培养时间14 h、pH5.0。
2.3 冷冻保护剂的优化
以脱脂奶粉、甘油、谷氨酸钠和吐温80为评价因素,采用4因素3水平的L9(34)正交试验,确定冷冻保护剂对菌株生物量的影响,正交试验结果见表7。
由表7可知,谷氨酸钠对活菌数影响最大,其次是甘油和脱脂奶粉,吐温80的影响最小。其最佳参数为1号组合,其活菌数为6.12×1011CFU/g,极差分析最优组合为A3B1C1D1。按A3B1C1D1进行验证试验,结果活菌数为5.82×1011CFU/g,低于1号组合,因此保护剂的最佳组合为脱脂奶粉12%、甘油2%、谷氨酸钠1%和吐温80为0.5%。

表7 保护剂配方优化正交试验结果与分析Table 7 Results and analysis of orthogonal tests for cryoprotectant formula optimization
3 结论
通过单因素及正交试验,确定了苹果酒酿酒酵母Z1在发酵过程中最适宜的培养基组成为碳源-葡萄糖2.5%,氮源-硝酸钾1.5%,无机盐-硫酸镁0.1%,最适培养条件为温度20℃、接种量1.0%、培养时间14 h、pH5.0。保护剂为脱脂奶粉12%、甘油2%、谷氨酸钠1%和吐温80为0.5%。冷冻干燥后菌剂的活菌数达到6.12×1011CFU/g。
[1]冯焕德,张永茂,康三江,等.我国苹果酒产业现状及发展对策[J].甘肃农业科技,2011(6):66-68.
[2]张珊珊.苹果酒的开发研究[D].辽宁:大连工业大学,2015.
[3]阮仕立,王西锐,刘德兵,等.苹果酒的开发研究进展[J].食品与发酵工业,2001,27(4):75-78.
[4]何昌流.苹果酒影响品质因素与发展前景[J].酿酒,2005,35(4):92-94.
[5]吴荣荣.苹果酒酵母代谢特性研究[J].现代农村科技,2012(22):56-58.
[6]杨晓东,李 丽,宗绪岩,等.一株低产高级醇酵母菌在苹果酒酿造中的应用[J].食品安全质量检测报,2013,4(6):1764-1767.
[7]程 超,韩北忠,陈晶瑜,等.本土葡萄酒酿酒酵母发酵性能的比较[J].中国酿造,2008,27(17):8-10.
[8]李 静.果酒酿造中优良酵母菌株的筛选[J].酿酒,2008,35(2):63-65.
[9]张 蕾,黄荣凯,胡喜贵,等.酿酒酵母培养基的优化[J].河南科技学院学报:自然科学版,2015,43(4):18-23.
[10]赵小丽,甄玉国,王兰惠,等.酿酒酵母有氧发酵培养基的研究[J].中国酿造,2013,32(7):43-47.
[11]王伟伟,安晓萍,齐景伟,等.酵母菌种子液发酵培养基的筛选[J].饲料研究,2014(5):71-73.
[12]张晓敏,李 擎,王 耀,等.苹果酒酿造工艺及成分研究进展[J].农产品加工,2015(14):68-70.
[13]王玉莹,戴洪义.响应面法优化苹果酒发酵工艺[J].中国酿造,2012,31(8):19-23.
[14]宋 静,夏玲玲,张玉刚,等.苹果酒发酵工艺对比研究[J].中国酿造,2014,33(4):71-74.
[15]张建峰,耿宏伟,王丕武.酿酒活性干酵母生产工艺优化及干燥剂的选择[J].食品科学,2011,32(9):213-216.
[16]王 华,贺金梅.中心组合设计优化热带假丝酵母菌冷冻干燥保护剂[J].食品科学,2013,34(1):244-247.
[17]任蓓蕾,李志辉,田洪涛,等.生香酵母C42真空冷冻干燥保护剂的筛选和优化[J].食品工业科技,2015,36(10):158-162.

ZHAO Juanjuan1,WU Rongrong1,LI Lin2
(1.Department of Life Science,Hengshui University,Hengshui 053000,China;2.Hengshui Center for Disease Control and Prevention,Hengshui 053000,China)
TS261
0254-5071(2017)11-0138-05
10.11882/j.issn.0254-5071.2017.11.030
2017-05-09
河北省科技计划项目(13213002)
赵娟娟(1982-),女,讲师,硕士,研究方向为食品发酵。
