曲妥珠单抗靶向治疗联合化疗对乳腺癌患者免疫功能及血清CCL-18和IL-6影响
2017-12-05林豫蓉韩小兵宋雅洁
林豫蓉,韩小兵,宋雅洁
(1.河南省息县人民医院,河南 信阳 464300;2.信阳中心医院,河南 信阳 464000;3.信阳职业技术学院附属医院,河南 信阳 464000)
曲妥珠单抗靶向治疗联合化疗对乳腺癌患者免疫功能及血清CCL-18和IL-6影响
林豫蓉1,韩小兵2,宋雅洁3
(1.河南省息县人民医院,河南 信阳 464300;2.信阳中心医院,河南 信阳 464000;3.信阳职业技术学院附属医院,河南 信阳 464000)
目的:研究并探讨曲妥珠单抗靶向治疗联合化疗对乳腺癌患者免疫功能及血清趋化因子配体(CCL)-18、白介素(IL)-6的影响。方法:选取2013年1月-2016年2月我院收治的80例乳腺癌患者为研究对象,按随机数字表法分为两组,各40例。对照组实施新辅助化疗,观察组在新辅助化疗同时给予曲妥珠单抗靶向治疗,比较两组患者的客观缓解率、毒副反应发生率、免疫功能指标、血清CCL-18、IL-6。结果:观察组的客观缓解率明显高于对照组(P<0.05);两组毒副反应发生率比较,差异无统计学意义(P>0.05);治疗后,两组免疫功能指标、血清CCL-18、IL-6水平均下降(P<0.05),且观察组明显低于对照组(P<0.05)。结论:乳腺癌采用曲妥珠单抗靶向治疗联合化疗,可有效控制乳腺癌进展,抑制炎症因子,减轻化疗对免疫功能的影响,安全性高。
乳腺癌;化疗;曲妥珠单抗;免疫功能
有研究报道,在新辅助化疗治疗乳腺癌时加用曲妥珠单抗靶向治疗,可有效提高患者的客观缓解率,但由于曲妥珠单抗存在一定的心脏毒性,临床上对于其在乳腺癌中应用的有效性和安全性尚存在质疑[1-2]。本次研究为探讨曲妥珠单抗靶向治疗联合化疗对乳腺癌患者免疫功能及血清趋化因子配体(CCL)-18、白介素(IL)-6水平的影响,选择2013年1月-2016年2月我院收治的80例乳腺癌患者为研究对象,分别对其实施新辅助化疗与新辅助化疗+曲妥珠单抗靶向治疗,比较其治疗效果及其他相关评价指标,报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月-2016年2月我院收治的80例乳腺癌患者为研究对象,均明确诊断为乳腺癌,预计存活时间至少3个月,排除研究前具有放化疗史患者、严重器质性疾病患者、恶性肿瘤患者等。本研究均经患者及其家属知情同意,并签署知情同意书,并通过医院伦理委员会审批。
遵循单盲随机分配原则将患者分为两组,各40例。对照组年龄38~49岁,平均年龄(43.85±5.27)岁,肿瘤直径为2.1~5.7 cm,平均直径(3.94±1.62)cm,肿瘤TNM分期包括Ⅰ期7例、Ⅱ期23例、Ⅲ期10例;观察组37~48岁,平均年龄(43.14±4.72)岁,肿瘤直径为2.3~5.8 cm,平均直径(4.12±1.59)cm,肿瘤TNM分期包括Ⅰ期6例、Ⅱ期23例、Ⅲ期11例。两组年龄、肿瘤直径、肿瘤TNM分期等一般资料比较无统计学差异(P>0.05),具有可比性。
1.2 方法
对照组采用新辅助化疗,具体化疗方案为:取100 mg卡铂加入至5%葡萄糖注射液中,稀释至10 mg/mL混合溶液后,再加入500 mL 5%葡萄糖注射液,充分混匀,200~400 mg/m2静脉滴注;多西他赛注射液75 mg/m2静脉滴注。1个化疗周期为3周,持续治疗6个化疗周期。
观察组在新辅助化疗同时给予曲妥珠单抗靶向治疗,新辅助化疗方案同对照组,曲妥珠单抗静脉滴注,每周1次,第1周给药剂量为4 mg/kg,第2~18周给药剂量为2 mg/kg。
1.3 观察指标
化疗结束后2周,比较两组患者的客观缓解率、毒副反应发生率、免疫功能指标、血清CCL-18、IL-6,其中,免疫功能指标包括T细胞免疫功能指标(CD3+、CD4/CD8)、NK细胞数值。
1.4 疗效评价
疗效判定标准[3]:完全缓解(CR),即病灶基本消失,且未出现毒副反应;部分缓解(PR),即病灶减小幅度≥30%,且毒副反应不明显;稳定(SD),即病灶减小幅度不足30%或病灶增大幅度不足20%,且毒副反应不明显;进展(PD),即病灶增大幅度≥20%,毒副反应明显,不耐受。
客观缓解率=完全缓解率+部分缓解率。
1.5 统计学方法
2 结果
2.1 两组客观缓解率比较
观察组的客观缓解率明显高于对照组(P<0.05),见表1。

表1 两组客观缓解率比较
2.2 两组毒副反应发生率比较
化疗期间,对照组出现4例胃肠道反应、1例心脏毒性、2例肝功能损害、6例白细胞计数减少,其毒副反应发生率为32.50%;观察组出现5例胃肠道反应、2例心脏毒性、1例肝功能损害、4例白细胞计数减少,其毒副反应发生率为30.00%。两组毒副反应发生率比较,差异无统计学意义(P>0.05)。
2.3 两组治疗前后免疫功能指标比较
治疗后两组免疫功能指标均降低(P<0.05),治疗后两组比较,观察组的免疫功能指标高于对照组(P<0.05)。见表2。
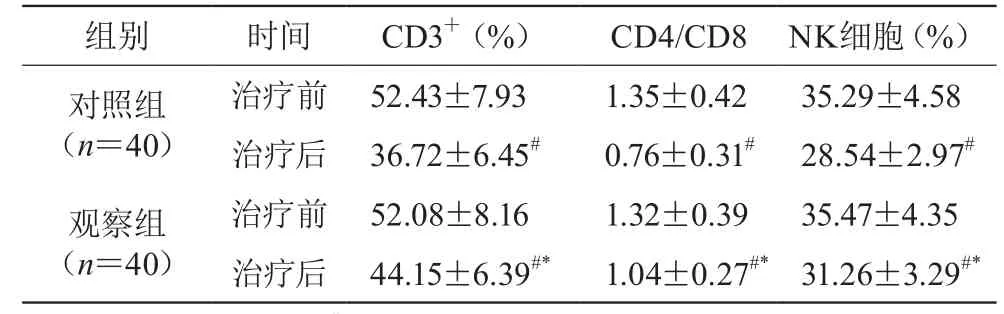
表2 两组治疗前后免疫功能指标比较
2.4 两组治疗前后血清CCL-18、IL-6水平比较
治疗后,两组血清CCL-18、IL-6水平均低于治疗前(P<0.05),两组比较有统计学差异(P<0.05)。见表3。
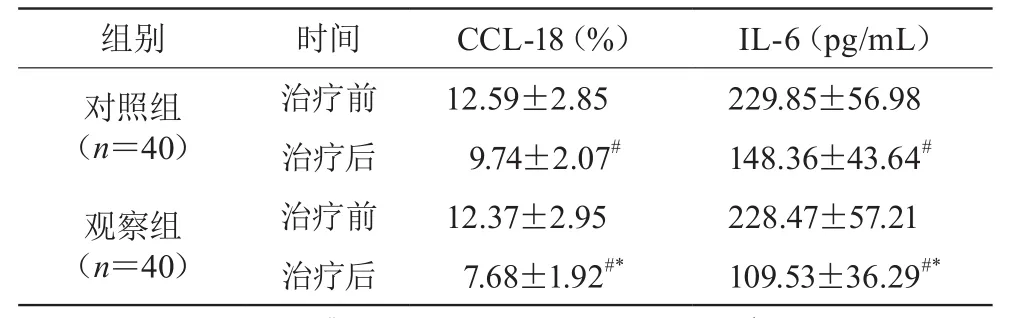
表3 两组治疗前后血清CCL-18、IL-6水平比较
3 讨论
乳腺癌是较为常见的女性恶性肿瘤,近年来,我国乳腺癌的发病率呈增长趋势,且其发病年龄呈现年轻化特点,已成为危害女性生命健康的主要疾病。乳腺癌晚期癌细胞出现远处转移和扩散,存在较高的致死风险[4-6]。临床上对乳腺癌的临床治疗进行深入研究,积极寻找乳腺癌的有效治疗方法,尽可能延长患者的生存期限。
新辅助化疗是目前治疗乳腺癌的主要方法,是通过手术前全身化疗来提高乳腺癌患者的抗癌效果,从而延长患者的生存期限[7-8]。新辅助化疗方案主要为多西他赛+卡铂,通过作用于癌细胞DNA,对癌细胞增殖及DNA复制进行抑制,诱导癌细胞凋亡,一定程度上缩小肿瘤病灶,控制肿瘤进展[9-10]。
近年来,随着对乳腺癌研究的逐渐深入,研究发现,人表皮生长因子2(HER2)的过度表达参与到乳腺癌的发生、发展中,临床上可将抑制HER2过度表达作为乳腺癌的治疗靶点[11]。曲妥珠单抗属于重组DNA衍生人源化单克隆抗体,对HER2的作用具有选择性,可通过提高HER2附着性,对表皮生长因子附着HER2进行抑制,从而抑制癌细胞的增殖、生长,起到抗癌作用[12-13]。本研究发现,观察组的客观缓解率明显高于对照组(P<0.05),治疗后观察组的血清CCL-18、IL-6水平均低于对照组(P<0.05),观察组免疫功能指标尽管出现下降,但仍高于对照组(P<0.05),且两组的毒副反应发生率比较无统计学差异(P>0.05)。
综上所述,乳腺癌患者采用曲妥珠单抗靶向治疗联合化疗,可有效控制肿瘤进展,抑制炎症因子,减轻化疗对免疫功能的影响,安全性高。
[1]Láng,I,Bell,R,Feng,FY, et al.Trastuzumab retreatment after relapse on adjuvant trastuzumab therapy for human epidermal growth factor receptor 2-positive breast cancer:Final results of the retreatment after herceptin adjuvant trial[J].Clin Oncol(R Coll Radiol),2014,26(2):81-89.
[2]闫海山,张冰雁.曲妥珠单抗联合新辅助化疗用于HER2过度表达乳腺癌的临床观察[J].中国药房,2016,27(29):4127-4130.
[3]马飞,徐兵河,李慧慧,等.曲妥珠单抗治疗拉帕替尼耐药的人表皮生长因子受体2阳性乳腺癌的临床疗效分析[J].中华肿瘤杂志,2013,35(7):521-524.
[4]Korkaya, H,Kim GI, Davis A, et al.Activation of an IL6 Inflammatory Loop Mediates Trastuzumab Resistance in HER2+ Breast Cancer by Expanding the Cancer Stem Cell Population[J].Mol Cell,2012,47(4):570-584.
[5]张丽华,李静.曲妥珠单抗联合紫杉醇诱导过表达HER-2的乳腺癌裸鼠皮下移植瘤乳腺癌细胞凋亡的作用机制和效果研究[J].临床和实验医学杂志,2016,15(14):1373-1377.
[6]Voutsas,IF, Mahaira LG,Fotopoulou K,et al.Gammairradiation induces HER-2/neu overexpression in breast cancer cell lines and sensitivity to treatment with trastuzumab[J].Int J Radiat Biol,2013,89(5):319-325.
[7]郭继红,徐兵河,马飞,等.曲妥珠单抗联合不同化疗方案治疗人表皮生子因子受体2阳性晚期乳腺癌的疗效和安全性[J].中华肿瘤杂志,2014,36(5):372-376.
[8]殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(9):725-727.
[9]Park EJ, Zhang YZ, Vykhodtseva N, et al.Ultrasoundmediated blood-brain/blood-tumor barrier disruption improves outcomes with trastuzumab in a breast cancer brain metastasis model[J].J Control Release,2012,163(3):277-284.
[10]谢奕彪,边莉,王涛,等.曲妥珠单抗联合蒽环类及紫杉类方案在乳腺癌新辅助化疗中安全性的观察和分析[J].中国癌症杂志,2012,22(5):396-398.
[11]刘君,杨艳芳(综述),顾林(审校),等.曲妥珠单抗在HER-2阳性乳腺癌患者新辅助治疗中的应用研究进展[J].中国肿瘤临床,2014,41(16):1065-1068.
[12]Liu P, Cai Z, Kang JW, et al.Intracellular routing in breast cancer cells of streptavidin-conjugated trastuzumab fab fragments linked to biotinylated doxorubicin-functionalized metal chelating polymers[J].Biomacromolecules,2014,15(3):715-725.
[13]李伟,潘燕,李学军.HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,30(1):48-51.
The Influence of Trastuzumab Targeted Therapy Combined with Chemotherapy on Immune Function in Patients with Breast Cancer and Serum Levels of CCL-18 and IL-6
Lin Yu-rong1, Han Xiao-bing2, Song Ya-jie3
(1.Xixian County people’s Hospital of Henan,Henan Xinyang 464300,China; 2.Xinyang Central Hospital,Henan Xinyang 464000,China; 3.Affiliated Hospital of Xinyang Vocational and Technical College,Henan Xinyang 464000,China)
Objective:To investigate the effect of trastuzumab targeted therapy combined with chemotherapy on immune function and serum chemokine ligand (CCL)-18 and interleukin (IL)-6 in breast cancer patients.Methods:80 cases of breast cancer patients in our hospital from January 2013 to February 2016 were selected as the research object. The patients were divided into two groups according to the random number table, 40 cases in each group. The control group was
neoadjuvant chemotherapy, the observation group was received trastuzumab targeted therapy combined with neoadjuvant chemotherapy. The objective response rate, adverse reaction rate,indexes of immune function, serum CCL-18 and IL-6 were compared between two groups.Results:The objective response rate of the observation group was significantly higher than that of the control group (P<0.05). There were no significant differences in the adverse reaction rate between the two groups (P>0.05). After treatment, the indexes of immune function, the levels of serum CCL-18 and IL-6 of two groups were decreased (P<0.05), and the data of observation group were lower than those of the control group (P<0.05).Conclusion:Trastuzumab targeted therapy combined with chemotherapy in the treatment of breast cancer can effectively control tumor progression, inhibit inflammatory factors, alleviate the effects of chemotherapy on immune function, and have high safety.
Breast cancer; Chemotherapy; Trastuzumab; Immune Function
R737.9
A
10.3969/j.issn.2096-3327.2017.10.020
2017 - 04 - 27
林豫蓉,女,副主任医师。研究方向:肿瘤临床。通讯作者E-mail:sdbg116@163.com
本文编辑:鲁守琴
