黄体酮对急性重型颅脑损伤患者血清标志物、颅内压和预后的影响
2017-12-04吴杰蒋达锦李严陈君王晨秋
吴杰,蒋达锦,李严,陈君,王晨秋
黄体酮对急性重型颅脑损伤患者血清标志物、颅内压和预后的影响
吴杰,蒋达锦,李严,陈君,王晨秋
黄体酮;颅脑损伤;白细胞介素-1β;S100B;颅内压
许多实验研究证实黄体酮具有神经保护、减轻脑水肿、改善颅脑损伤预后的作用[1]。但对于黄体酮治疗急性重型颅脑损伤(acute severe traumatic brain injury,asTBI)的作用和机制尚不完全清楚。本研究观察应用黄体酮治疗的asTBI患者的血清白介素(IL)-1β、S100B浓度及颅内压(intracranial pressure,ICP)和预后,以探讨黄体酮对asTBI的治疗效果及机制。
2013年10月1日至2016年12月31日苏州明基医院神经外科收治的asTBI患者83例,均符合以下入选标准:①男性;②年龄16~70岁;③受伤至入院时间<6 h;④重型颅脑损伤[格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分 ≤8分],头颅CT证实有脑挫伤、蛛网膜下腔出血、脑内血肿等一种或几种病理征象;⑤排除复合伤、伤后低氧血症、低血压、肝肾功能异常,及伤前严重器质性疾病者。用随机数字表法按入院先后将83例患者分为治疗组43例和对照组40例。治疗组中,年龄18~70岁,平均(41.0±16.0)岁;致伤原因:车祸25例,高处坠落伤8例,打击伤8例,其他伤2例。对照组中,年龄20~69岁,平均(42.6±16.4)岁;致伤原因:车祸29例,高处坠落伤6例,打击伤4例,其他伤1例。2组患者一般资料比较差异无统计学意义(均P>0.05)。本研究项目通过我院医学伦理委员会审核批准,入选患者或其家属均签订知情同意书。
2组患者均根据颅脑外伤病情行必要的神经外科处理及常规药物治疗,如入院后行脑室前角穿刺ICP监测(持续7 d,同时可外引流脑脊液),常规脱水降颅压、处理并发症、观察记录生命体征等治疗,有手术指征者行手术治疗,治疗组和对照组行开颅手术分别有31例和29例,术后有颅骨缺损者在术后2~5个月行颅骨修补术。治疗组在上述治疗基础上,加用黄体酮1.0 mg/(kg·d)静脉滴注,连用 5 d。观察指标:①血清IL-1β及S100B浓度:分别于入院时和伤后第1、5天抽取2组患者静脉血5 mL,离心分离血清保存于-70℃冰箱,采用ELISA法检测,IL-1β试剂盒购自北京东亚免疫技术研究所,S100B试剂盒购自加拿大BIOWEN公司。②ICP:监测入院时和伤后7 d内2组患者ICP。③GCS评分及预后:记录入院时和伤后7 d内2组患者GCS评分,并且于伤后6个月时电话和门诊随访,用格拉斯哥预后量表(Glasgow outcome scale,GOS)评定预后,分为死亡(1分)、植物状态(2分)、重度残疾(3分)、中度残疾(4分)和良好(5分);GOS评分1~3分为预后不良,4~5分为预后良好。④不良反应:观察治疗及至伤后6个月随访时治疗组的不良反应。采用SPSS 13.0分析数据。计量资料用(±s)表示,采用t检验或t'检验。计数资料用率表示,采用χ2检验。P<0.05为差异有统计学意义。
2组入院时血清IL-1β、S100B浓度差异无统计学意义(均P>0.05);治疗组伤后第1、5天血清IL-1β、S100B浓度显著低于对照组(均P<0.05),见表1。2组入院时ICP差异无统计学意义(P>0.05);伤后第3~7天,治疗组ICP显著低于对照组(均P<0.05),见表2。2组入院时GCS评分差异无统计学意义(P>0.05);伤后第5~7天,治疗组GCS评分显著高于对照组(均P<0.05);伤后6个月时,治疗组预后良好率显著高于对照组(χ2=4.31,P<0.05),见表3、4。治疗组在黄体酮治疗期间均未出现明显不良反应,无终止治疗者;随访时亦未见相关不良反应及并发症。
表1 2组患者血清IL-1β、S100B浓度比较(±s)
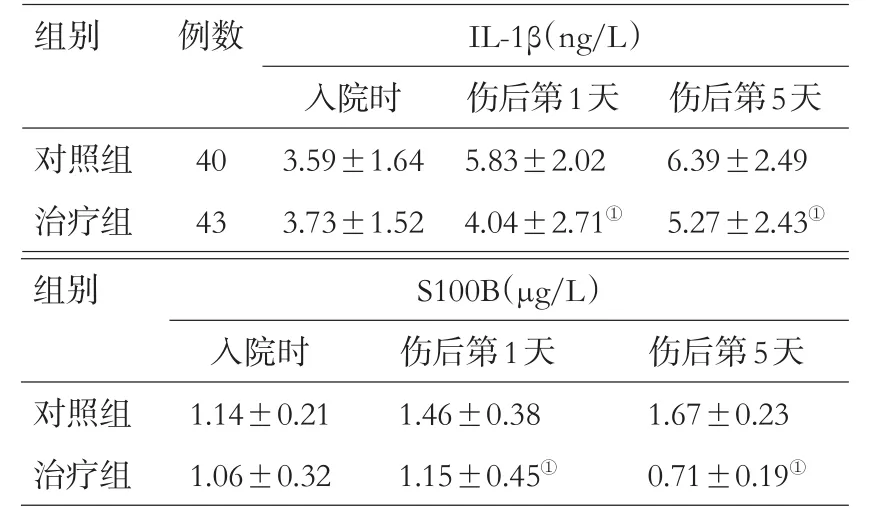
表1 2组患者血清IL-1β、S100B浓度比较(±s)
注:与对照组比较,①P<0.05
组别 例数I L-1 β(n g/L)入院时 伤后第1天 伤后第5天对照组治疗组4 0 4 3 3.5 9±1.6 4 3.7 3±1.5 2 5.8 3±2.0 2 4.0 4±2.7 1①6.3 9±2.4 9 5.2 7±2.4 3①组别S 1 0 0 B(μ g/L)对照组治疗组入院时1.1 4±0.2 1 1.0 6±0.3 2伤后第1天1.4 6±0.3 8 1.1 5±0.4 5①伤后第5天1.6 7±0.2 3 0.7 1±0.1 9①
表2 2组患者ICP比较(mmHg,±s)

表2 2组患者ICP比较(mmHg,±s)
注:与对照组比较,①P<0.05
组别对照组治疗组例数4 0 4 3入院时2 9.8±4.2 3 0.1±3.8伤后第1天2 2.3±4.1 2 0.6±5.7组别对照组治疗组伤后第2天2 6.1±5.0 2 4.8±4.4伤后第3天3 0.5±3.4 2 6.8±4.4①伤后第4天3 1.8±4.6 2 8.5±3.8①组别对照组治疗组伤后第5天3 2.7±5.2 2 9.4±3.6①伤后第6天3 1.4±3.8 2 8.6±5.4①伤后第7天2 9.7±3.5 2 6.2±5.2①
表3 2组患者GCS评分比较(分,±s)

表3 2组患者GCS评分比较(分,±s)
注:与对照组比较,①P<0.05
组别对照组治疗组例数40 43入院时6.2±1.4 6.1±1.6伤后第1天7.2±2.8 8.0±2.6组别对照组治疗组伤后第2天6.9±2.3 7.7±2.7伤后第3天7.2±2.7 7.9±1.9伤后第4天7.8±2.3 8.2±3.3组别对照组治疗组伤后第7天8.9±3.1 10.6±2.2①伤后第5天8.2±3.5 9.8±2.9①伤后第6天8.5±2.9 10.2±2.5①
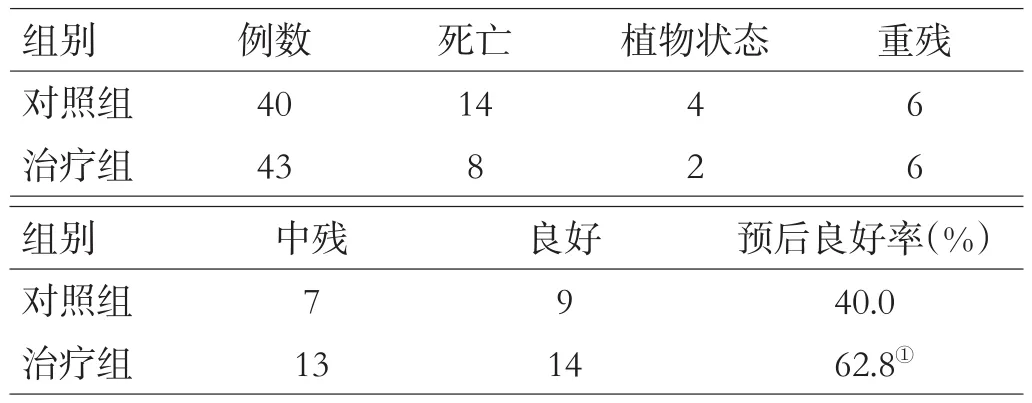
表4 2组患者预后比较(例)
外伤性脑损伤可引起急性炎症反应,炎症级联反应引起神经元赖以存在的环境变化,神经元变性,加重脑水肿及神经元损伤等[2]。IL-1是由单核细胞产生的多肽,有IL-1α和IL-1β2种异构体[3]。赵卫海等[4]研究发现,血清IL-1水平与急性颅脑损伤严重程度正相关。Yan等[5]研究表明,颅脑损伤后IL-1β广泛参与脑组织破坏、水肿形成等病理过程。
在哺乳动物,S100B主要分布于中枢神经系统星形胶质细胞,被认为是神经胶质的标记蛋白。实验证实颅脑损伤后常伴机械性脑细胞破坏和血脑屏障损害,从而使S100B进入血液循环[6]。因此,外周血S100B浓度可反映脑损害严重程度。S100B同其他神经组织生化标志物如神经元特异性烯醇化酶、髓鞘碱性蛋白等相比,具有更高特异性和敏感性[7]。检测患者血清S100B浓度有助于判断神经组织病变程度、治疗效果及预后等[8]。Rothoerl等[9]报道血清S100B浓度在伤后15 min即至峰值10.0µg/L ,6 h下降到1.14µg/L,12 h后降至0.5µg/L以下,具有很强时间依赖性。故血清S100B水平持续升高多由继发性颅脑损伤引起。
本研究观察到asTBI患者血清IL-1β和S100B浓度持续升高,伴ICP升高,在伤后第5天左右达到顶峰,表明asTBI患者伤后有炎症反应和继发性颅脑损伤的持续存在。
作为神经甾体的一员,黄体酮广泛存在于神经系统。动物试验表明,脑损伤后迅速给予黄体酮能抑制脑肿胀,防止神经细胞死亡,促进脑功能恢复。Pan等[10]报道黄体酮可降低大鼠创伤性脑损伤后炎症因子核转录因子KB(NF-KB)p65、TNF-α的表达和减轻脑水肿。黄体酮已被证明可减轻脑外伤后血管源性和细胞毒性水肿,Wright等[11]发现脑外伤模型大鼠血清黄体酮水平与伤后脑水肿程度呈负相关。在临床试验方面,Stein等[12]报道,82例接受黄体酮治疗的脑外伤患者,在治疗后3、6个月时GOS评定显示预后明显好于对照组,并且没有发现不良反应和并发症。黄体酮对asTBI的神经保护机制主要有[13,14]:①减轻脑水肿;②降低脂质过氧化和氧化应激;③调节细胞因子;④减少细胞凋亡和促进DNA修复;⑤上调γ-氨基丁酸A型(GABAA)受体;⑥修复神经髓鞘。
本研究选择男性asTBI患者,以随机数字表法设计了100例(治疗组和对照组各50例)病例,排除放弃治疗和资料不全等病例后,最后83例病例纳入统计(治疗组43例,对照组40例)。研究结果显示,黄体酮治疗可降低asTBI患者伤后第1、5天血清IL-1β和S100B浓度及伤后第3~7天ICP;提高伤后第5~7天GCS评分;显著改善伤后6个月时预后。我们认为应用黄体酮可抑制脑组织炎症反应,降低IL-1β等炎性标志物,减轻asTBI后脑水肿程度和持续时间,降低ICP,减少继发性脑损伤,降低脑损伤标志物S100B的浓度,改善预后。但在临床广泛推广黄体酮治疗asTBI还需要进一步研究和探索,其是否有远期不良反应和并发症还需长期随访观察。
[1]Stein DG.Is progesterone a worthy candidate as a novel therapy for traumatic brain injury[J]?Dialogues Clin Neurosci,2011,13:352-359.
[2]Villoslada P,Genain CP.Role of nerve growth factor and other trophic factors in brain inflammation[J].Prog Brain Res,2004,146:403-414.
[3]梁汝庆,丁新生.炎症因子与缺血性卒中神经损伤研究进展[J].神经损伤与功能重建,2011,6:147-151.
[4]赵卫海,海陈炼,余国栋.血清TNF-α IL-1 IL-6 IL-8在急性颅脑损伤后含量变化及意义[J].中国实用神经疾病杂志,2013,16:22-23.
[5]Yan EB,Hellewell SC,Bellander BM,et a1.Post-traumatic hypoxia exacerbates neurological deficit,neuroinflammation and cerebral metabolism in rats with diffuse traumatic brain injury[J].J Neuroinflammation,2011,8:147.
[6]Rothoerl RD,Brawanski A,Woertgen C.S100B protein serum levels after controlled cortical impact injury in the rat[J].Acta Neurochir(Wien),2000,142:199-203.
[7]李宁,沈健康,徐福林,等.S-100B,NES和MBP评估重型颅脑损伤预后的研究[J].中国临床神经外科杂志,2004,9:110-112.
[8]吴杰,陶进.硫酸镁对急性重型颅脑损伤患者血清S100B浓度和预后的影响[J].国际神经病学神经外科学杂志,2009,36:197-200.
[9]Rothoerl RD,Woertgen C,Holzschuh M,et a1.Rapid evaluation of S100 serum levels,case report and comparison to previous results[J].Brain Inj,1999,13:387-391.
[10]Pan DS,Liu WG,Yang XF,et a1.Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury[J].Biomed Environ Sci,2007,20:432-438.
[11]Wright DW,Bauer ME,Hoffman SW,et a1.Serum progesterone levels correlate with decreased cerebral edema after traumatic brain injury in male rats[J].J Neurotrauma,2001,18:901-909.
[12]Stein DG,Wright DW.Progesterone in the clinical treatment of acute traumatic brain injury[J].Expert Opin Investig Drugs,2010,19:847-857.
[13]Si D,Li J,Liu J,et a1.Progesterone protects blood-brain barrier function and improves neurological outcome following traumatic brain injury in rats[J].Exp Ther Med,2014,8:1010-1014.
[14]Liu F,Liao F,Li W,et a1.Progesterone alters Nogo-A,GFAP and GAP-43 expression in a rat model of traumatic brain injury[J].Mol Med Rep,2014,9:1225-1231.
R741;R651.15
ADOI10.16780/j.cnki.sjssgncj.2017.06.038
苏州明基医院神经外科江苏 苏州 215000
2017-01-19
蒋达锦jiangdajing73-1009@163.com
(本文编辑:雷琪)
