拐枣枝多酚提取工艺优化及其抗氧化活性研究
2017-12-02张保张萌李立天郑朋朋敖新宇
张保,张萌,李立天,郑朋朋,敖新宇
(西南林业大学生命科学院,云南昆明650224)
拐枣枝多酚提取工艺优化及其抗氧化活性研究
张保,张萌,李立天,郑朋朋,敖新宇*
(西南林业大学生命科学院,云南昆明650224)
采用响应面法优化拐枣枝多酚提取工艺,并研究其抗氧化活性,为拐枣枝多酚的应用提供理论依据。以拐枣枝为试验材料,在单因素试验的基础上选取浸提溶剂、料液比、浸提温度、浸提时间4个影响因素进行响应面优化试验;同时通过测定拐枣枝多酚对羟自由基、ABTS自由基、DPPH自由基的清除率来评估其抗氧化性。结果表明:拐枣枝多酚的最佳提取工艺为以无水乙醇为浸提剂,在料液比为1∶84(g/mL),浸提温度为60℃的条件下,浸提2.56 h,拐枣枝多酚的提取率为7.089%;拐枣枝多酚对羟自由基、ABTS自由基、DPPH自由基的最大清除率分别为90.97%、93.99%、97.19%。
拐枣枝;多酚;响应面法;抗氧化活性
植物多酚(plant polyphenol)又称为植物单宁(vegetable tannin),是一类具有酚羟基结构且广泛存在于植物体内的天然植物化学成分[1-3]。近年来,不断有国内外的研究员从茶叶、水果、中草药等植物体中提取到多酚类物质[4]。研究表明植物多酚具有抗氧化、抗肿瘤、抗菌、抗骨质疏松等多种生物学活性[5-8]。
拐枣(Hovenia acerba Lindl)学名枳椇,属于鼠李科枳椇属(Rhamnaceae hovenia),其富含蛋白质、维生素、生物碱和有机酸等活性物质[9-11]。根据相关文献报道,拐枣汁和醋能够显著降低谷草转氨酶(Aspartate transaminase,AST)、谷丙转氨酶(Alanine aminotransferase;ALT)和谷氨酰转移酶(Glutamyl transferase,gamma-GT),对饮酒造成肝损伤的小鼠有较好的缓解效果[12]。目前国内对拐枣果梗和拐枣子的研究报道较多,而对拐枣枝的研究报道极少。郑朋朋等[13]发现拐枣枝乙醇浸提物的抗氧化能力比拐枣子强,微弱于拐枣果梗,但未做进一步的研究。因此,本研究采用拐枣枝为试验材料,以多酚提取率为指标,采用响应面分析法优化拐枣枝多酚提取工艺,并通过清除ABTS自由基、DPPH自由基和羟自由基试验评价拐枣枝多酚的抗氧化性作用,为拐枣枝多酚的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
拐枣枝:采购于云南省昆明市西南林业大学东三环农贸市场的带枝拐枣,新鲜的拐枣除去拐枣果梗后放入烘箱中60℃烘至恒重,粉碎机粉碎,过80目筛,收集样品放置于干燥器中备用。
1.1.2 试剂
水杨酸、硫酸亚铁、抗环血酸、过硫酸钾、碳酸钠(均为分析纯)、福林酚(BR):国药集团化学试剂有限公司;丙酮、正丁醇、甲醇、乙醇、30%双氧水(均为分析纯):汕滇药业有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS):美国 Sigma公司;茶多酚标准品(茶多酚含量>98%,CAS号:84650-60-2):上海时代生物科技有限公司。
1.2 仪器与设备
BS224S电子天平:德国SARTORIUS公司;电热恒温鼓风干燥箱、HWS-12水浴锅:上海一恒科学仪器有限公司;M20粉碎机:德国KIKAWERKE公司;AS20500B超声波清洗仪:台湾信达电子仪器有限公司;DHG-9240A型5430R离心机:德国Eppendorf公司;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;B490真空旋转蒸发仪:瑞士BUCHI公司;FD5-8冷冻干燥器:美国GoldSim公司。
1.3 方法
1.3.1 茶多酚标准曲线绘制
精确称取40 mg的茶多酚标准品,置于50 mL的小烧杯中,加入适量的蒸馏水溶解并润洗,将溶液转移至100 mL的容量瓶中用蒸馏水定容,配制成400 μg/mL茶多酚标准液。分别吸取 0.0、0.2、0.4、0.6、0.8、1.0 mL的标准液置于试管中,分别配制成0、50、100、200、300、400 μg/mL的茶多酚标准待测液,补加蒸馏水至体积为1.0 mL,分别加入1.0 mL福林酚,摇匀后静置5 min,再加入质量浓度为10%的碳酸钠溶液2 mL,摇匀后置于黑暗处静置反应1 h,反应结束后补加5 mL蒸馏水。于760 nm波长处测定吸光度值,绘制茶多酚标准曲线。
1.3.2 拐枣枝多酚的提取
称取0.500 0 g拐枣枝干粉,置于100 mL的小烧杯中,按照预设的浸提溶剂,在不同的料液比、浸提温度和浸提时间的条件下进行水浴浸提。浸提完成后转移至50mL离心管中,在6000r/min的条件下离心10min,取上清液并转移至100 mL的容量瓶中定容待测。
1.3.3 拐枣枝多酚含量的测定
准确量取1.0 mL多酚样品待测液,置于试管中,依次加入1.0 mL福林酚、2 mL质量浓度为10%的碳酸钠溶液,摇匀后置于黑暗处静置反应1 h,暗反应结束后补加5 mL蒸馏水,于760 nm波长处测定吸光度值,对照茶多酚标准曲线方程计算多酚含量。多酚提取率计算公式如下:
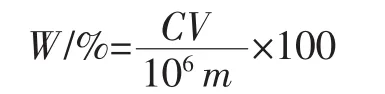
式中:W为多酚提取率,%;C为计算后所得样品多酚质量浓度,μg/mL;V为样品多酚体积,mL;m为拐枣枝样品质量,g。
1.3.4 单因素试验
1.3.4.1 浸提溶剂对拐枣枝多酚提取率的影响
在料液比为 1∶30(g/mL)、浸提温度为 55℃、浸提时间为60 min的条件下分别加入不同的浸提溶剂(水、甲醇、乙醇、正丁醇、丙酮),每组3个平行试验,按照1.3.2和1.3.3方法提取拐枣枝多酚并测定拐枣枝多酚提取率。
1.3.4.2 料液比、浸提温度、浸提时间对拐枣枝多酚提取率的影响
以乙醇为浸提溶剂,分别设置料液比1∶10、1∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60、1 ∶70、1 ∶80、1 ∶90(g/mL)、浸提温度 40、45、50、55、60、65、70 ℃和浸提时间 0.5、1.0、1.5、2.0、2.5、3.0 h 3个单因素试验。初始试验条件为料液比 1∶40(g/mL)、浸提时间 60 min、浸提温度 60 ℃,每组3个平行试验,利用1.3.2和1.3.3方法提取拐枣枝多酚并测定拐枣枝多酚提取率。
1.3.5 响应面优化试验
在单因素试验结果的基础上,采用Box-Behnken试验,优化拐枣枝多酚提取条件。选取液料比(A)、浸提温度(B)、浸提时间(C)3个自变量(影响因素),以拐枣枝多酚提取率(Y)为响应值,并以-1、0、+1分别代表自变量3个水平见表1。
1.3.6 拐枣枝多酚制备
称取50 g拐枣枝干粉,按响应面分析法优化的最佳提取工艺条件进行浸提,浸提结束后在6 000 r/min的条件下离心10 min,移取上清液,经旋转蒸发仪浓缩至200 mL,将样品浓缩液与蒸馏水1∶1(体积比)比例混合,样品混合液经真空冷冻干燥(-40℃,48 h)得到拐枣枝多酚样品,-20℃保存待用。
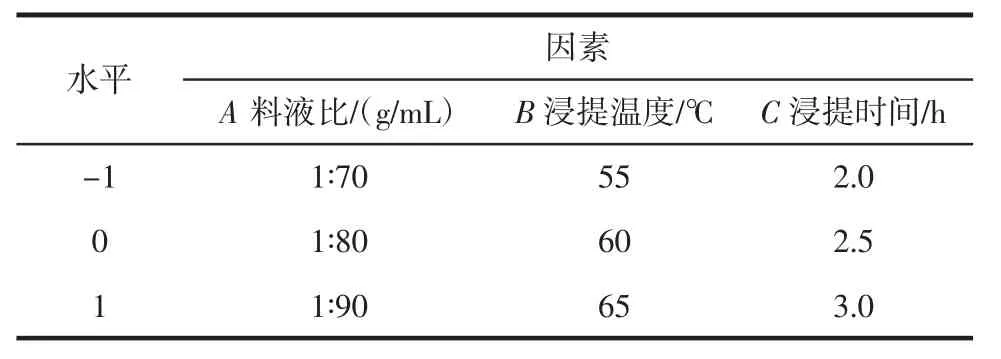
表1 响应面试验因素与水平设计Table 1 Independent factors and their levels of response surface experiments
1.3.7 拐枣枝多酚抗氧化性研究
1.3.7.1 清除羟自由基能力测定[14-15]
用蒸馏水溶解1.3.6中获得的多酚样品,配制成不同质量浓度梯度[0.5、1.0、2.0、3.0、4.0、5.0(mg/mL)]。准确量取1.0 mL不同质量浓度的多酚样品溶液(不同质量浓度的VC作为阳性对照),依次加入9 mmol/L FeSO4溶液 1.0 mL,9 mmol/L H2O2溶液 1.0 mL,9 mmol/L 水杨酸—乙醇溶液1.0 mL,在37℃下水浴30 min后,取出试管并在波长510 nm处测定吸光度值,羟自由基清除效率计算式如下:
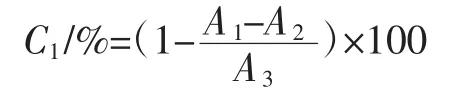
式中:C1为·OH清除率,%;A1为不同样品溶液吸光度值;A2为蒸馏水替代水杨酸的样品本底吸光度值;A3为蒸馏水替代样品的对照溶液吸光度值。
1.3.7.2 清除DPPH自由基能力测定[15-16]
用蒸馏水溶解1.3.6中获得的多酚样品,配制成不同质量浓度梯度[0.005、0.01、0.05、0.1、0.5、1.0、2.0、3.0(mg/mL)],准确量取1.0 mL不同质量浓度的多酚样品溶液(不同质量浓度的VC作为阳性对照),分别加入2.0 mL DPPH溶液(精确称取0.004 0 g DPPH溶液,甲醇溶解定容至100 mL,避光放置于4℃冰箱待用),混匀,暗反应40 min。暗反应结束后在波长517 nm处测定吸光度值,DPPH自由基清除率计算公式如下:
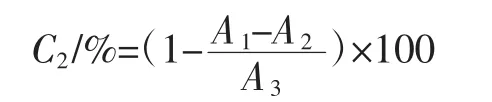
式中:C2为DPPH自由基清除率,%;A1为样品吸光度值;A2为本底吸光度值;A3对照溶液吸光度值。
1.3.7.3 清除ABTS自由基能力测定[15,17]
用蒸馏水溶解1.3.6中获得的拐枣枝多酚样品,配制成不同质量浓度梯度[0.005、0.01、0.05、0.1、0.5、1.0、2.0、3.0、4.0、5.0(mg/mL)],准确量取 1.0 mL 不同质量浓度的多酚样品溶液(不同质量浓度的VC作为阳性对照),再加入2.0 mL的ABTS自由基工作液(ABTS和过硫酸钾用蒸馏水分别溶解,使ABTS浓度为14 mmol/L,过硫酸钾的浓度为4.90 mmol/L,将ABTS和过硫酸钾1∶1(体积比)混合,将混合溶液在室温下避光反应16 h。然后用甲醇适当稀释ABTS自由基溶液,使其吸光度值在波长734 nm处为(0.700±0.002)范围内,即得到ABTS自由基工作液),混匀后于室温下反应10 min,在734 nm处测定其吸光度值。ABTS自由基清除率计算公式如下:
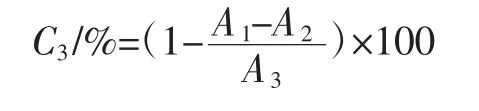
式中:C3为ABTS自由基清除率,%;A1为样品吸光度值;A2为样品本底吸光度值;A3对照溶液吸光度值。
2 结果与分析
2.1 茶多酚标准曲线
采用Origin 8.0软件对760 nm处测定不同质量浓度茶多酚标准溶液的吸光度值进行数据处理,得到茶多酚标准曲线,如图1。线性回归方程y=0.003 96x+0.039 74,R2=0.998;表明茶多酚质量浓度与吸光度值具有良好的线性关系。
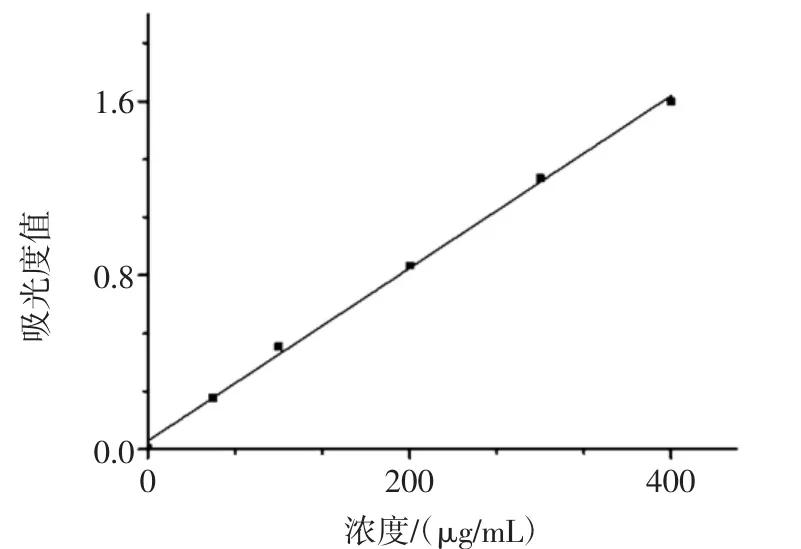
图1 茶多酚标准曲线Fig.1 Standard curve of tea polyphenols
2.2 单因素试验结果
2.2.1 浸提溶剂对拐枣枝多酚提取率的影响
浸提溶剂对拐枣枝多酚提取率的影响见图2。
由图2可知,不同溶剂对拐枣枝多酚提取率的影响有明显差异,提取率大小依次为:甲醇(9.49%)>乙醇(5.93%)>水(4.73%)>丙酮(3.48%)>正丁醇(1.45%)。然而,甲醇对人体有一定的毒副作用,在食品工业应用中受限。因此,选择乙醇作为浸提溶剂对拐枣枝进行多酚提取试验。
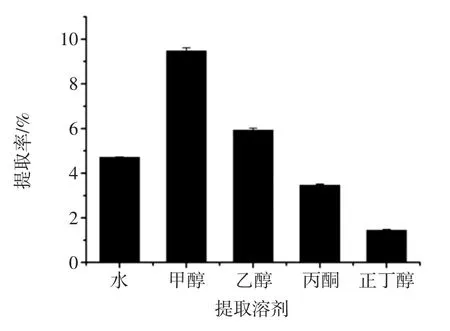
图2 浸提溶剂对拐枣枝多酚提取率的影响Fig.2 Effect of extraction solvent on extraction yield of Hovenia acerba sticks polyphenols
2.2.2 料液比对拐枣枝多酚提取率的影响
料液比对拐枣枝多酚提取率的影响结果见图3。
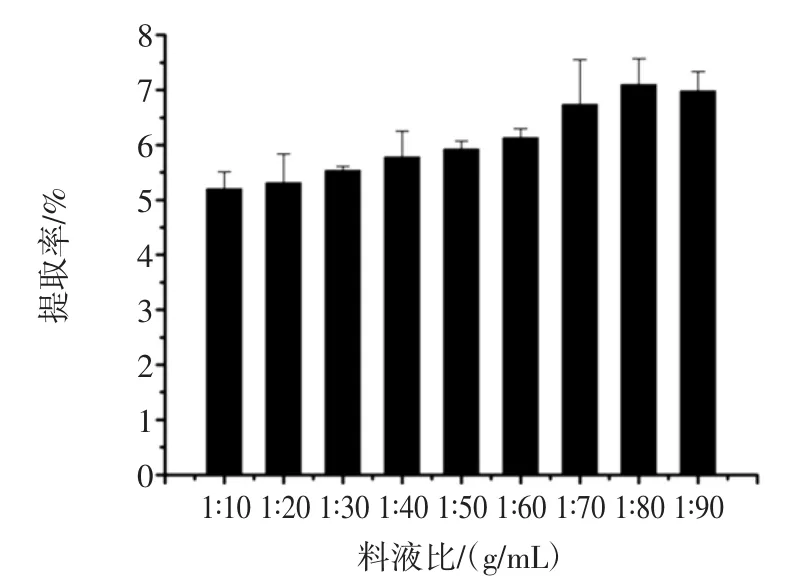
图3 料液比对拐枣枝多酚提取率的影响Fig.3 Effect of ratios of water to the raw material on extraction yield of Hovenia acerba sticks polyphenols
由图3可知,随着料液比的增加,多酚提取率逐渐提高。当料液比增大到1∶80(g/mL)时,其提取率达到最大值7.09%,继续增加料液比,多酚提取率趋于平缓,不再升高。因此,料液比选择在1∶80(g/mL)为宜。
2.2.3 浸提温度对拐枣枝多酚提取率的影响
浸提温度对拐枣枝多酚提取率的影响结果见图4。
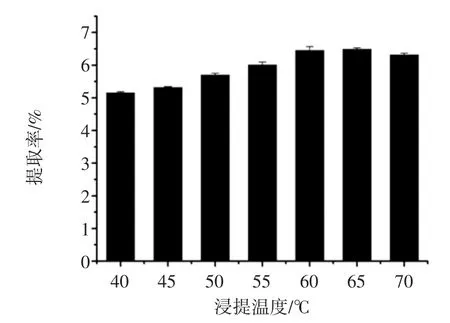
图4 浸提温度对拐枣枝多酚提取率的影响Fig.4 Effect of extraction temperature on extraction yield of Hovenia acerba sticks polyphenols
由图4可知,在浸提温度达到60℃前,随着浸提温度的升高,拐枣枝多酚提取率也逐渐提高。浸提温度在60℃时,多酚提取率最大(6.45%)。当浸提温度在60℃~70℃时,多酚提取率随着浸提温度的升高而趋于平缓且略有下降。因此浸提温度选择在60℃为宜。
2.2.4 浸提时间对拐枣枝多酚提取率的影响
浸提时间对拐枣枝多酚提取率的影响结果见图5。
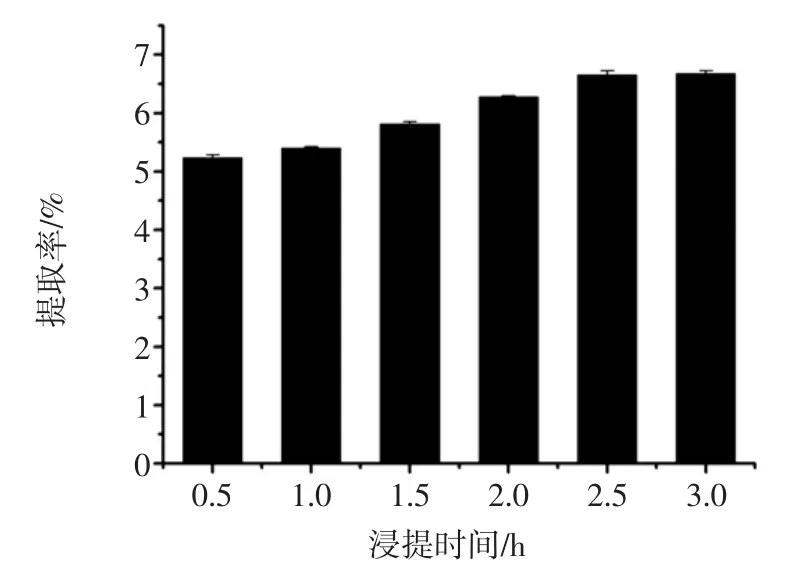
图5 浸提时间对拐枣枝多酚提取率的影响Fig.5 Effect of extraction time on extraction yield of Hovenia acerba sticks polyphenols
由图5可知,拐枣枝多酚提取率随着浸提时间的延长而不断提高。当浸提时间在2.5 h时,多酚提取率最大(6.66%),之后多酚提取率随着浸提时间的延长而趋于平缓。因此,浸提时间选择在2.5 h为宜。
2.3 响应面试验优化结果
2.3.1 Box-Behnken试验设计与结果
选择料液比、浸提温度、浸提时间3个影响因素,多酚提取率为响应值。根据Box-Behnken中心组合试验设计原理,利用Design-Expert 8.0.6软件设计三因素三水平的响应面试验方案,试验测定结果见表2。
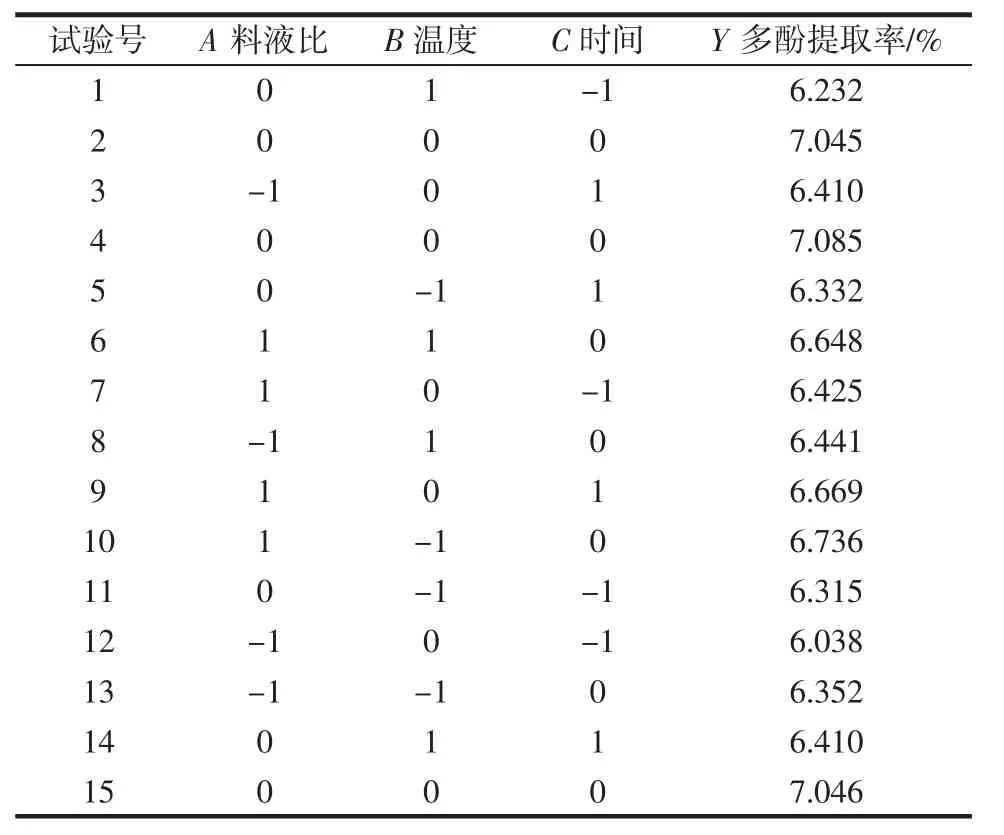
表2 响应面试验设计结果Table 2 Results of response surface experiments
2.3.2 模型方差分析
对响应面试验结果(表2)进行多元回归方程拟合,构建回归模型,方差分析见表3,得到二次多项式回归方程:
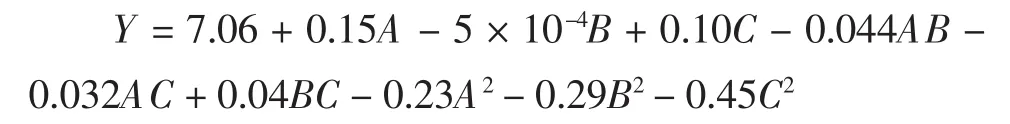
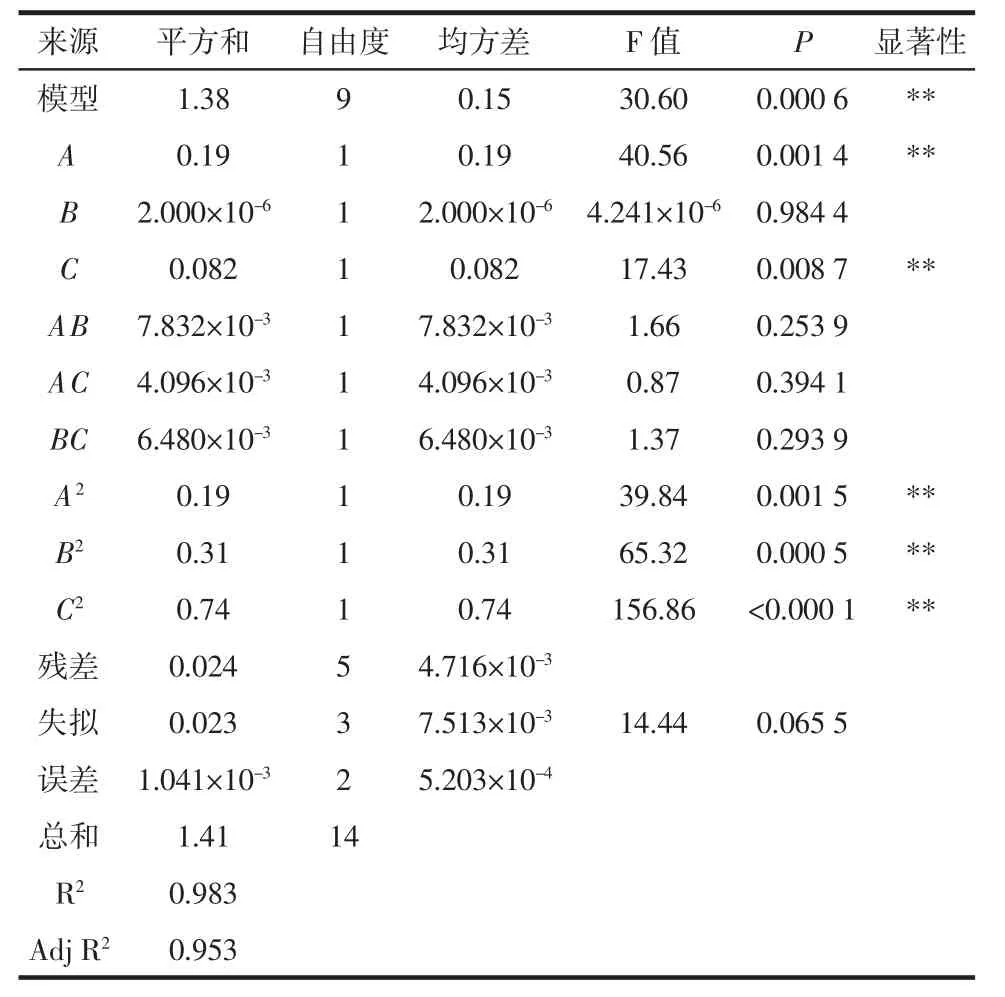
表3 回归模型方差分析Table 3 Variance analysis of regression model
此回归模型达到极显著水平(P<0.01),对多酚提取率影响程度依次为料液比(A)>浸提时间(C)>浸提温度(B)。模型中的 A、C、A2、B2、C2对响应值影响极显著(P<0.01),表明试验因素对响应值的影响不是偶然的随机事件,不可忽略。失拟项P=0.065 5>0.05,差异不显著。该模型的R2Adj=0.953,说明该模型能够解释95.3%的响应值变化,仅有总变异的4.7%不能用此模型来解释,决定系数R2=0.983,说明该方程与实际情况拟合良好,试验误差小,能够正确分析和预测不同提取工艺条件与多酚提取率之间的关系。
2.3.3 响应面图分析
料液比、浸提温度和浸提时间对多酚提取率影响的3D响应面见图6。
由图6可知,在所选的各因素的取值范围内,响应值(多酚提取率)呈现极大值。对响应值的影响极显著的因素有料液比和浸提时间,表现为曲线较陡;浸提温度对响应值的影响不显著,表现为曲线平缓。
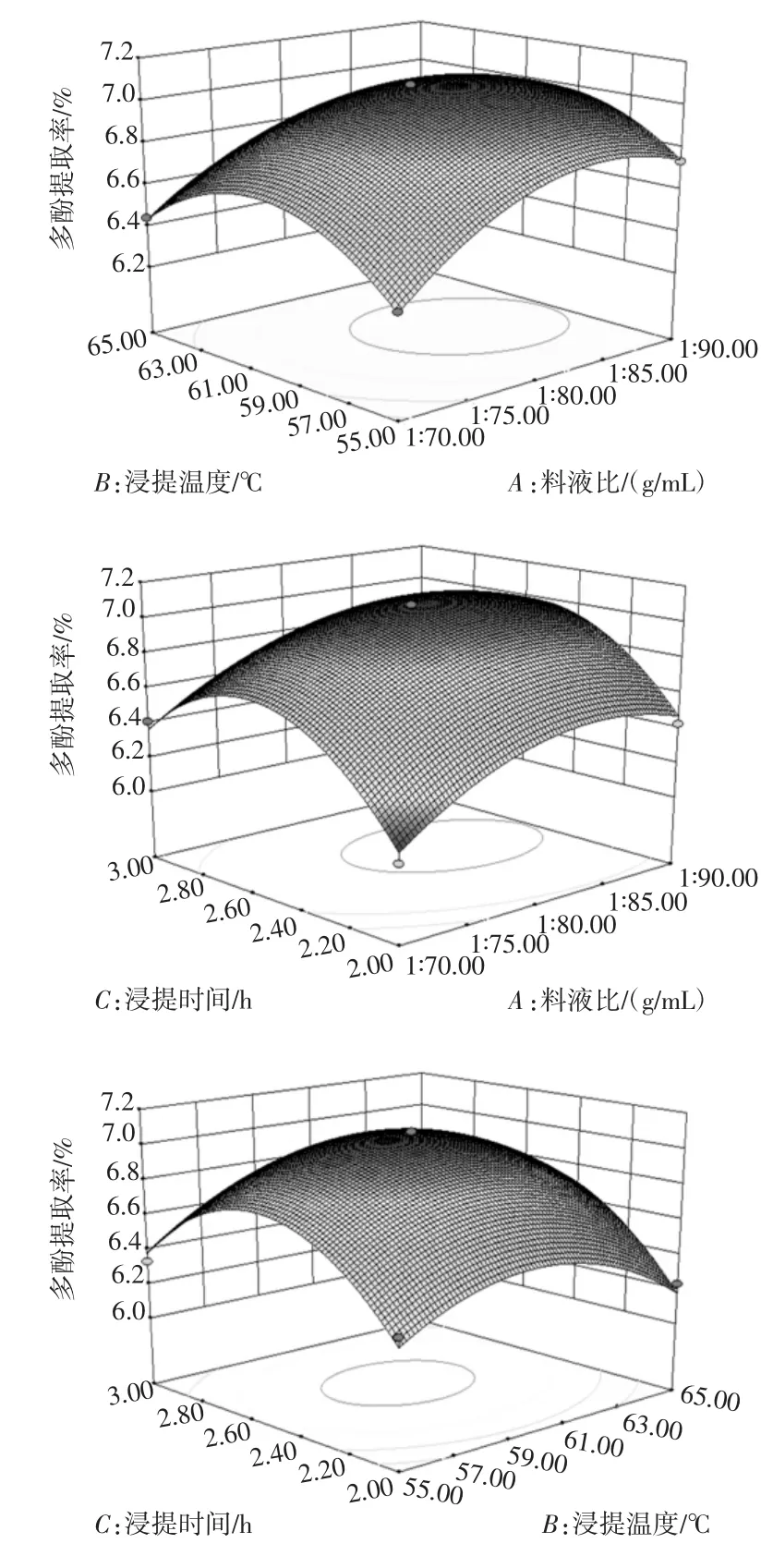
图6 料液比、浸提温度和浸提时间对多酚提取率影响的3D响应面Fig.6 The 3D response surface of extraction yield of polyphenols affected by ratio of solid to solution,extraction temperature,extraction time
2.3.4 最佳工艺条件验证
应用响应面寻优分析方法对回归模型进行分析得到最优结果:当料液比(A)为 1∶83.66(g/mL)、浸提温度(B)为59.63℃、浸提时间(C)为2.56 h时,理论最佳拐枣枝多酚提取率为7.089%。考虑到实际情况与试验操作的方便性,将各因素修正为:浸提温度60℃、浸提时间2.56 h、料液比1∶84(g/mL)。然后在此工艺条件下进行3次平行试验,得到多酚提取率为(7.048±0.103)%,且RSD为1.5%。因此,采用响应面法对拐枣枝多酚浸提条件进行优化是可行的。
2.4 拐枣枝多酚抗氧化结果分析
2.4.1 羟自由基清除率的测定
羟自由基可以在还原性过渡金属(Fe2+)和H2O2的存在下通过芬顿反应形成,是已知分子氧的所有还原形式中最具活性的,同时也被认为是生物体内细胞损伤的开始[18]。
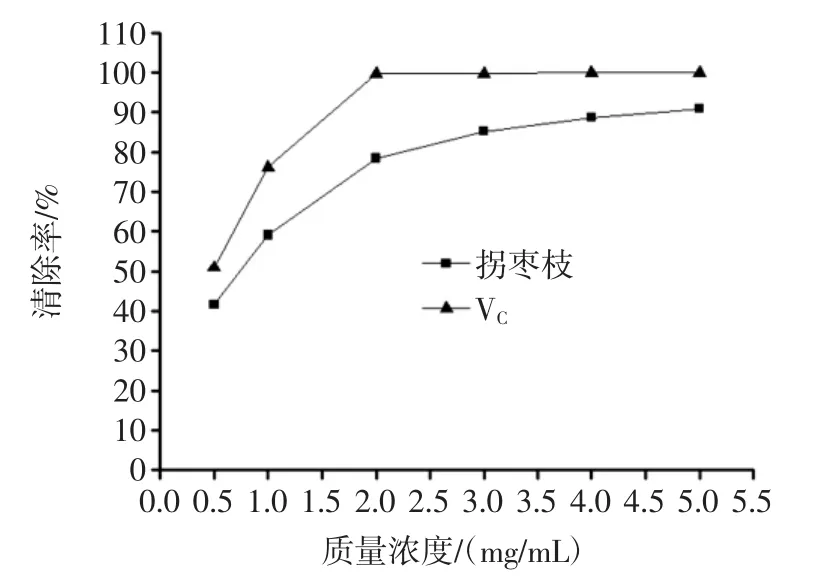
图7 多酚对羟自由基的清除作用Fig.7 Scavenging activity of polyphenols on hydroxyl radical
由图7可知,在试验的质量浓度范围内,拐枣枝多酚和VC对羟自由基均有明显的清除作用;在0.5mg/mL~3.0 mg/mL时,拐枣枝多酚对羟自由基的清除作用随着多酚浓度的增大而迅速增强,质量浓度在3.0 mg/mL~5.0 mg/mL时,拐枣枝多酚对羟自由基的清除作用随着浓度的增大而缓慢增强,之后趋于平缓,最大清除率达到90.97%。VC在0.5 mg/mL~2.0 mg/mL 时,VC对羟自由基的清除作用随着VC质量浓度的增加而迅速增强,质量浓度大于2.0 mg/mL后,清除率趋于稳定,维持在99.92%。与VC相比较,拐枣枝多酚对羟自由基的清除能力稍弱。
2.4.2 DPPH自由基清除率的测定
DPPH自由基在517 nm下有最大吸收峰,是一种稳定的自由基,很容易被抗氧化剂清除[19]。现在已被广泛应用于评估食物或植物提取物的抗氧化性能力[20]见图8。
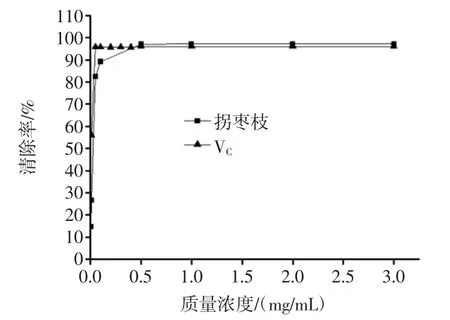
图8 多酚对DPPH自由基的清除作用Fig.8 Scavenging activity of polyphenols on DPPH radical
由图8可知,在试验的质量浓度范围内,拐枣枝多酚和VC对DPPH自由基均有明显的清除能力,在0.005 mg/mL~0.05 mg/mL时,拐枣枝多酚对DPPH自由基的清除能力随着多酚浓度的增大而迅速增强,质量浓度在0.05 mg/mL~3.0 mg/mL时,拐枣枝多酚对DPPH自由基的清除能力随着浓度的增大而缓慢增强,表现为曲线平缓,当质量浓度大于0.5 mg/mL时,其对DPPH自由基的清除率达到最大值97.19%。VC在0.01 mg/mL~0.05 mg/mL时,VC对DPPH自由基的清除作用随着VC质量浓度的增加而迅速增强,质量浓度大于0.05 mg/mL后,清除率趋于稳定,维持在96.05%。与VC相比较,虽然拐枣枝多酚在DPPH最大清除率上略高于VC,但是在低质量浓度范围内VC对DPPH自由基的清除能力比拐枣枝多酚强。
2.4.3 ABTS自由基清除率的测定
ABTS自由基是通过ABTS与过硫酸钾的氧化反应生成[21]。当ABTS自由基与样品中的抗氧化剂反应时,其特征颜色(蓝绿色)将会褪去[22],在734 nm处的特征吸收峰将会减弱。因此,通过检测734 nm处反应体系的吸光度值,可以定量分析ABTS自由基清除率大小,结果见图9。
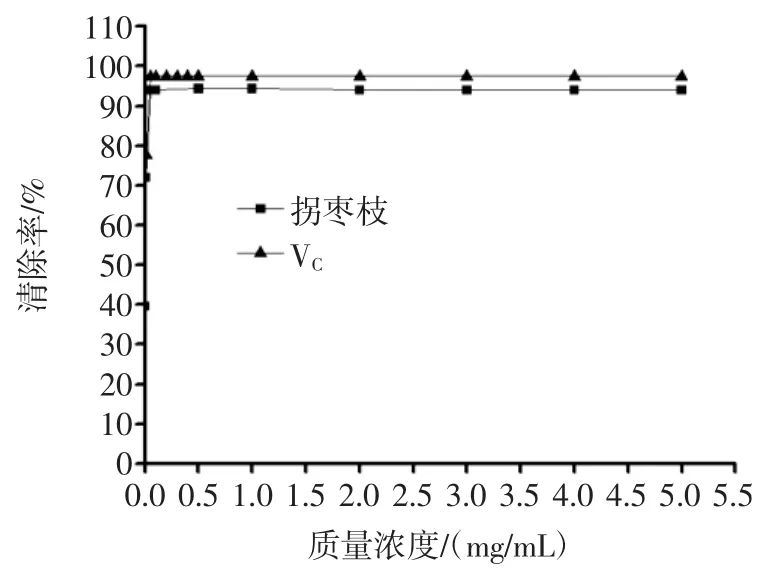
图9 多酚对ABTS自由基的清除作用Fig.9 Scavenging activity of polyphenols on ABTS radical
由图9可知,在试验的质量浓度范围内,拐枣枝多酚和VC对ABTS自由基均有明显的清除能力,质量浓度在0.005 mg/mL~0.05 mg/mL时,拐枣枝多酚对ABTS自由基的清除能力随着多酚浓度的增大而迅速增强,质量浓度在0.05 mg/mL~5.0 mg/mL时,拐枣枝多酚对ABTS自由基的清除能力随着浓度的增大而趋于平缓,最大清除率达到93.99%。VC0.01 mg/mL~0.05 mg/mL时,VC对ABTS自由基的清除作用随着VC质量浓度的增加而迅速增强,质量浓度大于0.05 mg/mL后,清除率达到最大值,维持在97.53%。与VC相比较,拐枣枝多酚对ABTS自由基的清除能力稍弱。
3 结论
本研究利用响应面分析法对拐枣枝多酚的提取工艺条件进行优化试验,回归模型方差分析后得出最佳提取工艺条件:在料液比为1∶84(g/mL),浸提温度为60℃的条件下,浸提2.56 h,拐枣枝多酚的理论提取率为7.089%,实际提取率为(7.048±0.103)%。因此,响应面分析法优化得到的拐枣枝多酚提取工艺参数是准确可靠的。抗氧化性试验研究结果表明,在试验的质量浓度范围内,随着拐枣枝多酚的质量浓度增加,其对羟自由基、ABTS自由基和DPPH自由基的清除作用增强,最大清除率分别达到90.97%、93.99%、97.19%。因此,拐枣枝多酚具有较强的抗氧化能力,是潜在的天然抗氧化剂,有待进一步研究和利用。
[1]李昊阳,夏继桥,杨连玉,等.植物多酚的抗氧化能力及其在动物生产中的应用[J].动物营养学报,2013,25(11):2529-2534
[2]徐国前,张振文,郭安鹊,等.植物多酚抗逆生态作用研究进展[J].西北植物学报,2011,31(2):423-430
[3]Pandey K B,Rizvi S I.Plant polyphenols as dietary antioxidants in humanhealthanddisease[J].Oxidativemedicineandcellularlongevity,2009,2(5):270-278
[4]Choi D Y,Lee Y J,Hong J T,et al.Antioxidant properties of natural polyphenols and their therapeutic potentials for Alzheimer's disease[J].Brain research bulletin,2012,87(2):144-153
[5]伊娟娟,左丽丽,王振宇.植物多酚的分离纯化及抗氧化、降脂降糖功能研究[J].食品工业科技,2013,34(19):391-395,399
[6]李谣,廖霞,肖星凝,等.基于蛋白质组学的植物多酚抗肿瘤作用机制研究进展[J].食品科学,2016,37(3):235-240
[7]杨成涛,赵云令,孙云,等.植物多酚抗骨质疏松作用的研究[J].食品工业科技,2014,35(17):386-389
[8]徐颖,樊明涛,程拯艮,等.7种苹果叶多酚的抗氧化性及抗菌性研究[J].食品工业科技,2015,36(10):90-95
[9]吴清华,许英豪,李志西,等.玉米须枳椇醋的研制及抗氧化性研究[J].中国酿造,2011,30(8):91-93
[10]Takai M,Ogihara Y,Shibata S.New peptide alkaloids from Hovenia dulcis and H.tomentella[J].Phytochemistry,1973,12(12):2985-2986
[11]Cho J Y,Moon J H,Park K H.Isolation and identification of 3-methoxy-4-hydroxybenzoic acid and 3-methoxy-4-hydroxycinnamic acid from hot water extracts of Hovenia dulcis Thunb and confirmation of their antioxidative and antimicrobial activity[J].Korean Journal of Food Science and Technology,2000,32(6):1403-1408
[12]Xiang J,Zhu W,Li Z,et al.Effect of juice and fermented vinegar from Hovenia dulcis peduncles on chronically alcohol-induced liver damage in mice[J].Food&function,2012,3(6):628-634
[13]郑朋朋,李珊,杨正涛,等.拐枣不同提取物的体外抗氧化作用[J].中国酿造,2015,34(9):121-124
[14]Rollet-Labelle E,Grange M J,Elbim C,et al.Hydroxyl radical as a potential intracellular mediator of polymorphonuclear neutrophil apoptosis[J].Free Radical Biology and Medicine,1998,24(4):563-572
[15]张保,李立天,张萌,等.拐枣枝多糖提取工艺优化与其抗氧化性研究[J].中国酿造,2016,35(7):155-160
[16]Bernaert N,De Paepe D,Bouten C,et al.Antioxidant capacity,total phenolic and ascorbate content as a function of the genetic diversity of leek (Allium ampeloprasum var.porrum)[J].Food chemistry,2012,134(2):669-677
[17]Hervert-Hernández D,García O P,Rosado J L,et al.The contribution of fruits and vegetables to dietary intake of polyphenols and antioxidant capacity in a Mexican rural diet:Importance of fruit and vegetable variety[J].Food Research International,2011,44(5):1182-1189
[18]Duan X,Wu G,Jiang Y.Evaluation of the antioxidant properties of litchi fruit phenolics in relation to pericarp browning prevention[J].Molecules,2007,12(4):759-771
[19]Lu Y,Foo L Y.Antioxidant activities of polyphenols from sage(Salvia officinalis)[J].Food chemistry,2001,75(2):197-202
[20]Sowndhararajan K,Kang S C.Free radical scavenging activity from different extracts of leaves of Bauhinia vahlii Wight&Arn[J].Saudi journal of biological sciences,2013,20(4):319-325
[21]Krishnaiah D,Sarbatly R,Nithyanandam R.A review of the antioxidant potential of medicinal plant species[J].Food and bioproducts processing,2011,89(3):217-233
[22]Packialakshmi B,Sudha G,Charumathy M.Total phenol,flavonoid and antioxidant properties of auricularia auricula-judae[J].International Journal of Pharmacy and Pharmaceutical Sciences,2015,7(12):233-237
Optimization of Extraction Technology of Hovenia acerba Sticks Polyphenols and Its Antioxidant Activity
ZHANG Bao,ZHANG Meng,LI Li-tian,ZHENG Peng-peng,AO Xin-yu*
(College of Life Science,Southwest Forestry University,Kunming 650224,Yunnan,China)
In order to provide theoretical basis for rationally developing and utilizing Hovenia accrba sticks polyphenols,the extraction technology of polyphenols from Hovenia accrba sticks was optimized by response surface methodology and studying its antioxidant activity.Using Hovenia accrba sticks as experimental materials,the effects of extraction solvent,material-liquid ratio,extraction temperature and extraction time on extraction rates of polyphenols were studied based on single factor experiment with response surface methodology.The antioxidant activities were investigated on the basis of hydroxyl radical,ABTS free radical and DPPH free radical assay.Result showed that the optimal extraction conditions were using anhydrous alcohol as extraction solvent with conditions of material-liquid ratio 1∶84 (g/mL),extraction temperature 60℃,extraction time 2.56 h,and the optimum extraction rate was up to 7.089%.The antioxidant activity tests revealed that polyphenols exhibited antioxidant activities in a concentration-dependent manner,and maximum scavenging rate were 90.97%,93.99%and 97.19%,respectively.
Hovenia accrba sticks;polyphenols;response surface methodology;antioxidant activity
10.3969/j.issn.1005-6521.2017.23.009
云南省优势特色重点学科生物学一级学科建设项目(50097505);西南林业大学科技创新基金(15125)
张保(1992—),男(汉),硕士研究生,研究方向:生物化学与分子生物学。
*通信作者:敖新宇(1978—),男(汉),副教授,硕士,主要从事于生物化学与分子生物学研究工作。
2017-04-20
