锥连栎种子萌发对种皮和温度的响应
2017-12-02云南大学生态学与地植物学研究所昆明650091
, , , , , , , (云南大学生态学与地植物学研究所, 昆明 650091)
锥连栎种子萌发对种皮和温度的响应
余婷,孟丽媛,张辉红,苏文华,司宏敏,吴雪涛,马筱,张光飞
(云南大学生态学与地植物学研究所, 昆明 650091)
以锥连栎(Quercusfranchetii)种子为实验材料,研究了不同温度(10,15,20,25,30,35,40 ℃)和去种皮与非去皮处理对种子萌发的影响。结果表明,种皮对锥连栎种子的萌发率(GP)、萌发指数(GI)和萌发速率系数(CRG)的影响极显著(p<0.01),温度及二者的交互作用对除萌发率外的其他2个萌发参数的影响均极显著(p<0.01)。种皮对锥连栎种子的萌发具有明显的抑制作用,除去种皮后,种子的萌发率及萌发指数极显著增加(p<0.01),且萌发进程加快。去种皮种子萌发的最适温度为25 ℃,最高萌发率达100%,升高或降低最适温度都会影响其萌发。有种皮种子萌发率最高仅为10%。锥连栎种皮水浸提液处理下的去种皮锥连栎和小麦种子的萌发率无显著差异(p>0.05),表明种皮对锥连栎种子的萌发无化学他感作用,但具有明显的机械抑制作用。
种皮; 温度; 种子萌发; 锥连栎
植物种皮的机械障碍作用[1-3]和种皮中含有抑制萌发的物质[4]都能引起种子休眠,即种皮导致植物种子有不同程度的休眠现象,甚至一些具有坚硬种皮或果皮的顽拗性种子也表现出一定程度的休眠[3,5]。壳斗科中大多数栎属植物的种子属于顽拗性种子[6],由种皮所引起的休眠现象在国内外皆有报道[7-8]。例如,辽东栎(Quercuswutaishanica)除去种皮可促进其种子的萌发[9]。另外,合欢(Albiziajulibrissin)[2]、Larreatridentata[10]、橡胶树(Heveabrasiliensis)[3]、板栗(Castaneamollissima)[11]等种子的种皮对萌发还具有明显的机械障碍作用。除种皮的机械抑制外,种子内存在抑制萌发的物质可能使种子表现出一定程度的休眠现象[8]。研究发现,成熟水栎(QuercusnigraL.)[12]果皮的浸提物和燕山红栗(CastaneamollissimaBI.cv.‘Yanshanhong’)[11]种皮中均含有抑制物质。温度是影响种子萌发的关键因素之一[13]。大量研究结果表明,植物的种子萌发适宜温度为25 ℃[10,14],但也有一些种子适宜的温度范围较宽,例如,棱棱种子萌发的适宜温度为15~30 ℃[15]。
锥连栎(Quercusfranchetii)为壳斗科(Fagaceae)栎属(Quercus)常绿阔叶植物,是我国西南地区的一种特有植物,在云南和四川分布范围较广,作为天然植被主要的建群种之一,其更新与种子萌发和幼苗的早期生长关系密切[16]。目前,与栎属植物实生更新密切相关的种子萌发方面的研究一直是国内外生态学和种子生物学领域的研究热点之一。关于种皮[8-9]和温度[17-18]对栎属植物种子萌发的影响已有很多研究,但有关锥连栎种子萌发对种皮和温度的响应特征报道较少。本研究以昆明植物研究所植物园采集的锥连栎种子为材料,研究其在不同温度条件下萌发时种皮的作用以及锥连栎种皮水浸提液对种子萌发的影响,以了解锥连栎种子萌发的最适温度以及萌发对种皮的响应。丰富了栎属植物种子生态生物学研究方面的科学数据,为锥连栎种群更新及造林实践提供参考。
1 材料与方法
1.1 材 料
锥连栎种子于2015年9月采自中国科学院昆明植物研究所植物园,小麦种子来自种子公司,选取完好种子用于萌发实验。
1.2 方 法
1.2.1 锥连栎种皮水浸提液的制取
称取50 g锥连栎种子皮,装入广口瓶中,加入500 mL的蒸馏水浸泡,常温下浸提24 h后取出滤除残渣,用蒸馏水定容至500 mL。然后将水浸提液再稀释成0.1,0.05,0.025 g/mL等浓度,用蒸馏水作对照组,皆置于4 ℃的冰箱中备用。
1.2.2 种子萌发实验
锥连栎种子分去皮和非去皮2组处理,每组分别设置10,15,20,25,30,35,40 ℃ 7个温度梯度,每处理设5个重复,每个重复20粒种子。在25 ℃下分别用浓度为0,0.1,0.05,0.025 g/mL的锥连栎种皮水浸提液处理小麦种子和去皮的锥连栎种子,实验设5个重复,每个重复20粒种子,置于培养瓶中培养。实验均在光照14 h/黑暗10 h的周期性光照条件下进行。胚根长出2 mm为萌发标志,实验过程中每天观察并作记录,移出已萌发的种子。
1.3 萌发参数计算
种子的萌发率(GP)、萌发指数(GI)、萌发速率系数(CRG)[19]分别按下列公式计算:
萌发率(%)=萌发种子数/供试种子总数×100%;
萌发指数=MDG×PV;
式中,MDG为平均每天种子萌发数,即萌发实验结束时种子萌发数/萌发天数;PV为种子最大萌发数,即萌发期间任何一天中达到的最大萌发数/达到最大值所需天数。
萌发速率系数=[∑(t×n)/∑n]×100;
式中,t为萌发实验开始时的天数;n为t天内萌发的种子数。
1.4 数据统计分析
利用Excel软件对数据进行统计分析并作图,采用SPSS软件进行单因子方差分析和双因子方差分析,Duncan检验法进行多重比较及差异显著性检验。
2 结果与分析
2.1 不同温度下去皮和非去皮种子的萌发率
去皮种子的平均萌发率为78.14%,非去皮种子的平均萌发率仅为2.86%。在40 ℃时,去皮和非去皮的种子萌发率均为0。去皮种子10 ℃时的萌发率显著低于15,20 ℃和25 ℃ 3个温度处理(p<0.05),其它温度处理间萌发率无显著差异(p>0.05)(图1)。非去皮种子在10,15,20,40 ℃时,种子萌发率均为0,在30 ℃时的种子萌发率最高仅为10%,25 ℃次之,为7%(图1)。
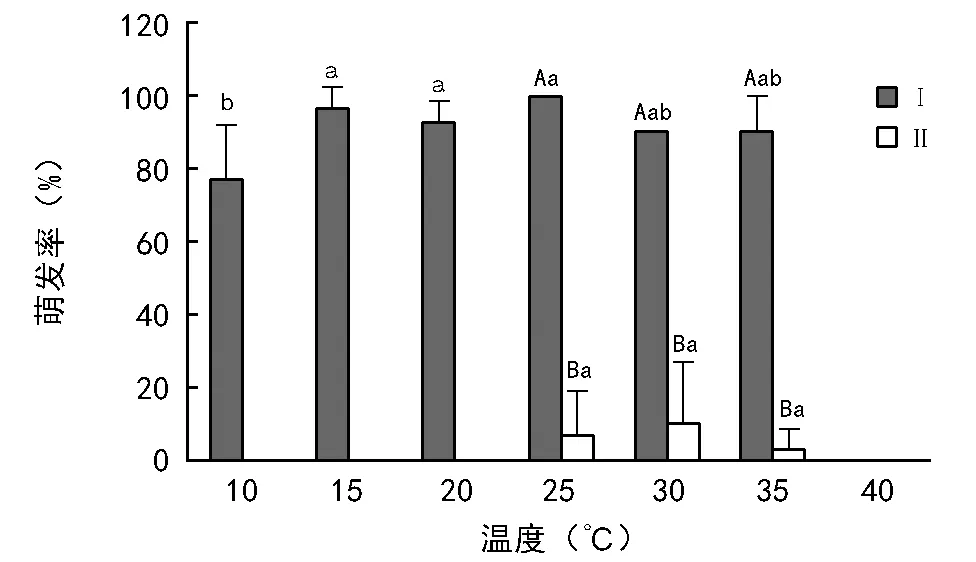
注:不同小写字母表示相同种皮处理下不同温度的锥连栎种子萌发率有显著性差异(p<0.05);不同大写字母表示相同温度下不同种皮处理的锥连栎种子萌发率有显著性差异(p<0.05)。下同。图1 去皮(Ⅰ)和非去皮锥连栎种子(Ⅱ)萌发率对温度的响应
表1 种皮和温度对锥连栎种子萌发影响的二因素方差分析

萌发参数 种 皮 温 度 种皮×温度 dfMSFpdfMSFpdfMSFp萌发率(%)16.93960.150.00050.022.090.10150.101.350.276萌发指数13.37393.850.00050.4754.450.00050.4653.930.000萌发速率系数110852346.6058.180.00051741778.543.390.00052740185.5614.690.000
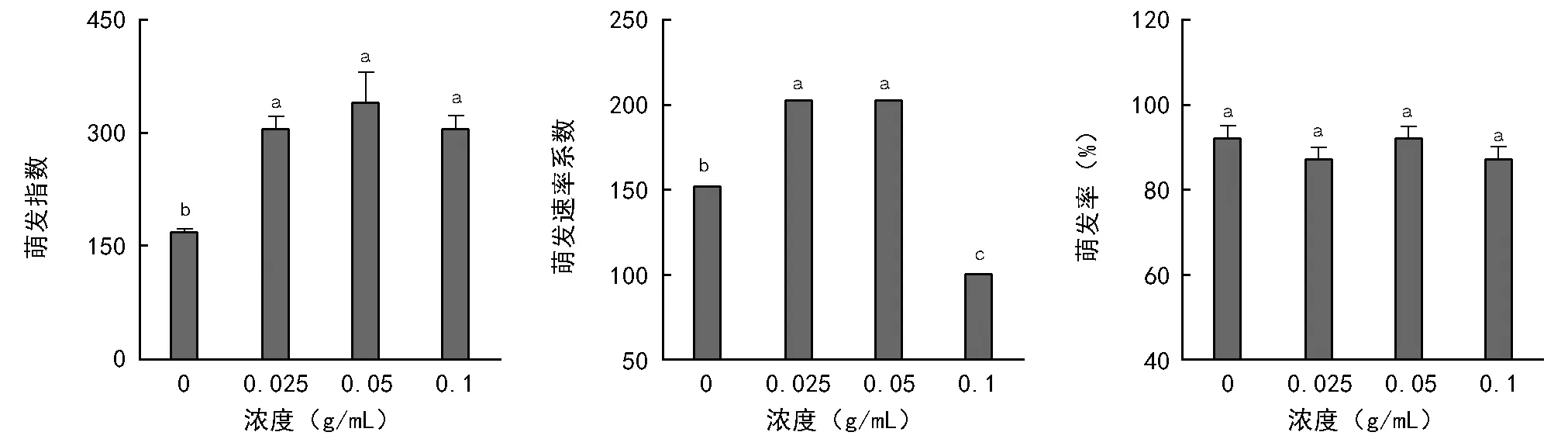
图4 锥连栎种皮水浸提液对小麦种子萌发的影响
种皮对种子的萌发率有极显著影响(p<0.01),温度及二者的交互作用对种子的萌发率均无显著影响(p>0.05)(表1)。
2.2 不同温度下去皮和非去皮种子的萌发指数
去皮后平均萌发指数为0.546,非去皮种子的平均萌发指数仅有0.003。去皮种子25 ℃时的萌发指数极显著大于其它温度(p<0.01),10,15 ℃和35 ℃的萌发指数不存在显著差异(p>0.05)。当温度从10 ℃提高到25 ℃,去皮种子萌发指数从0.14逐渐增大到1.56,随着温度的继续升高又逐渐减小。非去皮种子在30 ℃时萌发指数最大,但与其他温度无显著差异(p>0.05)。40 ℃时去皮和非去皮种子的萌发指数最低为0(图2)。种皮、温度及其交互作用对种子的萌发指数均有极显著影响(p<0.01)(表1)。
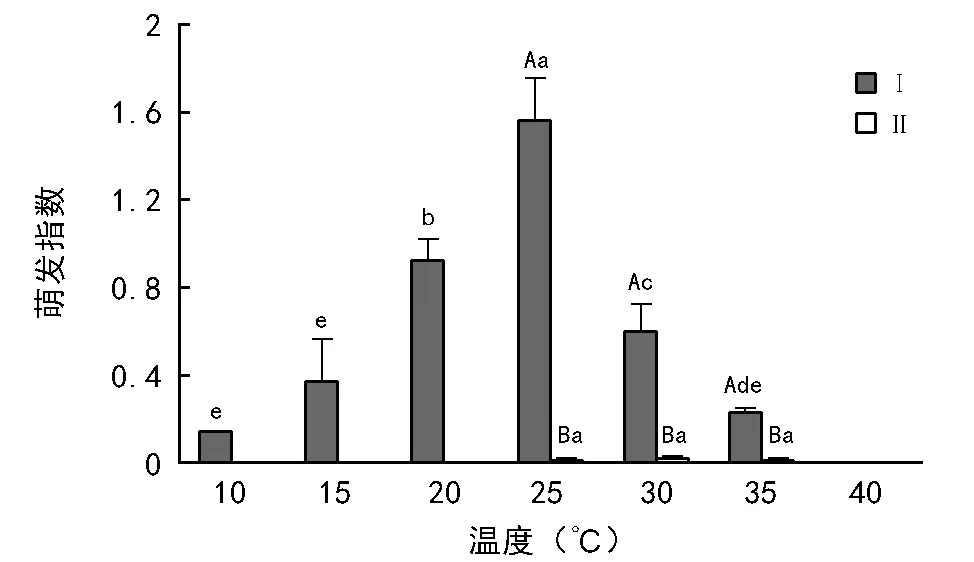
图2 去皮(Ⅰ)和非去皮锥连栎种子(Ⅱ)萌发指数对温度的响应
2.3 不同温度下去皮和非去皮种子的萌发速率系数
去除种皮加快了种子萌发进程。去皮种子的萌发速率系数在10~25 ℃范围内随着温度的升高而逐渐减少,在30~35 ℃时又逐渐增加,在40 ℃时为0;萌发速率系数在25 ℃时最小,为493.64,显著低于除40 ℃外的温度处理(p<0.01)。非去皮种子的萌发速率系数在35 ℃时最小,为300。30 ℃和35 ℃时非去皮种子的萌发速率系数显著低于去皮种子(p<0.05)(图3)。二因素方差分析结果显示,种皮、温度及其交互作用对种子萌发速率系数均具有极显著影响(p<0.01)(表1)。

图3 去皮(Ⅰ)和非去皮锥连栎种子(Ⅱ)萌发速率系数对温度的响应
2.4 锥连栎种皮水浸提液对小麦种子萌发的影响
锥连栎种皮水浸提液各浓度处理下的小麦种子萌发率无显著差异,其平均萌发率高达89.5%。各浓度之间萌发速率系数存在显著差异(p<0.05)。萌发速率系数在浓度为0.025 g/mL和0.05 g/mL下最大为200,浓度为0.1 g/mL下最小为100。浓度为0 g/mL下萌发指数最小为165,且随浓度的增加逐渐增加(图4)。
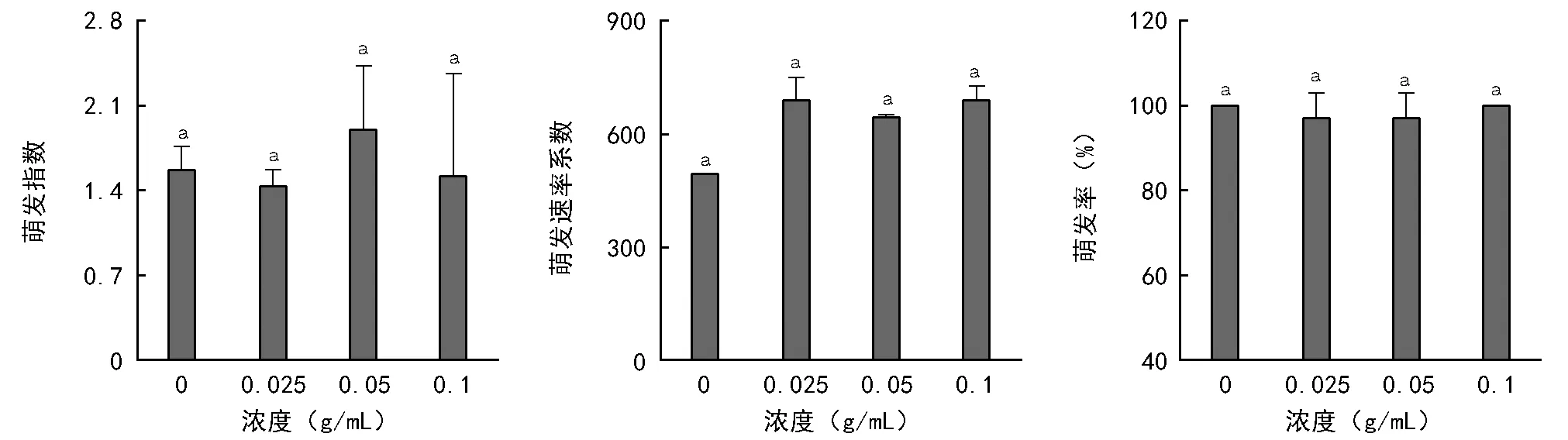
图5 锥连栎种皮水浸提液对锥连栎种子萌发的影响
2.5 锥连栎种皮水浸提液对锥连栎种子萌发的影响
锥连栎种皮水浸提液各浓度处理下的锥连栎种子萌发率、萌发速率系数和萌发指数均无显著差异(p>0.05)(图5)。其平均萌发率高达98.5%,平均萌发指数为1.60,平均萌发速率系数为631.5。
3 讨 论
3.1 种皮对种子萌发的抑制作用
种皮的机械性对水分和气体的交换有一定的阻碍作用[20-21],种皮对种子吸胀具有明显的机械障碍作用[10]。栎属植物种子有复杂的种皮结构,覆盖胚根的种皮区域有较厚的角质层及一层致密的栅栏组织[22],种皮的这一特殊结构可能通过机械抑制作用[23]而抑制种子萌发,去除种皮能促进此类种子的萌发[8-9,18,24]。本研究发现,种皮对锥连栎种子的萌发有极显著的抑制作用,除去种皮可显著提高种子萌发率,增大萌发指数,加速萌发进程。这一结果与其它一些栎属植物的研究结论一致[8-9]。除种皮的机械束缚外,造成栎类种子延迟萌发和出苗不整齐的原因可能是种子中含有抑制物质[25]。发芽抑制物质是由植物体产生的,或是植物体中虽不存在与发芽抑制有关的物质,这类物质可延迟或抑制同种或异种种子的发芽[26]。本实验对锥连栎种子抑制物测定均以锥连栎和小麦种子的萌发为参照,得出锥连栎种皮水浸提液处理下的去皮锥连栎和小麦种子萌发率无显著差异,即种皮对锥连栎种子的萌发无化学他感作用,抑制其萌发的主要原因是种皮的机械束缚。
3.2 种子萌发对温度的响应
不同植物种子的萌发对温度的要求不同。在萌发过程中,种子同时进行着活跃的代谢反应,因此在一定的温度范围内,萌发进程随温度的升高而加快,但过高的温度会使一些酶变性反而影响萌发[27]。植物种子萌发的适宜温度可能与其原生境密切相关[28],温带地区旱生植物梭梭(Haloxylonammodendron)种子萌发的最适温度为10 ℃[29],而很多热带地区的顽拗性种子不能耐受10~15 ℃的低温[3]。本研究发现,锥连栎种子萌发的温度耐受范围较广,去皮种子的萌发率在15 ℃时高达97%;25 ℃时萌发率最高为100%,萌发指数也最大;40 ℃时萌发率为0%,原因是高温使一些活性物质变性从而不能萌发。未去皮种子萌发率在30 ℃下最高,25 ℃次之。综合分析可得,锥连栎种子萌发的最适温度为25 ℃,该结果与多数研究者报道的部分温带地区植物种子萌发所需最适温度一致。
[1]段琦梅,梁宗锁,慕小倩,等.黄芪种子萌发特性的研究[J].西北植物学报,2005,25(6):1 246-1 249.
[2]郭学民,徐兴友,孟宪东,等.合欢种子硬实与萌发特性及种皮微形态与结构特征的研究[J].内蒙古农业大学学报(自然科学版),2006,27(3):13-18.
[3]闫兴富,曹敏.种皮和环境温度对橡胶树种子萌发的影响[J].热带亚热带植物学报,2009,17(6):584-589.
[4]许晓岗,丁芳芳,李翔,等.东京野茉莉种子休眠机制及其破除方法初探[J].西北植物学报,2012,32(11):2 270-2 278.
[5]Liu Y,Qiu Y P,Zhang L,et al.Dormancy Breaking and Storage Behavior of Garcinia cowa,Roxb.(Guttiferae) Seeds:Implications for Ecological Function and Germplasm Conservation[J].植物学报(英文版),2005,47(1):38-49.
[6]Dickie J B,Pritchard H W,Black M,et al.Systematic and evolutionary aspects of desiccation tolerance in seeds[M].2002.
[7]Hopper GM,Smith DWM,Parrish DJ.Germination and seedling growth of northern red oak:Effects of stratification and pericarp removal[J].Forest Science,1985,31:30-31.
[8]刘艳,李庆梅,刘广全,等.麻栎种子萌发的抑制机制[J].林业科学,2012,48(9):164-170.
[9]闫兴富,仇智虎,杜茜,等.种皮和环境温度对辽东栎种子萌发的影响[J].西北林学院学报,2014,29(3):119-124.
[10]张香凝,孙向阳,耿玉清,等.LarreaTridentata的种子萌发特性[J].东北林业大学学报,2006,34(2):8-10.
[11]白柯君,郭素娟,石青莲.燕山红栗种子休眠与种胚形态、种皮及内含物的关系[J].西南林业大学学报,2005,25(4):106-109.
[12]Peterson J K.Mechanisms involved in delayed germination ofQuercusnigraL. seeds[J].Annals of Botany,1983,52(1):81-92.
[13]黄振英,曹敏,刘志民,等.种子生态学:种子在群落中的作用[J].植物生态学报,2012,36(8):705-707.
[14]孙长生,龙祥友,朱虹,等.不同温度对山豆根种子发芽的影响[J].种子,2014,33(5):82-85.
[15]张树新,邹受益,杨美霞.梭梭种子发芽特性试验研究[J].内蒙古林学院学报,1995(2):56-63.
[16]刘方炎,张志翔,王小庆,等.生境异质性对金沙江干热河谷锥连栎天然更新幼苗早期生长的影响[J].应用与环境生物学报,2011(3):338-344.
[17]周元,孙卫邦,李从仁.三棱栎种子萌发特性初探[J].植物科学学报,2003,21(1):73-76.
[18]陈章和.英国栎(QuercuspedunculataEhrh.)种子萌发及幼苗生长分析[J].华南师范大学学报(自然科学版),1991(2):56-62.
[19]Boscagli A,Sette B.Seed germination enhancement inSaturejamontanaL.ssp.montana[J].Seed Science & Technology,2001,29(2):347-355.
[20]李望.种子休眠的机理及其破除方法[J].中国农学通报,1997,13(3):49-50.
[21]Debeaujon I,Léonkloosterziel K M,Koornneef M.Influence of the testa on seed dormancy,germination,and longevity in Arabidopsis[J].Plant Physiology,2000,122(2):403-14.
[22]S.Rakic,D.Povrenovic,V.Teševic,et al.Oak acorn,polyphenols and antioxidant activity in functional food[J].Journal of Food Engineering,2006,74(3):416-423.
[23]Sobrino-Vesperinas E,Viviani A B.Pericarp micromorphology and dehydration characteristics ofQuercussuberL.acorns[J].Seed Science Research,2000,10(3):401-407.
[24]Hu X W,Wang Y R,Wu Y P.Effects of the pericarp on imbibition,seed germination,and seedling establishment in seeds ofHedysarumscopariumFisch.et Mey.[J].Ecological Research,2009,24(3):559-564.
[25]李庆梅,刘艳,刘广全,等.栎属7种植物种子的发芽抑制物质研究[J].生态学报,2013,33(7):2 104-2 112.
[26]Evenari M.Germination inhibitors[J].The Botanical Review,1949,15(3):153-194.
[27]曹仪植,宋占年.植物生理学[M].兰州:兰州大学出版社,1998:365-372,423-424.
[28]张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106-112.
[29]黄振英,张新时,Yitzchak GUTTERMAN,等.光照、温度和盐分对梭梭种子萌发的影响[J].植物生理与分子生物学学报,2001,27(3):275-280.
Responses ofQuercusfranchetiito Seed Coat and Different Temperature in Seed Germination
YUTing,MENGLiyuan,ZHANGHuihong,SUWenhua,SIHongmin,WUXuetao,MAXiao,ZHANGGuangfei
(Institute of Ecology and Geobotany Yunnan University,Kunming 650091,China)
The experiment tookQuercusfranchetiiseeds as the test materials,the effects of seed coat and different temperature (10,15,20,25,30,35 ℃ and 40 ℃ respectively)on the seed germination ofQ.franchetiiwere studied.The results showed that significant effects of seed coat were detected (p<0.01) on germination percentage (GP),germination index (GI) and coefficient of rate of germination (CRG).Significant interaction effects between coat and temperature on two other germination parameters except GP were also observed (p<0.01).Seed coat played an obvious role of inhibition in seed germination and coat removal significantly increased GP and GI (p<0.01) and accelerated germination timing.The optimal temperature for germination of uncoated seeds was 25 ℃.The percentage of germination was up to100%.The changes in optimal temperature could reduce the seeds germination percentage and germination index.The GP of the seeds with capsules were only 10%.The effects of aqueous extract fromQ.franchetiiseeds on the GP of Triticum aestivum andQ.franchetiiseeds were not detected (p>0.05).It was concluded that seed germination of cone seeds chemical allelopathy effect but has obvious mechanical inhibition.
seed coat; temperature; seed germination;Quercusfranchetii
2017-01-29
国家水体污染控制与治理科技重大专项,“五采区”及其废弃地生态防护技术与工程示范(2012 ZX 07101-003-04-04);国家自然科学基金(31160092)。
余 婷(1992—),女,贵州遵义人;硕士研究生,研究方向:植物生理生态;E-mail:1403780818@qq.com。
通迅作者:张光飞(1966—),男,副教授,主要从事生理生态学研究;E-mail:gfzhang@ynu.edu.cn。
10.16590/j.cnki.1001-4705.2017.07.003
S 792.18
A
1001-4705(2017)07-0003-05
