蛋白芯片检测平台检测β-乳球蛋白的方法学评价*
2017-12-02殷继永霍军生马欣欣
殷继永 霍军生* 马欣欣 孙 静 黄 建
蛋白芯片检测平台检测β-乳球蛋白的方法学评价*
殷继永①霍军生①*马欣欣①孙 静①黄 建①
目的:评价本研究前期建立的用于β-乳球蛋白的蛋白芯片检测平台,以满足预防医学实验室的检测需求。方法:应用蛋白芯片检测平台对3份生牛乳样品进行批内重复8次检测β-乳球蛋白,计算其批内精密度;另对3份生牛乳分别重复8个批次检测,计算批间精密度。对高浓度标准品连续2倍比例稀释3种浓度后进行稀释回收率实验;另对3种浓度标准品进行加标回收率实验。取10份生牛乳样品,分别用蛋白芯片检测平台与商用ELISA试剂盒进行检测并进行方法学比较。结果:用于β-乳球蛋白的蛋白芯片检测平台的批内精密度为11.18%~17.62%,批间精密度为25.10%~29.96%;稀释回收率为104.27%~128.15%,加标回收率为45.98%~129.33%,两种方法的相关系数r=0.958,差异有统计学意义(t=9.46,P<0.05);两种方法配对比较t检验差异无统计学意义(t=-2.592,P>0.01)。结论:本研究建立的用于β-乳球蛋白的蛋白芯片检测平台能够满足预防医学实验室检测需要,现存在的操作偏倚需进一步优化。
蛋白芯片;β-乳球蛋白;检测平台;评价
牛乳是临床营养中的重要食物来源。β-乳球蛋白(β-Lactoglobulin,β-L)是牛乳中主要的蛋白质,在乳清蛋白中总含量达50%,占牛乳总蛋白的10%。β-L是由乳腺上皮细胞合成的牛乳特有蛋白,其分子量约为18 kDa,由162个氨基酸残基组成,其中4个半胱氨酸残基在链内形成了二硫键,这些特点保证了β-L结构的相对稳定,并进而使其可以作为牛乳真伪鉴定时具有代表性的标志蛋白[1]。此外,因牛乳中的主要致敏蛋白包括β-L,因此其也可作为牛乳致敏性蛋白检测时的标志蛋白[2]。
目前,有许多检测方法应用于牛乳蛋白的检测[3-5]。然而,各种方法检测过程复杂、不易于掌握和操作,且对检测仪器要求高,使日常生活中饮用的牛乳质量不能得到及时稳定的检测保证。为此,本研究前期利用蛋白芯片技术的检测特点,建立针对β-L的蛋白芯片检测平台[6]。该平台具有快速、高效、高灵敏度和操作性强的特点,但其具体的检测性能是否能满足实验室阶段的检测需求,尚需相应的评价实验进行检验。对检测平台进行性能评价的实验包括评价精确性的批内精密度、批间精密度实验,评价准确性的稀释回收率、加标回收率及方法学对照实验。因此,本研究利用前期建立的蛋白芯片检测β-L的平台进行检测性能评价,以期为蛋白芯片技术在预防医学中的应用奠定基础。
1 材料与方法
1.1 仪器与试剂
LuxScanTM10 K芯片扫描仪(北京博奥生物有限公司);Personal ArrayerTM16蛋白芯片点样仪(北京博奥生物有限公司)。牛乳β-L标准品(PCode1002101934,美国SIGMA);β-L鼠单抗与兔多抗(北京华大蛋白质研发中心有限公司);Cy3标记的羊抗兔多抗(code 111-165-003,美国,Jackson ImmunoResearch);阴性兔IgG,蛋白芯片点样液A(code 440015,北京博奥生物有限公司);晶芯®高分子三维基片(code 420040,北京博奥生物有限公司);磷酸盐缓冲液(phosphate buffer solution,PBS),Tween20。10份不同采样点的生牛乳(北京三元食品股份有限公司)。
1.2 试验方法
(1)本研究中所使用的蛋白芯片基本检测方法,与前期建立蛋白芯片平台研究中所优选出的基本检测方法相一致[6]。在精密度与准确度的方法学评价实验中,参照《体外诊断试剂分析性能评估系列指导原则》(简称“指导原则”)中的评价方法进行评价,各实验中所使用的标准曲线参考前期平台建立时所建立的标准曲线并根据实际检测需要略做调整。
(2)在批内精密度与批间精密度评价中分别随机选取三元食品股份有限公司提供的3份生牛乳进行实验。研究中的重复次数参考“指导原则”;在稀释回收率实验中,为了减少大比例稀释可能带来的稀释偏倚,选择的3个稀释浓度均在检测标准曲线的中上部。在加标回收率实验中,为确保加标前后的检测结果都不超出标准曲线最高点与最低点,以保证评价的可行性,本研究结合相关文献[7-8]报道,最终选择了现在使用的3个基础液浓度与加标液的浓度。方法学比较实验中使用的生牛乳样品选自北京周边奶源,由于奶源地的生牛乳质量相对稳定,因此本次评价实验中所使用的10份生牛乳已经能够满足实验室阶段的检测需求。
1.3 蛋白芯片检测项目与方法
1.3.1 基本检测方法
(1)将β-L的抗体探针β-L鼠单抗或β-L兔多抗和质控品(阳性控制为无关兔IgG,阴性控制为1×点样缓冲液,空白控制为PBS)分别重复点样在三维基片的每一个阵列中。经37 ℃固定18.5 h后,按以下操作完成实验。
(2)加抗原β-L蛋白稀释液(30 μl/阵列,37 ℃,1 h)→芯片洗涤(1‰PBST,5 min/次,5次)→甩干(1000 r/min,2 min)→加入检测抗体β-L鼠单抗或β-L兔多抗(30 μl/阵列,37 ℃,1 h)→芯片洗涤(1‰PBST,5 min/次,5次)→甩干(1000 r/min,2 min)→加入Cy3标记的二抗(30 μl/阵列,37 ℃,1 h)→芯片洗涤(1‰PBST,5 min/次,5次)→甩干(1000 r/min,2 min)→芯片扫描→获取检测图像与检测数据。
1.3.2 批内精密度
将β-L标准品以1‰PBST样本稀释液稀释5个标准浓度(2209.6 ng/ml、1104.8 ng/ml、552.4 ng/ml、276.2 ng/ml、138.1 ng/ml),以1‰PBST为阴性对照,做标准曲线。取3份生牛乳,编号为Ⅰ、Ⅱ、Ⅲ。其中生牛乳Ⅰ和Ⅱ按1∶400稀释,生牛乳Ⅲ按1∶800稀释后批内重复8次检测,以30μl/阵列加入各自相应的阵列。批内精密度计算为公式1:

1.3.3 批间精密度
取3份生牛乳,编号为Ⅰ、Ⅱ、Ⅲ。其中生牛乳Ⅰ和Ⅱ按1∶400稀释,生牛乳Ⅲ按1∶800稀释后,对3份生牛乳分8个批次检测、每批次内两阵列重复,以30μl/阵列加入各自相应的阵列。8个批次批间精密度检测计算为公式2:

式中S批间为批间实验的批间标准差;X1为每日每批的第一个检测结果;X2为每日每批的第二个检测结果;L为检测天数(4 d,8次)。
1.3.4 稀释回收率
对高浓度标准品(2984.4 ng/ml)连续稀释3个浓度(1492.2 ng/ml,746 ng/ml,373 ng/ml)后,以30 μl/阵列加入各自相应的阵列,进行稀释回收率实验,并根据实验结果计算稀释回收率。
1.3.5 加标回收率
对3个浓度基础液(639.5 ng/ml,426.35 ng/ml,479.65 ng/ml)进行加标回收率实验,每个浓度均加入其体积量1%体积的高浓度加标液(67150 ng/ml),加标原则参照文献[7-8]中的要求;以30 μl/阵列加入各自相应的阵列。根据实验结果计算加标回收率。
1.3.6 方法学对照
取10份生牛乳,于4 ℃、12000 r/min,离心30 min后各取中间清澈乳清部分并进行编号,各生牛乳乳清分为两部分,一部分用于ELISA试剂盒检测β-L含量,另一部分用于蛋白芯片检测β-L的含量。对两种方法的检测结果,计算相关系数,并进行配对比较的t检验。
1.4 统计学方法
采用Microsoft Office Excel 2007与SPSS 17.0软件对所有的数据进行分析处理。精密度评价实验以重复检测值的均数、标准差及由二者确定的变异系数表示;准确度评价以每个检测信号值代入回归方程求浓度的均数后进行计算;方法学对照评价,用配对比较的t检验和相关性分析对两种方法检测结果进行一致性评价。检验水准选定α=0.01,以P<0.01为差异有统计学意义。
2 结果
2.1 批内精密度
对Ⅰ~Ⅲ的3份生牛乳样品进行批内重复检测8次的结果显示,蛋白芯片检测平台对生牛乳中β-L检测的批内精密度为11.18%~17.62%(见表1)。

表1 蛋白芯片检测β-L的批内精密度评价
2.2 批间精密度
对3份生牛乳样品进行批间实验4 d(8次)的结果显示,蛋白芯片检测平台对生牛乳中β-L检测时,每批内2个结果间的批内精密度为15.37%~18.35%,日间精密度为9.88%~30.24%,每批次之间的批间精密度为25.10%~29.96%,总批间精密度为31.05%~45.37%(见表2)。
2.3 稀释回收率及加标回收率
(1)稀释回收率结果显示,蛋白芯片检测平台检测3种浓度β-L的稀释回收率为104.27%~128.15%,其平均回收率为113.75%(见表3)。
(2)加标回收率结果显示,蛋白芯片检测平台检测3种浓度β-L的加标回收率为45.98%~129.33%,其平均回收率为94.40%(见表3)。
2.4 方法学对照
两种检测方法的方法学对照结果显示,两种方法的相关系数r=0.958, 经检验有统计学意义(t=9.46,P<0.05),如图1所示。

图1 蛋白芯片法与ELISA法检测牛乳β-L的相关性分析示图
配对比较t检验结果显示,两种方法比较其差异无统计学意义(t=-2.592,P>0.01),见表4。
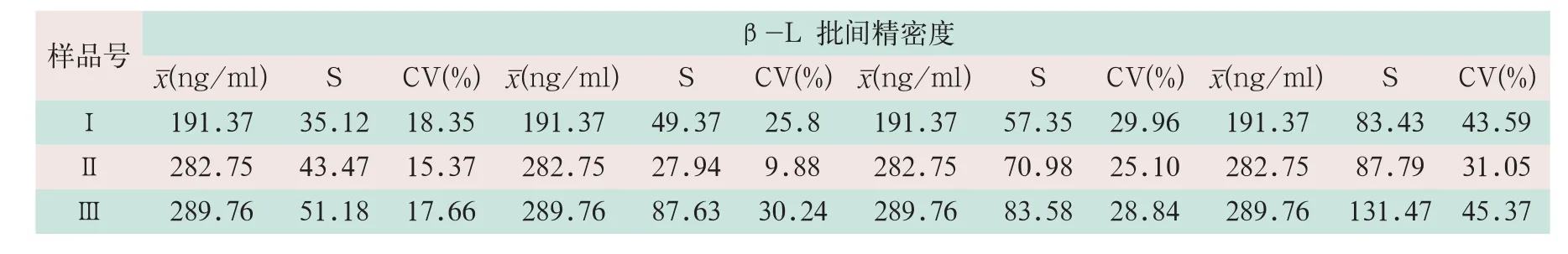
表2 蛋白芯片检测β-L的批间精密度评价(n=8)

表3 蛋白芯片检测β-L的回收率及加标回收率评价
表4 蛋白芯片法与ELISA法配对比较的t检验(±s,ng/ml)

表4 蛋白芯片法与ELISA法配对比较的t检验(±s,ng/ml)
序号 蛋白芯片法 E L I S A法 差值1 2 2 9 6 0.6 1 5 7 7 3 3.6 0 -3 4 7 7 2.9 9 2 3 1 5 5 3.8 8 6 3 6 0 9.4 0 -3 2 0 5 5.5 2 3 2 2 8 4 0.1 0 8 0 4 8 0.7 9 -5 7 6 4 0.6 9 4 2 1 3 2 8.2 8 5 3 2 3 8.5 8 -3 1 9 1 0.3 0 5 8 7 1 7 0.0 5 4 5 3 0 2 6.9 7 -1 9 5 6 5 9.4 6 6 3 6 4 9 0.2 3 7 7 7 6 6.8 9 -4 1 2 7 6.6 6 7 5 1 9 5 1.9 2 2 0 0 7 2 7.1 2 -1 4 8 7 7 5.2 1 8 1 9 3 0 4.8 5 8 2 4 4 4.9 9 -6 3 1 4 0.1 4 9 3 2 5 0 5.2 8 9 4 1 4 5.1 0 -6 1 6 3 9.8 2 1 0 3 1 4 0 6.6 1 5 3 1 1 5.2 0 -2 1 7 0 8.5 9 ±s 3 5 7 5 1±2 0 4 4 7 1 2 1 6 2 8±1 2 4 1 9 0 -6 8 8 5 7±5 7 2 9 1
3 讨论
利用蛋白芯片实现对样品中特定物质含量的测定是一种新兴的检测技术,目前国内外尚未见有利用此技术对牛乳中β-L进行研究的报道。本研究前期建立了利用蛋白芯片检测β-L的检测平台,并对此平台的检测条件进行了优化与确定。本研究对蛋白芯片检测β-L检测平台的检测性能进行综合评价,研究中所使用的芯片扫描仪(LuxScanTM10K Microarray Scanner)含有双激光发射器,采用了包括光学、信号处理和运动控制系统在内的10余项独特技术,是进行高、中、低密度微阵列芯片检测与分析的必备工具。芯片扫描仪采用532 nm和635 nm两种激发波长,配合专业设计的信号采集与处理电路,从而使得该仪器具有良好的线性动态范围和极高的检测灵敏度。在本研究中芯片扫描仪充分发挥了技术优势,为获得最终的评价结果提供了有力的技术支持。
检测性能评价包括精密度评价,即批内精密度与批间精密度;准确度评价,即稀释回收率、加标回收率和方法学对照。这些指标分别可以从不同角度对所建立的检测平台的实用性能进行性能检验。关于批间精密度实验的天数,不同的文献有不同的报道[9-12]。本研究选择检测4 d,每日2个批次的实验方式主要取决于本实验室对同一样品的重复验证≤4 d或8次,因此本研究中所选择的实验天数与次数能够满足对批间精密度的评价要求。在本平台进入生产阶段时,将按照生产要求对精密度时间与次数重新进行评价。此外,本平台的批内变异系数均<18%,批间变异系数均<30%,这主要与实验操作人员的熟练程度有关。本检测平台虽然在点制抗体与扫描阶段都已实现一致性高的机械化操作,但在整个流程中仍存在多次手工操作的步骤,因此不熟练的手工操作是导致精密度偏高的主要原因。在后续的产品应用阶段中,如果提高操作人员熟练度,可以实现批间精密度低于20%的水平。目前,对于总精密度的认识还存在分歧,但按照苏敏等[13]对总精密度的计算方法,可以分析出本研究中不同批次间差异与不同天数之间的差异是引起总精密度不理想的主要原因。因此,在产品应用阶段,从提高操作人员熟练程度出发,充分做好操作人员的上岗前培训、尽量减少其操作偏倚,进而降低不同批次间与不同检测天次间的操作误差。
稀释回收率实验结果显示,回收率随着稀释次数的增多而减小,主要与连续稀释时的操作偏倚有关。在后续的产品阶段加强操作人员培训,或减少连续稀释次数,可以使这一结果得到提高。在加标回收率实验中,本研究参照吴树宏等[7]和伍云卿等[8]的方法,对3种浓度的基础液,分别加入基础液体积1%的高浓度标液(67150 ng/ml)。本研究结果表明,最高浓度的基础液回收效果不大理想。根据这一情况,在未来的产品应用阶段,应将待测样本按比例稀释在标准曲线的中、低浓度范围内,以便获得更为准确的检测结果。
对方法学对照实验的结果显示,本研究所建立的平台与目前在用的ELISA试剂盒之间具有较好的一致性。由于生物学检测实验无金标准,因此根据目前的实验结果无法判断哪种方法是更优。
4 结语
本研究提供了一种新的与ELISA试剂盒等效的检测方法,现有的实验结果表明,这一方法已经能够满足本实验室的检测需求。
[1]兰欣怡,王加启,卜登攀,等.牛奶β-乳球蛋白研究进展[J].中国畜牧兽医,2009(6):109-112.
[2]Tsabouri S,Douros K,Priftis KN.Cow's milk allergenicity[J].Endocr Metab Immune Disord Drug Targets,2014,14(1):16-26.
[3]贾敏,张亦凡,张银志,等.牛奶过敏原检测方法研究进展[J].食品工业科技,2015,36(12):385-389.
[4]张海英,刘旸,吴冬雪,等.食品中β-乳球蛋白过敏原检测方法的比较[J].食品安全质量检测学报,2012(4):295-299.
[5]Okada H,Kaji N,Tokeshi M,et al.Analysis of potent milk allergen using highly sensitive protein separation chip[J].Nanomed Nanotechnol Biol Medic,2007,3(4):351.
[6]马欣欣,殷继永,孙静,等.蛋白芯片检测牛乳β-乳球蛋白条件的优化研究[J].卫生研究,2017,46(1):101-106.
[7]吴树宏,周春华.加标回收率计算方法的探讨[J].环境研究与监测,2000(3):179-180.
[8]伍云卿,涂杰峰,范超,等.加标回收实验方案探讨[J].福建分析测试,2010(3):67-68.
[9]陈保民,陈维娜.酶联免疫吸附实验全自动检测的控制[J].职业与健康,2002,18(5):46-47.
[10]蒋理,徐建,杨瑞霞.散射比浊法测定血清铁蛋白的方法学评价[J].放射免疫学杂志,2008,21(2):182-183.
[11]Cook JD,Flowers CH,Skikne BS.The quantitative assessment of body iron[J].Blood,2003,101(9):3359-3364.
[12]Erhardt JG,Estes JE,Pfeiffer CM,et al.Combined measurement of ferritin,soluble transferrin receptor,retinol binding protein,and C-reactive protein by an inexpensive,sensitive,and simple sandwich Enzyme-linked immunosorbent assay technique[J].J Nutr,2004,134(11):3127-3132.
[13]苏敏,沙玲,台虹.STAGO-STA型全自动血凝仪APTT测定总精密度评价[J].中国医学检验杂志,2001,2(5):348-350.
A methodology evaluation of detecting β-lactoglobulin by using proteinchip
YIN Ji-yong,HUO Jun-sheng, MA Xin-xin, et al
Objective:To evaluate the platform of proteinchip that established in the earlier stage of our study and was used to detect β-lactoglobulin in cow milk.Methods:Triplet cow milk samples were used to implement within-run precision of 8 repeats and other triplet cow milk samples were used to implement between-run precision of 8 batches. The high concentration standard was consecutively diluted so as to obtain dilution recovery. Three concentrations of standard substance were used to implement recovery experiment. And 10 cow milk samples were detected by proteinchip platform and commercial ELISA Kit, respectively.Results:The within-run precision and betweenrun precision were 11.18%-17.62% and 25.10%-29.96%, respectively. The dilution recovery and recovery were 104.27%-128.15% and 45.98%-129.33%, respectively. The relevant coefficient of the two detection methods was 0.958 and it was significant (t=9.46, P<0.05), and the result of paired t test showed that there was no difference between the two methods (t=-2.592, P>0.01).Conclusion:The platform of proteinchip for detecting β-Lactoglobulin in cow milk which was established in earlier stage of our research can satisfy the requirement of laboratory of prophylactic medicine, while its operation error need be further optimized.
Proteinchip; β-Lactoglobulin; Detection platform; Evaluation
National Institute for Nutrition and Health, Chinese Center for Disease Control and Prevention, Beijing 100050, China.
1672-8270(2017)11-0143-04
R446.62
A
10.3969/J.ISSN.1672-8270.2017.11.042

殷继永,男,(1975- ),博士,副研究员。中国疾病预防控制中心营养与健康所,研究方向:营养与食品卫生学研究。
中国疾病预防控制中心青年科研基金(2015A202)“蛋白质芯片技术定量检测牛乳中主要蛋白质的检测平台的建立”
①中国疾病预防控制中心营养与健康所 北京 100050
*通讯作者:jshuo@263.net.cn
China Medical Equipment,2017,14(11):143-146.
2017-10-19
