迎春花高效再生体系的建立
2017-12-01桂林医学院广西桂林54004桂林师范高等专科学校化学与药学系广西桂林5400
, , (.桂林医学院, 广西 桂林 54004; .桂林师范高等专科学校化学与药学系, 广西 桂林 5400)
迎春花高效再生体系的建立
杨冬业1,张丽珍2,罗美亿2
(1.桂林医学院, 广西 桂林 541004; 2.桂林师范高等专科学校化学与药学系, 广西 桂林 541001)
以迎春花作为材料,MS作为基础培养基,附加不同浓度的6-BA、IBA、NAA进行组合,研究不同处理对迎春花再生的影响。结果表明:迎春花最佳初代诱导培养基为MS+6-BA 0.75~1.00 mg/L+IBA 0.02~0.10 mg/L,诱导率为100%;最佳增殖培养基为MS+6-BA 0.5 mg/L+IBA 0.05 mg/L,增殖系数为3.73;最佳不定根诱导培养基为1/2 MS+IBA 0.5 mg/L+NAA 0.2 mg/L,在此培养基中,诱导的不定根粗且长,多根毛,多侧根,容易移栽。
迎春花; 组织培养; 再生
迎春花(JasminumnudiflorumLindl),属木犀科素馨属植物[1],别名小黄花、金腰带、黄梅、清明花。因其在百花之中开花最早,花后即迎来百花齐放的春天而得名。《中药大辞典》记载迎春花的枝、叶含丁香甙、迎春花苷和迎春花苦味质,主治发热头痛、小便热痛等病症[2]。目前对迎春花的研究主要集中在活性成分提取[3-6]和药理学活性研究,其结果表明,迎春花具有抗菌[7]、消炎[8]、提高免疫力[9]、抗心律失常[10]、镇静[11]和抗氧化作用[12]。对迎春花栽培育种研究较少,特别是建立无性再生繁殖体系鲜有报道。本研究应用组织培养手段,建立迎春花的无菌再生体系,对迎春花的繁殖育种和工厂化育苗具有重要意义。
1 材料与方法
1.1 材 料
城市绿化栽培的迎春花(JasminumnudiflorumLindl)枝条。
1.2 方 法
1.2.1 外植体的清洗消毒
取生长健壮的无病迎春花枝条作为外植体,设计8种清洗方式(详见表1)。
表1 外植体的清洗方式

外植体清洗方式消毒程序带腋芽茎段1洗洁精水擦洗,清水擦洗1遍,放到烧杯中用清水冲15min2洗洁精水擦洗,清水擦洗2遍,放到烧杯中用清水冲15min3洗洁精水擦洗,清水擦洗1遍,放到烧杯中用清水冲30min4洗洁精水擦洗,清水擦洗2遍,放到烧杯中用清水冲30min5洗洁精水擦洗,清水擦洗1遍,放到烧杯中用清水冲1h6洗洁精水擦洗,清水擦洗2遍,放到烧杯中用清水冲1h7洗洁精水擦洗,清水擦洗1遍,放到烧杯中用清水冲1.5h8洗洁精水擦洗,清水擦洗2遍,放到烧杯中用清水冲1.5h
对清洗干净的外植体设计4种消毒方式(详见表2)。
表2 外植体的消毒方式

外植体消毒方式消毒程序带腋芽茎段10.1%升汞溶液浸泡5min,并不断搅动,无菌水漂洗5次,用无菌滤纸吸干表面水分进行接种。20.1%升汞溶液浸泡8min,并不断搅动,无菌水漂洗5次,用无菌滤纸吸干表面水分进行接种。30.1%升汞溶液浸泡11min,并不断搅动,无菌水漂洗5次,用无菌滤纸吸干表面水分进行接种。40.1%升汞溶液浸泡15min,并不断搅动,无菌水漂洗5次,用无菌滤纸吸干表面水分进行接种。
表5 不同激素配比对迎春花不定芽诱导的影响
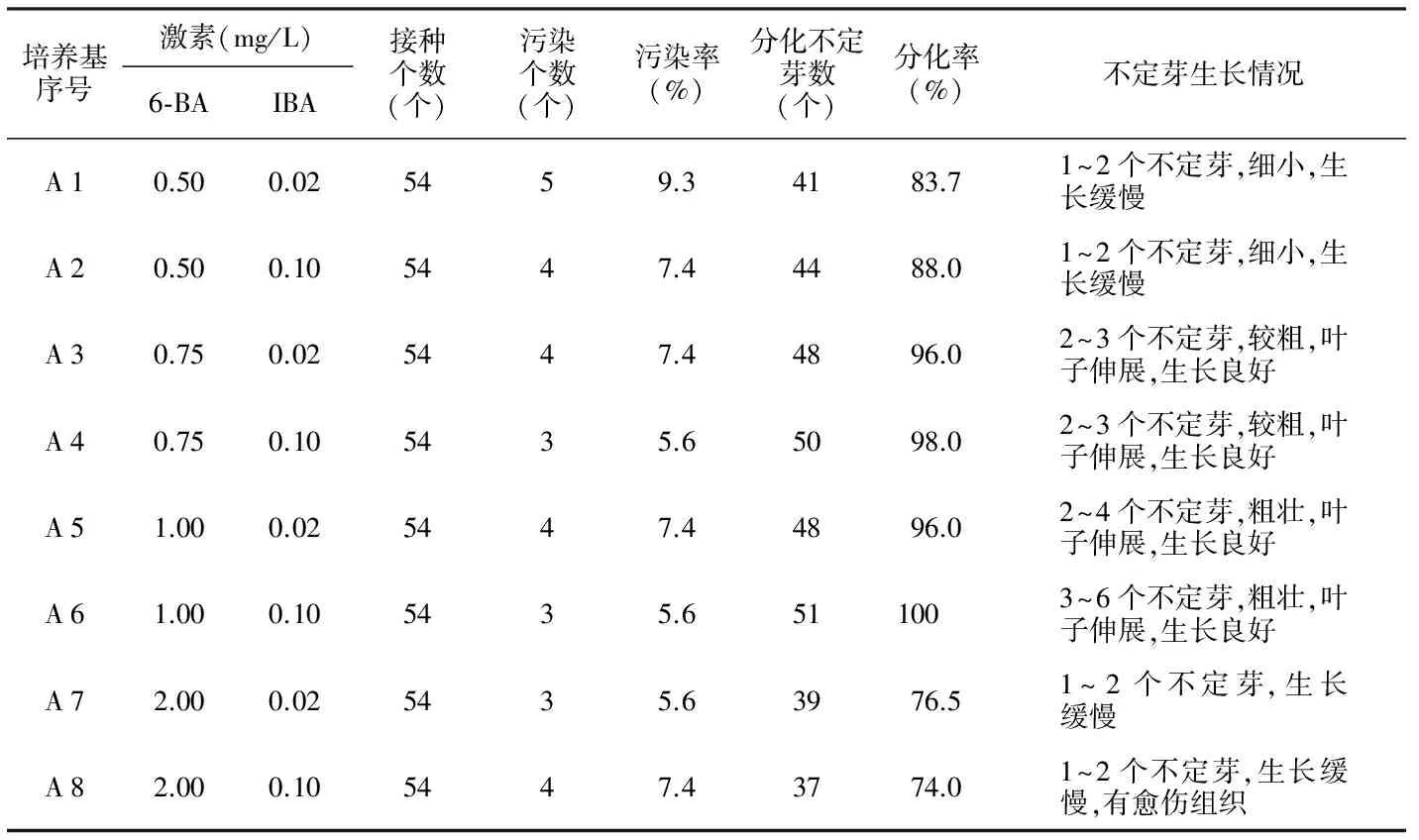
培养基序号激素(mg/L)6⁃BAIBA接种个数(个)污染个数(个)污染率(%)分化不定芽数(个)分化率(%)不定芽生长情况A10.500.025459.34183.71~2个不定芽,细小,生长缓慢A20.500.105447.44488.01~2个不定芽,细小,生长缓慢A30.750.025447.44896.02~3个不定芽,较粗,叶子伸展,生长良好A40.750.105435.65098.02~3个不定芽,较粗,叶子伸展,生长良好A51.000.025447.44896.02~4个不定芽,粗壮,叶子伸展,生长良好A61.000.105435.6511003~6个不定芽,粗壮,叶子伸展,生长良好A72.000.025435.63976.51~2个不定芽,生长缓慢A82.000.105447.43774.01~2个不定芽,生长缓慢,有愈伤组织
1.2.2 丛生芽的诱导
在超净工作台中,将已消毒好的带腋芽茎段外植体用解剖刀把枝条切成1~2 cm长的茎段,接种于诱导培养基上培养。整个接种过程均在酒精灯外焰上这一无菌环境中严格按照接种要求进行操作。定期进行观察统计。
1.2.3 继代增殖培养
当丛生芽长至1~2 cm后,从外植体上切割下来接入继代增殖培养基中培养,接种后观察激素的种类、浓度及不同组合变化对丛生芽诱导的影响。
1.2.4 生根培养
从把继代增殖培养好的组培苗中选出健壮植株截取2~4 cm,转接到1/2 MS基础培养基上,附加不同种类、不同浓度的生长素。20 d后观察统计诱导生根情况。
1.2.5 培养条件
以MS培养基为基本培养基,附加不同浓度的6-BA、IBA和NAA等生长调节剂配成固体培养基,蔗糖浓度为3%,琼脂用量为0.7%,pH值为5.8~6.0。培养温度(25±1)℃,每天光照14 h,光照强度2 000 lx。
2 结果与分析
2.1 外植体最佳清洗方式的选择
本试验从室外采集外植体后,在超净工作台外用洗洁精水进行预消毒,其外植体的污染率见表3。
从表3可以看出,在超净工作台外用洗洁精水进行预消毒的最佳方式是6和8,其污染率小至10%,方式6与8对比,方式8用清水冲的时间较长,浪费时间又浪费水资源,所以在初代阶段,为了节省时间、节省水资源,降低外植体的污染率,在迎春花的初代培养阶段超净工作台外首选的消毒方式为6:先用洗洁精水侵泡擦洗外植体,再用清水擦洗2遍,放到烧杯中用清水冲1 h。
2.2 外植体最佳消毒方式的选择
外植体经超净工作台外清洗后,再转移到超净工作台内用不同组合的消毒剂进行消毒,其外植体的污染率见表4。
从表4可以看出,超净工作台外消毒后,在超净工作台内的最佳消毒方式是3和4,其污染率小至10%,方式3与4对比,方式4用升汞溶液浸泡的时间较长,所以在迎春花的初代阶段超净工作台内消毒应选择方式3。
表3 不同清洗方式外植体的污染情况

消毒方式接种个数(个)污染个数(个)污染率(%)1502448250214235015304501326550918650510750918850510
表4 不同消毒方式对外植体的影响

消毒方式接种个数(个)污染个数(个)污染率(%)15022442501122350510450510
2.3 迎春花不定芽的诱导
以迎春花茎段为外植体建立体外繁殖再生系统,实验结果表明,以茎段为外植体消毒容易,污染率低,容易再生,低浓度的6-BA和IBA组合均能诱导出不定芽,而且生长良好(见表5)。
从表5可看出,不同浓度激素配比对存活率影响不大,但对分化率却有很大的影响。不同浓度的激素配比对迎春花外植体的启动、分化反应不同,丛生芽形成数量及生长状况差异较大。从8组实验数据可看出,微量的外源激素可诱导迎春花丛生芽的发生及生长,当细胞分裂素6-BA为0.50 mg/L时,诱导率达到83.7%以上;当细胞分裂素6-BA为0.75 mg/L时,诱导率达到96%以上;当细胞分裂素6-BA为1.00 mg/L时,诱导率高达100%。但当细胞分裂素6-BA为2.00 mg/L时,诱导率反而下降,说明细胞分裂素6-BA对迎春花丛生芽的诱导影响很大,低浓度的细胞分裂素IBA可启动迎春花丛生芽的发生,但高浓度的细胞分裂素6-BA却抑制了迎春花丛生芽的分化。因此,迎春花最佳初代诱导培养基为MS+6-BA 0.75~1.00 mg/L+IBA0.02~0.10 mg/L。
表6 不同激素配比对迎春花继代增殖的影响
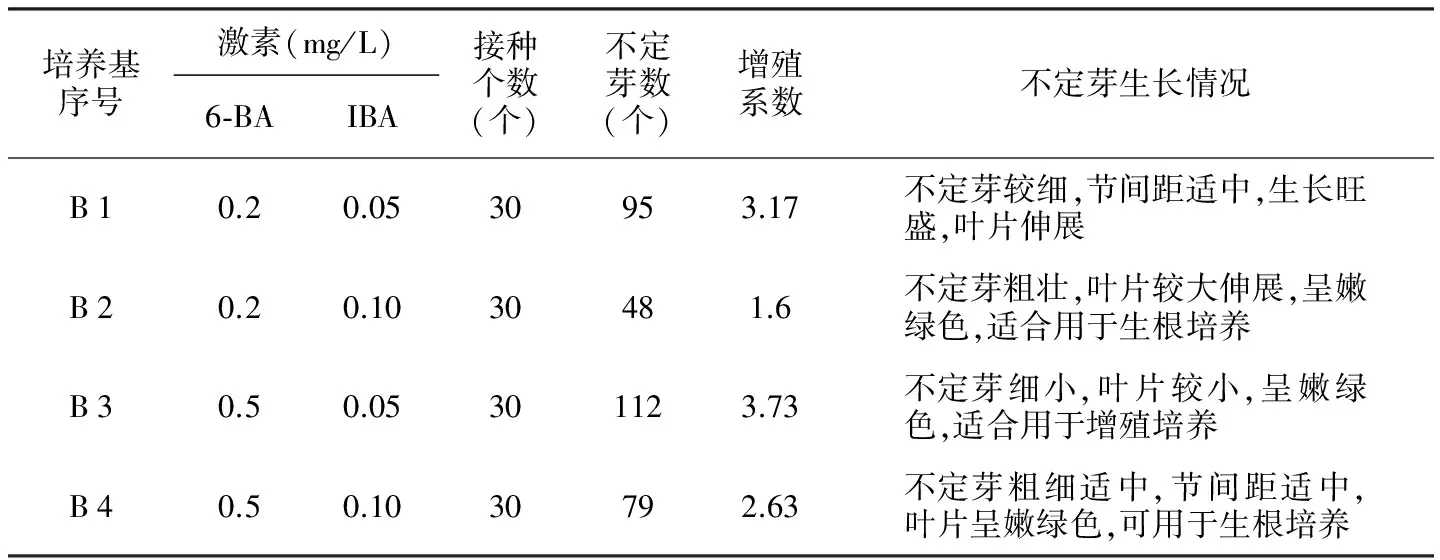
培养基序号激素(mg/L)6⁃BAIBA接种个数(个)不定芽数(个)增殖系数不定芽生长情况B10.20.0530953.17不定芽较细,节间距适中,生长旺盛,叶片伸展B20.20.1030481.6不定芽粗壮,叶片较大伸展,呈嫩绿色,适合用于生根培养B30.50.05301123.73不定芽细小,叶片较小,呈嫩绿色,适合用于增殖培养B40.50.1030792.63不定芽粗细适中,节间距适中,叶片呈嫩绿色,可用于生根培养
注:增殖系数=不定芽数/接种个数。
表7 不同浓度激素对迎春花不定根诱导的影响
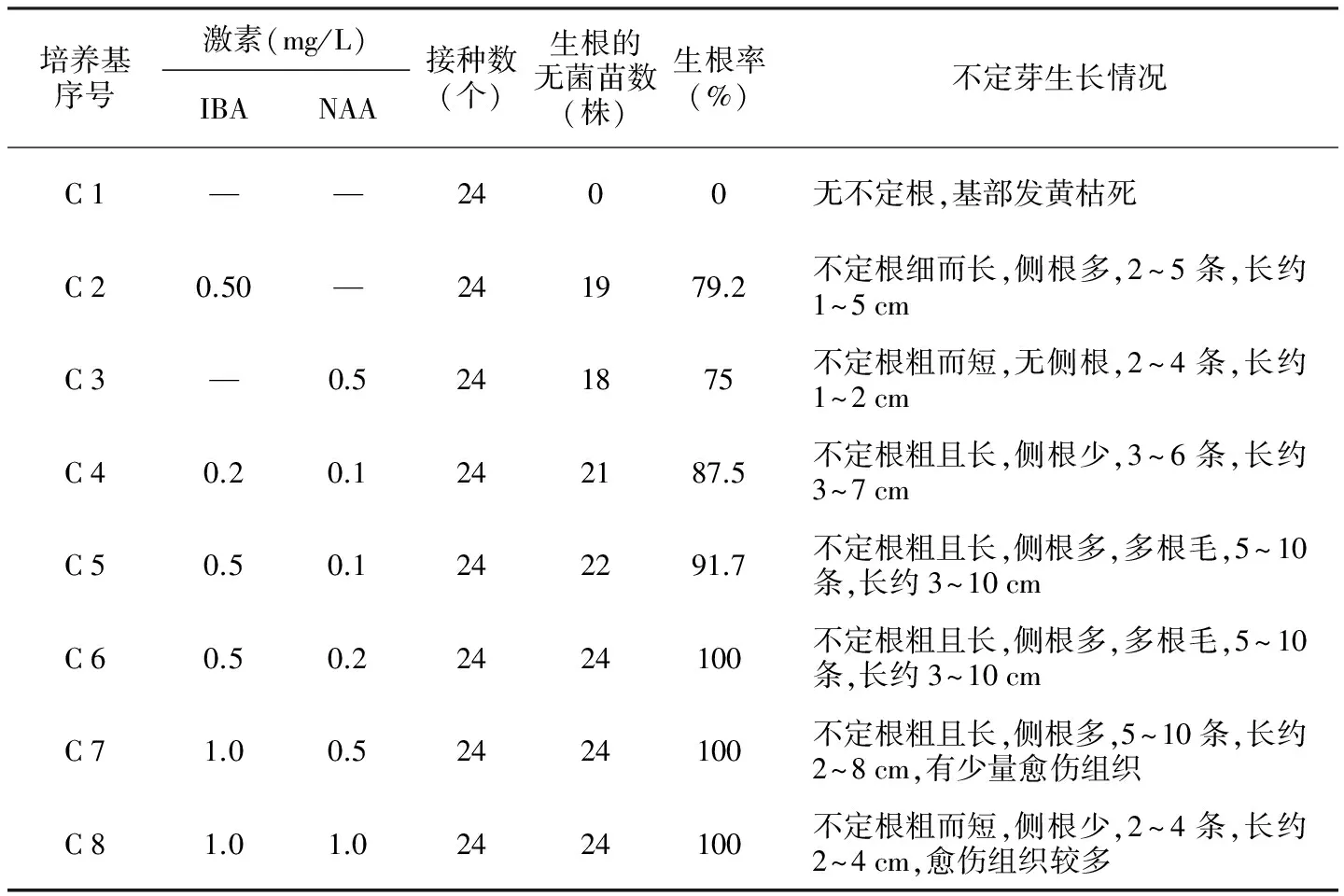
培养基序号激素(mg/L)IBANAA接种数(个)生根的无菌苗数(株)生根率(%)不定芽生长情况C1——2400无不定根,基部发黄枯死C20.50—241979.2不定根细而长,侧根多,2~5条,长约1~5cmC3—0.5241875不定根粗而短,无侧根,2~4条,长约1~2cmC40.20.1242187.5不定根粗且长,侧根少,3~6条,长约3~7cmC50.50.1242291.7不定根粗且长,侧根多,多根毛,5~10条,长约3~10cmC60.50.22424100不定根粗且长,侧根多,多根毛,5~10条,长约3~10cmC71.00.52424100不定根粗且长,侧根多,5~10条,长约2~8cm,有少量愈伤组织C81.01.02424100不定根粗而短,侧根少,2~4条,长约2~4cm,愈伤组织较多
2.4 迎春花继代培养阶段
当初代培养的迎春花诱导的不定芽长至1~2 cm 时,可转接至继代增殖培养基中进行扩大繁殖培养。7 d后均见其有明显生长,培养2周后观察生长情况(见表6)。
实验结果表明,将迎春花初代培养阶段诱导培养的丛生芽转接到不同的继代增殖培养基中培养,不同浓度的细胞分裂素与生长素配比对继代增殖影响效果不同。从整体来看,细胞分裂素与生长素比值越大,增殖系数越高,比值越小,增殖系数越低。从整体上看,不定芽增加的倍数都不大,经过多次继代培养以后,增殖系数有所提高。从表6的4组实验数据可知,当培养基为MS+6-BA 0.2 mg/L+IBA 0.1 mg/L时,不定芽粗壮,叶片较大伸展,呈嫩绿色,适合用于生根培养;当培养基为MS+6-BA 0.5 mg/L+IBA 0.05 mg/L时,增殖系数较高,适合用于增殖培养;当培养基为MS+6-BA 0.5 mg/L+IBA 0.1 mg/L时,不定芽粗细适中,节间距适中,叶片呈嫩绿色,可用于生根培养,亦可用于增殖培养。
2.5 生长素对迎春花不定根诱导的影响
当不定芽长至2~4 cm时,转接到1/2 MS基本培养基上,附加不同种类、不同浓度的生长素。7 d后观察到少数植株露白,15 d后不定根长至1~2 cm。
从表7可看出,生长素对不定根的诱导影响较大,缺乏生长素,迎春花不定根不生长,微量的吲哚丁酸(IBA)和奈乙酸(NAA)均能诱导迎春花不定根生长,但其效果明显不同。IBA诱导的不定根又细又长,而NAA诱导的不定根比较粗短;IBA和NAA配合使用,在较低浓度下可以使不定根诱导率达到100%,而且侧根多,根毛多,适合移栽;当生长素浓度为1 mg/L时,在植株基部产生大量愈伤组织,不利于移栽。因此最适合迎春花不定根诱导的培养基为:1/2 MS+IBA 0.5 mg/L+NAA 0.2 mg/L。
3 小 结
1) 在超净工作台外最佳清洁方式的选择阶段是先用洗洁精水浸泡擦洗外植体1遍,再用清水擦洗2遍,然后放到烧杯中用清水冲1 h。这样不仅可以适当的节省时间、节约水资源,又可以把外植体的污染率降到最低。

注:A为外植体诱导;B为继代增殖培养;C为壮苗培养;D为生根诱导培养。迎春花再生体系的建立图
2) 最佳消毒方式是用0.1%升汞溶液浸泡11 min,并不断搅动,无菌水漂洗5次,用无菌滤纸吸干表面水分后进行初代培养。
3) 迎春花初代培养阶段,以MS为基本培养基,附加0.75~1.00 mg/L的6-BA和0.02~0.10 mg/L的IBA可以有效的促进迎春花不定芽的启动与分化。
4) 在迎春花继代培养阶段,当培养基为MS+6-BA 0.2 mg/L+IBA 0.1 mg/L时,不定芽粗壮,叶片较大伸展,呈嫩绿色,适合用于生根培养;当培养基为MS+6-BA 0.5 mg/L+IBA 0.05 mg/L时,增殖系数较高,适合用于增殖培养;当培养基为MS+6-BA 0.5 mg/L+IBA 0.1 mg/L时,不定芽粗细适中,节间距适中,叶片呈嫩绿色,可用于生根培养,亦可用于增殖培养。
5) 最适合迎春花不定根诱导的培养基为1/2 MS+IBA 0.5 mg/L+NAA 0.2 mg/L。在此培养基中,诱导的不定根粗且长,多根毛,侧根多,容易移栽。
[1]李祖任,彭琼,吉志超,等.重瓣野迎春花部维管束系统的解剖学观察[J].湖南农业科学,2016(5):5-7.
[2]江苏新医学院.中药大辞典[M].上海:人民卫生出版社,1975:1 156-1 157.
[3]侯蓓,赵成爱,韩璐,等.迎春花总黄酮的生物活性研究[J].食品工业科技,2015,36(9):353-357.
[4]回瑞华,侯冬岩,李铁纯,等.迎春花黄酮类化合物抗氧化性的研究[J].鞍山师范学院学报,2007,9(6):18-21.
[5]赵惠芝,啜惠民,周永国,等.迎春花黄色素的提取及其稳定性[J].河北科技师范学院学报,2004,18(3):32-36.
[6]张建立,李公春.迎春花黄色素稳定性研究[J].湖北农业科学,2013,52(7):1 625-1 627.
[7]卢成瑛,杨伟波,黄早成,等.迎春花叶抑菌活性物研究[J].食品科学,2007,28(12):44-46.
[8]高天鹏,索栋,王一峰,等.迎春花水提物抗炎活性研究[J].中兽医医药杂志,2009,28(3):32-33.
[9]陆辉,朱善元,郁杰,等.迎春花水提物对小白鼠免疫功能的影响[J].南京晓庄学院学报,2008(6):119-211.
[10]黄贤华,胡晓,潘火英,等.迎春花提取物抗心律失常作用[J].中药药理与临床,2006,22(6):47-49.
[11]杨晓宁,黄贤华,曾靖,等.迎春花提取物的镇痛镇静作用[J].中国临床康复,2006,10(35):42-44.
[12]唐琳.迎春花黄色素的提取和抗氧化活性研究[D].济南:山东师范大学,2006.
Study on Effective Regeneration System ofJasminumnudiflorumLindl
YANGDongye1,ZHANGLizhen2,LUOMeiyi2
2017-03-20
国家自然科学基金“青葙属植物锰富集性状差异及其与SRAP标记的关联分析”(41471270);广西高校科研项目“金银花快速繁殖与工厂化育苗综合技术研究”(2013 LX 078);桂林师范高等专科学校科研项目(XJKY 201409)。
杨冬业(1976—),男,广西昭平市人;硕士,讲师,主要从事细胞工程研究。
张丽珍(1979—),女,广西贵港人;博士研究生,副教授,主要从事植物细胞工程研究;E-mail:xiaozhang446@163.com。
10.16590/j.cnki.1001-4705.2017.10.076
S 567
A
1001-4705(2017)10-0076-04
