托吡酯对蛛网膜下腔出血后神经细胞凋亡影响及机制的实验研究
2017-12-01曹杰范成普杜杭根周冰之王承郝必烈
曹杰 范成普★ 杜杭根 周冰之 王承 郝必烈
·论著·
托吡酯对蛛网膜下腔出血后神经细胞凋亡影响及机制的实验研究
曹杰 范成普★ 杜杭根 周冰之 王承 郝必烈
目的从神经细胞凋亡角度探讨托吡酯(TPM)对实验性大鼠蛛网膜下腔出血(SAH)后早期脑损伤(EBI)的神经保护作用,从而为临床应用提供理论依据。方法取140只健康雄性SD大鼠,随机分为5组,分别为假手术组(20只)、SAH模型组(30只)和SAH+TPM干预组(90只平均分为3组,术后2h分别予TPM 20mg/kg、40mg/kg及80mg/kg腹腔注射)。利用颈内动脉穿刺法制作蛛网膜下腔出血模型,对各组在制模后24h进行死亡率统计和神经行为学评分,采用干湿重法检测脑水肿指数,TUNEL/NeuN/DAPI/Merge荧光染色观察神经元细胞凋亡,Western blot法评估Caspase-3及Bcl-2、Bax凋亡相关蛋白表达情况。结果与假手术组比较,SAH模型组和各TPM干预组的死亡率和脑水肿指数上升,神经学评分降低。与SAH模型组比较,3个TPM干预组的神经学评分均上升,脑水肿指数均下降,差异有统计学意义(P<0.05)。大鼠SAH后24h,Caspase-3及Bcl-2、Bax凋亡相关蛋白表达增强,凋亡细胞增加。TPM干预后,Caspase-3和促凋亡蛋白Bax表达减少,抑制凋亡蛋白Bcl-2表达增加,凋亡细胞数目有所减少,且这种效应与剂量呈正相关。结论TPM可能通过抑制Caspase-3、Bax表达,促进Bcl-2表达,从而减轻SAH后神经元细胞继发性凋亡损伤,在神经功能保护方面具有积极作用。
托吡酯 蛛网膜下腔出血 早期脑损伤 细胞凋亡 凋亡相关蛋白
蛛网膜下腔出血(SAH)是指脑底部或脑表面的病变血管破裂,血液直接流入蛛网膜下腔引起的一种临床综合征,其死亡率高达50%,1/3的人预后不良[1]。SAH后早期脑损伤(EBI)是指SAH发病后72h内产生的颅脑损伤,减轻SAH后EBI对于改善患者预后具有重要意义,如在EBI期间联用扩张血管、改善微循环、平衡代谢和抗炎、抗氧化应激、抗血小板的药物,能有效防治再出血、血管痉挛及脑水肿等并发症,从而改善患者预后。托吡酯(TPM)除了抗癫痫作用,还具有显著的神经保护作用,已在缺血缺氧性脑损伤等研究中得到证实[2],但其在蛛网膜下腔出血后早期脑损伤治疗方面的应用还缺乏相关研究。
1 材料与方法
1.1 材料 健康的成年雄性SD大鼠140只,购于浙江中医药大学动物实验中心。术前置于空气过滤的环境,保持温湿度一致,自由获取食物和水。
1.2 方法 (1)分组:140只大鼠随机分为5组,分别为假手术组(20只)、SAH模型组(30只)和SAH+TPM干预组(90只平均分为3组,术后2h分别予TPM 20mg/kg、40mg/kg及80mg/kg腹腔注射)。(2)模型制作:颈内动脉穿刺法SD大鼠蛛网膜下腔出血模型[3]:取实验用SD大鼠,用1%戊巴比妥钠(50m/kg)腹腔注射麻醉后仰卧固定,右侧股动脉插管监测血压及动脉血气,术前及蛛网膜下腔出血后各抽取一次动脉血行血气分析。固定头部及四肢,颈前部备皮、消毒,取颈部正中切口,钝性分离暴露右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)结扎切断ECA和ICA之间的吻合支,将ECA结扎并切断拉直,使其与ICA成一直线。取3.0单股尼龙线50mm(3号渔线)将头端锐化,于线端18.5mm处作标记,将尼龙线从颈外动脉置入颈内动脉的颅内段,插入深度为18.5mm左右,当感觉有阻力时再前进3mm刺破血管,造成蛛网膜下腔出血,大约15s后迅速将尼龙线拔出,用丝线结扎颈外动脉残端,恢复血流,缝合颈部切口,术中维持肛温37℃。假手术组除了不刺破血管壁外,其余操作均与SAH模型组一致。麻醉未清醒前给予电热毯保暖,术后大鼠单笼饲养,注意保暖。(3)取脑固定方法:用2%戊巴比妥钠(0.12ml/50g)腹腔注射麻醉后,迅速开胸暴露心脏,灌注固定后取脑固定2~4h,分别置于15%和30%蔗糖梯度溶液中直至标本沉底。冰冻切片机作连续冠状切片,取海马和齿状回互包平面,片厚30μm。(4)给药方式:TPM干预组于制模后2h,予不同剂量TPM腹腔注射(20mg/kg、40mg/kg、80mg/kg),假手术组和SAH模型组在同等条件下注射等量生理盐水。
1.3 观察指标 (1)死亡率和行为学分析:制模后24h为评估时间点,统计大鼠死亡率,进行神经行为学评分[4],最低分3分,最高分18分。(2)脑组织水含量测定:各组大鼠制模后24h完成上述指标统计后断头取脑,采用干、湿重法,取伤侧大脑半球脑组织标本,电子天平称取湿重(温度20℃~25℃,湿度70%~90%),然后将标本置于(100±2)℃恒温干燥箱内24 h烘干至恒重,称取干重,脑组织含水量=(湿重-干重)/湿重×100%。(3)凋亡途径相关指标检测:采用TUNEL/NeuN/DAPI/Merge荧光染色观察神经元细胞凋亡,Western blot方法评估Caspase-3及Bcl-2、Bax凋亡相关蛋白表达情况。
1.4 统计学方法 采用SPSS 23.0统计软件。计量资料以(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 死亡率、神经行为学评分和脑组织水肿指数 假手术组的大鼠未发生死亡,SAH模型组和各TPM干预组之间的死亡率无显著差异。与假手术组比较,SAH能导致SAH模型组和各TPM干预组的神经学评分降低,脑水肿指数增高,随着TPM给药剂量的增加,神经学评分逐渐上升,脑水肿指数逐渐下降。与SAH模型组比较,经TPM治疗后,上述指标均有不同程度改善,差异有统计学意义(P<0.05);其中小剂量TPM减轻脑水肿作用不明显,中等剂量和高剂量TPM对脑水肿有明显的缓解作用,差异有统计学意义(P<0.05)。见表1。
表1 制模后24h各组大鼠死亡率、神经行为学评分和脑水肿指数(±s)
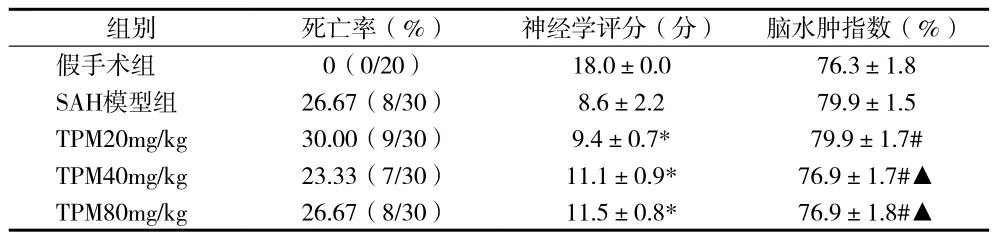
表1 制模后24h各组大鼠死亡率、神经行为学评分和脑水肿指数(±s)
注:与SAH模型组比,*P<0.05,#P<0.05;与TPM20mg/kg组脑水肿指数比较,▲P<0.05
组别死亡率(%)神经学评分(分)脑水肿指数(%)假手术组0(0/20)18.0±0.076.3±1.8 SAH模型组26.67(8/30)8.6±2.279.9±1.5 TPM20mg/kg30.00(9/30)9.4±0.7*79.9±1.7#TPM40mg/kg23.33(7/30)11.1±0.9*76.9±1.7#▲TPM80mg/kg26.67(8/30)11.5±0.8*76.9±1.8#▲
2.2 神经元细胞凋亡情况 与假手术组比较,SAH模型组和各TPM干预组中可观察到更高比例绿色标记的凋亡细胞,Caspase-3及Bcl-2、Bax凋亡相关蛋白表达增强。经TPM治疗后,绿色标记的凋亡细胞比例随着给药剂量增加而逐渐下降,Caspase-3和促凋亡蛋白Bax表达减少,抑制凋亡蛋白Bcl-2表达增加,且这种效应与剂量呈正相关。见图1、2。
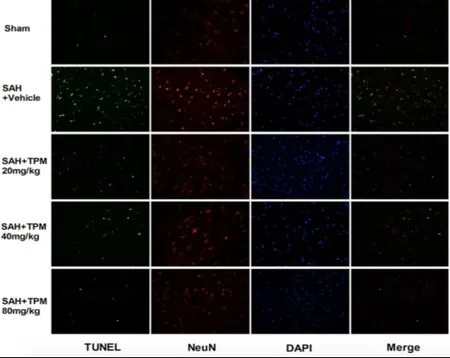
图1 各组大鼠大脑皮层TUNEL/NeuN/DAPI/Merge荧光染色的代表性显微照片
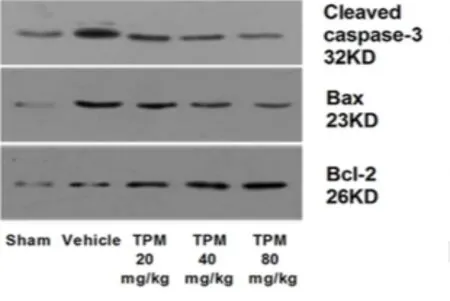
图2 各组大鼠Caspase-3和Bax 、Bcl-2表达情况
3 讨论
蛛网膜下腔出血是一种常见的神经系统疾病,其致死和致残的主要原因可能是早期脑损伤和脑血管痉挛[5]。近年来关于EBI的病理生理机制研究表明,SAH后发生的颅内压升高、脑血管痉挛、脑缺血—再灌注损伤、有氧呼吸抑制、血脑屏障破坏、脑组织水肿以及神经元死亡共同导致了继发性神经功能受损[5-6],这为SAH后EBI进程提供了多个可能的干预靶点。Park等[7]发现,SAH后血管内皮细胞的凋亡可以增加血脑屏障的通透性,进而导致脑血管痉挛。Xi G等研究表明氧化应激在蛛网膜下腔出血后早期脑损伤的发生中具有重要作用,可归因于血红蛋白的大量释放及铁离子超负荷[8]。氧化应激反应可引起大量炎症介质释放,包括IL-1β、IL-6、TNF-α、ICAM-1等,炎症级联反应可以激活经线粒体途径细胞凋亡通路的开放,多种细胞膜受体如TNFR、Fas、DR3-5由其相关配体激活,继而活化Caspase前体蛋白,诱导细胞凋亡的发生。多个研究中心都可以检测到SAH后线粒体途径的Caspase-3活化[9],所以抑制Caspase-3依赖的凋亡途径可能有助于减轻大鼠蛛网膜下腔出血后早期脑损伤。
TPM又称为妥泰,是近年来开发并用于临床的一种新型抗癫痫药,其化学结构为2,3,4,5-双氧-1-甲基亚乙基-β-右旋-氨基硫磺吡喃果糖,即自然态单糖右旋果糖的硫化物。TPM的神经保护作用机制可能与以下方面有关:(1)抑制Na+、Ca2+通道的过度活化,减轻线粒体内Ca2+内流,因为神经细胞损伤后Ca2+内流可引起线粒体膜通透性增强进而释放一些酶如细胞色素C等,引发一系列细胞凋亡的级联反应,导致细胞凋亡。(2)抑制KA/AMPA型谷氨酸受体的作用,降低谷氨酸的兴奋性毒性和氧化应激的损伤。(3)增强γ-氨基丁酸(GABA)系统介导的突触抑制作用,防止神经细胞过度反应。Alves等[10]通过微透析技术检查脑外伤病例发现,TPM可以通过血脑屏障,在脑组织达到相应浓度,降低脑组织Glu含量,并可作为一种神经营养因子,对膜蛋白复合体的磷酸化状态进行调节,抑制脑组织内Ca2+内流,从而影响谷氨酸、GABA及AMPA等受体介导的神经元凋亡。研究者利用成年大鼠创伤性脑损伤模型研究发现:运用TPM治疗可明显提高脑损伤后的神经功能评分,缩小梗死体积,且治疗结果与治疗剂量呈正相关[11]。但目前TPM在蛛网膜下腔出血后早期脑损伤治疗方面的应用尚缺乏相关研究。
本实验结果显示:SAH模型组大鼠的死亡率、脑水肿指数及凋亡细胞比例都明显高于假手术组,而神经学评分低于假手术组,经TPM干预治疗后,上述指标都有不同程度的改善。TPM还能下调Caspase-3相关凋亡蛋白表达,使促凋亡蛋白Bax表达减少而抑制凋亡蛋白Bcl-2表达增加,初步显示TPM具有潜在的减轻SAH后神经元细胞凋亡的作用,且这种效应随着给药剂量的加大而逐渐增强。然而,本研究尚存在诸多不足:(1)实验设计中缺乏阳性药物对照组,难以凸显TPM治疗EBI的临床价值及意义。(2)未观察到TPM剂量的上限效应,因此,更合适的干预剂量需要进一步研究。(3)只选取了SAH后24h为评估时间点,未考虑药物作用的时间效应关系。这些问题还有待进一步实验研究。
[1] Bahram Aminmansour, Abbas Ghorbani, Davood Sharifi, et al.Cerebral vasospasm following traumatic subarachnoid hemorrhage.Journal of Research in Medical Sciences the Official Journal of Isfahan University of Medical Sciences, 2009, 14(6):343-8.
[2] Shank RP, Maryanoff BE. Molecular Pharmacodynamics,Clinical Therapeutics, and Pharmacokinetics of Topiramate. Cns Neuroscience amp; Therapeutics, 2008, 14(2):120–142.
[3] Sehba FA. The Rat Endovascular Perforation Model of Subarachnoid Hemorrhage//Neurovascular Events After Subarachnoid Hemorrhage. Springer International Publishing,2015: 321-324.
[4] Jeon H, Ai J, Sabri M, et al. Neurological and neurobehavioral assessment of experimental subarachnoid hemorrhage. BMC Neuroscience, 2009, 10(1):103.
[5] Hasegawa Y, Suzuki H, Sozen T, et al. Apoptotic mechanisms for neuronal cells in early brain injury after subarachnoid hemorrhage.Acta Neurochirurgica Supplement, 2011, 110(Pt 1):43-48.
[6] Kolias AG,Sen J,Belli A.Pathogenesis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage:putative mechanisms and novel approaches.J Neurosci Res,2009, 87:1-11.[7] Park S, Yamaguchi M, Zhou C, et al. Neurovascular protection reduces early brain injury after subarachnoid hemorrhage. Stroke, a journal of cerebral circulation, 2004, 35(10):2412-7.
[8] Xi G, Keep RF, Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage. Lancet Neurol, 2006,5(1):53-63.
[9] Simard JM, Geng Z, Woo SK, et al. Glibenclamide reduces inflammation, vasogenic edema, and caspase-3 activation after subarachnoid hemorrhage. Journal of Cerebral Blood Flow amp;Metabolism Official Journal of the International Society of Cerebral Blood Flow amp; Metabolism, 2009, 29(2):317-30.
[10] Alves OL, Doyle AJ, Clausen T, et al. Evaluation of Topiramate Neuroprotective Effect in Severe TBI Using Microdialysis. Annals of the New York Academy of Sciences, 2003, 993(1):25-34.
[11] Liu Y, Barks JD, Xu G, et al.Topiramate extends the therapeutic window for hypothermia-mediated neuroprotection after stoke in neonatal rats. Stroke, 2004,35(6):1461-1465.
ObjectiveTo explore the neuroprotective effect of topiramate on brain injury in rats after experimental subarachnoid hemorrhage from the perspective of neuronal apoptosis,so as to provide theoretical basis for clinical application.MethodsForty healthy male SD rats were randomly divided into 5 groups:sham operation group(20 rats),SAH model group(30 rats)and SAH + TPM intervention group(90 rats were divided into 3 groups,2 hours after operation TPM 20mg/kg,40mg/kg and 80mg/kg intraperitoneal injection). The model of mortality and neurobehavioral scores were made in each group at 24 h after model establishment. The brain edema index was measured by dry and wet weight method.TUNEL/NeuN/DAPI/Merge fl uorescence staining were used to observe the apoptosis of neurons. The expression of Caspase-3,Bcl-2 and Bax-related proteins was evaluated by Western blot.ResultsCompared with the sham group,the mortality and brain edema index of the SAH model group and each TPM intervention group was increased and the neurological score was decreased. Compared with SAH model group,the neurological scores of the three TPM intervention groups was increased and the brain edema index was decreased,the differences were statistically signi fi cant(P<0.05).After 24 hours of SAH,the expression of Caspase-3,Bcl-2 and Bax was up-regulated and the number of apoptotic cells were increased. After TPM intervention,the expression of Caspase-3 and pro-apoptotic protein Bax was decreased,the expression of Bcl-2 and the number of apoptotic cells were decreased,and the effect was positively correlated with the dose.ConclusionsTPM may promote the expression of Bcl-2 by inhibiting the expression of Caspase-3 and Bax,thereby reducing the secondary apoptosis of neurons after SAH,and has a positive effect on neurological function protection.
Topiramate Subarachnoid hemorrhage Early brain injury Apoptosis Apoptosis-related proteins
浙江中医药大学校级科研基金资助项目(2015ZY20);浙江省教育厅一般科研项目资助项目(Y201636786)
310053 浙江中医药大学第二临床医学院(曹杰)310005 浙江中医药大学附属第二医院(范成普 杜杭根周冰之 王承 郝必烈)
*通信作者
