柑橘黄龙病对赣南脐橙果园土壤生物学性质的影响
2017-11-30管冠何天养朱婧姚锋先袁水秀
管冠+何天养+朱婧+姚锋先+袁水秀

摘要:通过平板计数法、比色法、Biolog Eco微平板分析法测定柑橘黄龙病(citrus huanglongbing,HLB)不同染病级别脐橙的土壤微生物种群数量、土壤酶活性及土壤微生物功能多样性。结果表明,与健康的晚棱脐橙相比,在感染黄龙病前期其土壤生物学性质的变化不大;在感染的中后期,由于根系在营养缺乏和病害的双重影响下逐渐坏死,根系生态系统遭到破坏,晚棱脐橙土壤的微生物数量、土壤酶活性及土壤微生物功能多样性均明显下降。
关键词:柑橘黄龙病;赣南脐橙;土壤;酶活性;微生物数量;微生物功能多样性
中图分类号: S436.661.1+9 文献标志码: A 文章编号:1002-1302(2017)20-0162-03
柑橘黄龙病是柑橘生产具有毁灭性的一种病害,堪称柑橘的癌症,一旦发病大多采用根除果树的办法防治,对产业发展发展危害极大[1]。由于黄龙病病原(韧皮部杆菌)的不可培养性,目前对于柑橘黄龙病的防治尚无特效药剂,也没有抗(耐)病品种可供应用[2]。黄龙病由木虱传播侵染,病树主要表现为叶片斑驳型黄化、均匀型黄化、缺素型黄化和“红鼻子”果等症状[3-4]。一般认为,黄龙病病害症状的产生往往是其细胞、组织或器官受到某种破坏而变质所致,同时也是叶片内部矿质营养元素供给失衡的外显[5]。有研究表明,在黄龙病的典型症状——叶片斑驳黄化之前,根系就已经被病菌入侵,从而导致根系养分吸收与输送功能受损并逐步丧失正常功能,使得根际土壤微生物的生存环境发生变化,威胁柑橘植株根系土壤的生态稳定,不利于土壤微生物的活动与土壤生物活性的维持[6-7]。
土壤生物学的研究表明,作为土壤生态系统的重要组成部分,土壤微生物直接参与土壤营养物质的矿化过程,在维持整个土壤生态系统能量流动和物质循环中发挥着关键作用[8]。而土壤微生物多样性则是指土壤微生物及其与环境形成的生态复合体以及与此相关的各种生态过程的总和,是果园土壤生态系统的重要组成部分,它代表着土壤微生物群落的稳定性[9]。与土壤理化性质相比,土壤微生物对于果树根系环境的变化更为敏感,同时在其利用碳源的代谢过程中所产生的各种代谢产物与果树根系分泌物一起参与果树对土壤养分的吸收利用[10]。活跃的土壤微生物活动是自然状态下培肥土壤的重要途径,并对土壤酶活性的增加具有积极影响,有助于维持果园土壤生态系统的稳定以及果树对土壤营养元素的吸收利用,同时也可以评估植物根系病害的状况。
本研究以感染柑橘黄龙病的晚熟脐橙品种晚棱为研究对象,以健康植株为对照,研究黄龙病侵染对晚熟脐橙果园土壤微生物数量、土壤酶活性及土壤微生物功能多样性的影响,以探究赣南脐橙果园土壤生物学性质对黄龙病的响应。
1 材料与方法
1.1 材料
材料为5年生晚棱脐橙叶片及果园土壤,试验地位于江西省赣州市信丰县嘉定镇,地理坐标为25°22′26 N,115°2′48 E,属中亚热带季风湿润气候,日照充足,降雨较多,年均日气温19.2 ℃,年均降水量1 500 mm。于2016年12月,在果园中随机选取各病情级别的病树3株,从不同方向采集有症状的叶片带回实验室待测。土壤带回实验室后在自然状况下风干,过2 mm筛保存待测。
1.2 黄龙病的分级
根据文献报道及经验将存活的黄龙病侵染的病树依病情分为5级[11-12]。0级:全树无病;1级:树上有1~2个梢有斑驳黄化叶出现;2级:树上部分侧枝或主枝有斑驳黄化症状,症状枝占全树的1/3及以下;3级:症状侧枝或主枝占全树的1/3以上和2/3以下;4级:癥状枝在2/3及以上。
1.3 分析方法
黄龙病的检测通过聚合酶链式反应(PCR)进行[3];土壤微生物数量测定:细菌数量采用牛肉膏蛋白胨培养基平板混菌法培养测定;真菌数量采用孟加拉红培养基平板混菌法培养测定;放线菌数量采用高氏l号培养基平板混菌法培养测定[13]。土壤酶活性的测定:磷酸酶活性采用PNPP法测定[14],脲酶活性采用苯酚钠比色法测定[14],蔗糖酶活性采用水杨酸比色法测定[15-16]。
土壤微生物群落功能多样性采用Biolog Eco微平板分析法测定,取10 g新鲜土壤加入100 mL灭菌的0.9% NaCl水溶液中,200 r/min振荡10 min,将其稀释至1 000倍后接种(150 μL),25 ℃下恒温培养7 d,每隔24 h用多功能酶标仪在590 nm波长下读数,计算获得平均颜色变化率(average well colourdevelopment,AWCD)[17]。
1.4 数据统计分析
试验测定数据采用Excel 2007进行整理,SigmaPlot 100作图,采用SAS 8.0统计分析软件进行方差分析。
2 结果与分析
2.1 黄龙病的分子检测
从晚棱脐橙叶片黄龙病病原菌PCR检测结果可以看出,未染病的0级健康树体叶片上没有扩增到目的条带,而1~4级存活的黄龙病晚棱脐橙树上所采集的斑驳黄化叶片均扩增得到 1 167 bp 的目的条带(图1)。结果表明,在试验果园中,所采的黄龙病树体从分子水平上可判定为已感染黄龙病病原菌,而所采无症状果树则尚未感染黄龙病病原菌。
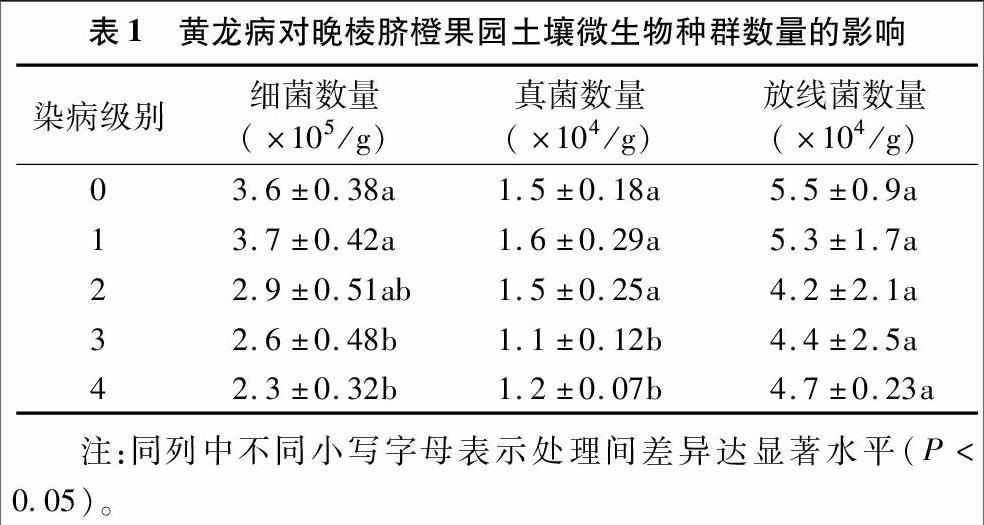
2.2 黄龙病对晚棱脐橙果园土壤微生物种群数量的影响
在本试验中,与健康的晚棱脐橙土壤的细菌数量相比,黄龙病侵染中后期的晚棱脐橙土壤细菌数量均出现不同程度的减少(表1)。如3级和4级病害的晚棱脐橙土壤的细菌数量与健康植株(0级病害)土壤相比,均显著减少;而1级病害的晚棱脐橙土壤细菌数量与健康植株则没有显著差别。晚棱脐橙果园土壤中的真菌数量在黄龙病感染后期下降明显,即在3级和4级染病果树土壤中真菌数量下降幅度明显;而在黄龙病感染前期(1级,2级),与健康植株土壤相比,其土壤真菌数量变化不大。土壤放线菌数量在黄龙病感染的整个过程中虽然有小幅减少,但从统计分析上看差异未达到显著水平。endprint
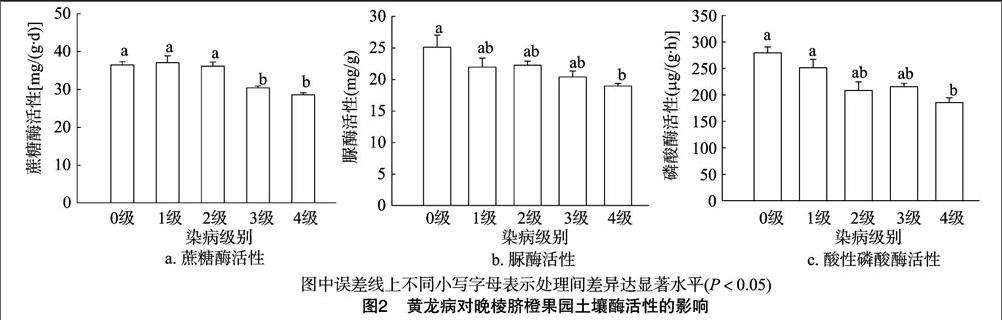
2.3 黄龙病对晚棱脐橙果园土壤酶活性的影响
在本试验中所采土壤为挂果期果园果树树冠滴水线内 0~20 cm表层土样。黄龙病对晚棱脐橙果园土壤酶活性的影响如图2所示。在本试验中,与健康晚棱脐橙(0级病害)相比,在黄龙病感染的后期,3级和4级染病果树的土壤蔗糖酶活性下降显著,而在黄龙病感染果树的前中期(1级、2级病害),土壤蔗糖酶活性并未发生显著变化(图2-a)。与土壤蔗糖酶活性类似,晚棱脐橙在黄龙病感染后,与健康植株相比,其土壤脲酶活性均发生了不同程度的下降。特别是在黄龙病感染后期,4级染病果树的土壤脲酶活性相比健康植株(0级病害)土壤显著下降(图2-b)。在黄龙病侵染晚棱脐橙后,土壤酸性磷酸酶活性发生了不同程度的下降,表现出与前2种酶类似的变化趋势(图2-c)。在黄龙病感染前期(1级病害)土壤酸性磷酸酶活性没有发生显著下降,而在黄龙病感染中后期,土壤酸性磷酸酶活性的下降幅度明显,其中4级病害晚棱脐橙的土壤酸性磷酸酶活性相比健康植株(0级病害)显著下降。
2.4 黄龙病对晚棱脐橙果园土壤微生物功能多样性的影响
平均颜色变化率(AWCD)反映了土壤微生物群落利用碳源的整体能力,能够表征土壤微生物群落的整体代谢活性[18]。黄龙病对晚棱脐橙果园土壤微生物功能多样性的影响如图3所示,随着培养时间的延续,各处理的AWCD值均呈“S”形逐渐增加,符合微生物的生长规律。在培养的0~24 h,不同染病级别的土壤AWCD值较低,土壤微生物对于碳源的利用较少,代谢活性低。在培养24 h之后,不同染病级别的土壤AWCD值呈指数增长,一方面反映了微生物数量的增加,另外一方面表明土壤微生物在24 h后的代谢活性显著提高。在培养后期(144~168 h),不同染病级别的土壤AWCD不再增加,表明土壤微生物活性趋于稳定。AWCD与土壤酶活性的表现类似,在本试验中,与健康晚棱脐橙(0级病害)相比,在黄龙病感染的后期(3级、4级染病果树)土壤的AWCD值下降明显,其中4级病害果树土壤的AWCD值最低。而黄龙病感染前期(1级、2级病害)的晚棱脐橙土壤的AWCD值则没有明显差异。
3 讨论
土壤微生物的生长需要利用土壤碳源,其代谢过程中释放的多种次生代谢产物与脐橙根系分泌物互作,会在土壤根系附近形成复杂且稳定的生态系统,而土壤生物学性质能够有效地反映根系土壤生态环境的变化[19]。虽然黄龙病病原菌本身并不会直接污染脐橙土壤,但由于黄龙病危害,脐橙植株营养元素的离子流会发生变化,以致植株根系营养的供给失衡[20]。大量报道表明,在黄龙病侵染脐橙后,叶片和茎中会出现淀粉累积,根部淀粉被耗尽,以致根系表皮逐渐脱落、腐烂,继而丧失其正常的生理功能[21-22]。同时,黄龙病病原菌的入侵导致根系功能逐步减弱,使得植物-土壤-微生物原有健康的根际生态遭到破坏。
有研究表明,黄龙病病原菌在根部的定殖早于叶、茎,但在染病前期叶、茎部分可检出的病原菌相对含量远大于根[23-24]。在本试验中,与健康脐橙相比,黄龙病感染初期土壤微生物数量没有显著变化,土壤细菌、真菌数量的显著下降表现在黄龙病感染后期,而土壤酶活性及土壤微生物功能多样性也呈现类似的特征。研究结果表明,在黄龙病感染脐橙初期,根系土壤生态环境并未立即遭到破坏。这可能是因为黄龙病病原菌主要寄生在韧皮部,早期被侵染的植物会自主地激活相应的防御体系如营养免疫等多种方式以抵抗病原菌的入侵,以保证根对土壤矿质离子的吸收过程照常进行[25]。而在黄龙病感染后期,胼胝质的积累堵塞了筛管运输系统导致矿质营养元素不能有效地运输到根系,同时根系黄龙病病原菌的含量增加,导致根系在营养缺乏和病害的双重影响下逐渐坏死,破坏原有的根系土壤生态环境。由于赖以生存的基础环境发生变化和破坏,原有生存在根系土壤周围的微生物数量开始减少,土壤微生物功能多样性也随之下降[26]。而几种参与营养元素循环的土壤酶(蔗糖酶、脲酶、酸性磷酸酶)本身与土壤微生物代谢关系密切[27],在本试验中呈现出与土壤微生物类似的变化特征也符合理论预期。
4 结论
晚棱脐橙感染黄龙病前期的土壤生物学性质未发生显著变化,而在感染的中后期,由于根系在营养缺乏和病害的双重影响下逐渐坏死,根系生态系统遭到破坏,土壤的微生物数量、土壤酶活性及土壤微生物功能多样性均明显下降。研究结果表明,当晚棱脐橙黄龙病症状侧枝或主枝占全树的1/3以上时,其土壤生物学性质显著下降。
参考文献:
[1]胡文召. 中国柑橘黄龙病病原及分化研究[D]. 重庆:西南大学,2010.
[2]Tyler H L,Roesch L F,Gowda S,et al. Confirmation of the sequence of ‘Candidatus Liberibacter asiaticus and assessment of microbial diversity in Huanglongbing-infected citrus phloem using a metagenomic approach[J]. Molecular Plant-Microbe Interactions,2009,22(12):1624-1634.
[3]蘇华楠. 中国柑橘黄龙病病原调查、种群遗传分化及其原噬菌体溶菌酶蛋白原核表达[D]. 重庆:西南大学,2013.
[4]许美容,陈燕玲,邓晓玲. 柑橘黄龙病症状与“Candidatus Liberibacter asiaticus”PCR检测结果的相关性分析[J]. 植物病理学报,2016,46(3):367-373.
[5]曹继容. 柑橘叶片离子组及其对黄龙病病原菌侵染的响应[D]. 重庆:西南大学,2014.
[6]Johnson E G,Wu J,Bright D B,et al. Association of‘Candidatus Liberibacter asiaticusroot infection,but not phloem plugging with root loss on huanglongbing-affected trees prior to appearance of foliar symptoms[J]. Plant Pathology,2014,63(2):290-298.endprint
[7]马晓芳. 柑橘木虱转录组分析及与柑橘黄龙病病原菌互作的初步研究[D]. 杭州:浙江大学,2014.
[8]贺纪正,王军涛. 土壤微生物群落构建理论与时空演变特征[J]. 生态学报,2015,35(20):6575-6583.
[9]林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报,2008,45(5):892-900.
[10]管 冠,姚锋先,刘桂东,等. 不同施肥年限对赣南脐橙果园土壤酶活性及微生物种群的影响[J]. 江苏农业科学,2016,44(2):382-385.
[11]胡文召. 中国柑橘黄龙病病原及分化研究[D]. 重庆:西南大学,2010.
[12]袁亦文,戈丽清,王德善,等. 柑橘黄龙病对柑橘产量和品质的影响[J]. 浙江农业科学,2007(1):87-88.
[13]Xu G H,Zheng H Y. Analytical handbook of Soil microbes[M]. Beijing:China Agriculture Press,1986.
[14]邱现奎,董元杰,万勇善,等. 不同施肥处理对土壤养分含量及土壤酶活性的影响[J]. 土壤,2010,42(2):249-255.
[15]Tabatabai M A. Soil enzymes[M]//Wearer R W,Augle J S,Bottomley P S. Methods of soil analysis. Part2. Microbiological and biochemical properties properties. Madison,Wis.:SSSA,1994:775-883.
[16]關松荫. 土壤酶及其研究方法[M]. 北京:农业出版社,1986.
[17]Xue D,Yao H Y,Ge D Y,et al. Soil microbial community structure in diverse land use systems:a comparative study using biolog,DGGE,and PLFA analyses[J]. PEDOSPHERE,2008,18(5):653-663.
[18]夏 昕,石 坤,黄欠如,等. 长期不同施肥条件下红壤性水稻土微生物群落结构的变化[J]. 土壤学报,2015(3):697-705.
[19]Guan G,Tu S X,Li H L,et al. Phosphorus fertilization modes affect crop yield,nutrient uptake,and soil biological properties in the rice-wheat cropping system[J]. Soil Science Society of America Journal,2013,77(1):166-172.
[20]高玉霞,卢占军,刘志芳,等. 柑橘黄龙病诊断方法的研究进展[J]. 赣南师范学院学报,2013,34(3):37-40.
[21]郭 恒. 基于碘-淀粉反应的柑橘黄龙病鉴定技术的研究[D]. 广州:华南农业大学,2009.
[22]陈国庆,鹿连明,杜丹超,等. 柑橘黄龙病防控技术研究进展[J]. 浙江柑桔,2012(3):20-27.
[23]黄爱军. 韧皮部杆菌亚洲种简单重复序列(SSR)多态性及其侵染甜橙后转录组学研究[D]. 重庆:西南大学,2014.
[24]孙丽琴. 携带黄龙病菌的柑桔木虱内生细菌菌群多样性分析及功能验证[D]. 重庆:重庆大学,2014.
[25]樊 晶. 柑橘宿主对黄龙病病原菌侵染的应答机制[D]. 重庆:重庆大学,2010.
[26]戴泽翰,许美容,邓晓玲. 感染黄龙病菌的柑橘叶片解剖学研究[C]//中国植物病理学会. 中国植物病理学会2015年学术年会论文集.北京:中囯农业出版社,2015.
[27]李南洁,曾清苹,何丙辉,等. 缙云山柑橘林土壤微生物磷脂脂肪酸(PLFAs)及酶活性的季节变化特征[J]. 环境科学,2017(1):309-317.endprint
