黄精多糖体外抗氧化作用及其对小鼠炎症性肠病的作用研究
2017-11-29薛学彬房树华汪华君
薛学彬++房树华++汪华君

[摘要] 目的 探討黄精多糖(PSP)体外抗氧化作用及其对小鼠炎症性肠病是否具有保护作用。 方法 体外抗氧化实验观察PSP对羟自由基(·OH)的产生、·OH对红细胞破坏作用及肝匀浆脂质产生是否具有抑制作用;建立小鼠炎症性肠病模型并给予PSP治疗,观察小鼠疾病活动度积分(DAI)评分,检测小鼠结肠组织中MDA、SOD、MPO,并应用Western blot对小鼠结肠组织中NF-κB蛋白表达进行测定。 结果 PSP在体外对·OH的产生及·OH对红细胞破坏具有抑制作用(P<0.01)、抑制肝匀浆脂质过氧化过程(P<0.01),且其体外抗氧化作用具有剂量依赖性(P<0.05~0.01);与模型组相比,PSP能降低DAI评分(P<0.01)、抑制结肠组织中MDA、MPO产生(P<0.05~0.01),增加SOD含量(P<0.05),并对NF-κB蛋白表达具有抑制作用(P<0.05)。 结论 黄精多糖具有体外抗氧化作用,其对小鼠炎症性肠病的抑制作用可能是抑制NF-κB通路,通过减少MDA、MPO产生和增加SOD含量实现的。
[关键词] 黄精多糖;炎症性肠病;体外抗氧化能力;NF-κB通路
[中图分类号] R285 [文献标识码] A [文章编号] 1673-9701(2017)29-0027-04
Study on the antioxidant effect in vitro of polygonatum sibiricum polysaccharides and its effect on inflammatory bowel disease in mice
XUE Xuebin1 FANG Shuhua2 WANG Huajun3
1.Department of Drug and Equipment, Zhenjiang Second Peoples Hospital in Jiangsu Province, Zhenjiang 212000, China; 2.Department of Pharmacy, Zhenjiang First Peoples Hospital in Jiangsu Province, Zhenjiang 212000, China; 3.Department of Pharmacy, the Affiliated Hospital of Jiangsu University, Zhenjiang 212001, China
[Abstract] Objective To investigate the anti-oxidative effects of polygonatum sibiricum polysaccharides(PSP) in vitro and its protective effect on inflammatory bowel disease in mice. Methods In vitro anti-oxidative experiment was carried out to observe the effect of PSP on the generation of hydroxyl radical(·OH), the effect of ·OH on the destruction of erythrocytes and whether lipid production of liver homogenate had inhibitory effect. The model of mice inflammatory bowel disease was established and was given PSP treatment. Mice disease activity score(DAI) was calculated, MDA, SOD and MPO in colonic tissue of mice were detected, and the expression of NF-κB protein in the colonic tissue of mice was determined. Results PSP showed inhibitory effect on the generation of ·OH in vitro and ·OH showed inhibitory effect on the destruction of erythrocytes(P<0.01), which inhibited liver homogenate lipid peroxidation process(P<0.01), and its in vitro anti-oxidant effect was dose-dependent(P<0.05-0.01). Compared with the model group, PSP can reduce the DAI score(P<0.01), inhibit the generation of MDA and MPO in colonic tissues(P<0.05-0.01), and increase the content of SOD(P<0.05). It also showed inhibitory effect on the NF-κB protein expression(P<0.05). Conclusion Polygonatum sibiricum polysaccharide has antioxidant effect in vitro. Its inhibitory effect on mice inflammatory bowel disease may be the inhibition pathway of NF-κB, which is achieved by reducing the MDA, MPO production and increasing the SOD content.endprint
[Key words] Polygonatum sibiricum polysaccharides (PSP); Inflammatory bowel disease; In vitro anti-oxidative ability; NF-κB pathway
近年来,炎症性肠病(inflammatory bowel disease,IBD)在我国发病率呈明显增高趋势。IBD是一种慢性非特异性炎症,可造成组织损伤和功能障碍[1]。目前,其发病机制尚未完全阐明。已有研究表明,活性氧(reactive oxygen species,ROS)在免疫和炎性反应通路中发挥了重要作用,其在IBD的发生发展中也发挥重要作用[2]。
黄精多糖(polygonatum sibiricum polysaccharide,PSP)是黄精的主要生物活性成分之一,系中药黄精中主要生物活性物质,具有调节免疫力、抗肿瘤、降脂降糖、改善学习记忆、抗炎抑菌等功效[3-5]。但黄精多糖对IBD的作用尚未见研究报道。
本实验拟考察黄精多糖体外抗氧化作用,建立小鼠IBD模型,观察黄精多糖干预后,小鼠结肠中丙二醛(MDA)、超氧化物歧化酶(SOD)、髓过氧化物酶(MPO)和核因子κB(NF-κB)的变化,探讨黄精多糖对IBD小鼠是否具有保护作用及其机制,为黄精多糖的药用价值开发与临床应用提供理论依据。
1 材料与方法
1.1 实验动物、试剂与药品
雄性昆明小鼠24只,SPF级,18~22 g(大连医科大学实验动物中心);黄精多糖(纯度≥90%,南京泽朗医药科技有限公司,批号:ZL20160315012);2,4-二硝基苯磺酸(dinitrobenzenesulfonic acid,DNBS,山东西亚化学工业有限公司,批号:A91321)BCA蛋白浓度测定试剂盒(增强型)(江苏碧云天生物技术研究所);丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);超氧化物歧化酶(SOD)(南京建成生物工程研究所);髓过氧化物酶(MPO)(南京建成生物工程研究所);β-actin一抗、NF-κB一抗、山羊抗兔IgG-HRP、山羊抗鼠 IgG-HRP、ECL化学发光检测试剂盒(武汉三鹰生物技术有限公司),其余试剂均为化学分析纯。
1.2 实验方法
1.2.1 黄精多糖体外抗氧化实验研究 参照文献[6-8],进行PSP体外抗氧化实验研究。分别采用邻二氮菲-Fe2+氧化法检测黄精多糖对羟自由基(·OH)产生的抑制作用(PSP浓度:20 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL);硫代巴比妥酸(TBA)法检测黄精多糖对家兔肝脏脂质过氧化物的抑制作用(PSP浓度:5.65 μg/mL、28.25 μg/mL、56.50 μg/mL、113.00 μg/mL)以及黄精多糖对羟自由基引发家兔红细胞膜破裂的抑制作用(PSP浓度:5.71 μg/mL、28.57 μg/mL、57.14 μg/mL、114.28 μg/mL)。
1.2.2 黄精多糖对IBD小鼠的作用研究
1.2.2.1 分组与模型制备 参照相关文献[9,10],将小鼠分为三组(空白对照组、模型组、PSP给药组),每组8只,小鼠禁食不禁水24 h后,5%水合氯醛,400 mg/kg,ip,小鼠麻醉后,3.5F导管从肛门插入肠道深约4.5 cm,模型组及PSP给药组灌注100 μL DNBS/乙醇溶液(含4 mg DNBS的50%乙醇溶液),空白对照组灌注100 μL50%乙醇溶液,倒立15 min,之后将小鼠放入笼中自然苏醒。1 h后,PSP给药组小鼠先给予PSP溶液2600 mg/kg灌胃,空白对照组和模型组给予等量生理盐水灌胃,之后,PSP或生理盐水连续灌胃7 d,每日1次。
1.2.2.2 小鼠疾病活动评估 疾病活动情况的评估观察小鼠进食、饮水、活动等一般情况,称量体重,观察粪便性状,参照Hamamoto标准,计算各组小鼠疾病活动度积分(disease activity index,DAI)。見表1。
表1 疾病活动度积分评分
注:*正常大便:软硬适度,成形大便;松散大便:糊状、半成形大便,但不粘附于肛门;稀便:黏附于肛门、稀水样便
1.2.2.3 结肠组织MDA、SOD、MPO的检测 最后一次给药前禁食不禁水18 h,第7天给药后1 h,将各组小鼠脱颈处死,打开腹腔,找到回盲部,自回盲肠后端1 cm向下取5~6 cm结肠,PBS冲洗内容物,液氮速冻,-80℃保存,备用。参照MDA、SOD、MPO检测试剂盒说明书,检测结肠组织中MDA、SOD、MPO含量。
1.2.2.4 结肠组织NF-κB蛋白表达的检测 取材方法同上,将结肠组织用Western及IP细胞裂解液后研磨,致组织样品完全裂解,12 000×g 离心15 min,取上清,BCA法测定蛋白浓度,加入2×loading buffer,100℃煮沸5 min变性,分装,-20℃保存。SDS-PAGE电泳,转至PVDF膜,NF-κB一抗(1∶1000)4℃封闭过夜。1∶1000二抗常温封闭2 h,ECL曝光显色。
1.3 统计学方法
各组实验数据应用SPSS 11.5进行统计分析,计量资料以(x±s)表示,采用One-way ANOVA法进行方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 PSP体外抗氧化作用研究
PSP体外抗氧化实验结果表明,PSP对·OH产生、·OH诱导家兔红细胞破裂以及家兔肝匀浆脂质过氧化均具有明显抑制作用(P<0.01),且具有剂量依赖性(P<0.05~0.01)(表2~4、图1)。endprint
2.2 小鼠疾病活动力评估
经7 d PSP给药后,记录各组小鼠体征,计算各组小鼠疾病活动度积分(disease activity index,DAI)并进行比较,可见经DNBS灌肠后,小鼠出现体重减轻,稀便、便血(便隐血)增多,DAI评分升高。与空白对照组DAI评分0分相比,模型组DAI评分[(3.29±0.70)分]明顯升高(P=0.0000),提示小鼠出现明显结肠炎症;与模型组相比,PSP给药组DAI评分[(1.57±0.90)分]显著降低(P=0.008),提示PSP对小鼠结肠炎症具有缓解作用。
2.3 各组小鼠结肠组织中MDA、SOD、MPO的测定
经7 d PSP给药后,取各组小鼠结肠组织,检测各组小鼠结肠组织中MDA、SOD和MPO含量,结果如表5所示,与空白对照组相比,模型组MDA、MPO明显增多(P<0.01),SOD含量明显减少(P<0.01);与DNBS组相比,PSP给药组MDA、MPO含量减少(P<0.05~0.01),SOD含量明显增多(P<0.05)。
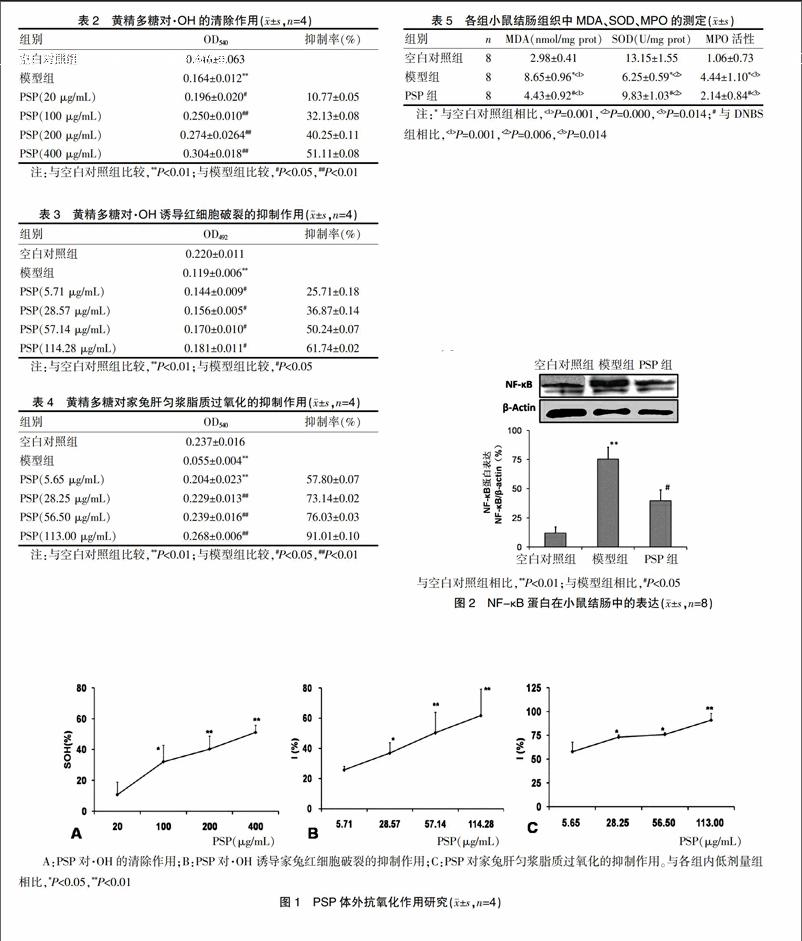
2.4 各组小鼠结肠组织中NF-κB蛋白含量测定
经7 d PSP给药后,取各组小鼠结肠组织,Western-blot检测小鼠结肠组织中NF-κB蛋白表达,结果如图2所示,与空白对照组[(12.09±5.31)%]相比,模型组NF-κB表达[(75.45±10.11)%]显著增多(P=0.005);与模型组相比,PSP给药组NF-κB表达显著减少(P=0.021)。
与空白对照组相比,**P<0.01;与模型组相比,#P<0.05
图2 NF-κB蛋白在小鼠结肠中的表达(x±s,n=8)
3 讨论
2,4-二硝基苯磺酸(dinitrobenzenesulfonic acid,DNBS)是一种半抗原物质,乙醇溶解肠黏膜表面的黏液,破坏肠黏膜屏障,使TNBS与肠道蛋白结合后成完全抗原,引起肠黏膜的免疫反应,诱发结肠炎的发生。其发病机制、病理特点及临床表现均与炎症性肠病相似,因此在对IBD治疗药物筛选与研究时,常用于动物模型的制备。
已有研究表明,氧化应激损伤与IBD动物模型和IBD患者发病及疾病严重程度具有明显相关性[11-15]。破坏结肠黏膜屏障功能、促进炎症介质释放、肠黏膜组织内免疫调节紊乱等,同时炎症介质的释放也会进一步加重氧化应激损伤。因此将具有抗氧化作用药物应用于IBD的治疗也是IBD药物治疗与研发的新途径与新热点。本实验第一部分研究结果表明,PSP在体外对·OH的产生及·OH对红细胞破坏具有抑制作用(P<0.01)、抑制肝匀浆脂质过氧化过程(P<0.01),且其体外抗氧化作用具有剂量依赖性(P<0.05~0.01),提示PSP在体外具有良好的抗氧化活性,为其应用于IBD的治疗提供理论支持与实验依据。
正常情况下机体内活性氧簇(ROS)的产生与抗氧化保护机制处于平衡状态。IBD患者肠黏膜层和黏膜下层中吞噬细胞大量增加,导致耗氧量增肌,引起黏膜细胞脂质过氧化损伤,同时生成具有更高活性的羟自由基(·OH),进一步破坏肠道黏膜组织[16]。丙二醛(MDA)是脂质过氧化反应的重要产物,能引起蛋白质、核酸等生命大分子的交联聚合而失去活性,同时具有细胞毒性,能使肠黏膜组织损害进一步加重。超氧化物歧化酶(SOD)是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质,其在体内水平的高低是机体抗氧化作用能力的重要体现。MDA与SOD是评价组织氧化损伤的重要指标,其含量反映了组织中过氧化损伤程度与抗氧化能力的高低。MPO是一种催化过氧化物还原的酶,是中性粒细胞和单核细胞氧依赖性杀菌系统的重要组分,同时也是氧化应激的一个主要标志物,可以催化产生次氯酸、酪氨酰基、硝基酪氨酸等氧化产物。MPO水平与中性粒细胞激活程度具有显著的相关性。MPO在结肠中的活性与组织中中性粒细胞浸润程度呈线性相关[17]。当细胞MPO水平升高时,可促进炎症效应细胞的增殖与活化,使效应细胞更易于穿越内皮屏障到达局部炎症组织,可进一歩导致结肠炎症的形成[18]。
本实验结果表明,与空白对照组相比,模型组结肠组织MDA、MPO显著增多(P<0.01),SOD含量显著下降(P<0.01),提示在小鼠IBD模型中,结肠组织出现了明显的氧化应激与炎症反应。与模型组相比,PSP给药组能降低DAI评分(P<0.01)、抑制结肠组织中MDA、MPO产生(P<0.05~0.01),增加SOD含量(P<0.05),提示PSP能缓解IBD结肠炎症反应,可能是通过降低结肠氧化应激损伤与炎症反应,提高结肠组织抗氧化能力实现的。
NF-κB是多条氧化应激与炎症信号通路中一个重要的汇聚点,是许多炎症介质在基因水平的重要转录调节因子。已有研究结果表明,在IBD动物模型和患者中,NF-κB可以调节与IBD相关的促炎性细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、IL-6及IL-12等的释放,加重肠道的炎性反应;提示NF-κB的激活在调节IBD的免疫及炎性反应中起着关键作用[19-20]。当结肠受到炎症或内毒素等刺激侵袭后,NF-κB被激活后从细胞质转位到细胞核,促进炎症介质MPO、TNF-α等的表达[21]。NF-κB与IBD的病变程度呈现明显相关性,因此寻找NF-κB抑制剂也成为治疗IBD的新热点。本实验结果表明,与模型组相比,PSP给药组对NF-κB蛋白表达具有抑制作用(P<0.05),提示PSP可能会通过NF-κB通路减少氧化应激损伤与结肠炎症反应。
综上所述,本实验研究发现黄精多糖具有体外抗氧化作用,其对小鼠炎症性肠病的抑制作用可能是通过抑制NF-κB通路,减少MDA、MPO产生,增加SOD含量,减少结肠氧化损伤,提高结肠抗氧化能力,减轻肠道炎症反应实现的。本实验的发现为黄精多糖药理作用的进一步开发与研究及未来临床应用提供理论支持。endprint
[參考文献]
[1] 武晓琳,赵亚楠,王丽波,等. 炎症性肠病相关信号通路的研究进展[J]. 国际消化病杂志,2016,36(2):105-107.
[2] Yang Y,Bazhin AV,Werner J,et al. Reactive oxygen species in the immune system[J]. Int Rev Immunol,2013, 32(3):249-270.
[3] 段华,王保,张跃文.黄精多糖对肝癌H22 移植瘤小鼠的抑瘤作用及机制研究[J]. 中药新药与临床药理研究, 2014,25(1):5-7.
[4] 李友元,邓洪波,张萍,等.黄精多糖降脂及抗动脉粥样硬化的实验研究[J]. 中国动脉硬化杂志,2005,13(4): 429-431.
[5] 雷升萍,王靓,龙子江,等. 黄精多糖通过TLR4-MyD88-NF-κB通路抑制缺氧/复氧H9C2心肌细胞炎性因子释放[J]. 中国药理学通报,2017,33(2):255-260.
[6] Jin M,Cai YX,Li JR,et al. 10-Phennanthroline-Fe2+ oxidative assay of hydroxyl radical produced by H2O2/Fe2+[J].Prog Biochem Biophys,1996,23(6):553-556.
[7] 周海玲,马麟,易智彪. 基于三种体外抗氧化方法对白木香种子抗氧化能力的研究[J]. 中国医药导报,2016, 13(22):12-15.
[8] Fonseca SF,Padilha NB,Thurow S,et al. Ultrasound-promoted copper-catalyzed synthesis of bis-arylselanyl chrysin derivatives with boosted antioxidant and anticancer activities[J]. Ultrason Sonochem,2017,39:827-836.
[9] Daniela Impellizzeri,Giuseppe Bruschetta,Rosanna Di Paola,et al. The anti-inflammatory and antioxidant effects of bergamot juice extract(BJe)in an experimental model of inflammatory bowel disease[J]. Clinical Nutrition,2015,34(6):1146-1154.
[10] Pallio G,Bitto A,Pizzino G,et al. Adenosine receptor stimulation by polydeoxyribonucleotide improves tissue repair and symptomology in experimental colitis[J]. Front Pharmacol,2016,(7):273.
[11] Tanida S,Mizoshita T,Mizushima T,et al. Involvement of oxidative stress and mucosal addressin cell adhesion molecule-1(MAdCAM-1)in inflammatory bowel disease[J].J Clin Biochem Nutr,2011,48(2):112-116.
[12] Pravda J. Radical induction theory of ulcerative colitis[J].World J Gastroenterol,2005,11(16):2371-2384.
[13] Pavlick KP,Laroux FS,Fuseler J,et al. Role of reactive metabolites of oxygen and nitrogen in inflammatory bowel disease[J]. Free Radic Biol Med,2002,33(3):311-322.
[14] Hatsugai M,Kurokawa MS,Kouro T,et al. Protein profiles of peripheral blood mononuclear cells are useful for differential diagnosis of ulcerative colitis and Crohns disease[J]. J Gastroenterol,2010,45(5):488-500.
[15] Cracowski JL,Bonaz B,Bessard G,et al. Increased urinary F2-isoprostanes in patients with Crohns disease[J]. Am J Gastroenterol,2002,97(7):99-103.
[16] Tuzun A,Erdil A,Inal V,et al. Oxidative stress and antioxidant capacity in patients with inflammatory bowel disease[J]. Clin Biochem,2002,35(7):569-572.
[17] 王皓,欧阳欽,胡仁伟. 二硝基苯磺酸结肠炎动物模型的建立[J]. 胃肠病学,2001,6(1):7-10.
[18] Michiels C,Minet E,Mottet D,et al. Regulation of gene expression by oxygen:NF-kappa B and HIF-1,two extremes[J]. Free RadicBiol Med,2002,33(9):1231-1242.
[19] Ghosh S,Hayden MS. New regulators of NF-kappaB in inflammation[J]. Nat Rev Immunol,2008,8(11):837-848.
[20] Wang K,Wan YJ. Nuclear receptors and inflammatory diseases[J]. ExP Biol Med(Maywood),2008,233(5):496-506.
[21] Wahli W. A gut feeling of the PXR,PPAR and NF-kappaB connection[J]. J Intern Med,2008,263(6):613-619.
(收稿日期:2017-08-31)endprint
