c-fos调控p16/CyclinD1信号途径并促进口腔鳞状细胞癌增殖和迁移
2017-11-29罗锐张睿智龚正林张萍
罗锐 张睿智 龚正林 张萍
c-fos调控p16/CyclinD1信号途径并促进口腔鳞状细胞癌增殖和迁移
罗锐 张睿智 龚正林 张萍
目的探讨c-fos对口腔鳞状细胞癌增殖和迁移的影响及作用机制。方法免疫组化法分别检测口腔鳞状细胞癌组织标本和正常口腔黏膜组织标本(n=60)中的CyclinD1、p16和c-fos。根据不同处理将HN6和SCC9细胞分为空白对照组、siRNA-scramble组、siRNA-c-fos组。检测各组细胞中CyclinD1和p16 mRNA和蛋白表达量的变化,以及细胞增殖和迁移能力的变化。结果与正常组比较,病例组中c-fos和CyclinD1表达增加,p16表达降低;与空白对照组相比,siRNA-c-fos组HN6和SCC9细胞中CyclinD1表达显著降低,p16表达明显上升,细胞的增殖能力和迁移能力都显著下降。结论c-fos可以通过p16/CyclinD1信号途径增强口腔鳞状细胞癌增殖和迁移。
c-fos; 细胞周期蛋白D1; 口腔鳞状细胞癌; 增殖; 迁移
口腔鳞状细胞癌是一种具有较高入侵潜力和极易向淋巴结转移的恶性肿瘤[1]。细胞周期蛋白D1(CyclinD1)是细胞周期G1期细胞增殖的关键蛋白[2]。在正常细胞中CyclinD1的表达呈低水平,CyclinD1蛋白的过表达被认为是细胞恶变过程中的早期标志。在细胞周期G1-S期间,CyclinD1、p16、pRB是重要的调控因子,其含量表达变化会影响肿瘤细胞的增殖和迁移。研究表明,转录激活因子AP-1在细胞的增殖和迁移中至关重要[3],AP-1家族蛋白主要包含c-fos、fosB。但c-fos对口腔鳞状细胞肿瘤细胞p16/CyclinD1信号以及对增殖和迁移影响目前尚不清楚[4]。本文探讨c-fos对p16/CyclinD1信号途径以及对肿瘤细胞的增殖和迁移的影响,从而为肿瘤的治疗和预防提供实验证据。
1 材料与方法
1.1 标本
60 例口腔鳞状细胞癌组织标本(病例组)和60例正常口腔黏膜组织标本(正常组)来自2012~2013 年陕西安康中心医院口腔颌面外科手术患者,其中男性62 例,女性58 例;年龄20~89 岁,平均年龄为49 岁。经过本院伦理委员会审查同意并且所有患者均签订知情同意书。
1.2 细胞株和主要试剂
人口腔鳞状细胞癌系HN6和SCC9由西安交通大学第一附属院中心试验室提供。胎牛血清、DMEM液体培养基、LipofectamineTM2000、反转录试剂盒、山羊抗兔IgG-HRP、Western免疫印迹的化学发光检测试剂盒以及抗体CyclinD1、抗体c-fos和抗体p16(美国Sigma公司)。Transwell试剂盒(美国Corning公司)。引物合成由上海英俊公司完成。
1.3 方法
1.3.1 免疫组化 将石蜡包埋的60 例病例组切片和60 例正常组切片经过脱蜡、脱二甲苯、脱水处理,3%甲醇双氧水中封闭10 min;清水冲洗3 遍后加入枸橼酸缓冲液(pH=6.0),95 ℃抗原修复20 min,PBS洗后滴加一抗,分别加入CyclinD1、p16和c-fos抗体(1∶200稀释)。4 ℃过夜。PBS 洗后滴加生物素标记的二抗(1∶1 000稀释),37°C孵育30 min;再次振洗后滴加链霉素抗生物素蛋白-过氧化物酶孵育 30 min,DAB 显色、苏木精复染。
染色背景清晰,检测蛋白定位于细胞的胞质或(和)胞核中。本研究以镜下组织胞质或胞核中出现棕色或者棕黄色染色为阳性(+)标准。着色强度分为 4 个等级:无着色计0 分、浅棕黄色计1 分、棕黄色计2 分、棕褐色计3 分。阳性细胞所占比例分为4 个等级:百分比lt;10%计0 分、10%~30%计1 分、31%~60%计2 分、gt;60%计 3分。本研究结合阳性细胞百分比及着色强度分数相加后分级,所得分数为 0~1 分时,分级为(-);2~3 分为(+);4~5分为(++);6 分为(+++),其中-为阴性组、+~+++为阳性组,结果由病理专家根据相应评分标准赋值[5]。
1.3.2 HN6和SCC9细胞分组 分别将HN6和SCC9常规培养于DMEM培养基中,37 ℃、5%CO2培养箱常规传代培养。分别分组如下:①空白对照组:常规培养,不加处理;②siRNA-scramble组:按照脂质体转染试剂LipofectamineTM2000试剂盒说明将pLK0.1-Scramble通过脂质体TM2000分别转染HN6和SCC9细胞,转染24 h后,用含有2 μg/ml嘌呤毒素的DMEM培养基筛选[6];③siRNA-c-fos组:分别转染pLK0.1-siRNA-c-fos载体。
1.3.3 荧光定量PCR 用RNA抽提试剂盒提取各组细胞中总RNA,采用荧光定量PCR技术检测p16和CyclinD1转录的mRNA水平,所用引物如下:CyclinD1-F 5'-GAACAAACAGATCATCCGCAAAC-3'和CyclinD1-R 5'-GCGGTAGTAGGAAGGAAGTTG-3';p16-F 5'ACCCCCTCCATCTGTGC-3'和p16-R 5'-TTCTGGACACGGGTG-3'。采用β-actin作为内参基因来作为对照,每个样品平行试验2 次。
1.3.4 Western blot实验 各组细胞加入裂解液提取蛋白,BCA法总蛋白定量。调整上样量为25 μg总蛋白/样本,上样,电泳,转膜,封闭过夜。分别加入一抗(CyclinD1和p16)(1∶1 000),4 ℃孵育过夜。洗膜,加入II抗即辣根过氧化酶(HRP)标记的山羊抗兔IgG抗体(1∶2 000)室温中反应1 h。洗膜,采用Image J软件测定各条带的灰度值,以目的蛋白条带灰度值与相应的β-actin灰度值的比值作为CyclinD1和p16蛋白的表达水平。
1.3.5 各组细胞增殖能力分析 分别各组细胞按照密度为2.5×103个/ml孔接种于96 孔板中,37 ℃、5%CO2培养箱中孵育待细胞贴壁后,每孔加入10 μl CCK-8后分别置37 ℃、5%CO2培养箱中孵育24、48、72 和96 h,酶标仪测定其在450 nm处的吸光度A值,每个样品平行试验3 次。
1.3.6 各组细胞迁移能力分析 调整各组细胞使其密度为4×104个/ml。在Transwell下室加入1 ml含有5%FBS的DMEM培养基,上室加入0.5 ml浓度为4×104个/ml的待测细胞。培养24 h,去除上室的细胞,用4%多聚甲醛溶液固定黏附在Transwell小室膜下表面细胞15 min,再用0.05%结晶紫染色40 min,然后使用Leica DC 300F正置显微镜随机选取10 个视野计数细胞个数,求其平均值。
1.4 统计学方法

2 结 果
2.1 免疫组化分析
与正常组相比,60 例病例组中CyclinD1表达明显升高,p16表达降低(Plt;0.05)。c-fos在细胞质和细胞核中均出现阳性染色,在病例组和正常组之间差异也存在显著性(Plt;0.05)(表 1)。
2.2 各组细胞中CyclinD1和p16的mRNA相对表达量
与空白对照组相比,siRNA-c-fos组中CyclinD1的mRNA相对表达量降低,p16的mRNA相对表达量上升(Plt;0.05)(图 1)。
2.3 各组细胞中CyclinD1和p16蛋白表达量变化
与空白对照组相比,siRNA-c-fos组中CyclinD1的表达量明显降低,p16的表达量明显上升(Plt;0.05)(表 2,图 2)。
表 1 CyclinD1、p16和c-fos蛋白在病例组和对照组中的表达 (n=60)
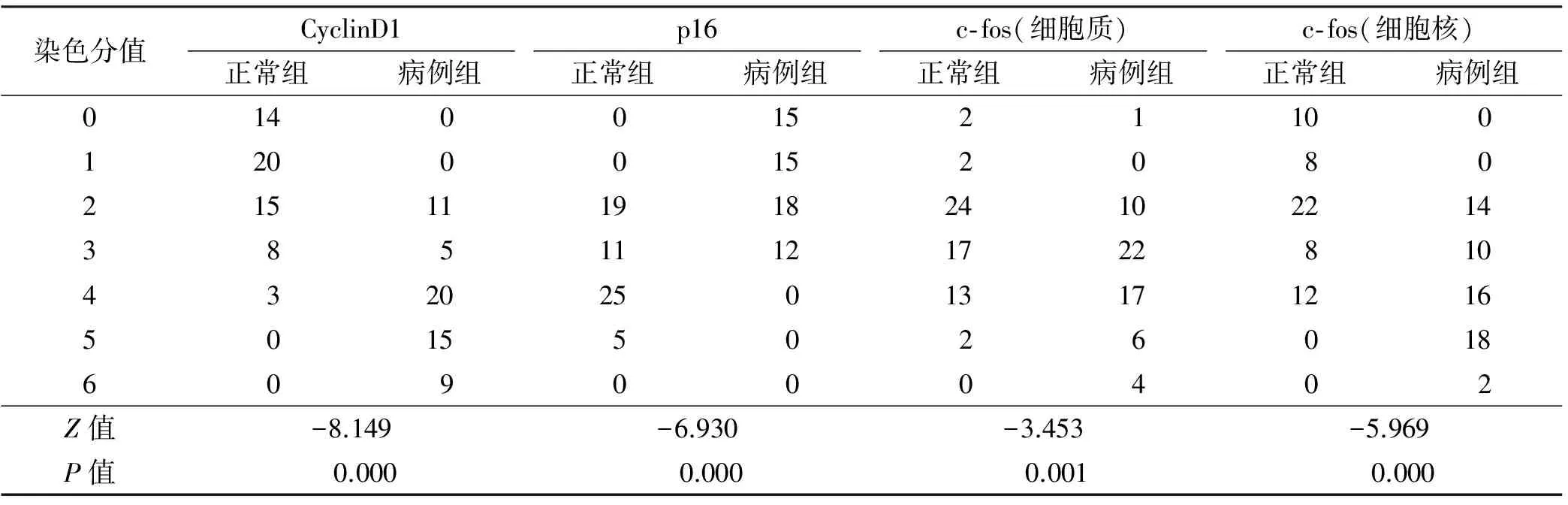
Tab 1 CyclinD1, p16 and c-fos expression in the case and control groups (n=60)

图 1 3 组HN6和SCC9细胞中CyclinD1和p16的mRNA的表达

空白对照组siRNA⁃scramble组siRNA⁃c⁃fos组SCC9HN6SCC9HN6SCC9HN6CyclinD10.916±0.0380.900±0.0470.822±0.0190.839±0.0150.165±0.020①0.170±0.018①p160.398±0.0250.409±0.0690.425±0.0470.412±0.0751.129±0.310①1.120±0.029①
注: ①与空白对照组相比,Plt;0.05
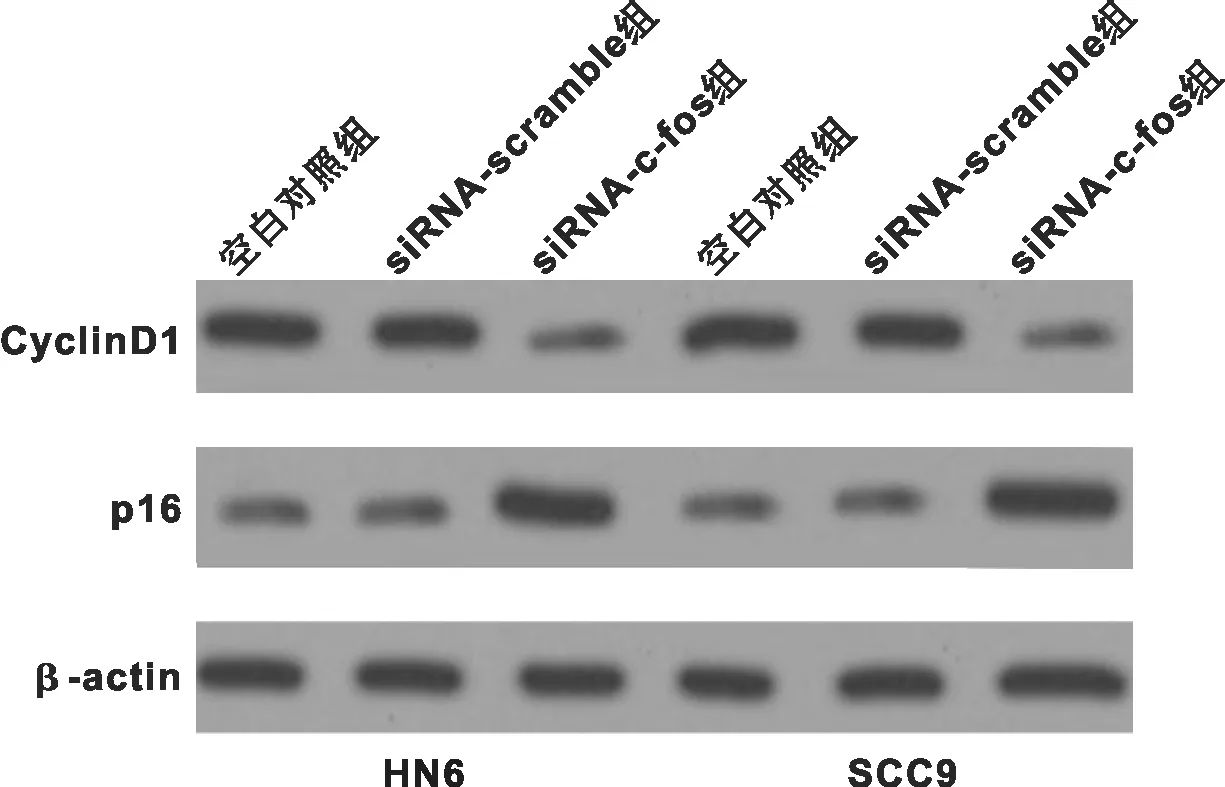
图 2 3 组HN6和SCC9细胞中CyclinD1和p16蛋白表达
Fig 2 CyclinD1 and p16 protien expression in SCC9 and HN6 cells of the 3 groups
2.4 各组细胞增殖能力分析
与空白对照组相比,siRNA-c-fos组细胞中A值显著下降,细胞增殖受到明显抑制(图 3)。
2.5 各组细胞迁移能力比较
显微镜下观察发现siRNA-c-fos组HN6和SCC9中Transwell小室底膜上下室侧附着的细胞个数分别为(55±6)、(58±3) 个,与siRNA-scrmble组数据[(150±9)、(148±8) 个]和空白对照组数据[(153±5)、(146±3) 个]相比明显减少(Plt;0.05)(图 4)。
3 讨 论
口腔鳞状细胞癌是口腔面部常见的恶性肿瘤,其癌细胞的入侵和转移机制比较复杂,并且尚未被明确报道[7]。侵袭和转移过程在口腔鳞状细胞癌的转移发展过程中有着至关重要的作用[8]。这些过程伴随着分子特征的变化有助于深入了解口腔鳞状细胞癌的产生和转移机制,同时为这类癌症的诊断、治疗和预防提供新的有效手段。

图 3 3 组HN6和SCC9细胞增殖能力比较

图 4 各组细胞迁移状态
研究表明,恶性肿瘤与细胞周期调控失常有密切联系。CyclinD1是细胞周期G1期到分裂期的调节蛋白[9],与细胞周期蛋白依赖激酶(CDK) 竞争性地结合[10],控制CDK对蛋白磷酸化作用的强度[11],促进细胞增殖。在正常细胞中CyclinD1的表达是低水平的。但在癌症发生时,CyclinD1蛋白的表达会随着病程恶化而急剧增加[12]。p16作为CDK4,6特异的抑制剂[13],可以抑制其活性,使细胞停滞在G1期[14]。因此,p16/CyclinD1信号途径的异常变化与口腔鳞状细胞癌的发生有密切关系。本研究显示,CyclinD1在口腔癌患者组织中的表达明显高于正常口腔黏膜组织中的表达量,而p16蛋白表达降低。CyclinD1与口腔癌患者组织间这种正相关表达的关系,有助于从下调CyclinD1的表达或改变p16/CyclinD1信号途径等方面探索诊断和治疗口腔癌新手段。
细胞增殖周期中许多原癌基因的激活或者抑癌基因的失活是恶性肿瘤发生的主要机制[15]。原癌基因c-fos属于即时早期(immediate early gene)家族的成员,编码的核蛋白Fos具有结核特异DNA序列和激活基因转录的功能。在本研究中,c-fos在口腔鳞状细胞癌组织中表达量明显增加,而在正常黏膜组织中表达较少。因此,原癌基因c-fos可能和口腔癌的发生、发展有密切联系。然而通过沉默c-fos基因,发现口腔鳞状细胞癌SCC9和HN6中CyclinD1表达量明显降低,p16蛋白表达增加,降低细胞的增殖和迁移能力。因此,我们推断沉默c-fos可以影响p16/CyclinD1信号途径,并且抑制口腔鳞状细胞癌组织细胞的增殖能力和迁移能力。这有助于进一步的研究和探索c-fos的作用机制,以便于为口腔鳞状细胞癌的治疗提供新的有效方案。
[1] Melchers LJ, Clausen MJ, Mastik MF, et al. Identification of methylation markers for the prediction of nodal metastasis in oral and oropharyngeal squamous cell carcinoma[J]. Epigenetics, 2015, 10(9):850-860.
[2] Qu DW, Xu HS, Han XJ, et al. Expression of cyclinD1 and Ki-67 proteins in gliomas and its clinical significance[J]. Eur Rev Med Pharmacol Sci, 2014, 18 (4):516-519.
[3] Ding X, Pan H, Li J, et al. Epigenetic activation of AP1 promotes squamous cell carcinoma metastasis[J]. Sci Signal, 2013, 6(273):ra28.1-13,S0-15.
[4] Fan Q, He M, Deng X, et al. Derepression of c-Fos caused by microRNA-139 down-regulation contributes to the metastasis of human hepatocellular carcinoma[J]. Cell Biochem Funct, 2013, 31 (4):319-324.
[5] 郭泳杉,徐江,郑军. 朊蛋白在cN0口腔鳞状细胞癌中的表达与意义[J]. 石河子大学学报, 2015, 33 (1):102-105.
[6] Dong C, Ye DX, Zhang WB, et al. Overexpression of c-fos promotes cell invasion and migration via CD44 pathway in oral squamous cell carcinoma[J]. J Oral Pathol Med, 2015, 44 (5):353-360.
[7] 林曦, 黄旋平, 吴忆霖, 等. 舌鳞癌原发灶及其颈部淋巴转移灶中p16基因甲基化状态的比较研究[J]. 实用口腔医学杂志, 2015, 31(6): 868-871.
[8] Carrera M, Bitu CC, de Oliveira CE, et al. HOXA10 controls proliferation, migration and invasion in oral squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2015, 8 (4):3613-3623.
[9] Srivastava V, Patel B, Kumar M, et al. Cyclin D1, retinoblastoma and p16 protein expression in carcinoma of the gallbladder[J]. Asian Pac J Cancer Prev, 2013, 14 (5):2711-2715.
[10]Sánchez-Martínez C, Gelbert LM, Lallena MJ, et al. Cyclin dependent kinase (CDK) inhibitors as anticancer drugs[J]. Bioorg Med Chem Lett, 2015, 25(17):3420-3435.
[12]Lee JY, Lee NK. Up-regulation of cyclinD1 and Bcl2A1 by insulin is involved in osteoclast proliferation[J]. Life Sci, 2014, 114 (2):57-61.
[13]Young RJ, Urban D, Angel C, et al. Frequency and prognostic significance of p16(INK4A) protein overexpression and transcriptionally active human papillomavirus infection in laryngeal squamous cell carcinoma[J]. Br J Cancer, 2015, 112 (6):1098-1104.
[14]Taylor-Harding B, Aspuria PJ, Agadjanian H, et al. Cyclin E1 and RTK/RAS signaling drive CDK inhibitor resistance via activation of E2F and ETS[J]. Oncotarget, 2015, 6 (2):696-714.
[15]Schwentner R, Papamarkou T, Kauer MO, et al. EWS-FLI1 employs an E2F switch to drive target gene expression[J]. Nucleic Acids Res, 2015, 43 (5):2780-2789.
(收稿: 2016-10-22 修回: 2016-12-14)
c-fosmodulatesp16/CyclinD1signalingpathwaysandpromotestheproliferationandmigrationoforalsquamouscellcarcinoma
LUORui,ZHANGRuizhi,GONGZhenglin,ZHANGPing.
725000,DepartmentofStomatology,AnkangCityCenterHospitalofShaanxi,China
Objective: To investigate the effect of c-fos on the proliferation and migration of oral squamous cell carcinoma and potential mechansism.MethodsThe expression of c-fos, CyclinD1 and p16 in 60 oral squamous cell carcinoma samples and 60 oral mucosa tissue samples was examined by immunohistochemistry. HN6 and SCC9 cells were respectively transfected with siRNA-c-fos and siRNA-scramble, then were respectively divided into control group, siRNA-scramble group and siRNA-c-fos group. The mRNA and protein expressions of CyclinD1 and p16 were decteted, meanwhile cell proliferation and migration were tested.ResultsCompared with the oral mucosa tissue samples,the expressions of CyclinD1 and c-fos were increased in the carcinoma samples, while the expression of p16 was reduced. Compared with control group, the expressions of CyclinD1 in siRNA-c-fos group were significantly reduced, while p16 enpression was increased, with the inhibition of cell proliferation and migration.Conclusionc-fos may regulate p16/CyclinD1 signaling pathways and promote the proliferation and migration of oral squamous cell carcinoma.
c-fos;CyclinD1;Oralsquamouscellcarcinoma;Proliferation;Migration
725000,安康市中心医院口腔科
罗锐 E-mail: huanghai598@163.com
R739.8
A
10.3969/j.issn.1001-3733.2017.01.022
