经皮种植体表面纳米二氧化硅抗菌涂层的研究
2017-11-29王嘉吴国锋孙冠阳赵铱民魏洪波
王嘉 吴国锋 孙冠阳 赵铱民 魏洪波
经皮种植体表面纳米二氧化硅抗菌涂层的研究
王嘉 吴国锋 孙冠阳 赵铱民 魏洪波
基础医学研究
目的研究纯钛表面制备可降解载药二氧化硅纳米颗粒的抗菌性能。方法通过非模版法制备可降解载庆大霉素的二氧化硅纳米颗粒,采用纳米粒径分析仪和扫描电镜对纳米粒进行特征分析;将载药纳米粒振荡交联至纯钛微弧氧化处理后形成的微米级形貌表面,用扫描电镜进行形态观测;将处理前后的样品与金黄色葡萄球菌共培养,体外抑菌圈法考察抗菌性能;对载药二氧化硅纳米颗粒的抗菌涂层进行体外药物释放实验。结果载药纳米粒为直径(298.1±12.2) nm的圆球状;通过振荡交联后固定在纯钛微弧氧化层火山口样的结构内形成抗菌涂层;体外抑菌圈大小为(16.7±1.4) mm, 而对照组未观测到抑菌圈; 载药二氧化硅纳米颗粒的抗菌涂层可有效释放庆大霉素长达28 d。结论基于可降解二氧化硅纳米粒制备的抗菌涂层可实现庆大霉素的缓控释放,并对金黄色葡萄菌的生长起到抑制作用, 有望在今后应用于种植体经皮部位的设计。
纳米二氧化硅颗粒; 药物控释; 经皮种植体; 抗菌
恶性肿瘤、创伤及诸多先天因素造成了众多的颜面缺损患者,目前利用经皮纯钛种植体固位的赝复体修复是很多患者最理想的治疗方式。但是,临床常用的种植体经皮段通常是光滑的,植入体内主要形成机械扣锁封闭,容易形成纤维包囊;并且由于经皮部位直接暴露于外界环境,在种植体植入和愈合的过程中极易受到细菌的侵袭,使得经皮生物学封闭遭到破坏,最终导致种植体失败[1-2]。为了克服上述问题,有学者开始尝试在种植体表面制备抗菌药物缓释涂层[3-6],但仍存在例如药物释放时间过短、抑菌药物易失效、操作过于繁琐等问题。
模版法制备的二氧化硅纳米颗粒具有良好的生物相容性、颗粒直径可控和原料丰富等优点,因而被广泛应用于药物缓控释系统中[7-9]。而采用非模版法[10]制备的可降解二氧化硅纳米颗粒不但步骤简便,而且产物仍保持上述优点,目前尚未被应用于种植体表面处理领域。本实验拟制备装载庆大霉素的可降解纳米二氧化硅颗粒,然后采用明胶交联法[11]将该纳米颗粒固定在钛种植体微弧氧化的火山口样孔洞内,形成抗菌缓释涂层,进行扫描电镜观测;并对该抗菌涂层进行体外抗菌性能研究。
1 材料与方法
1.1 材料与设备
无水乙醇、氨水、丙酮、戊二醛(CP,富宇精细化工,天津);正硅酸乙酯、硫酸庆大霉素、A型明胶(Sigma-Aldrich,美国);圆形纯钛片(直径10 mm、厚2 mm,西北有色金属研究院);碳化硅砂纸(600~7000目);β-甘油磷酸二钠盐五水(β-GP,瑞禧生物科技有限公司,西安);乙酸钙(CA,瑞禧生物科技有限公司,西安);金黄色葡萄球菌(Sa,ATCC 25923,第四军医大学口腔微生物实验室);营养肉汤及营养琼脂培养基(北京奥博星生物技术有限公司);一次性培养皿(Corning,美国);PBS缓冲液(博士德生物工程有限公司,武汉);磁力搅拌仪(DragonLab,北京);超声波细胞破碎仪(Sonics,美国);高速冷冻离心机(Thermo Scientific,美国);真空冷冻干燥机(SIM,美国);纳米粒径分析仪(Beckmen Coulter,美国);场发射扫描电镜(S-4800,Hitachi,日本); 漩涡振荡仪(恒奥德仪器仪表有限公司,北京);微弧氧化相关设备(西北有色金属研究院);细菌浊度计(悦丰仪器仪表有限公司,上海);恒温摇床(KYC系列,富玛实验设备有限公司,上海);透析袋(截留物质分子量大于10 000,绿鸟科技发展有限公司,上海);庆大霉素elisa kit(Resenbio)。
1.2 载药二氧化硅纳米颗粒的制备及特征分析
1.2.1 载药二氧化硅纳米颗粒的制备 精确称量20 mg硫酸庆大霉素,溶解在3.4 ml 25% 氨水溶液中,将上述溶液滴加在75 ml无水乙醇中,最后缓慢加入200 μl正硅酸乙酯,磁力搅拌下剧烈反应24 h。15 000 r/min高速离心分离收集制备好的纳米粒,用去离子水反复清洗5次,真空冷冻干燥后备用。
1.2.2 载药纳米颗粒的粒径分析 取2 mg 冻干后的载药纳米颗粒超声分散在1 ml去离子水中,用纳米粒径分析仪进行粒径分析,重复3 次后计算均值。
1.2.3 载药纳米颗粒的表面形貌观测 取2 mg 冻干后的载药纳米颗粒超声分散在1 ml去离子水中,滴加10 μl于盖玻片上,真空干燥后表面喷金,置于场发射扫描电镜下进行形貌观测。
1.3 各实验组钛板试件的制备及表面形貌观测
1.3.1 光滑组钛板试件的制备 取纯钛板90 枚,在流水下依次用600、800、1000、2000、3000、5000、7000目碳化硅砂纸打磨抛光,然后用无水乙醇、丙酮和去离子水超声清洗10 min,干燥后备用。
1.3.2 微弧氧化组钛板试件的制备 按照0.04 mol/L β-GP和0.2 mol/L CA的配方制备电解液10 L,然后取上述干燥好的光滑钛板60 枚放入电解液中,以纯钛片为阳极,不锈钢锅为阴极,采用脉冲直流电源进行微弧氧化。电解参数为:电压300 V,频率600 Hz,占空比8%,时间5 min。制备完成后用无水乙醇和去离子水超声清洗10 min,干燥后备用。
1.3.3 载药涂层组钛板试件的制备 精确称量2 mg载药纳米二氧化硅颗粒,超声分散于1 ml 0.1%明胶溶液中,然后用移液器吸取200 μl上述悬浊液滴加在微弧氧化组钛板表面,将试件放在漩涡振荡器上振荡30 min;重复上述步骤,以使纳米颗粒突破表面张力进入微弧氧化的火山样孔洞内,4 ℃过夜干燥;将钛板浸泡在2.5%明胶溶液中使明胶发生交联反应,再用无水乙醇漂洗3遍,干燥后备用[11]。
1.3.4 各实验组钛板试件表面形貌观测 取各组实验用钛板试件5枚,表面喷金后放置在场发射扫描电镜下进行表面形貌观测。
1.4 各实验组钛板试件体外抗菌性能的研究
1.4.1 金黄色葡萄球菌的培养 复苏细菌于营养琼脂平板上, 37 ℃下恒温培养24 h后备用。
1.4.2 抑菌圈实验 将复苏的细菌用PBS缓冲液稀释至细菌浊度计测定为108CFU/ml,再稀释100 倍至浓度为106CFU/ml,用移液器吸取100 μl上述菌液滴加至营养琼脂平板上,并涂布均匀。将钴60 照射灭菌后的各实验组钛板各10 枚放置在涂有菌液的平板上,37 ℃恒温培养24 h后,测量抑菌圈并拍照。
1.5 载药抗菌涂层钛板的体外药物释放实验
1.5.1 透析袋扩散法 将载药抗菌涂层钛板放置在装有2 ml PBS缓冲液的透析袋内,扎紧袋口后,再将透析袋转移至放有48 ml PBS缓冲液的锥形瓶内,密封后置于恒温摇箱内恒速振荡(37 ℃,150 r/min)。
1.5.2 药物释放研究 在预定的时间点从透析袋外缓冲液中取样1 ml,并立即补充等量同质同温的PBS缓冲液。将取出的液体保存在4 ℃下,全部样品取完后统一采取elisa kit法进行药物浓度测定,计算药物释放的剂量,并绘制释放曲线。
2 结 果
粒径分析显示载药纳米颗粒的直径为(298.1±12.2) nm。扫描电镜下该纳米颗粒为形状均匀的圆球形,粒径约为250 nm,与粒径分析结果一致(图 1)。
各实验组钛板试件的表面形貌见图 1,光滑组表面仅可见少量方向相同的打磨痕迹;微弧氧化组表面凹凸不平,形成了火山口样的孔洞,大小约为1~5 μm;载药涂层组在火山样的孔洞内填满了圆球状的二氧化硅纳米颗粒,高倍镜下可以观察到纳米颗粒之间连接的明胶。
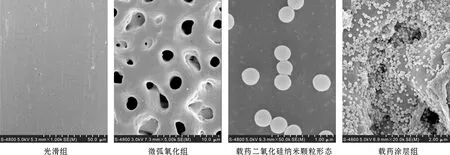
图 1 试件表面形貌(SEM)
图 2为各实验组钛板在涂有菌液的琼脂平板上培养24 h后形成的细菌生长分布形态。光滑组和微弧氧化组钛板周围长满了细菌;而微弧氧化组钛板周围由于庆大霉素的缓慢释放,可以观察到周围形成的抑菌圈,直径为(16.7±1.4) mm。

A: 载药涂层组; B: 微弧氧化组; C: 光滑组
A: Antibacterial coating group; B: Titanium after micro-arc oxidation; C: Polished titanium group
Fig 2 Inhibition zone of the samples
图 3为载药抗菌钛板中的庆大霉素在体外条件下的缓释规律。可见庆大霉素随着时间延长逐渐释放,其缓释时间可达28 d。
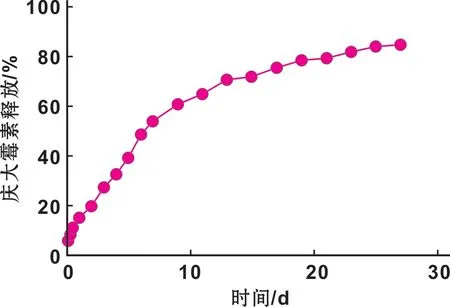
图 3 载药抗菌钛板体外庆大霉素释放曲线图
Fig 3Invitrogentamycin release curve of antibacterial titanium specimen
3 讨 论
3.1 种植体固位的赝复体修复失败率高
良好的固位是赝复治疗成功的基础,因具备良好的生物相容性和力学性能,利用经皮纯钛种植体固位已成为赝复最理想固位方式。但是由于种植体经皮段直接面对外界环境,细菌可直接在种植体经皮部位表面黏附增殖并形成生物膜[12-13]。生物膜形成后,细菌对宿主免疫系统和抗菌剂的抵抗力将大大增强,可以沿着种植体长轴继续侵袭,破坏种植体与骨的结合界面,最终导致植体脱落,治疗失败[1-2]。并且一旦钛种植体感染发生,彻底清除感染往往不可能。研究表明,因经皮部位感染而导致的种植体失败率为15%~20%,在有放疗史的患者中,失败率高达44.4%[14-16]。
3.2 目前常用的抗菌方法及缺陷
种植体表面药物缓释涂层能够在种植体周围局部形成高浓度的药物环境,可以有效防止细菌的黏附定植及细菌生物膜的形成[3]。此前已有许多关于载抗生素、无机抗菌剂及抑菌肽涂层的文献报道[4-6],但是多集中在种植体与骨结合界面,对经皮软组织界面的相关研究甚少。且目前的抗菌药物缓释系统仍存在诸多问题,有的制备工艺过于复杂,在操作过程中可能导致药物失效;无机抗菌剂的抗菌机制不明确,存在潜在的生物毒性;有的抗菌药物释放时间过短,不能有效预防细菌感染。
3.3 新型二氧化硅纳米载体和抗菌药物涂层的设计
二氧化硅纳米颗粒因具有多种优点被广泛应用于药物缓释系统中[7],其降解产物为硅酸[17],具有良好的生物相容性;并且原料丰富,价格低廉。本文通过在原料中加入庆大霉素的方法成功的制备出了载庆大霉素二氧化硅纳米颗粒,由于这种方法未使用模版剂,因此在后续的实验过程中不需要高温焙烧或者萃取去除模版剂,这样不但使得实验步骤更加简便,而且降低了药物发生降解的可能性。该方法制备的纳米颗粒,因内部药物浓度高,可在缓冲液体系中随着药物的扩散而逐渐降解[18]。并且通过调整各原料的比例,可以控制药物的释放速率和释放剂量,以达到控释的目的[10]。通过在纯钛钛板表面进行微弧氧化处理,其表面形成了直径约1~5 μm的火山口样微观形貌,内部可容纳纳米级的二氧化硅颗粒,本实验采用振荡交联法[11]将纳米粒用A型明胶固定在其中。当明胶发生降解反应时,载药二氧化硅纳米粒被逐渐释放,可以进一步延长药物的作用时间[11]。
3.4 新型抗菌药物涂层的抗菌效果
金黄色葡萄球菌是种植体经皮部位感染最常见的病原菌[19],因此本实验中采取体外培养测定抑菌圈的方法测试了上述载药二氧化硅明胶交联涂层的抗菌性能,结果显示,与光滑和单纯微弧氧化对照组相比,新型抗菌涂层组钛板周围可见明显的抑菌圈,而对照组未见,抑菌圈测量结果显示直径为(16.7±1.4) mm。可以证明新型抗菌涂层组钛板具备抑制细菌生长的性能,而光滑组和微弧氧化组则不能。这说明采用抗菌涂层处理可有效阻挡细菌入侵,减少软组织反应,为皮肤生长创造出一个良好的环境,从而促进经皮封闭,提高种植体成功率。
4 结 论
本文成功制备出一种新型可降解载药二氧化硅纳米粒,并应用振荡交联法将其固定在纯钛微弧氧化处理后的火山口样孔洞内,形成抗菌涂层,实现了药物的缓控释放,并对金黄色葡萄菌的生长起到抑制作用,今后应用于种植体经皮部位的设计中,有望降低经皮种植体的感染率,提高颜面赝复用经皮种植体成功率。
[1] Jansen JA, van der Waerden JP, de Groot K. Fibroblast and epithelial cell interactions with surface-treated implant materials[J]. Biomaterials,1991,12(1):25-31.
[2] Holt BM, Betz DH, Ford TA, et al. Pig dorsum model for examining impaired wound healing at the skin-implant interface of percutaneous devices[J]. J Mater Sci Mater Med, 2013,24(9):2181-2193.
[3] 魏洪波, 吴淑仪, 董岩, 等. 简易冻干法制备二氧化钛纳米管载药涂层的研究[J]. 实用口腔医学杂志, 2012, 28(2):136-140.
[4] de Breij A, Riool M, Kwakman PH, et al. Prevention of Staphylococcus aureus biomaterial-associated infections using a polymer-lipid coating containing the antimicrobial peptide OP-145[J]. J Control Release,2016,222: 1-8.
[5] Calliess T, Sluszniak M, Winkel A, et al. Antimicrobial surface coatings for a permanent percutaneous passage in the concept of osseointegrated extremity prosthesis[J]. Biomed Tech(Berl),2012,57(6):467-471.
[6] Abdulkareem EH, Memarzadeh K, Allaker RP, et al. Anti-biofilm activity of zinc oxide and hydroxyapatite nanoparticles as dental implant coating materials[J].J Dent,2015,43(12):1462-1469.
[7] Yildirim A, Ozgur E, Bayindir M. Impact of mesoporous silica nanoparticle surface functionality on hemolytic activity, thrombogenicity and non-specific protein adsorption[J]. J Mater Chem B,2013,1(14):1909-1920.
[8] Lu J, Li Z, Zink JI, et al.Invivotumor suppression efficacy of mesoporous silica nanoparticles-based drug-delivery system: Enhanced efficacy by folate modification[J].Nanomedicine,2012,8(2):212-220.
[9] Tang J, Slowing II, Huang Y, et al. Poly(lactic acid)-coated mesoporous silica nanosphere for controlled release of venlafaxine[J].J Colloid Interface Sci,2011,360(2):488-496.
[10]Zhang S, Chu Z, Yin C,et al. Controllable drug release and simultaneously carrier decomposition of SiO2-drug composite nanoparticles[J].J Am Chem Soc, 2013,135(15):5709-5716.
[11]Cheng Y, Wu J, Gao B, et al. Fabrication and in vitro release behavior of a novel antibacterial coating containing halogenated furanone-loaded poly(L-lactic acid) nanoparticles on microarc-oxidized titanium[J]. Int J Nanomedicine,2012,7(6):5641-5652.
[12]Swartjes JJ, Sharma PK, van Kooten TG, et al. Current developments in antimicrobial surface coatings for biomedical applications[J].Curr Med Chem,2015,22(18):2116-2129.
[13]Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: A common cause of persistent infections[J]. Science,1999,284(5418):1318-1322.
[14]Roumanas ED, Freymiller EG, Chang TL, et al. Implant-retained prostheses for facial defects: An up to 14-year follow-up report on the survival rates of implants at UCLA[J]. Int J Prosthodont,2002,15(4):325-332.
[15]Curi MM, Oliveira MF, Molina G, et al. Extraoral implants in the rehabilitation of craniofacial defects: Implant and prosthesis survival rates and peri-implant soft tissue evaluation[J]. J Oral Maxillofac Surg,2012,70(7):1551-1557.
[16]Karakoca S, Aydin C, Yilmaz H, et al. Survival rates and periimplant soft tissue evaluation of extraoral implants over a mean follow-up period of three years[J]. J Prosthet Dent,2008,100(6):458-464.
[17]Sripanyakorn S, Jugdaohsingh R, Dissayabutr W, et al. The comparative absorption of silicon from different foods and food supplements[J]. Brit J Nutr, 2009,102(6):825-834.
[18]Fan L, Zhang Y, Wang F, et al. Multifunctional all-in-one drug delivery systems for tumor targeting and sequential release of three different anti-tumor drugs[J].Biomaterials, 2016,76:399-407.
[19]王晓静, 王国伟, 赵铱民. 金黄色葡萄球菌在不同种植体表面涂层粘附情况的体外实验研究[J].中国口腔种植学杂志, 2009,14(2):16.
(收稿: 2016-09-18 修回: 2016-11-08)
Investigationofsilicabasedantibacterialcoatingonpercutaneoustitaniumimplants
WANGJia1,WUGuofeng2,SUNGuanyang1,ZHAOYimin1,WEIHongbo3.
1. 710032Xi'an,StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterForOralDiseaseamp;ShaanxiKeyLaboratoryofOralDiseases,DepartmentofProsthodontics,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China; 2.NanjingStomatologicalHospital,MedicalSchoolofNanjingUniversity; 3.StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterForOralDiseaseamp;ShaanxiEngineeringResearchCenterforDentalMaterialsandAdvancedManufacture,DepartmentofOralImplant,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi'an
Objective: To study the antibacterial effect of self-decomposable silica nanoparticle coating on pure titanium percutaneous implant.MethodsGentamycin loaded silica nanoparticles were prepared using non-template method, the characterization of the particles was analyzed by size analyzer and field emission scanning electron microscope(FESEM). Then the drug-loaded nanoparticles were cross-linked onto the titanium after micro-arc oxidation treatment and observed by SEM. After that, antibacterial properties of the treated specimens against Staphylococcus aureus were investigated by measuring the diameter of bacterial inhibition zone. Finally, drug release of the antibacterial coating specimen was carriedinvitro.ResultsThe spherical silica nanoparticles were (298.1±12.2) nm in diameter. The nanoparticles were fixed within the holes of micro-arc oxidation titanium after oscillation and crosslink. While bacterial inhibition zone was not observed in the control group, there was a bacteriostatic area in the diameter of(16.7±1.4) mm around the antimicrobial coating specimen. The silica nanoparticles-loaded antibacterial coating specimen could effectively release gentamycin for up to 28 days.ConclusionAn antimicrobial coating based on self-decomposable silica nanoparticles can be prepared on titanium substrates, which can realize control release of gentamycin as well as retard bacterial growth. It is expected to apply in designing percutaneous implants in the future.
Silicananoparticles;Controlreleaseofdrug;Percutaneousimplants;Antibacterial
国家自然科学基金(编号: 81300918)
710032 西安, 军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔医学重点实验室,第四军医大学口腔医院修复科(王嘉 孙冠阳 赵铱民); 南京大学医学院附属口腔医院, 南京市口腔医院(吴国锋); 军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心, 陕西省口腔生物工程技术研究中心,第四军医大学口腔医院口腔种植科(魏洪波)
魏洪波 E-mail: weihongbo101@gmail.com
R783.1
A
10.3969/j.issn.1001-3733.2017.01.001
