拮抗核盘菌Bt菌株的筛选及抑菌活性研究
2017-11-29王美玲耿丽丽段江燕
王美玲, 耿丽丽, 段江燕, 张 杰*
(1. 山西师范大学生命科学学院, 临汾 041004; 2. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室, 北京 100193)
拮抗核盘菌Bt菌株的筛选及抑菌活性研究
王美玲1,2, 耿丽丽2, 段江燕1*, 张 杰2*
(1. 山西师范大学生命科学学院, 临汾 041004; 2. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室, 北京 100193)
利用平板对峙试验从170株Bt菌株中筛选获得12株对核盘菌Sclerotiniasclerotiorum有抑菌活性的菌株,对其中4株活性较强的菌株进行抗病相关基因分析,发现菌株中都含有几丁质酶基因,测定4AP1菌株发酵液的几丁质酶活力为672.4 U/mL。通过对4AP1菌株pH和温度敏感性的研究发现,4AP1菌株最高可耐受55℃高温及pH 12缓冲液的处理,抑菌活性与对照无显著差异。且该菌株抑菌谱较广,除核盘菌外,对小麦赤霉病菌Fusariumgraminearum等其他9种病原真菌均有抑制作用。本研究获得的4AP1菌株对核盘菌具有较强抑制作用,且耐热耐强碱环境,为构建杀虫抗病Bt工程菌提供了菌株资源。
核盘菌; Bt菌株; 抑菌活性; 几丁质酶
油菜菌核病是由核盘菌引发的一种真菌病害,在全世界近100多个国家造成不同程度的危害[1]。核盘菌的寄主范围极其广泛,可寄生的植物多达75个科278个属408个种以及42个变种或亚种[2]。目前对核盘菌比较有效的防治方法是化学防治,但每年我国化学农药的使用量高达50多万t,对环境已造成严重的破坏,国际上部分国家已经限制使用化学杀菌剂[3-4]。而生物防治因其对环境友好且不易产生抗性等优点具有很好的开发前景。目前生物防治菌核病主要是应用木霉和芽胞杆菌等[5-8],芽胞杆菌因其易于分离以及产生的芽胞抗逆性强等优点,在病害防治中占有重要的地位。
苏云金芽胞杆菌Bacillusthuringiensis,简称Bt,可产生多种杀虫晶体蛋白,对昆虫有很强的毒性作用,是一种应用最广泛的微生物杀虫剂[9-13]。Takahashi和Hyakumachi等研究发现,Btfukuokaensis亚种B88-82菌株和sotto亚种RG1-6菌株可以诱导植物产生系统抗性,通过增强植物自身免疫力而提高抗病性[14-15]。Bt菌株可以分泌一些抗病抑菌活性物质,祁红兵等从80株Bt菌株中筛选到两株Bt菌株QB51和HD7,这2株菌株均具有较高的几丁质酶活力[16];卢伟等筛选到19株Bt菌株,其分泌产生的几丁质酶对小麦赤霉病菌FusariumgraminearumSchwabe有抑菌活性[17]。许多细菌、病毒等都能够产生几丁质酶(chinitase,EC 3.2.1.14)。微生物所产生的几丁质酶与其他来源的几丁质酶一样分为外切几丁质酶和内切几丁质酶,而绝大多数微生物产生的是内切几丁质酶,能特异性地将几丁质中的β-1,4-糖苷键水解成N-乙酰-D-氨基葡萄糖(N-acetyl-D-glucosamine,NAG)[18]。微生物几丁质酶活性的最适pH一般在3~10之间,而发挥抑菌活性的最适温度多在50~60℃,高于60℃酶容易失活[19]。
目前报道,解淀粉芽胞杆菌、地衣芽胞杆菌以及枯草芽胞杆菌等可以用于防治油菜菌核病[6, 20-21],而关于Bt的报道主要集中在其杀虫活性方面[22]。本研究从Bt标准菌株库中分离获得对核盘菌有较高抑菌活性的4AP1菌株,并对其抑菌谱、抑菌活性的稳定性及其中几丁质酶的活性进行研究。旨在获得对核盘菌有较高防效的Bt菌株,以期为真菌病害的防治提供菌株资源。
1 材料与方法
1.1 材料
病原真菌:10种供试病原真菌,核盘菌Sclerotiniasclerotiorum、小麦赤霉病菌Fusariumgraminearum、黄瓜炭疽病菌Colletotrichumorbiculare、苹果轮纹病菌Botryosphaeriaberengerianaf.sp.piricola、水稻稻瘟病菌Magnaporthegrisea、黄瓜枯萎病菌Fusariumoxysporum、黄瓜黑星病菌Cladosporiumcucumerinum、水稻纹枯病菌Thanatephoruscucumeris、棉花黄萎病菌Verticilliumdahliae、苹果腐烂病菌Cytosporamandshurica由武汉科诺公司提供。
Bt菌株:供试菌株共170株,其中165株来自中国农业科学院植物保护研究所的标准Bt菌株库;另外5株Bt185、G03、HD73、HD73-和HBF-18由中国农业科学院植物保护研究所抗虫生物技术课题组保存。
供试植物:甘蓝型油菜Brassicanapus(L.),品种为‘新四月蔓’,栽培用土为营养土∶蛭石=2∶1;光照时间14 h(7 000 lx),黑暗时间10 h,种植时间约30 d;种植地点为中国农业科学院植物保护研究所温室。
培养基:LB液体培养基(胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L,121℃灭菌20 min),LB固体培养基(LB液体培养基加琼脂15 g/L),5%的胶体几丁质和PDA固体培养基,购自北京冰达生物科技有限公司。
引物由Sangon Biotech北京合成部合成,测序由中国农业科学院农作物基因资源与基因改良国家重大科学工程开放实验室完成,生化及分子生物学试剂均为市售分析纯。
1.2 对核盘菌具有抑菌活性Bt菌株的筛选
将纯化后的Bt菌株分别接种在LB液体培养基中,30℃,220 r/min活化12 h。核盘菌在固体PDA平板上活化生长至满板时,利用打孔器取直径为7 mm的圆形菌饼倒置于90 mm PDA固体培养基平板的中央位置,然后在平板对称位置距离菌饼20 mm处放置4个直径为6 mm的圆形无菌滤纸片,每个滤纸片滴加5 μL待测菌液,随后将平板置于28℃恒温培养箱中培养,观察有无抑菌圈产生,每个处理3个重复。
1.3 菌株中抑菌基因的检测
提取菌株的基因组,方法参照《分子克隆指南》[23]。利用Raddadi等[24]报道的引物(表1)扩增以下5个基因:降解真菌细胞壁几丁质的几丁质酶基因和几丁质外切酶基因、ZwA抗生素基因簇的丙二酸单酰辅酶A转酰基酶基因和ZwA抗性基因、干扰细菌病原菌群体感应系统的酰基高丝氨酸内酯酶基因。PCR扩增反应体系(20 μL):2×TaqMix 10 μL,上、下游引物各0.4 μL,浓度为10 μmol/L,模板DNA 1 μL,超纯水8.2 μL。PCR扩增反应条件:94℃预变性10 min;94℃变性1 min,合适的温度退火1 min,72℃延伸一定的时间(1 kb的扩增产物延伸时间为1 min),30个循环;72℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶、140 V电泳检测,产物送交测序。将测序获得的核酸序列,上传NCBI数据库进行BlastN比对分析。
表1PCR引物的核酸序列和退火温度
Table1NucleotidesequencesandannealingtemperaturesofPCRprimers

基因名称Genesname引物名称和序列(5′→3′)Primernameandsequence(5′→3′)退火温度/℃Annealingtemperature几丁质酶基因ChitChitF:ATTCACACTGCTATTACTATCChitR:TGACGGCATTTAAAAGTTCGGC50胞外几丁质酶基因Chit36Chi36F:GATGTTAAACAGGTTCAAChi36R:TTATTTTTGCAAGGAAAG50丙二酸单酰辅酶A转酰基酶基因MAT(orf2)F:ATTGTATTTATGTTTCCTGGCGTAR:TTTGTTCTCTCTCTTTAATCTGTT55ZwA抗性基因zmaRA0678:ATGTGCACTTGTATGGGCAGA0677:TAAAGCTCGTCCCTCTTCAG55酰基高丝氨酸内酯酶基因aiiAAIF:TAAATGTAAAGGTGGATACATAATGACAGTAIR:AGCTCATGACTTTTTGCACTATATATA50
1.4 几丁质酶活力的测定
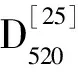
1.5 不同pH缓冲液及温度对4AP1菌株抑菌能力的影响
将菌株接种在5 mL LB液体培养基中,30℃振荡培养12 h,收集菌液,分别取300 μL菌液于10个1.5 mL离心管中,其中4管分别加入等量的pH分别为10、11、12和13的缓冲液,颠倒混匀,室温反应30 min。5管分别置于温度为55、60、65、70和80℃的恒温水浴锅中温育30 min,剩余1管不做任何处理。分别取5 μL反应液通过平板对峙试验检测其对核盘菌的抑菌能力,并测量其抑菌圈直径,每个处理设3个重复。
1.6 抑菌谱的检测
利用对核盘菌抑菌能力最强的菌株,通过平板对峙试验检测其对10种病原真菌的抑菌能力,每个处理设3个重复,并测量抑菌圈直径,培养温度均为28℃。
2 结果与分析
2.1 抗核盘菌Bt菌株的筛选
通过平板对峙试验检测170株Bt菌株对核盘菌的抑菌能力,结果显示来自标准菌株库的12株Bt菌株4AP1、4R1、4BR1、4BS1、4AA1、4J5、4K5、4L1、4D12、4D16、4G7和4B3对核盘菌有抑菌活性,比例为7.1%。其中4AP1、4BR1、4BS1、4AA1菌株抑菌能力较强(图1),而实验室常用菌株Bt185、G03、HD73、HD73-和HBF-18均对核盘菌无抑菌活性。

图1 Bt菌株抑菌能力检测Fig.1 Analysis of antifungal activity of Bt strains
2.2 Bt菌株中抑菌相关基因检测及几丁质酶活力的测定
提取4AP1、4BR1、4BS1、4AA1菌株的基因组,对4个真菌病害抗性相关基因:几丁质酶基因、几丁质外切酶基因、丙二酸单酰辅酶A转酰基酶基因和ZwA抗性基因,以及1个细菌病害抗性相关基因:酰基高丝氨酸内酯酶基因进行PCR鉴定。鉴定结果显示,4个菌株中均检测到几丁质酶基因和酰基高丝氨酸内酯酶基因(表2);4AP1菌株含有4个抗病相关基因,包括几丁质酶基因、丙二酸单酰辅酶A转酰基酶基因、ZwA抗性基因和酰基高丝氨酸内酯酶基因(图2)。对4AP1菌株的几丁质酶基因进行PCR扩增并测序,NCBI BlastN结果显示4AP1菌株中几丁质酶基因(1 873 bp)与BtHD201几丁质酶基因(GenBank登录号:AY452506.1)核酸序列相似性为99%。随后对4AP1菌株发酵液的几丁质酶活力进行测定,结果显示其酶活力为672.4 U/mL。
表24AP1、4BR1、4BS1、4AA1菌株抗病相关基因鉴定结果1)
Table2Identificationofdiseaseresistance-relatedgenesof4AP1,4BR1,4BS1and4AA1strains
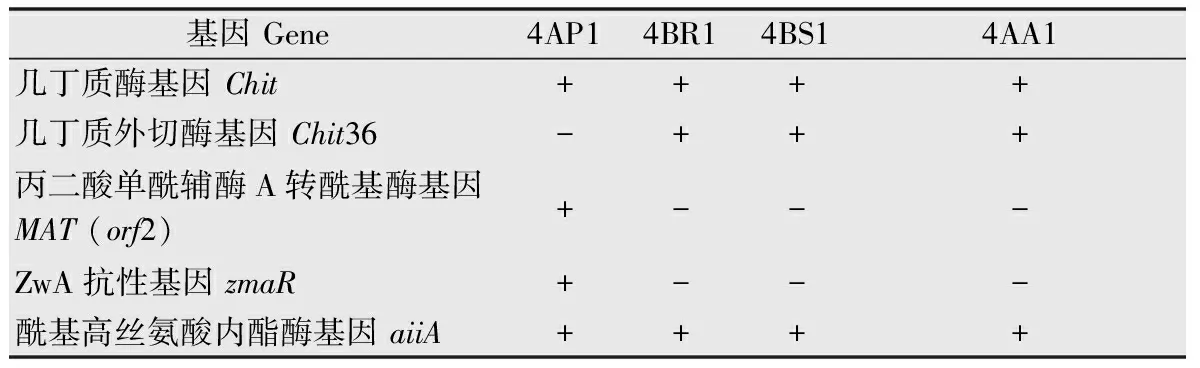
基因Gene4AP14BR14BS14AA1几丁质酶基因Chit++++几丁质外切酶基因Chit36-+++丙二酸单酰辅酶A转酰基酶基因MAT(orf2)+---ZwA抗性基因zmaR+---酰基高丝氨酸内酯酶基因aiiA++++
1) “+”表示鉴定到该基因;“-”表示未鉴定到该基因。
“+” represents identified gene; “-”represents unidentified gene.
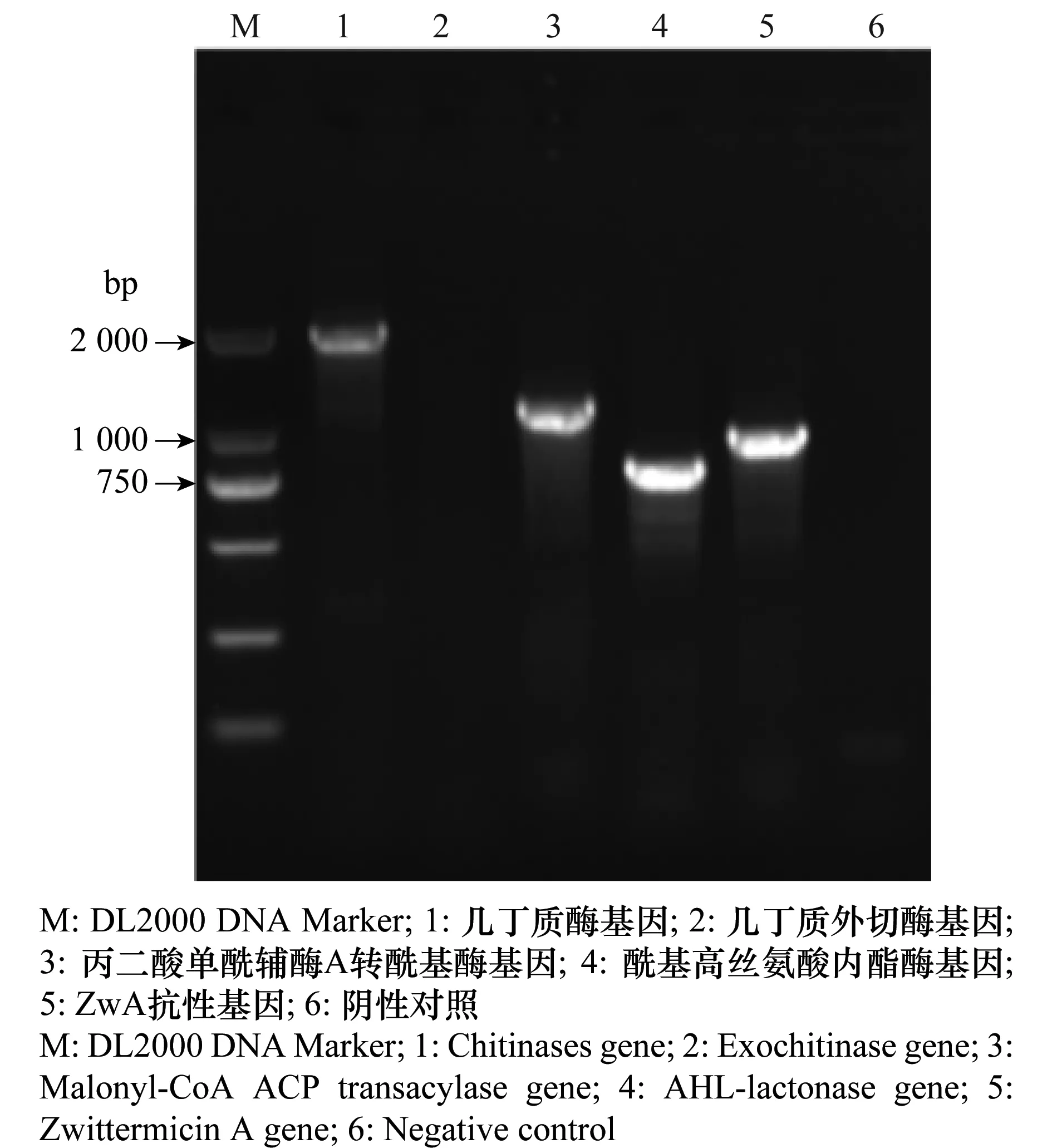
图2 4AP1菌株抗病相关基因鉴定结果Fig.2 Identification of disease resistance-related genes of 4AP1 strains
2.3 pH及温度对4AP1菌株抑菌能力的影响
选择抑菌能力最强的4AP1菌株,分析pH及温度对Bt菌株抑菌能力的影响。室温条件下,经pH分别为10、11、12的缓冲液处理30 min后,4AP1菌株抑菌活性与对照无显著差异,抑菌圈直径在30.3~32.8 mm之间,而经pH为13的缓冲液处理后,其抑菌活性显著降低,抑菌圈直径为(25.0±0.9)mm(图3a),说明在pH 10~12缓冲液中4AP1菌株能保持稳定的抑菌活性。
不同温度处理对4AP1菌株活性影响测定结果表明:经55℃处理30 min后4AP1菌株可保持稳定的抑菌活性,抑菌圈直径为(29.2±0.8)mm;随着处理温度升高其抑菌活性均显著降低,80℃高温处理后其抑菌活性完全丧失(图3b)。表明4AP1菌株仅耐55℃高温处理。
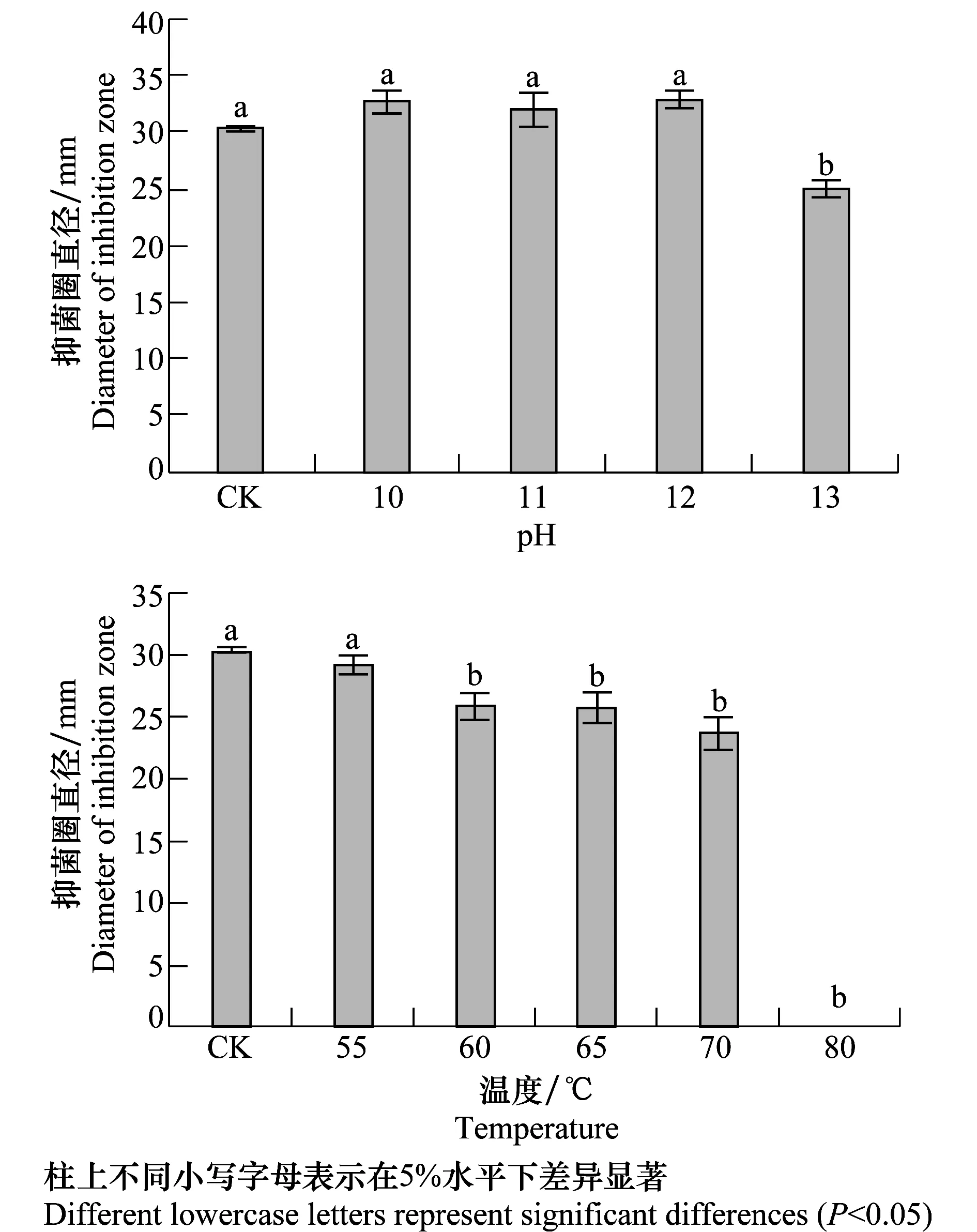
图3 pH及温度对4AP1菌株抑菌能力的影响Fig.3 Effects of pH and temperature on antagonistic ability of 4AP1 strains
2.4 4AP1菌株抑菌谱的测定
利用平板对峙试验对4AP1菌株的抑菌谱进行测定,结果显示:4AP1菌株对核盘菌S.sclerotiorum、小麦赤霉病菌F.graminearum、黄瓜炭疽病菌C.orbiculare、苹果轮纹病菌B.berengerianaf.sp.piricola、水稻稻瘟病菌M.grisea、黄瓜枯萎病菌F.oxysporum和黄瓜黑星病菌C.cucumerinum的抑菌能力最强,抑菌圈直径均>30 mm;对水稻纹枯病菌T.cucumeris和棉花黄萎病菌V.dahliae的抑菌效果较强,抑菌圈直径介于20~30 mm之间;对苹果腐烂病菌C.mandshurica的抑菌效果较弱,抑菌圈直径<20 mm,具有较广的抑菌谱(表2)。
3 讨论
长期以来,人们对于Bt的研究主要集中于对其杀虫活性的研究[11, 22],也有研究报道Bt可以抑制病原真菌的生长。韩苗苗等研究发现Bt519-1对小麦赤霉病菌F.graminearum等8种病原真菌有不同的抑制作用[26];周国旺等研究发现BtLTS290菌株可抑制6种马铃薯致病镰孢菌的生长[27]。本研究从165株标准Bt菌株和5株实验室常用菌株中筛选到4株对核盘菌抑菌活性较强的Bt菌株,发现其中的4AP1菌株对其他9种病原真菌均有不同程度的抑制作用,尤其对病害严重的水稻稻瘟病菌M.grisea以及小麦赤霉病菌F.graminearum等具有较强的抑制效果。此外,PCR鉴定结果显示4株抑菌活性较强的Bt菌株中都含有几丁质酶基因,且4AP1菌株发酵液具有较高的几丁质酶活力,因此推测该菌株的抑菌活性可能与其含有的几丁质酶相关,或者与Bt菌株分泌的环脂肽类抗生素相关[28],需要进一步的试验验证。
表24AP1菌株抑菌能力测试1)
Table2Antagonisticabilityassayof4AP1strains

病原真菌Pathogenfungus4AP1菌株抑菌能力Antagonisticabilityof4AP1核盘菌Sclerotiniasclerotiorum+++小麦赤霉病菌Fusariumgraminearum+++黄瓜炭疽病菌Colletotrichumorbiculare+++苹果轮纹病菌Botryosphaeriaberengerianaf.sp.piricola+++水稻稻瘟病菌Magnaporthegrisea+++黄瓜枯萎病菌Fusariumoxysporum+++黄瓜黑星病菌Cladosporiumcucumerinum+++水稻纹枯病Thanatephoruscucumeris++棉花黄萎病Verticilliumdahliae++苹果腐烂病Cytosporamandshurica+
1) “+”表示抑菌圈直径≤20 mm,“++”表示20 mm<抑菌圈直径<30 mm,“+++”表示抑菌圈直径≥30 mm。
+ represents diameter of inhibition zone≤20 mm; ++ represents 20 mm< diameter of inhibition zones<30 mm; +++ represents diameter of inhibition zone≥30 mm.
已有的研究表明,微生物几丁质酶在pH 3~10之间、低于60℃的条件下可以保持降解几丁质的活性[19]。陶树兴等研究发现枯草芽胞杆菌2-3-2分泌几丁质酶的最适温度为40℃,最适pH为7.0,温度高于50℃及碱性条件下酶活力都会下降[29]。黄小红等研究发现Bt-WB7分泌的几丁质酶活性在pH 4.5~6.5区域稳定,而在pH>8时酶很快失活,且55℃处理30 min后,酶的活性没有发生变化,高于该温度,酶就失去活性[30]。本研究发现的4AP1菌株55℃处理30 min后活性无显著变化,随着温度的升高,活性降低,80℃处理后活性完全丧失;经pH 10~13缓冲液处理30 min后仍有较高的抑菌活性,但其发酵液上清没有抑菌活性,该几丁质酶可能存在于菌体内,需要后续纯化分离,进一步确定其对碱性条件的耐受能力。
通过本研究发现Bt菌株中部分菌株对核盘菌等病原真菌有较强抑菌能力,其中4AP1菌株抑菌物质具有耐碱和耐热性,为真菌病害生防菌的筛选提供了新的思路,为构建杀虫抗病Bt工程菌奠定了基础,对于增加Bt制剂的市场份额具有重要的意义。
[1] 李丽丽.世界油菜病害研究概述[J]. 中国油料作物学报, 1994, 16(1): 79-81.
[2] Boland G J, Hall R.Index of plant hosts ofSclerotiniasclerotiorum[J]. Canadian Journal of Plant Pathology, 1994, 16(2): 93-108.
[3] 林玉锁, 龚瑞忠. 农药环境管理与污染控制[J]. 环境导报, 2000(3): 4-6.
[4] Kland M J. Chapter 8 teratogenicity of pesticides andother environmental pollutants [J]. Studies in Environmental Science, 1988, 31(1): 315-463.
[5] Hunter J E, Steadman J R, Cigna J A.Preservation of ascospores ofSclerotiniasclerotiorumon membrane filters[J]. Phytopathology, 1982, 72(6): 650-652.
[6] 薛鹏琦,刘芳,乔俊卿,等.油菜菌核病生防芽孢杆菌的分离鉴定及其脂肽化合物分析[J].植物保护学报,2011,38(2):127-132.
[7] 侯毅平,章四平,王建新,等.枯草芽孢杆菌NJ-18对油菜菌核病的防治效果及其定殖动态[J].植物病理学报, 2013, 43(4): 411-417.
[8] Tozlu E, Mohammadi P, Senol Kotan M, et al. Biological control ofSclerotiniasclerotiorum(Lib.) de Bary, the causal agent of white mould disease in red cabbage, by some bacteria[J]. Plant Protection Science, 2016, 52(3): 188-198.
[9] Jiao Yaoyu, Yang Yan, Meissle M, et al. Comparison of susceptibility ofChilosuppressalisandBombyxmorito fiveBacillusthuringiensisproteins[J]. Journal of Invertebrate Pathology, 2016, 136: 95-99.
[10] Azizoglu U, Ayvaz A, Yilmaz S, et al. Expression ofcry1Abgene from a novelBacillusthuringiensisstrain SY49-1 active on pest insects [J].Brazilian Journal of Microbiology,2016,47(3): 597-602.
[11] Azzouz H, Kebaili-ghribi J, BenFarhat-Touzri D,et al. Selection and characterisation of an HD1-likeBacillusthuringiensisisolate with a high insecticidal activity againstSpodopteralittoralis(Lepidoptera: Noctuidae)[J]. Pest Management Science, 2014, 70(8): 1192-1201.
[12] Bi Yang, Zhang Yanrui, Shu Changlong, et al. Genomic sequencing identifies novelBacillusthuringiensisVip1/Vip2 binary and Cry8 toxins that have high toxicity toScarabaeoidealarvae [J].Applied Microbiology and Biotechnology,2015,99(2): 753-760.
[13] Yu Yajun, Yuan Yihui, Gao Meiying. Construction of an environmental safeBacillusthuringiensisengineered strain against Coleoptera [J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4027-4034.
[14] Takahashi H, Nakaho K, Ishihara T, et al. Transcriptional profile of tomato roots exhibitingBacillusthuringiensis-induced resistance toRalstoniasolanacearum[J]. Plant Cell Reports, 2014, 33(1): 99-110.
[15] Hyakumachi M, Nishimura M, Arakawa T, et al.Bacillusthuringiensissuppresses bacterial wilt disease caused byRalstoniasolanacearumwith systemic induction of defense-related gene expression in tomato [J]. Microbes and Environments, 2013, 28(1): 128-134.
[16] 祁红兵, 刘铭, 李红敬. 产几丁质酶苏云金芽胞杆菌的筛选及其对甜菜夜蛾高毒菌株的增效活性[J]. 江苏农业科学, 2003, 23(6): 61-63.
[17] 卢伟, 赵秋敏, 陈艳玲, 等. 几丁质酶在苏云金芽胞杆菌中的分布及抑小麦赤霉菌菌株的筛选[J]. 南开大学学报(自然科学版), 2007, 40(3): 97-101.
[18] 喻子牛. 苏云金杆菌[M]. 北京: 科学出版社, 1990.
[19] 胡荣康, 肖正, 林满红, 等.微生物热稳定几丁质酶的研究进展[J]. 食品工业科技, 2016, 37(22): 359-364.
[20] 孙启利, 陈夕军, 童蕴慧, 等. 地衣芽孢杆菌W10抗菌蛋白对油菜菌核病菌的抑制作用及防病效果[J]. 扬州大学学报(农业与生命科学版), 2007, 28(3): 82-86.
[21] 江木兰, 赵瑞, 王国平. 油菜内生枯草芽孢杆菌BY-2抗油菜菌核病菌有效成分的鉴定和分离提纯[J]. 中国油料作物学报, 2006, 28(4): 453-456.
[22] 束长龙, 张风娇, 黄颖, 等. Bt杀虫基因研究现状与趋势[J]. 中国科学:生命科学, 2016, 46(5): 548-555.
[23] 萨姆布鲁克, 鲁塞尔. 分子克隆实验指南[M]. 第3版. 黄培堂, 译. 北京: 化学工业出版社, 2008.
[24] Raddadi N, Belaouis A, Tamagnini I, et al. Characterization of polyvalent and safeBacillusthuringiensisstrains with potential use for biocontrol [J].Journal of Basic Microbiology,2009, 49(3): 293-303.
[25] 李力, 黄胜元, 关雄. 产几丁质酶的苏云金杆菌菌株筛选及酶合成条件研究[J]. 中国病毒学, 2000, 15(S1): 97-100.
[26] 韩苗苗,肖亮,蔡峻,等.一株抑真菌、对甜菜夜蛾高效的苏云金芽胞杆菌菌株[J].微生物学通报,2008,35(11):1750-1754.
[27] 周国旺, 李玉红, 张圆, 等. 苏云金芽胞杆菌LTS290菌株抑制镰孢菌的作用[J]. 生物技术通报, 2015, 31(8): 153-158.
[28] Jouzani G S, Valijanian E, Sharafi R.Bacillusthuringiensis: a successful insecticide with new environmental features and tidings [J]. Applied Microbiology and Biotechnology, 2017, 101: 2691-2711.
[29] 陶树兴, 张娟妮, 郭贤,等. 枯草芽孢杆菌2-3-2的抗线虫作用和产酶条件与酶特性[J]. 陕西师范大学学报(自然科学版), 2013, 41(3): 45-49.
[30] 黄小红, 陈清西, 王君,等. 苏云金芽胞杆菌(Bacillusthuringiensis)几丁质酶的分离纯化及酶学性质[J]. 应用与环境生物学报, 2004, 10(6): 771-773.
(责任编辑: 田 喆)
ScreeningofandstudyingonBtstrainswithantagonisticactivityagainstSclerotiniasclerotiorum
Wang Meiling1,2, Geng Lili2, Duan Jiangyan1, Zhang Jie2
(1.CollegeofLifeSciences,ShanxiNormalUniversity,Linfen041004,China; 2.StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
A total of 12 Bt strains with antifungal activity againstSclerotiniasclerotiorumwere obtained from 170 strains of Bt strains by the plate confrontation test. Disease resistance-related genes of 4 strains with higher activity were analyzed and all these strains containedchitgene. Chitinase activity of 4AP1 strain cell culture was 672.4 U/mL. The 4AP1 strain could withstand high temperature of 55℃ and pH 12, and its antifungal activity was not significantly different from the control. Moreover, the antimicrobial spectrum of 4AP1 strain was broad, except forS.sclerotiorum, which had antifungal activity against the other 9 fungal diseases such asFusariumgraminearum, etc. In this study, 4AP1 strains with strong antifungal activity againstS.sclerotiorum, and heat and alkali resistance were obtained, and this provides strain resources for construction of engineering Bt with insecticidal activity and disease-resistance.
Sclerotiniasclerotiorum; Bt strain; antagonistic activity; chitinase
2017-02-08
2017-03-31
国家重点研发计划(2017YFD0201204)
* 通信作者 E-mail: duanjiangyan123@163.com; jzhang@ippcaas.cn
S 476
A
10.3969/j.issn.0529-1542.2017.06.009
