蟾蜍灵对人胶质瘤细胞U87MG及其成球细胞增殖和凋亡影响的研究*
2017-11-29孔令凯孙舒岚李晓曦张桂荣朴浩哲
刘 佳 孔令凯 孙舒岚 李晓曦 张桂荣 朴浩哲△
(1.辽宁中医药大学,辽宁 沈阳 110032;2.大连医科大学肿瘤干细胞研究院,辽宁 大连116044;3.中国医科大学肿瘤医院,辽宁省肿瘤医院中心实验室,辽宁 沈阳 110042)
蟾蜍灵对人胶质瘤细胞U87MG及其成球细胞增殖和凋亡影响的研究*
刘 佳1孔令凯2孙舒岚3李晓曦3张桂荣3朴浩哲3△
(1.辽宁中医药大学,辽宁 沈阳 110032;2.大连医科大学肿瘤干细胞研究院,辽宁 大连116044;3.中国医科大学肿瘤医院,辽宁省肿瘤医院中心实验室,辽宁 沈阳 110042)
目的观察蟾蜍灵对人胶质瘤细胞系U87MG及U87MG成球细胞增殖和凋亡作用的影响。方法取对数生长期的U87MG细胞,制成细胞悬液,分别向细胞悬液中加入不同浓度的蟾蜍灵,另设DMSO作为对照组,MTT检测细胞存活情况;克隆形成2周后,观察不同浓度蟾蜍灵对细胞增殖的影响;蟾蜍灵处理U87MG细胞12 h和48 h后,流式细胞仪检测细胞凋亡情况;Western blot检测蟾蜍灵处理U87MG细胞48 h后凋亡相关蛋白Cleaved-caspase-3和Cleaved-PARP表达水平;分别用成球培养基和含有蟾蜍灵的成球培养基培养U87MG细胞7 d,显微镜下观察细胞是否成球及其形态、成球体积大小变化和数量变化;成球的U87MG细胞加入不同浓度蟾蜍灵72 h后,PI避光染色1 h,荧光显微镜下观察细胞死亡情况。结果加入蟾蜍灵处理的U87MG细胞生存率较空白对照组和DMSO组明显下降,24 h、48 h和72 h的IC50分别为85 nmol/L、34 nmol/L和22 nmol/L。蟾蜍灵处理后克隆形成数量低于空白对照组。U87MG细胞经蟾蜍灵处理后,细胞凋亡比例增加,并存在药物浓度时间依赖性;凋亡相关蛋白Cleaved-caspase-3和Cleaved-PARP表达量较空白对照组增加;U87MG细胞在成球培养基中培养后可以成球;加蟾蜍灵干预后,细胞成球体积明显比空白对照组小,且数量减少。PI染色观察到随药物浓度增加,细胞球死亡比例增加。结论蟾蜍灵可以抑制U87MG细胞生长和增殖,并能促进其凋亡;蟾蜍灵可以抑制胶质瘤U87MG成球,并能杀伤干细胞。
蟾蜍灵 胶质瘤 凋亡 肿瘤干细胞
胶质瘤是神经系统肿瘤中发病率最高的原发恶性肿瘤,具有病死率及复发率高的特点,总体预后较差。肿瘤干细胞是肿瘤细胞中的一小部分,这些细胞负责肿瘤的转移能力,并产生耐药性[1]。如今,虽然经过传统治疗后,部分肿瘤瘤体可以缩小,但多数在治疗后会再次复发,这是由于肿瘤干细胞可以使肿瘤细胞再生所致[2-3]。因此,寻找杀伤肿瘤干细胞的药物对治疗恶性肿瘤起到至关重要的作用。蟾毒灵是中药蟾酥的主要成分之一,是从中华大蟾蜍或黑眶蟾蜍分泌的毒液中提取的[4]。蟾酥主要含蟾蜍灵、华蟾酥毒基、酯蟾毒配基3种蟾毒单体,具有强心、麻醉和调节血压的作用[5],并且这3种单体都能影响肿瘤细胞周期进程,诱导细胞凋亡[6],其中以蟾蜍灵的抗癌活性最强,属于强心苷类物质[7]。强心苷类是强有力的肿瘤生长抑制剂[8]。因此,近些年蟾蜍灵的抗肿瘤作用机制成为研究热点,结果证明蟾蜍灵对多种肿瘤细胞都有作用,如前列腺癌、肺癌、肝癌、卵巢癌、结肠癌、胶质瘤等[9-15]。 蟾蜍灵在其他恶性肿瘤中作用相对明确,但在胶质瘤上的作用研究较少,对胶质瘤来源的肿瘤干细胞的作用还尚无报道。胶质瘤U87MG细胞经成球培养基培养后可以成球,而成球后的细胞具有较强的干细胞性质[16]。本实验旨在观察蟾蜍灵对胶质瘤U87MG细胞及其成球后细胞增殖和凋亡作用的影响。
1 材料与方法
1.1 研究材料
人胶质瘤细胞系U87MG购自ATCC细胞库,由本实验室培养传代;蟾蜍灵购自Sigma-Aldrich公司,纯度为98%,用二甲基亚砜(DMSO)充分溶解后,调整浓度为16 mmol/L储存,使用前用细胞培养基稀释成所需浓度。
1.2 实验方法
1.2.1 细胞培养 U87MG细胞培养于含10%胎牛血清、1%青链霉素的DMEM培养基中,置于37℃,CO2浓度为5%的培养箱中。取对数生长期的细胞待用,细胞每 2~3 日用含 EDTA 的胰酶以 1∶3~1∶5 传代。
1.2.2 MTT检测U87MG细胞生存率 取对数生长期的胶质瘤细胞系U87MG细胞,制成细胞悬液,接种于3 个 96 孔板中,每孔约 5000 个细胞,100 μL/孔,细胞贴壁后, 分别向孔板中加入蟾蜍灵(0、10、20、40、80、160 nmol/L),另外设定DMSO对照组,共7组。每组实验设立6复孔,于37℃培养箱中分别培养24 h、48 h和72 h后,每孔加入10 μL MTT液混匀,培养3~4 h后,弃掉培养基,每孔各加100 μL MTT专用DMSO,混匀10 min充分溶解结晶后,用双波长测定490 nm处吸光度(OD值)。实验重复3次。计算细胞生存率,制作标准生长曲线。
1.2.3 克隆形成观察细胞增殖水平 正常消化细胞后,细胞计数,取每孔约1000个细胞铺于6孔板,每孔2 mL,细胞过夜贴壁后,各孔加不同浓度蟾蜍灵(0、10、20 nmol/L),37℃培养箱中培养2周左右,待出现肉眼可见克隆时,弃掉培养基,PBS洗两次,每孔加多聚甲醛1 mL固定液固定细胞15~20 min,固定结束后弃掉固定液,每孔加1 mL GIMSA染色液染色10~30 min后,用流水缓慢清洗掉染色剂,空气中自然干燥。
1.2.4 流式细胞仪检测细胞凋亡 取对数生长期的细胞,制成细胞悬液后接种于24孔板中,1 mL/孔,待细胞贴壁后分别向孔板中加入蟾蜍灵 (0、10、20 nmol/L),置于37℃培养箱中分别培养12 h和48 h后,用PBS小心清洗1次,每孔加入200 μL不含EDTA的胰酶消化细胞,1 min后加1 mL含血清培养基终止消化,轻轻吹打成细胞悬液,1000 r/min离心5 min,弃上清。每个样品加300 μL的Binding Buffer轻轻吹打混匀,加入 3 μl Annexin V 和 3 μL PI染色,混匀后避光15 min,300目过滤网过滤后,应用流式细胞仪检测各组细胞凋亡情况。
1.2.5 Western Blot检测凋亡蛋白表达水平 向细胞培养基中加入不同浓度蟾蜍灵 (0、20、40、80 nmol/L)48 h后,提取总蛋白制样。向电泳槽中加入Running Buffer浸没胶板。拔掉梳子后向胶板小槽中加样开始电泳。电泳结束后,将夹好的转模板放入电泳槽中,加入Trans Buffer,盖上盖子冰浴转膜。转膜结束后,NC膜用丽春红染液染色,铅笔标记Marker,切膜。用预冷的PBS洗去染液。加入4 mL封闭液慢摇床上室温封闭 1.5~2.5 h。 弃掉封闭液,用预冷的 PBS 洗 1~2 遍,加入一抗稀释液,慢摇床上4℃孵育过夜(12 h)。次日早回收一抗。用预冷的TBST洗膜。加入二抗封闭液,常温慢摇床上摇1 h。弃掉封闭液,再用预冷的TBST 2 μL洗3遍,最后用PBS清洗1次浸泡,凝胶成像系统显影。
1.2.6 胶质瘤细胞成球 U87MG细胞正常消化后,用完全培养基悬浮细胞,1000 r/min离心5 min,弃上清,用DMEM-F12重悬,再离心1次,弃上清,用成球培养基(无血清DMEM-F12培养基、10 ng/mL bFGF、20 ng/mL EGF、2%的b27)重悬,细胞计数后铺板培养(低黏附孔板)7 d后,显微镜下观察细胞形态。
1.2.7 蟾蜍灵对成球细胞的影响 U87MG细胞加入含有不同浓度蟾蜍灵(0、10、20 nmol/L)的成球培养基,置于低黏附细胞培养板中培养7 d,细胞成球后,电子显微镜下观察细胞成球大小并计数成球数。成球后的细胞球加入不同浓度的蟾蜍灵(0、5、10、40 nnmol/L)处理 72 h 后,加入 PI(10 μg/mL)避光染色 1 h,荧光显微镜下观察细胞球死亡情况 (细胞死亡部分显示红色荧光)。
1.3 统计学处理
2 结 果
2.1 各时间点蟾蜍灵对胶质瘤细胞U87MG生存率的影响
见表1,图1。与空白对照组、DMSO组比较,U87MG细胞经蟾蜍灵处理后的细胞生存率逐渐下降,并存在时间浓度依赖性,处理48 h和72 h后的细胞生存率明显低于24 h组(P<0.05)。
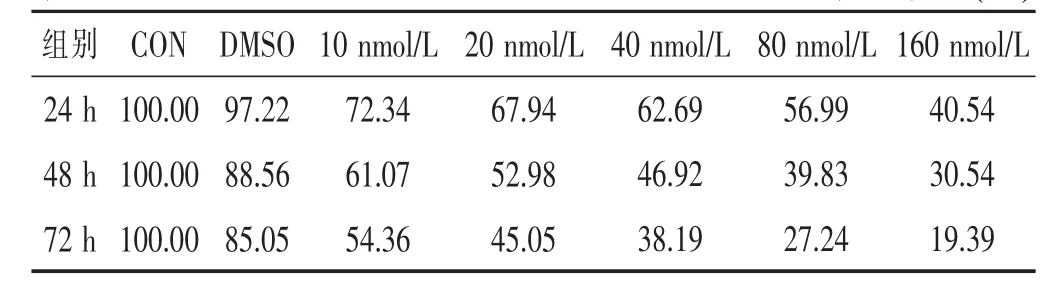
表1 各时间点蟾蜍灵对胶质瘤细胞U87MG生存率的影响(%)
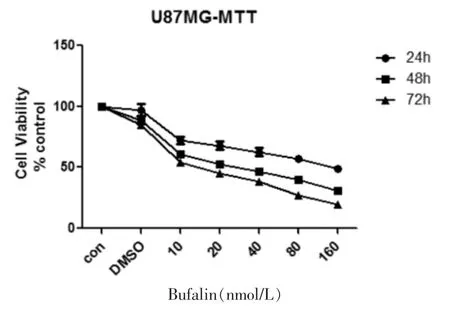
图1 蟾蜍灵处理U87MG细胞后的细胞生长增殖情况
2.2 各时间点蟾蜍灵对胶质瘤细胞U87MG增殖的影响
见图 2。 蟾蜍灵(0、10、20 nmol/L)处理 2 周后的U87MG细胞增殖作用与空白对照组相比明显被抑制,在10 nmol/L蟾蜍灵处理的U87MG细胞组就可看到细胞增殖有所减少,在20 nmol/L时抑制作用显著。
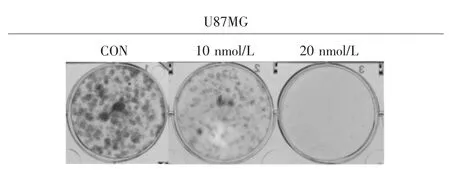
图2 U87MG 细胞经不同浓度蟾蜍灵 (0、10、20 nmol/L)处理2周后,细胞克隆形成情况
2.3 各时间点蟾蜍灵对U87MG细胞凋亡的影响
见表2,图3。蟾蜍灵处理后的胶质瘤细胞U87MG早期凋亡和晚期凋亡比例与空白对照组相比均有升高,其中48 h处理的凋亡比例高于12 h凋亡比例,并与药物浓度呈正相关,差异有统计学意义(P<0.05)。

表2 各时间点蟾蜍灵对U87MG细胞凋亡的影响(%)
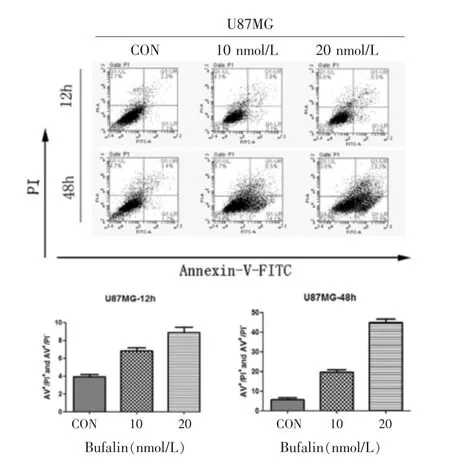
图3 蟾蜍灵对U87MG细胞凋亡的影响
2.4 蟾蜍灵对胶质瘤细胞U87MG凋亡蛋白表达的影响
见表3,图4。凋亡蛋白Casepase-3的裂解活化表达量在蟾蜍灵20 nmol/L时与空白对照组相比有少量增加,而在40、80 nmol/L时表达量明显增加;裂解的PARP蛋白表达水平同样随蟾蜍灵浓度的增加而增加。
2.5 U87MG细胞成球
见图5。U87MG细胞在普通培养基中正常贴壁生长,而在成球培养基中培养7d后,显微镜下观察到U87MG细胞在低黏附的细胞培养板中形成多细胞聚集的球体,悬浮于培养基中。
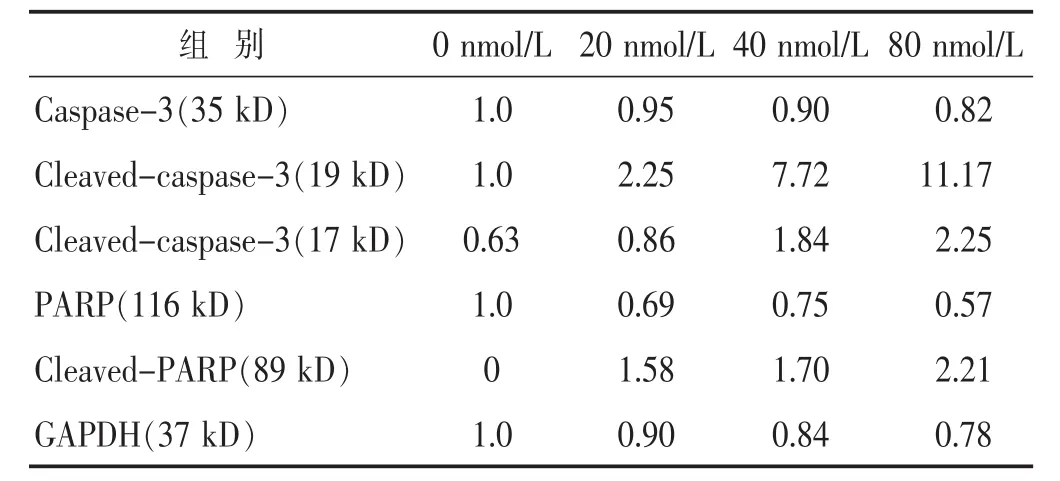
表3 各时间段蟾蜍灵对胶质瘤细胞U87MG凋亡蛋白表达的影响(%)
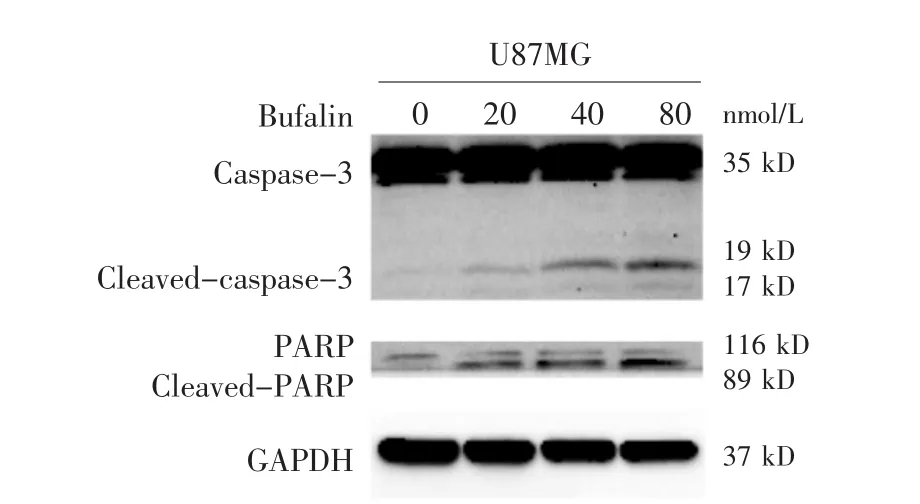
图 4 Western blot检测蟾蜍灵 (0、20、40、80 nmol/L) 处理U87MG细胞48 h后凋亡相关蛋白Cleaved-caspase-3及Cleaved-PARP的表达水平

图5 U87MG细胞经成球培养基培养后成球
2.6 蟾蜍灵对成球细胞的影响
见图 6。U87MG 细胞在加入蟾蜍灵(0、5、20 nmol/L)的成球培养基中成球培养7 d,细胞成球体积与空白对照组相比明显减小(取5个视野,测量细胞球大小计算平均值,依次为空白对照组210 μm,5 nmol/L组105.5 μm,20 nmol/L 组 78 μm), 成球数量也有减少;蟾蜍灵(0、5、10、40 nmol/L)处理细胞球 72 h 后PI染色结果显示,细胞在不同浓度处理后的死亡情况不同,加入蟾蜍灵10、40 nmol/L后的细胞死亡比例与空白对照组及蟾蜍灵5 nmol/L组相比有明显增加,并与蟾蜍灵浓度正相关。
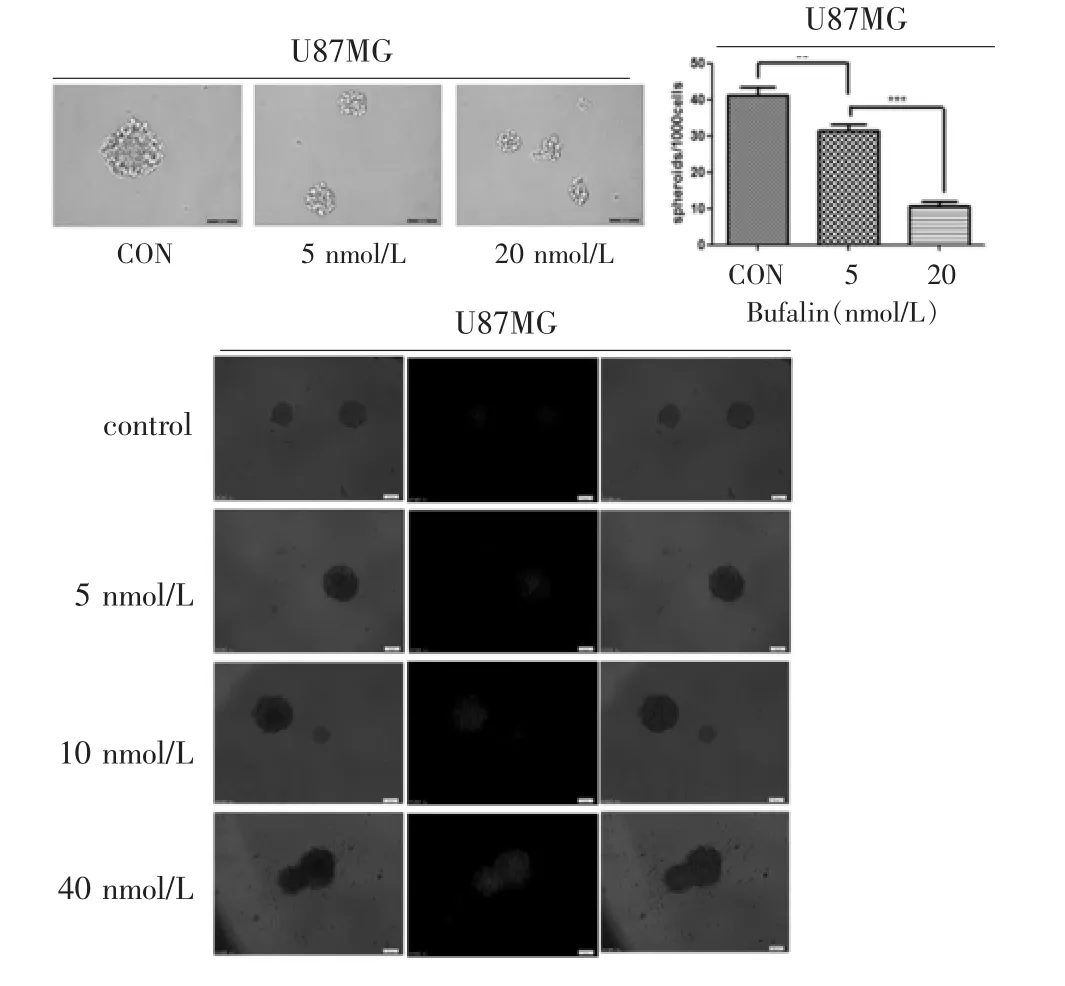
图6 蟾蜍灵对U87MG细胞成球的影响
3 讨 论
胶质瘤是神经系统中发病率最高的原发恶性肿瘤,多呈侵袭性生长,与正常脑组织界限不清,手术彻底切除肿瘤组织难以实现[17],由于血脑屏障的存在,治疗胶质瘤的药物很难起到百分之百的作用,但随着科技的发展,新的给药途径的出现,未尝不可达到提高局部药物浓度、降低毒性的效果,如从供应肿瘤血液的血管注入药物,提高局部组织药物浓度等[18],因而,寻求新的具有良好抗胶质瘤作用的药物,仍具有重要意义。近年来中医药在治疗胶质瘤方面取得了一定的进展,特别是中西医结合治疗在提高生存率,改善放化疗后的毒副作用方面,显示出其独有的优势。笔者发现中药蟾酥的提取物蟾蜍灵,在多种肿瘤细胞中有明确的抑制作用[9-15]。有研究表明Na+-K+-ATP酶很可能是蟾蜍灵抑制肝癌细胞增殖的靶点之一[19]。蟾蜍灵通过活化ERK通路Raf、MEK、ERK,抑制ERK通路的过度激活,从而抑制食管癌细胞的增殖迁移[20]。蟾蜍灵在很多肿瘤细胞中作用及机制相对明确,但在胶质瘤上的作用报道较少,有研究报道蟾蜍灵可引起胶质瘤细胞凋亡与自噬,其机制可能是通过Caspase-3及PARP的裂解活化表达、下调Bcl-2蛋白表达、上调Bax蛋白表达、释放细胞色素C来完成的,并提出二者与内质网应激有密切关系[15]。近年来,有研究证明蟾蜍灵能抑制胰腺癌和骨肉瘤来源的肿瘤干细胞的分化和增殖[21-23],但蟾蜍灵对胶质瘤干细胞的作用研究还未见报道。
笔者研究结果提示,蟾蜍灵处理胶质瘤U87MG细胞后,细胞生存率明显低于空白对照组及DMSO组,存在浓度时间依赖性,并能抑制细胞增殖,促进细胞凋亡,这与Shuying Shen等[15]研究结果相符。笔者随后按照先前研究[24]的方法进行了胶质瘤细胞成球实验,结果提示胶质瘤细胞可以成球。经过蟾蜍灵处理后,成球体积及数量明显减少;分离出的细胞球经蟾蜍灵处理72 h后,PI染色发现细胞死亡比率与空白对照组相比明显升高,说明蟾蜍灵对胶质瘤U87MG来源的肿瘤干细胞有明确的杀伤作用,并随药物浓度的升高杀伤作用增强。
总之,蟾蜍灵抑制U87MG细胞生长及增殖,并促进其凋亡,对成球后的细胞也有一定的杀伤作用,这为蟾蜍灵在临床治疗胶质瘤提供了新的理论依据,并为胶质瘤的实验研究提供了新的科研思路。
本实验研究存在一定的局限性,到目前为止我们只进行了蟾蜍灵对胶质瘤U87MG及其成球后细胞的杀伤现象研究,对于机制研究尚未进行,另外还尚未在动物模型中开展实验,其临床疗效还有待评估。笔者将在后续的实验中继续深入。
[1]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67:1030-1037.
[2]Costello RT,Mallet F,Gaugler B,et al.Human acute myeloid leukemia CD34+/CD38-progenitor cells have decreased sensitivity to chemotherapy and Fas-induced apoptosis,reduced immunogenicity,and impaired dendritic cell transformation capacities[J].Cancer Res,2000,60:4403-4411.
[3]Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance[J].Nat Rev Cancer.2005,5:275-284.
[4]Liang Y,Liu AH,Qin S,et al.Simultaneous determination and pharmacokinetics of five bufadienolides in rat plasma after oral administration of Chansu extract by SPE-HPLC method[J].J Pharm Biomed Anal,2008,46:442-448.
[5]Lenaerts C,Demeyer M,Gerbaux P,et al.Analytical aspects of marinobufagenin[J].Clin Chim Acta,2013,421:193-201.
[6]Zhang DM,Liu JS,Tang MK,et al.Bufotalin from Venenum Bufonis inhibits growth of multidrug resistant HepG2 cells through G2/M cell cycle arrest and apoptosis[J].Eur J Pharmacol,2012,692(1-3):19-28.
[7]陈小义,韩景田,王刚.蟾蜍灵对白血病小鼠的保护作用[J].中国药物与临床,2015,5(1):35-36.
[8]Wang Y,Lonard DW,Yu Y,et al.Bufalin is a potent smallmolecule inhibitor of the steroid receptor coactivator SRC-3 and SRC-1[J].Cancer Res,2014,74(5):1506-1517.
[9]Yeh JY,Huang WJ,Kan SF,et al.Effects of bufalin and cinobufagin on the proliferation of androgen dependent and independent prostate cancer cells [J].Prostate,2003,54:112-124.
[10]Jiang Y,Zhang Y,Luan J,et al.Effects of bufalin on the proliferation of human lung cancer cells and its molecular mechanisms of action[J].Cytotechnology,2010,62:573-583.
[11]Qi F,Inagaki Y,Gao B,et al.Bufalin and cinobufagin induce apoptosis of human hepatocellular carcinoma cells via Fasand mitochondria-mediated pathways[J].Cancer Sci,2011,102:951-958.
[12]Takai N,Ueda T,Nishida M,et al.Bufalin induces growth inhibition,cell cycle arrest and apoptosis in human endometrial and ovarian cancer cells [J].Int J Mol Med,2008,21:637-643.
[13]Wang J,Chen C,Wang S,et al.Bufalin inhibits HCT116 colon cancer cells and its orthotopic xenograft tumor in mice model through genes related to apoptotic and PTEN/AKT pathway[J].Gastroenterol Res Pract,2015,2015:457193.
[14]Wang H,Zhang C,Xu L,et al.Bufalin suppresses hepatocellular carcinoma invasion and metastasis by targeting HIF-1a via the PI3K/AKT/mTOR pathway [J].Oncotarget,2016,7:20193-20208.
[15]Shen S,Zhang Y,Wang Z,et al.Bufalin induces the interpiay between apoptosis and autophagy in glioma cells through endoplasmic reticulum stress[J].Int J Biol Sci,2014,10(2):212-224.
[16]Joana B,Diana M,Luiz G,et al.The expression of connexins and SOX2 reflects the plasticity of glioma stem-like cells[J].Translational Oncology,2017(10),555-569.
[17]Van Meir EG,Hadjipanayis CG,Norden AD,et a1.Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J].CA Cancer Clin,2010,60(3):166-193.
[18]Sathomsumetee S.Rich JN.New approaches to primary brain tumortreatment[J].AnticancerDrugs,2006,17(9):l003-10l6.
[19]Li H,Wang P,Gao Y,et a1.Na+/K+-ATPase alpha3 mediates sensitivity of hepatocellular carcinoma cells to bufalin [J].Oncol Rep,2011,25(3):825-830.
[20]苏丽宏.Bufalin对人食管癌细胞 ERK的影响[D].石家庄:河北医科大学,2012.
[21]Wang H,Ning Z,Li Y,et al.Bufalin suppresses cancer stemlike cells in gemcitabine-resistant pancreatic cancer cells via Hedgehogsignaling[J].MolMedRep,2016,14(3):1907-1914.
[22]Chang Y,Zhao Y,Gu W,et al.Bufalin inhibits the differentiation and proliferation of cancer stem cells derived from primary osteosarcoma cells through Mir-148a[J].Cell Physiol Biochem,2015,36(3):1186-1196.
[23]Chang Y,Zhao Y,Zhan H,et al.Bufalin inhibits the differentiation and proliferation of human osteosarcoma cell line hMG63-derived cancer stem cells[J].Tumour Biol,2014,35(2):1075-1082.
[24]Hu L,Sun S,Wang T,et al.Oncolytic newcastle disease virus triggers cell death of lung cancer spheroids and is enhanced by pharmacological inhibition of autophagy[J].Am J Cancer Res,2015,5(12):3612-3623.
Effect of Bufalin on Proliferation and Apoptosis of Human Glioma Cell Line U87MG and U87MG spheroids
LIU Jia, KONG Lingkai, SUN Shulan, et al. Liaoning University of Traditional Chinese Medicine,Liaoning, Shenyang 110032,Chinal.
Objective:To study the effects of bufalin on proliferation and apoptosis of human glioma cell line U87MG and U87MG spheroids.Methods:The logarithmic growth phase of U87MG cells were used to make cell suspensions.The cells were treated with different concentrations of Bufalin,and a DMSO control group was set up.Cell survival level of U87MG was detected by MTT.The effect of different concentrations of bufalin on cell proliferation for 2 weeks was measured by colony formation.U87MG cells were treated with Bufalin for 12 and 48h,and apoptosis was assessed by flow cytometric analysis using Annexin V and propidium iodide (PI) double-staining.Western blot detected the expression of cleaved-caspase-3 and cleaved-PARP in U87MG cells after treated with Bufalin for 48 h.The U87MG cells were cultured in serum-free medium with or without Bufalin for 7 days.Then whether U87MG cells can be spheroids,the morphology of the cells,the change of the size and quantity of the spheroids were observed by microscope.U87MG spheroids were infected with Bufalin for 72h and stained with PI away from light for 1 hour.Subsequently,cells were visualized by fluorescence microscopy that red fluorescencing cells were indicative of cell death.Results:The survival rate of U87MG cells which treated with Bufalin were significantly decreased than the control group and DMSO group ,and the IC50of 24 h,48 h and 72 h was respectively 85 nmol/L,34 nmol/L and 22 nmol/L.The number of clones treated with bufalin is lower than the control group,and the apoptosis ratio increased with the concentration and time dependent.The expression of cleavedcaspase-3 and cleaved-PARP were higher than control group.U87MG cells maintained in serum-free mediumcan generate spheroids.The spheroids after treated with bufalin were significantly smaller than the control group,as well as the number of spheroids.PI staining was observed that cell death ratio increased with the increase of Bufalin's concentration.Conclusion:Bufalin can inhibit the growth and proliferation of U87MG cells and promote apoptosis.Bufalin can also inhibit and kill the U87MG spheroids.
Bufalin;Glioma;Apoptosis;Cancer stem cell
R289.5
A
1004-745X(2017)11-1933-05
10.3969/j.issn.1004-745X.2017.11.015
辽宁省临床能力建设重大项目(LNCCC-B04-2015)
△通信作者(电子邮箱:pzpy@163.com)
2017-08-08)
