滇重楼预处理对脓毒症大鼠的肠道功能保护及小肠HMGB1表达的影响
2017-11-28熊伟陈思如修光辉凌斌孙洁刘萍
熊伟+陈思如+修光辉+凌斌+孙洁+刘萍
摘要:目的构建脂多糖(Lipopolysaccharide,LPS)诱导脓毒症(sepsis)大鼠早期肠损伤模型,给予不同浓度滇重楼(Rhizoma Paridis of yunnan)灌胃预处理,探讨滇重楼对脓毒症大鼠的肠道功能保护及小肠高迁移率族蛋白B1(high mobility group protein B1,HMGB1)表达的影响。方法清洁级成年SD大鼠雌性80只,随机分为5组,16只/组,对照组、模型组、低剂量组(20mg/kg.po)、中等剂量组(40mg/kg.po)、高剂量组(80mg/kg.po)。给予滇重楼预处理后,构建脓毒症大鼠模型(LPS 1mg/kg.iv),于24h取材,检测血中白细胞数(WBC)、谷丙转氨酶(ALT)、肌酸激酶同工酶MB(CK-MB)、肌酐(Cre)、乳酸(Lac)的含量,行小肠病理检查并组织学评分,采用ELISA法检测血浆中二胺氧化酶(DAO)和D乳酸(D-Lac)的含量,分别采用WesternBlot和Q-PCR检测小肠中HMGB1的蛋白及mRNA表达水平。结果模型组大鼠与对照组比较全血中ALT、CK-MB、Cre、Lac含量升高,WBC含量下降,有统计学意义(P<0.05);模型组与对照组比较大鼠存活率下降,病理组织学评分>Ⅲ级百分比升高,有统计学意义(P<0.05);不同浓度滇重楼预处理均能改善脓毒症大鼠的实验室指标、存活率及病理组织学评分,但治疗组与模型组比较ALT及高剂量组Cre差异无统计学意义(P>0.05)。模型组血浆中DAO和D-Lac含量高于对照组,而滇重楼治疗组低于模型组,差异有统计学意义(P<0.05);模型组大鼠小肠HMGB1的蛋白及mRNA表达水平高于对照组,而滇重楼治疗组低于模型组(P<0.05)。结论滇重楼预处理可能通过抑制HMGB1表达参与抗炎反应,从而改善小肠黏膜屏障通透性,发挥肠道保护功能,同时提高脓毒症大鼠的生存率,优化预后。
关键词:脓毒症;滇重楼;肠道功能保护;高迁移率族蛋白B1
中图分类号:R285.5文献标志码:A文章编号:1007-2349(2017)11-0071-04脓毒症(sepsis)是重症医学科危重患者常见死因之一,患病率约为人口3‰,病死率高达20.3%~29.9%[1],是机体对感染的反应失调而导致危及生命的器官功能障碍[2],也是严重创伤、休克、感染、外科手术等常见并发症。目前,脓毒症的发病机制尚不完全明确,而肠道细菌及内毒素移位导致的肠黏膜屏障功能障碍是其主要机制之一,也是脓毒症发生的始动环节,可诱发失控性全身炎症反应综合征(systematic inflammatory response syndrome,SIRS)致多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS),常表现为肠道功能紊乱发生最早及恢复最迟。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种高度保守的非组DNA结合蛋白,可诱导RAGE、TLR2/4、NF-κB等炎症因子释放导致多器官靶细胞损伤,作为一种晚期炎症因子在脓毒症的发生发展中起重要作用[3-5]。
据报道,滇重楼多种成分具有抗炎作用,临床可用于器官保护、抗病原微生物、抗蛇虫毒及治疗免疫系统和妇产科疾病[6]。笔者前期研究,利用脂多糖(Lipopolysaccharide,LPS)15mg/kg腹腔注构建大鼠肠黏膜功能障碍模型,滇重楼连续灌胃提示其肠黏膜抗炎保护作用。但结合临床实践经验,脓毒症炎症因子瀑布样级联释放常使疾病迅速向MODS难逆转性转变,如何在SIRS早期通过抑制炎症因子释放成为干预疾病转归的重点。本课题拟通过LPS 1mg/kg股静脉注射构建脓毒症大鼠早期肠损伤模型,探讨滇重楼预处理对脓毒症大鼠的肠道功能保护及小肠HMGB1表达的影响。
1材料与方法
1.1材料清洁级健康成年SD大鼠雌性80只,体重(200±10)g,由解放军昆明总医院科研实验中心提供(实验动物质量合格证号:SYXK(滇)2016-2017)。滇重楼由昆明医科大学第四附属医院药剂科提供。脂多糖购于美国Sigma公司;血浆二胺氧化酶(DAO)和D乳酸(D-Lac)ELISA试剂盒购于武汉华美公司;HMGB1一抗、二抗购于abmart公司;Trizol Reagent 试剂盒购于Lifetech公司;RevertAidTM First Strand cDNA Synthesis Kit试剂盒购于Fermentas公司。
1.2方法
1.2.1实驗动物分组实验采用成组设计,清洁级健康SD大鼠雌性80只,随机分为5组,对照组、模型组、低剂量组、中等剂量组、高剂量组,每组16只。将滇重楼颗粒用生理盐水制成混悬液灌胃预处理,剂量按照成人剂量的5倍、10倍、20倍,分别对应低剂量组(20 mg/kg)、中等剂量组(40 mg/kg)、高剂量组(80 mg/kg),对照组及模型组给予相同剂量生理盐水。除对照组经股静脉予以相同剂量生理盐水外,其余组经股静脉予以LPS 1 mg/kg.iv。灌胃前禁食禁饮2 h,灌胃后正常饮食,密切观察大鼠排便进食、呼吸心跳、精神状态等变化,于24 h取材分别进行检测。
1.2.2实验室指标检测腹腔注射水合氯醛0.4 g/kg麻醉大鼠,迅速开腹经腹主动脉采集动脉血,分别检测各组动物白细胞数(WBC)、谷丙转氨酶(ALT)、肌酸激酶同工酶MB(CK-MB)、肌酐(Cre)、乳酸(Lac)观察模型成立及脏器功能变化情况。
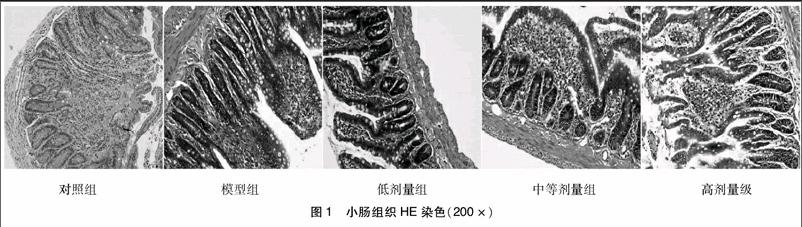
1.2.3存活率及病理组织学评分观察24 h内脓毒症大鼠存活率。分别取各组大鼠小肠用10%多聚甲醛固定24 h,经梯度乙醇脱水、二甲苯透明、石蜡包埋、常规切片和苏木素-伊红染色后,封片镜检,并对小肠切片病理组织学评分[7]:0级,黏膜无明显炎症;I级,黏膜有明显水肿,黏膜下及肌层内轻度白细胞浸润;II级,黏膜明显水肿,黏膜下及肌层内白细胞浸润增多;III级,黏膜部分缺失,腺体部分不完整,白细胞聚集;IV级,黏膜广泛破坏,腺体多数不完整,溃疡形成,肉芽组织形成,组织结构明显破坏。endprint
1.2.4ELISA法检测DAO和D-Lac水平分别取各组大鼠全血离心制成血浆,按每孔100ul分别加标准品或待测样本,37℃温育,依次加生物素标记抗体工作液、辣根过氧化物酶标记亲和素工作液、底物溶液、终止溶液,终止反应后5min内用酶标仪在450nm波长依次测量各孔OD值,分别对照DAO和D-Lac标准品进行统计分析。
1.2.5WesternBlot法检测小肠HMGB1水平分别取小肠标本制成检测标本,在样品中等体积2×上样缓冲液,按每孔100 ug蛋白上样液。配10% SDS聚丙烯酰胺凝胶进行电泳分离,转印,恒流转膜,5% 脱脂牛奶封闭,室温,摇床上摇2 h,加β-actin一抗,1:1000,4℃,过夜;TBST漂洗,加入HRP标记通用型二抗(goat来源),孵育1 h,TBST漂洗,成像。扫描条带,并用Image J进行分析。
1.2.6Q-PCR检测小肠mRNA水平采用Trizol法分别提取小肠组织的总RNA,逆转录获得cDNA,Q-PCR仪扩增(按说明书操作)。大鼠HMGB1上游引物5-TTCTTCTTGTTCTGTTCTGAG-3,下游引物5-CTTCGCAACATCACCAAT-3,PCR产物大小219 bp;内参照β-actin上游引物5-CGAGAAGATGACCCAGAT-3,下游引物5-GATAGCACAGCCTGGATA-3。软件自行得出△Ct、△△Ct、2-△△Ct值,由溶解曲线判断扩增产物的特异性。
1.3统计学处理
使用SPSS 21.0统计软件进行统计学处理。全部数据均用均数±标准差(x±s)表示,P<0.05有统计学意义;P>0.05无统计学意义。各实验组的组间及组内均采用单因素方差分析(One-Way ANOVA)对资料进行统计处理。率的比较用完全随机设计资料χ2检验,P<0.05提示两个率差异有统计学意义,P>0.05提示两个率之间差异无统计学意义。
2结果
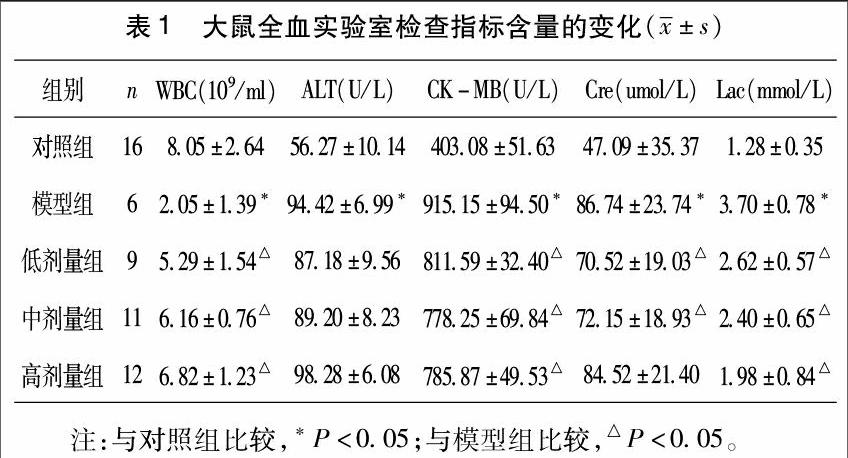
2.1生化指标检测结果模型组大鼠与对照组比较全血中ALT、CK-MB、Cre、Lac含量升高,WBC含量下降,差异均有统计学意义(P<0.05);滇重楼治疗组(低、中、高)与模型组比较全血中CK-MB、Lac含量下降,WBC含量升高,差异均有统计学意义(P<0.05);但治疗组与模型组比较ALT及高剂量组Cre差异无统计学意义(P>0.05)。见表1。
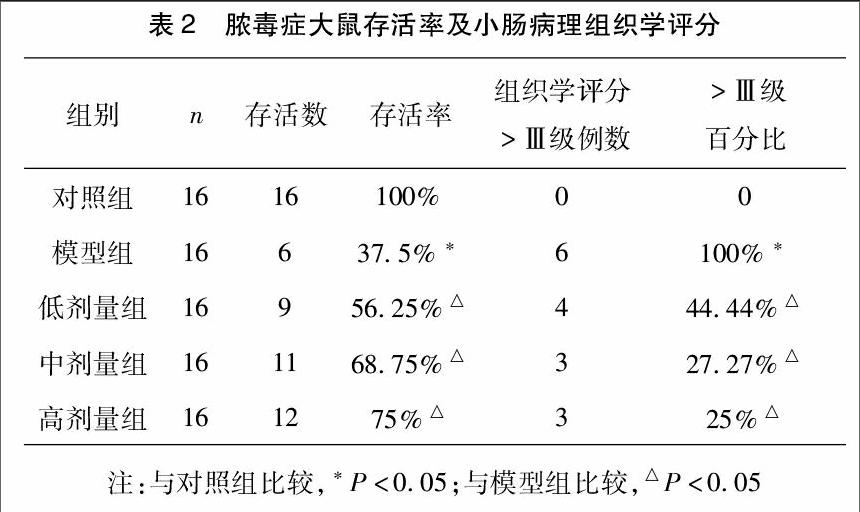
2.2脓毒症大鼠存活率及病理组织学评分结果模型组与对照组比较大鼠存活率下降,病理组织学评分>Ⅲ级百分比升高,差异均有统计学意义(P<0.05),且模型组大鼠死亡率高达62.5%;滇重楼治疗组(低、中、高)与模型组比较大鼠存活率升高,病理组织学评分>Ⅲ级百分比下降,差异均有统计学意义(P<0.05)。见表2,图1。
2.3滇重楼对脓毒症大鼠肠道功能保护作用模型组与对照组比较血浆中DAO和D-Lac含量升高,差异有统计学意义(P<0.05);滇重楼治疗组(低、中、高)与模型组比较血浆中DAO和D-Lac含量下降,差异有统计学意义(P<0.05)。见表3,图2。
2.4滇重楼对脓毒症大鼠小肠HMGB1的表达影响模型组与对照组比较小肠中HMGB1蛋白和mRNA含量升高,差异有统计学意义(P<0.05);滇重楼治疗组(低、中、高)与模型组比较小肠中HMGB1蛋白和mRNA含量下降,差异有统计学意义(P<0.05),其中中等剂量组下降最明显。见表4,图3~4。
3讨论
滇重楼为云南道地药材,资源丰富,品质优良,具有极高的药用价值,其起效方式表现在免疫调节、抗氧化作用以及对炎症细胞和因子、下丘脑-垂体-肾上腺轴、细胞凋亡、凝血/纤溶系统的影响[6],呈现出多成分、多靶点、多途径的起效方式,对于致病机制复杂的脓毒症可以起到多方位作用。周满红等[7]利用重楼总皂苷(RPTS)干预脓毒症大鼠肺损伤可使血中早期炎症因子TNF-α和IL-1显著降低。黄彦峰等[8]报道证实重楼水提液可调节小肠运动从而治疗肠道功能紊乱,其机理可能与M胆碱能受体、肾上腺素能系统有关。前期实验也发现,滇重楼连续灌胃可明显改善脓毒症大鼠腹泻、精神萎靡、运动迟缓等症状,但是,脓毒症炎症因子瀑布样级联释放常使疾病迅速向MODS难逆转性转变,如何在SIRS早期通过抑制炎症因子释放成为干预疾病转归的重点。
Tropskaya NS和Zhang Y等[9-11]研究發现滇重楼等中药可改善重症患者APACHE-Ⅱ评分、肠鸣音评分和SIRS评分,缓解腹胀、血白细胞计数降低,减少与脓毒症相关的胃肠功能障碍,其机制可能与营养支持、抗炎反应、调节肠蠕动、抗胆碱能通路等有关。本实验发现中,模型组与对照组相比大鼠血中ALT、CK-MB、Cre、Lac含量升高,WBC含量下降,差异均有统计学意义(P<0.05),提示模型组大鼠全身多个系统(肝、心、肾、循环及免疫等)均表现出功能障碍,且死亡率>60%,符合脓毒症模型指标。但治疗组ALT和Cre与模型组差异无统计学意义(P>0.05),可能与滇重楼的肝肾毒性有关。经滇重楼预处理的治疗组与模型组比较,血浆中DAO和D-Lac降低,小肠病理组织学评分>Ⅲ级百分比下降,差异均有统计学意义(P<0.05),表明滇重楼可改善肠黏膜通透性,早期预防肠内细菌移位及内毒素入血,阻断脓毒症进展,从而起到肠道保护作用。
HMGB1通过坏死细胞破坏被动释放或主动活化炎症细胞,而介导早期和晚期炎症反应及适应性免疫应答,其含量与疾病的严重程度呈正相关[12-14]。在本实验中,模型组小肠中HMGB1蛋白和mRNA表达水平高于对照组,而滇重楼治疗组低于模型组(P<0.05),其中中等剂量组下降最明显,说明滇重楼对晚期炎症因子HMGB1的分泌有抑制作用。综上所述,滇重楼预处理可能通过抑制HMGB1表达参与抗炎反应,从而改善小肠黏膜屏障通透性,发挥肠道保护功能,同时提高脓毒症大鼠的生存率,优化预后。endprint
