EPC、FMD与脓毒症患者病情严重程度的相关性研究
2019-07-06陈伟栋徐嘉黄振华古钎林廖瑾莉韦秋霞詹红
陈伟栋 徐嘉 黄振华 古钎林 廖瑾莉 韦秋霞 詹红
【摘要】目的探讨脓毒症患者外周血循环内皮祖细胞(EPC)数量及肱动脉内皮依赖性舒张功能(FMD)与病情严重程度的相关性。方法纳入脓毒症患者15例为脓毒症组,同期住院非脓毒症患者巧例为非脓毒症组,以Ficoll密度梯度离心法分离外周血单个核细胞,体外诱导分化EPC,利用ac-LDL及Lectin抗体荧光标记法进行双阳性计数;用彩色多普勒超声检查测定2组患者的FMD;以序贯器官功能衰竭估计(SOFA)评分评价患者病情严重程度。结果脓毒症组患者EPC数量较非脓毒症组少(33.9±7.7 vs.45.0±7.4,P<0.05),FMD測定值较低[(6.3±1.2)%VS.(7.7±0.9)%,P<0.05]。EPC数量与FMD测定值呈正相关(rr=0.770,P<0.001);脓毒症组患者EPC数量与SOFA评分呈负相关(rs=-0.615、P<0.001),FMD测定值与SOFA评分呈负相关(rs=-0.636、P=0.011)。结论脓毒症患者外周血循环EPC数量及FMD测定值或可作为评估脓毒症病情严重程度的指标。
【关键词】脓毒症;内皮祖细胞;肱动脉内皮依赖性舒张功能;序贯器官功能衰竭估计评分
脓毒症是因感染引起宿主反应失调导致的危及生命的器官功能障碍,是急诊科常见的危重症之一,发病率逐年升高,病死率高,救治困难[1-2]。机体发生脓毒症时,病原体通过炎症介质、细胞因子等介导而引发一系列的炎症反应,导致血管内皮损伤。血管内皮功能损伤,一方面,血管舒张、毛细血管渗漏、内皮肿胀等导致的炎性介质浸润造成组织、器官微循环障碍,引发缺血、缺氧;另一方面,内皮细胞直接参与免疫应答,引起机体免疫功能下降,组织、器官对抗病原体能力下降,造成器官损伤进一步加重[3-4]。内皮祖细胞(EPC)是近年来被发现的一类具有干细胞潜能的前体细胞,能够定向分化增殖形成成熟的血管内皮细胞,从而起到修复、再生血管作用。在心血管疾病、脑血管疾病、周围血管疾病及肿瘤血管新生研究中,均证实了EPC在维持和修复内皮细胞功能、血管新生中扮演重要角色[5]。肱动脉血流介导的内皮依赖性舒张功能(FMD)能反映内皮功能紊乱程度,FMD检测是一种无创、可重复的检测血管内皮功能的新技术[6]。在脓毒症发病机制中EPC数量和FMD变化及其作用机制迄今尚未明确。笔者通过测定脓毒症患者循环EPC数量和FMD,就其与脓毒症病情严重程度的相关性进行初步探讨。
对象与方法
一、研究对象
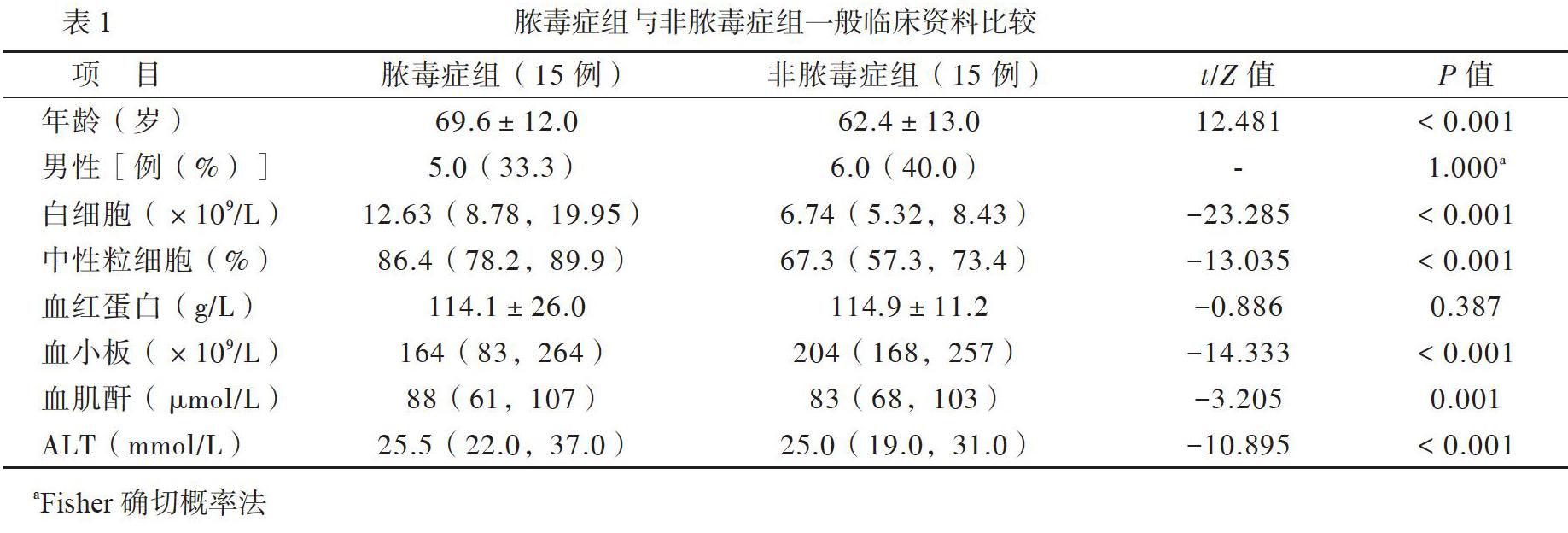
连续纳入2017年10月至2018年3月中山大学附属第一医院急诊科收治的脓毒症患者15例为脓毒症组,诊断标准参照2016年拯救脓毒症运动制定的脓毒症和脓毒症休克诊断指南(Sepsis 3.0)[1]。15例中男5例、女10例;同时抽取同期住院的非脓毒症患者15例作为非脓毒症组,其中男6例、女9例。所有患者均排除以下情况:①既往有高血压病、糖尿病、高脂血症、冠状动脉粥样硬化性心脏病、脑卒中、肿瘤病史;②孕妇;③年龄小于18岁。2组患者基线资料见表1。本研究由中山大学附属第一医院伦理委员会批准,人组前所有患者或其家属均签署了知情同意书。
二、主要仪器与试剂
红细胞裂解液、淋巴细胞分离液购于中国碧云天公司,EBM-2培养基、DMEM高糖培养基、胎牛血清和0.25%胰酶购于美国Gibco公司,人纤维黏连蛋白购于康宁公司,磷酸盐缓冲液(PBS)、乙酞化低密度蛋白(ac-LDL)一抗和外源凝集素(Lectin)一抗购于美国Sigma公司,4%多聚甲醛购于雷根公司,日立彩色多普勒超声诊断仪(型号TJ454)。
三、分离外周血单个核细胞及培养EPC
抽取2组患者外周静脉血15ml,常温下保存于肝素抗凝管。3h内加入等体积PBS稀释,抽取混合稀释后的血液缓慢垂直加入等体积淋巴细胞分离液液面,常温离心,400g×30min、小心吸取中间的白膜层置于15ml离心管,经PBS 5ml洗涤2次,加入红细胞裂解液后充分裂解,常温离心,400g×10min。弃上清后加入EBM-2培养基,混合后均匀铺于人纤维蛋白包被的6孔细胞培养板,于5%二氧化碳、37℃培养箱常规培养。培养第4日换液,第7日置于倒置相差显微镜下观察细胞形态[7]。
四、细胞计数
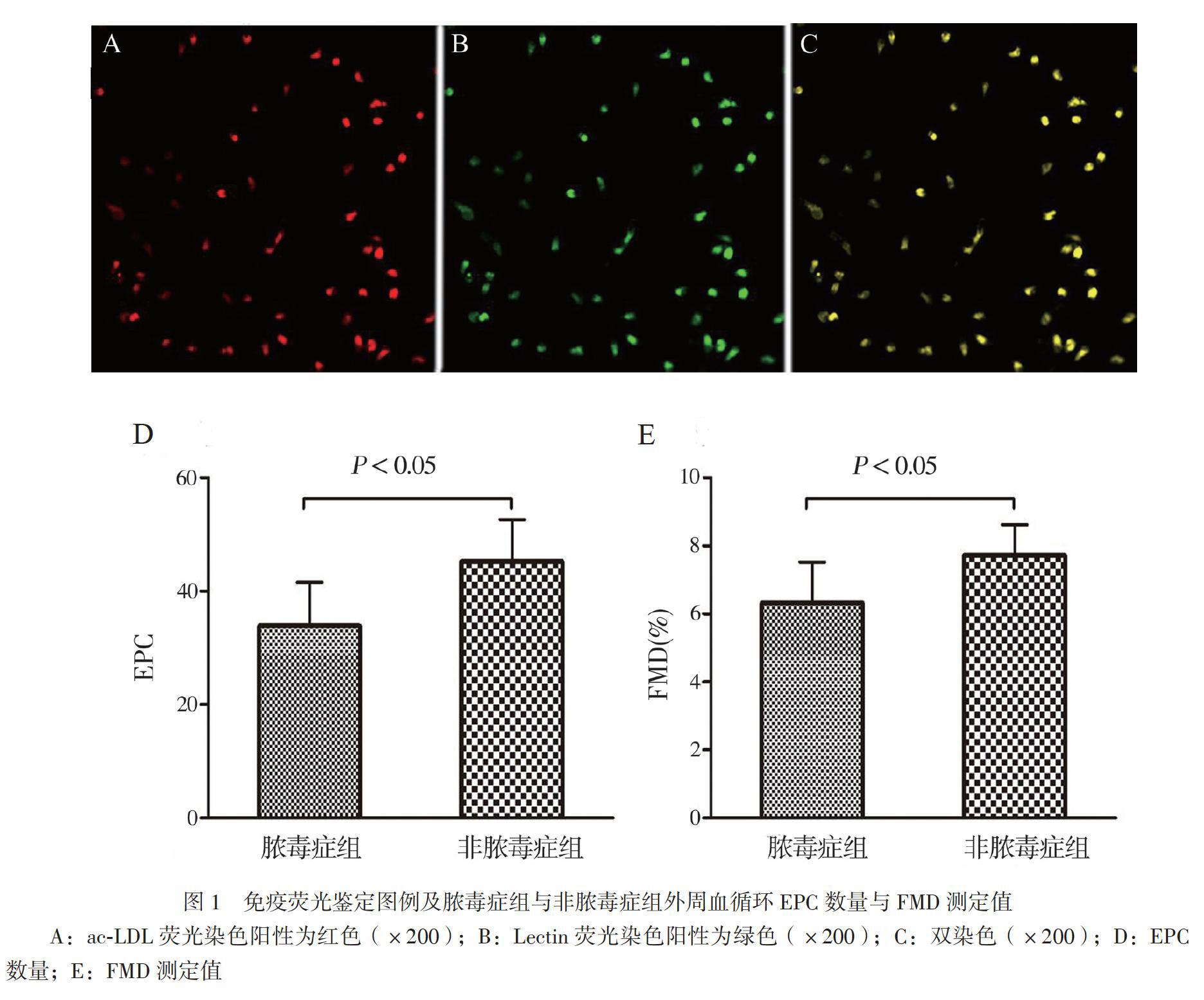
细胞培养7d后取一部分贴壁细胞在10μg/L的ac-LDL溶液中孵育1h,之后用4%多聚甲醛固定,以10μg/L的Lectin抗体溶液孵育1h,并置于荧光显微镜下观察拍片,贴壁细胞吞噬ac-LDL荧光染色阳性为红色,Lectin抗体荧光染色阳性为绿色,双染色阳性即红色和绿色双染色细胞为EPC,计算EPC数量[7]。
五、计算脓毒症组与非脓毒症组患者序贯器官功能衰竭估计(SOFA)评分
记录2组患者循环血压、氧合指数、肌酐、胆红素、血小板计数及GCS评分,根据脓毒症和脓毒症休克诊断指南(Sepsis 3.0)进行SOFA评分川。
六、受试者胧动脉FMD测定值
使用日立彩色多普勒超声诊断仪分别测定2组安静状态下、反应性充血时肱动脉内径变化。于右臂肘上2~3cm处探测肱动脉,取其纵切面,调节增益直至前后壁内膜显示最清晰,同步在心电波形R波顶点处测量心室舒张末期时前后内膜间距作为血管基础内径。后行反应性充血试验,将血压计袖带缚于前臂肘关节下2~3cm处,充气加压至250mm Hg(1mm Hg=0.133kPa),持续5min后迅速放气,于放气后1min内测量胧动脉内径。在测量过程中,超声探头始终固定于同一位置,测量同一处血管[8]。取3个心动周期的平均值,计算充血实验前后差值与基础内径比值。
七、统计学处理
采用SPSS 15.0分析数据。正态分布计量资料以x1s表示,2组间比较采用t检验;非正态分布计量资料用中位数(上、下四分位数)表示,组间比较用秩和检验。计数资料用率(百分比)表示,组间比较用Fisher确切概率法。相关性采用Spearman秩相关分析。P<0.05为差异有统计学意义。
结果
一、脓毒症组与非脓毒症组EPC数量和FMD测定值的比较
免疫荧光染色图例见图1A~C。比较脓毒症组与非脓毒症组EPC数量和FMD测定值,结果显示脓毒症组EPC数量为33.9±7.7,较非脓毒症组45.0±7.4少(t=-3.63,P<0.05),见图1D;脓毒症组FMD测定值为(6.3±1.2)%,较非脓毒症组的(7.7±0.9)%低(t=-4.05,P<0.05),见图1E。
二、脓毒症组和非脓毒症组EPC、FMD与SOFA评分的相关分析结果
Spearman秩相关分析结果显示EPC数量与FMD测定值呈正相关(rs=0.770,P<0.001)。在脓毒症组中进一步分析,结果显示EPC数量与反映患者病情严重程度的SOFA评分呈负相关(rs=-0.615,P=0.015)、且FMD测定值与SOFA评分呈负相关(rs=-0.636,P=0.011)。
讨论
机体发生脓毒症时,病原体引起的各种炎症介质及细菌毒素释放均可造成血管内皮损伤,发生组织渗漏、有效循环血量减少、组织缺血缺氧加重,严重者最后发展至MODS。既往的研究表明,内皮细胞损伤的严重程度与脓毒症患者的预后直接相关,内皮功能损伤越严重的脓毒症患者预后越差,病死率越高。血管内皮损伤时,作为内皮细胞前体细胞的EPC从骨髓到损伤部位进行修复及新生血管再生,在维持血管内皮细胞功能上发挥着重要作用。我们通过测定EPC的数量及肱动脉FMD来反映血管内皮功能,从而进一步评估脓毒症患者的病情严重程度。
本研究结果显示脓毒症组患者的EPC数量较非脓毒症组少,这与既往文献报道的结论相一致。Mayr等[9]发现,将小剂量的内毒素注人人体可减少EPC数量。Zahran等[10]发现,在儿科脓毒症患儿中,严重脓毒症患儿EPC数量更低,EPC数量高的脓毒症患儿生存率越高。Fan等[11]发现, EPC及基质细胞生长因子可改善脓毒症患者预后。徐喜媛等[12]的动物实验表明,移植到脓毒症小鼠体内的EPC可成功通过血管进人肺、肝、肾等组织,下调促炎反应程度,提高小鼠的生存率,预示EPC移植或可改善脓毒症患者预后。我们使用经典的SOFA评分对脓毒症患者进行器官损伤的评分,发现EPC数量与SOFA评分呈负相关,提示EPC数量可以反映脓毒症患者的病情严重程度。严重脓毒症时EPC数量明显下降可能与骨髓抑制、EPC损伤破坏、炎症介质诱导EPC凋亡有关,具体机制尚未明确[13]。
FMD检测是一种无创的检查方法,FMD测定值已被广泛认可作为血管内皮功能的评价指标。本研究中2组患者外周血循环EPC数量与FMD测定值呈正相关,提示EPC数量可以正向反映患者的血管内皮功能,脓毒症时EPC数量下降伴随FMD测定值减低,血管内皮功能受损。
我们进行FMD测定值与SOFA评分的相关性分析,发现两者呈负相关,即SOFA评分越高,FMD测定值越低,表明FMD测定值可以用于评价脓毒症患者的病情严重程度。
总之,脓毒症患者外周血循环EPC数量减少,FMD测定值降低,且与SOFA评分呈负相关,因此可通过无创的方法测定肱动脉FMD及循环EPC数量来评估器官损傷程度,预测病情预后,为临床评估脓毒症病情提供新的检测手段。EPC或可作为评估脓毒症严重程度新的分子生物学标志物和重要治疗靶点,相关机制需作进一步探讨。
参考文献
[1]Singer M,Deutschman CS,Seymour CW,Shankar-Hari M,Annane D,Bauer M,Bellomo R,Bernard GR,Chiche J,Coopersmith CM,Hotchkiss RS,Levy MM,Marshall JC,Martin GS,Opal SM,Rubenfeld GD,van der Poll T,VincentJ,Angus DC.The third international consensus definitions forsepsis and septic shock(Sepsis-3).JAMA,2016,315(8):801-810.
[2]Martin GS.Sepsis,severe sepsis and septic shock:changesin incidence,pathogens and outcomes.Expert Rev Anti InfectTher,2012,10(6):701-706.
[3]章志丹,马晓春.脓毒症血管内皮细胞损伤与微循环功能障碍.中华危重病急救医学,2011,23(2):125-128.
[4]Bracco D.Microcirculation:more questions than answers.CritCare Med,2009,37(8):2470-2471.
[5]Ikutomi M,Sahara M,Nakajima T,Minami Y,Morita T,Hirata Y,Komuro I,Nakamura F,Sata M.Diverse contributionof bone marrow-derived late-outgrowth endothelial progenitorcells to vascular repair under pulmonary arterial hypertensionand arterial neointimal formation.J Mol Cell Cardiol,2015,86:121-135.
[6]Liu X,Zhang GX,Zhang XY,Xia WH,Yang Z,So C,QiuYX,Xu SY,Zhan H,Tao J.Lacidipine improves endothelialrepair capacity of endothelial progenitor cells from patients withessential hypertension.Int J Cardiol,2013,168(4):3317-3326
[7]Yang Z,Chen L,So C,Xia WH,Wang Y,Wang JM,ChenF,Zhang YY,Wu F,Xu SY,Zhang XL,Tao J.Impairedendothelial progenitor cell activity is associated with reducedarterial elasticity in patients with essential hypertension.ClinExp Hypertens,2010,32(7):444-452.
[8]Lambiase MJ,Dorn J,Thurston RC,Roemmich JN.Flow-mediated dilation and exercise blood pressure in healthyadolescents.J Sci Med Sport,2014,17(4):425-429.
[9]Mayr FB,Spiel AO,Leitner JAI,Firbas C,Sieghart W,Jilma B.Effects of low dose endotoxemia on endothelial progenitor cells inhumans.Atherosclerosis,2007,195(1):e202-e206.
[10]Zahran AM,Elsayh KI,Mohamad IL,Hassan GM,Abdou MA.Circulating endothelial cells and endothelial progenitor cells inpediatric sepsis.Pediatr Emerg Care,2016,32(3):163-167.
[11]Fan H,Goodwin AJ,Chang E,Zingarelli B,Borg K,GuanS,Halushka PV,Cook JA.Endothelial progenitor cells and astromal cell-derived factor-lalpha analogue synergistically im-prove survival in sepsis.Am J Respir Crit Care Med,2014,189(12):1509-1519.
[12]徐喜媛,楊敬平,那[格日勒,乌日娜,田红军,宋慧芳,王慧.内皮祖细胞移植对脓毒症大鼠的治疗作用.中华危重病急救医学,2015,27(6):514-519.
[13]张颖轩.内皮祖细胞内皮修复的影响因素.新医学,2013、44(12):803-806.
(收稿日期:2018-12-20)
(本文编辑:洪悦民)
DOI:10.3969/j.issn.0253-9802.2019.05.010
基金项目:国家自然科学基金青年项目(81801948);广东省自然科学基金(2016A030313249);广州市科技项目(201804010007)
作者单位:510080 广州,中山大学附属第一医院急诊科
通信作者,詹红,E-mail:zhanhong81@126.com
