氧化苦参碱抑制DBTC刺激的胰腺腺泡细胞中上皮间质转化相关蛋白及TβRⅡ和p-Smad2/3表达
2017-11-28李如月向晓辉夏时海
张 斌,许 威,李如月,张 青,向晓辉,夏时海
(武警后勤学院附属医院 肝胆胰脾中心,天津 300162)
临床医学研究
氧化苦参碱抑制DBTC刺激的胰腺腺泡细胞中上皮间质转化相关蛋白及TβRⅡ和p-Smad2/3表达
张 斌,许 威,李如月,张 青,向晓辉,夏时海
(武警后勤学院附属医院 肝胆胰脾中心,天津 300162)
目的探讨二氯二丁基酯(Dibutyltin dichloride,DBTC)及氧化苦参碱(oxymatrine,OM)对胰腺腺泡细胞中上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白和TGFβ1/Smad信号通路影响。方法体外常规传代培养AR42J细胞。CCK-8法检测0、0.1、1、10、100 μmol/L的DBTC对AR42J细胞毒性作用。Western Blot法检测0、0.1、1、10 μmol/L的 DBTC刺激AR42J细胞72h后EMT相关蛋白E-cadherin、Vimentin及Snail1表达。Western Blot法检测对照组(Control组)、模型组(DBTC:10 μmol/L)、OM治疗组(DBTC: 10 μmol/L; OM: 1mg/mL)及药物对照组(OM: 1 mg/mL)中E-cadherin、Vimentin、Snail1及转化生长因子β1Ⅱ型受体(TβRⅡ)、p-Smad2/3的表达。结果浓度低于10 μmol/L的DBTC对AR42J细胞无明显的毒性作用。1 μmol/L及10μmol/L DBTC刺激AR42J细胞可下调E-cadherin同时上调Vimentin、Snail1的表达。与对照组相比,10 μmol/L DBTC刺激AR42J细胞72 h后还可上调TβRⅡ、p-Smad2/3表达,OM可逆转上述蛋白的表达。结论DBTC可诱导胰腺腺泡细胞发生EMT,OM对此有抑制作用,其机制可能与TGFβ1/Smad 通路有关。
氧化苦参碱;上皮间质转化;DBTC;胰腺纤维化
胰腺纤维化(pancreatic fibrosis,PF)是慢性胰腺炎(chronic pancreatitis,CP)的主要病理过程,近些年认为胰腺星状细胞(pancreatic stellate cell,PSC)异常激活产生大量细胞外基质(extracellular matrix,ECM)是PF的中心环节[1]。上皮间质转化(epithelial-mesenchymal transition,EMT)使上皮细胞向间质样细胞转变,增加ECM中纤维成分的表达,因此可认为是纤维化的重要补充[2-3]。最近的研究也发现EMT存在于人的PF组织中[3],但关于EMT在PF发生发展中作用的相关研究还极少。二氯二丁基酯(Dibutyltin dichloride,DBTC)是常用的CP动物模型造模药物,存在TGFβ1/Smad 信号通路的激活;同时DBTC还可诱导胰腺腺泡细胞发生凋亡并且与PF程度相关[4-5],提示胰腺腺泡细胞可能参与了PF过程,但其发挥作用的方式还不清楚。氧化苦参碱(oxymatrine,OM)是药用苦参干燥根中提取的生物碱,具有抗实验性PF作用,同时对PF模型中高表达的转化生长因子β1(transforming growth factorβ1,TGFβ1)Ⅱ型受体(TβRⅡ)及Smad2/3有抑制作用[1,6]。此外,研究还发现OM可以通过抑制肾小管EMT进而抑制肾纤维化,且机制可能与TGFβ1/Smad 信号通路有关[7]。基于上述研究,我们利用DBTC体外刺激胰腺腺泡细胞,观察EMT相关蛋白E-cadherin、Vimentin和Snail1以及TβRⅡ、p-Smad2/3的表达;同时观察OM对上述蛋白表达影响,初步探讨EMT在PF发生中的作用及OM抗实验性PF的机制,为CP的临床药物开发提供理论参考。
1 材料与方法
1.1 材料 大鼠胰腺腺泡细胞株AR42J购自美国典型培养物保藏中心(American type culture collection,ATCC);胎牛血清(fetal bovine serum,FBS)购自Gibco公司;RPMI1640培养基购自HyClone公司;青链霉素混合液购自Solarbio公司;DBTC购自Sigma公司;OM购自Abcam公司;CCK-8试剂盒购自日本同仁公司;全蛋白提取试剂盒购自上海碧云天公司;BCA 蛋白定量试剂盒购自北京鼎国昌盛公司;蛋白Marker购自Solarbio公司;PVDF 膜购自BD公司;ECL发光液购自上海碧云天公司;单克隆兔抗鼠E-cadherin、兔抗鼠Vimentin、兔抗鼠Snail1、兔抗鼠p-Smad2/3和兔抗鼠GAPDH 购自沈阳万类公司;兔抗鼠TβRⅡ购自Proteintech公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗购自北京鼎国昌盛公司。Multiskan FC多功能酶标仪购自美国Thermo Fisher公司;电泳仪、垂直版电泳槽、转膜槽购自美国Bio-Rad公司;5 200 Multi自动荧光/化学发光成像仪购自上海天能科技有限公司。
1.2 方法
1.2.1 细胞培养 AR42J 细胞用含10%FBS、1% 青链霉素的1640培养基,置于37 ℃、5%CO2的孵育箱中常规传代培养。将对数生长期细胞随机分为4组分别用0、0.1、1、10 μmol/L的DBTC处理筛选出DBTC的最佳药物刺激浓度进行后续实验;再将细胞随机分为对照组(Control组)、模型组(DBTC:10 μmol/L)、OM治疗组(DBTC:10 μmol/L;OM:1 mg/mL)、药物对照组(OM:1 mg/mL)以研究DBTC对AR42J细胞EMT相关蛋白和TGFβ1/Smad通路影响及OM对此的作用。待细胞增至70%~80%接触率时用不含FBS的1640培养基继续培养4h后加入相应药物,OM提前半小时加入,72 h后终止培养。
1.2.2 CCK-8法测AR42J细胞增殖 取对数生长期的AR42J细胞接种于96孔板,每孔加入含10%FBS的细胞悬液100μL,细胞密度为1×104个/孔,实验孔周围每孔加D-Hank’s液100 μL以保持湿度。实验孔分别以0、0.1、1、10、100 μmol/L的DBTC刺激,设4复孔,另设调零组(加入不含细胞的1640培养基100 μL)。分别加入相应药物于37 ℃、5%CO2的孵育箱中培养72 h。而后每孔加入10 μLCCK-8试剂,于孵育箱中继续培养4 h后,摇床低速震荡10 min。酶联免疫检测仪450 nm波长下检测各孔吸光度值(OD值)。
1.2.3 Western Blot检测EMT相关蛋白及TβRⅡ、p-Smad2/3表达 超声裂解法提取AR42J细胞总蛋白,定量后用聚丙烯酰胺凝胶电泳法进行分离,上样量30 μg,电泳电压为80 V,电泳结束后以200 mA恒流2 h冰浴下将蛋白转至PVDF 膜上,转膜结束后将目的蛋白条带置于含5%脱脂奶粉的TBST缓冲液中封闭2 h,再对应加入兔抗鼠E-cadherin、Vimentin、Snail1、TβRⅡ、p-Smad2/3和GAPDH一抗稀释液(1∶1 000), 4 ℃条件下过夜,TBST洗膜3次,每次10 min,而后加入HRP标记的山羊抗兔二抗稀释液(1∶10 000)室温中孵育3 h,TBST洗膜3次,每次10 min,ECL化学发光显影。以GAPDH 作为内参,条带灰度值通过Image J软件测取。
1.3 统计学处理 采用GraphPad Prism 6统计软件进行统计分析。多组间比较用单因素方差分析,两组比较采用SNK法,Plt;0.05为差异有统计学意义。
2 结果
2.1 DBTC对AR42J细胞的毒性作用 以不同量级浓度DBTC刺激AR42J细胞观察DBTC对其增殖影响。结果显示,100 μmol/L DBTC可抑制AR42J细胞增殖(Plt;0.05),而10 μmol/L以下浓度DBTC对AR42J细胞增殖无明显抑制即无明显毒性作用(见图1)。故用10 μmol/L以下浓度DBTC进行后续实验。
2.2 DBTC对AR42J细胞中EMT相关蛋白表达影响 与0 μmol/L DBTC刺激组相比,1 μmol/L及10 μmol/L浓度的DBTC刺激AR42J细胞72 h
可下调E-cadherin及上调Vimentin、Snail1的蛋白表达水平(Plt;0.05),而0.1 μmol/L DBTC无明显作用(见图2)。其中1 μmol/L与10 μmol/L DBTC组间差异无统计学意义,我们选择后者进行后续实验。
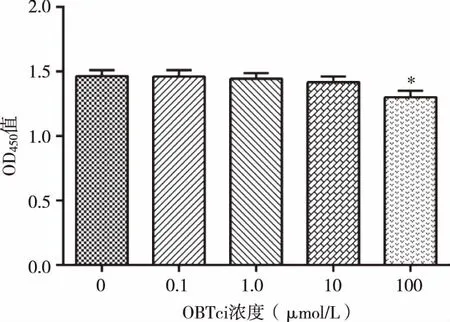
与0 μmol/L DBTC组比较,*Plt;0.05。 图1 DBTC对AR42J细胞的毒性作用
2.3 OM对DBTC刺激的AR42J细胞中EMT相关蛋白表达影响 10 μmol/L DBTC刺激AR42J细胞72 h可下调E-cadherin及上调Vimentin、Snail1的蛋白表达水平;OM(1 mg/mL)干预后上述结果被逆转;单独的OM对EMT相关蛋白表达无影响(与对照组相比,*Plt;0.05;与DBTC组相比,#Plt;0.05,见图3)。

A:电泳图;B:数据图;与对照组相比,*Plt;0.05;与DBTC组相比,#Plt;0.05。 图3 OM对DBTC刺激的AR42J细胞中EMT相关蛋白表达影响
2.4 OM对DBTC刺激的AR42J细胞中TβRⅡ及p-Smad2/3表达影响 100 μmol/L DBTC刺激AR42J细胞72 h可上调TβRⅡ及p-Smad2/3的表达水平;OM(1 mg/mL)干预后上述结果被逆转;单独的OM对TβRⅡ及p-Smad2/3表达无影响(与对照组相比,*Plt;0.05;与DBTC组相比,#Plt;0.05,见图4)。
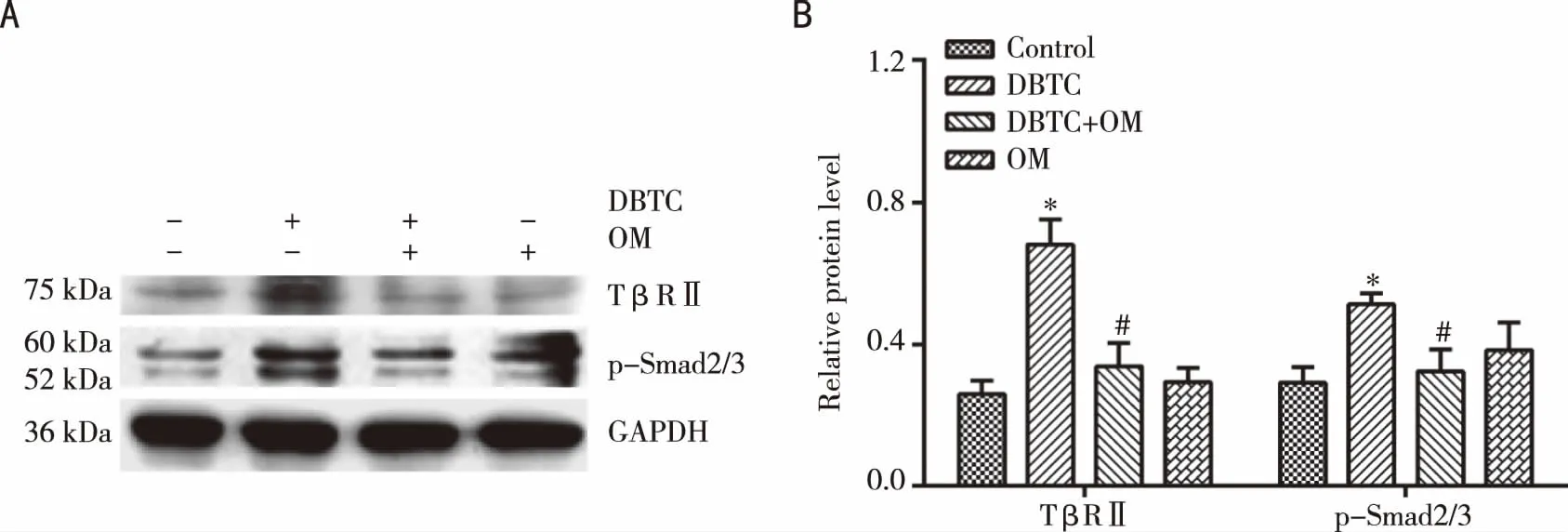
A:电泳图;B:数据图;与对照组相比,*Plt;0.05;与DBTC组相比,#Plt;0.05。 图4 OM对DBTC刺激的AR42J细胞中TβRⅡ及p-Smad2/3表达影响
3 讨论
CP发病机制复杂,临床尚无特效药物,其主要病理特征为PF,表现为纤维组织逐步取代正常胰腺组织导致内外分泌功能障碍。PF的发生基础是ECM合成增加而降解减少导致基质中胶原纤维、纤连蛋白等纤维成分大量沉积[6]。PSC的异常激活在PF的发生中发挥核心作用,此外胰腺腺泡细胞也可能是纤维成分的重要来源[8]。课题组前期研究发现,TGFβ1刺激AR42J细胞,EMT相关标志蛋白表达变化明显[9];进一步的实验得出TGFβ1可能通过诱导胰腺腺泡细胞发生EMT进而促进PF的进展,且机制与TGFβ1/Smad信号通路有关。
EMT已证实是肝、肾、肺等组织发生纤维化的重要途径,它是指上皮细胞失去极性和细胞间连接转变成间质样细胞的过程,表现为细胞增殖、迁移能力增强,伴有上皮标志蛋白E-Cadherin、ZO-1表达减少而间质标志蛋白Vimentin、α-SMA等表达增加,同时EMT相关转录因子如Snail、Twist等被激活,在肿瘤转移及组织纤维化中发挥重要作用[2,7,10-11]。TGFβ1是最强效的EMT诱导因子和促纤维化因子,可通过激活TGFβ1/Smad通路诱导EMT进而发生纤维化,且其他刺激因子在诱导EMT的过程中多伴有TGFβ1的表达增高[7,10]。DBTC是常用的CP动物模型造模药物,其对胰胆管上皮细胞的毒性作用可导致上皮坏死、导管梗阻,随后胆汁持续淤积产生CP;血源性的DBTC还可造成胰腺细胞线粒体损伤、自噬、凋亡,加重胰腺的急性期炎症[12-13],且DBTC造成的大鼠胰腺腺泡细胞凋亡与纤维化程度有关[5]。同时,TGFβ1/Smad通路参与了DBTC诱导的大鼠CP模型,且Smad7在蛋白水平表达下降而mRNA水平表达升高,可能与TGFβ1/Smad通路的负反馈调节有关[4,13-14]。Xu等发现,滨蒿内酯可抑制DBTC诱导的大鼠CP模型,其机制可能与滨蒿内酯对TGFβ1/Smad通路及EMT的抑制有关[15]。基于上述研究,我们用DBTC体外刺激AR42J细胞,发现E-cadherin表达下调以及Vimentin、Snail1表达上调,表明DBTC可以诱导胰腺腺泡细胞发生EMT。同时TβRⅡ、p-Smad2/3表达升高,提示TGFβ1/Smad通路可能参与了DBTC诱导的胰腺腺泡细胞发生EMT的过程。
OM是从传统中药苦参中提取的喹诺里西啶类生物碱,具有抗病毒、抗纤维化、抗炎等多种药理作用,其作用的信号通路包括TGFβ/Smad、TLR等多种通路[16]。我们的前期研究发现OM具有抗实验性PF作用,其机制包括对胰腺细胞中TGFβ/Smad通路的抑制[1,6]。此外,Liu等发现,OM可以抑制肾小管发生EMT进而抑制肾纤维化的进展,其机制与TGFβ1/Smad通路有关[7]。OM还可以通过抑制TGFβ1/Smad通路的EMT进而抑制肿瘤的转移[17]。在本实验中我们发现,OM可逆转DBTC刺激AR42J细胞引起的E-cadherin下调以及Vimentin、Snail1、TβRⅡ、p-Smad2/3的上调,提示OM可能是通过抑制TGFβ1/Smad 通路来抑制DBTC诱导胰腺腺泡细胞发生EMT样改变。
综上所述,DBTC可诱导胰腺腺泡细胞发生EMT样改变,结合DBTC可诱导大鼠PF,提示EMT可能在PF的发生中发挥重要作用。OM一定程度逆转了DBTC诱导的EMT样改变,同时抑制了DBTC引起的TβRⅡ和p-Smad2/3的上调,丰富了OM抗PF的机制,为OM未来的临床应用提供理论参考。
[1] 陈凯,荣亚梅,曹卫丽,等.氧化苦参碱对TGFβ1刺激的胰腺星状细胞Smad通路相关因子表达的影响[J].世界华人消化杂志,2015,23(12):1883-1889.
[2] 李小波,彭榜亚,杨江权,等.桃仁、红花对UUO大鼠肾组织ILK、E-Cad、FN和α-SMA表达的影响[J].遵义医学院学报,2017,40(2):134-138.
[3] Deng S C,Zhu S,Wang B,et al.Chronic pancreatitis and pancreatic cancer demonstrate active epithelial-mesenchymal transition profile,regulated by miR-217-SIRT1 pathway[J].Cancer Letters,2014,355(2):184-191.
[4] 许小凡,姜婷婷,刘芳,等.大柴胡汤调控TGFβ1/Smad信号通路对DBTC 联合乙醇诱发小鼠胰腺纤维化的防治作用[J].中国应用生理学杂志,2016,32(5):446-449.
[5] Matsushita K,Mizushima T,Shirahige A,et al.Effect of taurine on acinar cell apoptosis and pancreatic fibrosis in dibutyltin dichloride-induced chronic pancreatitis[J].Acta Med Okayama,2012,66(4):329-334.
[6] 苏丽婷,夏时海,郑永青.转化生长因子β1Ⅱ型受体在大鼠慢性胰腺炎中的表达及氧化苦参碱对其的影响[J].世界华人消化杂志,2011,19(2):121-125.
[7] Liu L R,Wang Y Y,Yan R,et al.Oxymatrine inhibits renal tubular EMT induced by high glucose via upregulation of snon and inhibition of TGF-β1/Smad signaling pathway [J].Plos One,2016,11(3):e0151986.
[8] 赵德育,崔勤.胰腺腺泡细胞及导管上皮细胞产生胶原纤维的研究(简报)[J].中国医学科学院学报,1993,15(5):363.
[9] 张青,王亚丽,卢美丽,等.TGFβ1刺激不同时间对胰腺腺泡细胞中ZNF580和EMT相关因子的影响[J].武警后勤学院学报:医学版,2016,25(12):959-963.
[10]Rivka C,Irena Pastar S,Ojeh N,et al.Epithelial-mesenchymal transition in tissue repair and fibrosis[J].Cell Tissue Res,2016,365(3):495-506.
[11]丁伟娜,冯继红,丁陈波,等.PRDX2基因沉默促进结直肠癌细胞上皮-间质转化增强侵袭转移能力[J].遵义医学院学报,2015,38(1):74-80.
[12]Merkord J,Jonas L,Weber H,et al.Acute interstitial pancreatitis in rats induced by dibutyltin dichloride (DBTC): pathogenesis and natural course of lesions[J].Pancreas,1997,15(4):392-401.
[13]Zhang S K,Cui N Q,Zhuo Y Z,et al.Modified xiaochaihu decoction prevents the progression of chronic pancreatitis in rats possibly by inhibiting transforming growth factor-β1/Sma- and Mad-Related proteins signaling pathway[J].Chin J Integr Med,2013,19(12):935-939.
[14]Hou X J,Jin Z D,Jiang F,et al.Expression of Smad7 and Smad ubiquitin regulatory factor 2 in a rat model of chronic pancreatitis[J].J Dig Dis,2015,16(7):408-415.
[15]Xu M,Cai J,Wei H,et al.Scoparone protects against pancreatic dibrosis via TGF-β/smad signaling in rats[J].Cell Physiol Biochem,2016,40(1-2):277-286.
[16]Lu M L,Xiang X H,Xia S H.Potential signaling pathways involved in the clinical application of oxymatrine[J].Phytother Res,2016,30(7):1104-1112.
[17]Wang X Y,Liu C,Wang J Q,et al.Oxymatrine inhibits the migration of human colorectal carcinoma RKO cells via inhibition of PAI-1 and the TGF-β1/Smad signaling pathway[J].Oncol Rep,2017,37(2):747-753.
[收稿2017-08-10;修回2017-09-06]
(编辑:王福军)
Oxymatrineinhibitsepithelial-mesenchymaltransitionandtherelatedproteinexpressionsofTβRⅡandp-Smad2/3inducedbyDibutyltindichlorideinpancreaticacinarcells
ZhangBin,XuWei,LiRuyue,ZhangQing,XiangXiaohui,XiaShihai
(Department of Hepatopancreatobiliary and Splenic Medicine,Affiliated Hospital of Logistics University of the People ′s Armed Police,Tianjin 300162,China)
ObjectiveTo explore the effects of Dibutyltin dichloride (DBTC) and oxymatrine (OM) on epithelial-mesenchymal transition (EMT) and the related protein expressions of TGFβ1/Smad signaling pathway in pancreatic acinar cells.MethodsAR42J cells were culturedinvitroand treated with DBTC for 72 hours at different concentrations.The cytotoxicity of DBTC on AR42J cells was measured by CCK-8 assay.The protein expressions of E-cadherin,Vimentin,Snail1,TβRⅡand p-Smad2/3 treated by DBTC with or without OM in AR42J cells were detected by Western Blotting.ResultsDBTC had no significant cytotoxicity on AR42J cells at less than 10 μmol/L concentration.DBTC (1 μmol/L or 10 μmol/L) could downregulate E-cadherin and upregulate Vimentin and Snail1 in AR42J cells.Compared with control group,DBTC (10 μmol/L) stimulated AR42J cells for 72 hours and also upregulated TβRⅡand p-Smad2/3,whereas OM reversed the alterations.ConclusionDBTC induces EMT,which could be inhibited by OM,via TGFβ1/Smad signaling pathway in pancreatic acinar cells.
Oxymatrine; epithelial-mesenchymal transition; DBTC; pancreatic fibrosis
国家自然科学基金青年项目(NO:81500489);天津市应用基础与前沿技术研究计划青年项目(NO:15JCQNJC45600);武警后勤学院附属医院种子基金重点项目(NO:FYZ201508)。
夏时海,男,博士,教授,硕士生导师,研究方向:胰腺疾病临床与基础,E-mail:xshhcx@sina.com。
R285.5
A
1000-2715(2017)05-0531-05
