气相色谱法测定猪凝血酶冻干粉中磷酸三丁酯残留量
2017-11-27刘璐赵莹莹张军东
刘璐+赵莹莹+张军东



摘 要 建立了气相色谱法测定猪凝血酶中磷酸三丁酯残留量,并进行了方法学验证。采用聚乙二醇毛细管柱Agilent HP-INNOWAX(30 m × 250 mm × 0.25 mm),溶剂为正己烷;气化室温度190 ℃,分流比1∶1,进样量1 ml;FID检测器温度210 ℃;载气为高纯氮气,流速为3 ml/min;柱温150 ℃,运行时间13 min。结果显示该方法专属性强;标准曲线的线性范围为2.406~19.25 mg/ml;低、中、高3个浓度水平的平均回收率分别为97.1%、101.1%和98.2%,总平均回收率为99.8%,总相对标准偏差为2.37%;中间精密度总标准偏差为5.01%;检测限为0.762 mg/ml,定量限为2.54 mg/ml;3批样品的磷酸三丁酯残留量均低于《中华人民共和国药典》2015年版三部的限量要求(<10 mg/ml)。该方法专属性强、准确度、精密度、稳定性、耐用性良好,可用于猪凝血酶冻干粉中磷酸三丁酯残留检测。
关键词 气相色谱 猪凝血酶 磷酸三丁酯 殘留
中图分类号:O657.71; R926 文献标识码:A 文章编号:1006-1533(2017)21-0076-05
Determination of the residual tri-n-butyl phosphate in porcine thrombin by gas chromatography
LIU Lu*, ZHAO Yingying, ZHANG Jundong
(Shanghai Haohai Biological Technology Co., Ltd, Shanghai 200052, China)
ABSTRACT A gas chromatography method was established to determine the residual Tri-n-butyl phosphate in porcine thrombin and was completely evaluated. An Agilent HP-INNOWAX column (30 m×250 mm×0.25 mm) was adopted and the operation procedures were as follows: vaporizing chamber temperature 190 ℃, split ratio 1:1, sample volume 1 ml; FID detector temperature 210 ℃; carrier gas: highly pure nitrogen at 3 ml/min; column temperature 150 ℃ and running for13 min. The results showed that the method had strong specificity and the standard curve was linear over the range of 2.406~19.246 mg/ml. The average recoveries at low, medium and high levels were 97.1%, 101.1% and 98.2%, respectively and the overall average recovery was 99.8%, and the overall RSD value was 2.37% and RSD value of the mid-precision was 5.01%. The limit of detection was 0.762 mg/ml and the limit of quantitation was 2.54 mg/ml. The residual TNBP values from three batches of porcine thrombin were apparently lower than the limit value set by Chinese Pharmacopoeia (<10 mg/ml). The method was suitable for the determination of residual TNBP in porcine thrombin with good accuracy, reproducibility, stability and robustness.
KEy WORDS gas chromatography; porcine thrombin; tri-n-butyl phosphate; residue
猪源纤维蛋白黏合剂(含猪纤维蛋白原、猪凝血酶及相应的溶解液)原为Ⅲ类医疗器械,临床主要用于术中辅助止血。国家食品药品监督管理总局2006年发布《关于规范纤维蛋白胶类产品监督管理有关事宜的公告》要求猪源纤维蛋白粘合剂类产品由医疗器械升级为药品管理[1]。为提高产品临床使用的安全性,本公司参照《血液制品去除/灭活病毒技术方法及验证指导原则》[2]在猪凝血酶生产过程中采用有机溶剂/去污剂(S/D)处理法进行病毒灭活,其中有机溶剂为磷酸三丁酯(tri-n-butyl phosphate,TNBP),研究表明TNBP对包膜病毒具有较好的灭活效果[3-4],但对人体有一定的毒性[5],故按《中华人民共和国药典》2015年版三部规定,磷酸三丁酯残留量应不高于10 mg/ml[6]。本研究采用气相色谱法对本公司生产的猪凝血酶进行TNBP残留检测,并对方法进行了验证。
1 材料与方法
1.1 样品与试剂
猪凝血酶冻干粉(2.5 ml规格,批号:20161211、20170114、20170301)由本公司生产。endprint
磷酸三丁酯(GC,纯度>99.9%,批号:BCBN5037V)购自上海凌峰化學试剂有限公司;磷酸三丙酯(GC,纯度>99%,批号:38196TJV)购自美国Sigma-Aldrich公司;正己烷(HPLC,批号:68977223)购自上海迈瑞尔化学技术有限公司;高氯酸(AR,批号:20141025)购自永华化学科技(江苏)有限公司;水为纯化水。
1.2 主要仪器
安捷伦7890B气相色谱仪含氢火焰离子化检测器(FID)(美国安捷伦科技有限公司);ME104型电子天平(梅特勒-托利多国际股份有限公司);H1650型高速台式离心机(湖南湘仪实验室仪器开发有限公司);DKS24型电热恒温水浴锅(上海精宏实验设备有限公司)。
1.3 溶液配制
高氯酸溶液(1.5 mol/L):量取70%高氯酸溶液12 ml加入装有约80 ml超纯水的100 ml量瓶中,待其温度降至室温后,加超纯水定容至刻度并混匀。
内标溶液:精密称取磷酸三丙酯0.25 g,加正己烷定容至25 ml,即为内标储备液(10 mg/ml)。临用前取内标储备液0.50 ml于25 ml量瓶中,用正己烷定容即得内标溶液(200 mg/ml)。
对照品溶液(STD):精密称取磷酸三丁酯0.25 g,加正己烷定容至25 ml,即为对照品母液(10 mg/ml)。临用前取对照品母液0.75 ml于25 ml量瓶中,用正己烷定容即得对照品溶液(300 mg/ml)。
样品溶液:每瓶猪凝血酶冻干粉加2.5 ml纯化水,待其完全溶解后,即得样品溶液。
1.4 样品处理
精密量取样品溶液1.25 ml于玻璃离心管中,精密加内标溶液50 ml和1.5 mol/L高氯酸溶液0.375 ml,混匀,置37 ℃水浴保温10 min后,加入正己烷2 ml,混匀,静置10 min,3 000 r/min离心20 min,吸取上层清液进样。
1.5 气相色谱条件
聚乙二醇毛细管柱Agilent HP-INNOWAX(30 m ×250 mm × 0.25 mm);溶剂为正己烷;气化室温度190 ℃,分流比1∶1,进样量1 ml;FID检测器温度210 ℃;载气为高纯氮气,流速为3 ml/min;柱温150 ℃,运行时间13 min。
1.6 方法验证
1.6.1 专属性验证
分别取适量内标(磷酸三丙酯)和对照品(磷酸三丁酯)用正己烷配制成浓度为5.0 mg/ml的内标溶液和对照品溶液,按1.5项进样分析,考察方法的专属性。
1.6.2 线性范围确定
精密量取对照品溶液10、20、40、60、80 ml(25%、50%、100%、150%、200%水平),分别置已加1.25 ml水的离心管中,再向各对照品管精密加入内标溶液50 ml,混匀,置于37 ℃水浴保温10 min后,放冷,再加入正己烷2 ml,混匀,静置10 min后,3 000 r/min离心20 min,吸取上层清液,分别进样上述溶液各一次。以对照品磷酸三丁酯浓度为x轴,以磷酸三丁酯和内标物峰面积之比(As/Ai)为y轴,进行线性回归。
1.6.3 检测限与定量限确定
检测限确定:精密量取对照品母液3 ml置10 ml容量瓶中,正己烷定容至刻度,摇匀,再精密量取该溶液10 ml于加有1.25 ml水的离心管中,再加入50 ml的内标储备液,混匀,置于37 ℃水浴保温10 min后,放冷,再加入正己烷2 ml,混匀,静置10 min后,3 000 r/min离心20 min,小心吸取上层正己烷层即得检测限样品,按1.5项进样检测。
定量限确定:精密量取对照品母液10.0 ml于加有1.25 ml水的离心管中,再加入50 ml的内标储备液,混匀,置于37 ℃水浴保温10 min后,放冷,再加入正己烷2 ml,混匀,静置10 min后,3 000 r/min离心20 min,小心吸取上层正己烷层即得定量限样品,按1.5项进样检测。
1.6.4 准确度、精密度(中间精密度)、稳定性试验
准确度验证:分别取对照品母液20、40 和60 ml于加有1.25 ml样品溶液的离心管中,按1.4项样品处理后即得浓度水平为50%、100%、125%的准确度样品溶液,每一浓度水平平行配制3份,进样检测。
精密度验证:采用准确度实验数据作为操作人员甲的精密度(中间精密度)数据,操作人员乙在不同的日期、使用不同色谱柱、不同的系列溶液,平行配制6份100%水平准确度样品以及2份控制样品溶液,进样检测。
稳定性试验:取对照品溶液和样品溶液(100%水平准确度样品),分别放置在室温条件0、12、24和48 h,进样检测考察溶液稳定性。
1.6.5 耐用性试验
在其他色谱条件不变的条件下,方法发生微小变动,分别调整离心转速至方法规定的±200 r/min、调整载气流速至方法规定的±0.2 ml/min、调整柱温至方法规定的±2 ℃,考察其系统适应性。
2 结果
2.1 系统适用性
分别取空白溶剂和对照品溶液(STD)注入气相色谱仪中分析。结果表明对照溶液(STD)中理论板数按磷酸三丁酯峰计算均高于5 000;磷酸三丁酯峰与内标峰的分离度均大于1.5;起始5针对照溶液(STD)中磷酸三丁酯与内标峰面积比的RSD均≤5.0%。所有间插进样的对照品溶液中磷酸三丁酯与内标物峰面积之比与起始5针对照品溶液的平均峰面积的比值在95.99%~102.7%之间。
2.2 专属性试验
正己烷对内标物和对照品的保留时间没有干扰,专属性结果符合接受标准(图1)。endprint

2.3 線性试验
线性方程为y = 0.137 4x + 0.015 4,线性范围为2.406~19.25 mg/ml,相关系数r = 0.999 7,符合接受标准(≥0.990)。
2.4 检测限与定量限确定
检测限样品测得的信噪比(S/N)为5.2,满足接受标准(S/N≥3),该方法的检测限为0. 762 mg/ml。定量限样品6次测得的信噪比(S/N)为15.2~16.8,6份样品中主成分含量测定结果的RSD(n=6)为3.56%,满足接受标准(S/N≥10,RSD 5.0%),该方法的定量限为2.54 mg/ml(表 1)。
2.5 准确度、精密度(中间精密度)、稳定性试验
不同浓度准确度样品测得主成分总平均回收率为99.8%,RSD为2.37%(表2)。
精密度样品检测结果显示两位操作人员制备的样品中主成分回收率测定结果的RSD为5.01%(n=18),结果满足接受标准(15.00%)(表3)。
稳定性试验样品检测结果显示对照品溶液和样品溶液在不同时间内回收率比值均在 95.0%~105.0%之间(表4)。
2.6 耐用性试验
正常方法与改变参数方法所得回收率之比应在95.0%~105.0%之间。结果显示方法发生微小变动后主成分回收率在95.9%~100.9%(表5)。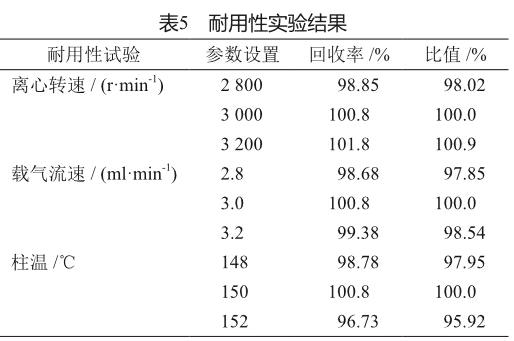
2.7 样品检测
取3批猪凝血酶样品(20161211、20170114、20170301)按1.4项进行样品处理,进样测定磷酸三丁酯残留量,检测结果分别为0.97、1.46和1.32 mg/ml,均小于方法的定量限(2.54 mg/ml),明显低于《中华人民共和国药典》2015年版三部规定不高于10 mg/ml,磷酸三丁酯残留量合格。
3 讨论
本法所用样品为每瓶猪凝血酶冻干粉加2.5 ml纯化水溶解后所得溶液。因样品处理步骤较多、用量较大易导致挥发损失,从而引起较大误差,因此将样品取用量减至1.25 ml,同时将对照品、内标的浓度减半,将高氯酸溶液、正己烷和纯化水的体积相应减半,使实验结果更为准确可靠。
气相色谱法已用于多种生物制品中磷酸三丁酯残留量检测[5-10]。在样品处理过程中存在一定的乳化现象,且离心难以完全消除[5,8],为使样品离心更完全,本法将样品混匀后静置10 min再进行离心,有效降低了乳化可能导致对检测的不利影响,提高了检测结果的准确性。
在样品处理过程中,药典方法[6]以及多项研究[5,9]均采用吸取上层正己烷,用氮吹仪吹扫浓缩再取样检测的方法,不仅过程繁琐且过程难以控制。本研究将空气流浓缩步骤省略,改为增加进样量直接进样,可简化实验步骤而不影响实验结果。同时本法参考药典方法并根据实际情况对色谱条件做了相应调整,以得到更好的峰形和分离度。
参考文献
[1] 国家食品药品监督管理总局. 关于规范纤维蛋白胶类产品监督管理有关事宜的公告[EB/OL]. (2006-09-30)[2017-06-03]. http: //www. sda.gov.cn/WS01/CL0087/14810.html.
[2] 国家食品药品监督管理总局. 关于印发《血液制品去除/灭活病毒技术方法及验证指导原则》的通知[EB/OL].(2002-05-09)[2017-06-03]. http: //www.sda.gov.cn/WS01/ CL0058/9330.html.
[3] 王剑锋, 英志芳, 李长贵, 等. S/D法灭活血液制剂中脂包膜病毒效果验证的研究[J]. 微生物学免疫学进展, 2008, 36(3): 38-41.
[4] 赵宜为, 常娅莉, 王巍, 等. S/D灭活血浆内脂包膜病毒及病毒灭活血浆的研究[J]. 微生物学免疫学进展, 2004, 32(l) : 17-19.
[5] 袁彩君, 朱天新. 气相色谱法测定降纤酶中磷酸三丁酯残留量[J]. 中国医药指南, 2015, 13(22): 56-57.
[6] 国家药典委员会. 中华人民共和国药典(三部)[S]. 北京:中国医药科技出版社, 2015: 通则3205.
[7] 盛凤仙. 冻干人纤维蛋白胶制品中磷酸三丁酯残留量的气相色谱法测定[J]. 中国医药工业杂志, 2002, 33(3): 137-138.
[8] 梁伟, 郭菊玲, 张琦惠, 等. 马破伤风免疫球蛋白F(ab)2中磷酸三丁酯残留量的测定[J]. 中国处方药, 2015, 13(9): 21-23.
[9] 李肖锋, 孔双泉, 翟志芳, 等. 气相色谱法测定牛纤维蛋白原中磷酸三丁酯残留量[J]. 中国生物制品学杂志, 2015, 28(6): 645-647, 653.
[10] 刘婷婷, 徐琛, 陈益乐, 等. 气相色谱法测定医用纤维蛋白胶制品中磷酸三丁酯残留量[J]. 中国临床药学杂志, 2011, 20(4): 225-228.endprint
