锂电池百篇论文点评(2017.8.1—2017.9.30)
2017-11-24赵俊年武怿达詹元杰陈宇阳起文斌俞海龙贲留斌刘燕燕黄学杰
赵俊年,武怿达,詹元杰,陈宇阳,陈 彬,金 周,张 华,起文斌,俞海龙,贲留斌,刘燕燕,黄学杰
锂电池百篇论文点评(2017.8.1—2017.9.30)
赵俊年,武怿达,詹元杰,陈宇阳,陈 彬,金 周,张 华,起文斌,俞海龙,贲留斌,刘燕燕,黄学杰
(中国科学院物理研究所,北京 100190)
该文是一篇近两个月的锂电池文献评述,以“lithium”和“batter*”为关键词检索了Web of Science从2017年8月1日至2017年9月30日上线的锂电池研究论文,共有2609篇,选择其中100篇加以评论。正极材料主要研究了层状、尖晶石和磷酸盐正极材料的结构演变以及表面包覆和掺杂作用。高容量的硅、锡基和氧化物负极材料侧重于研究材料合成和应用条件与循环性能的关系以及容量随循环损失的机理。金属锂负极的研究侧重于通过集流体和表面覆盖层的设计来提高其循环性能。固态电解质方面制备方法和离子输运机理是研究重点,电解液添加剂的研究目标是提高电池的高温稳定性。锂空电池、锂硫电池侧重于改进电池的循环性能。理论模拟工作包括材料体相、界面结构和输运性质,除了以材料为主的研究之外,针对电池的原位分析的研究论文也有多篇。
锂电池;正极材料;负极材料;电解质;电池技术
1 正极材料
1.1 层状氧化物正极材料
CHEN等[1]在三元材料LiNi0.8Co0.1Mn0.1O2中引入Ca掺杂来提高其阳离子有序度,Ca占据具有相似离子半径的Ni的位置,发现6%掺杂的样品能够最大程度减小Li/Ni混排,从而获得最好的性能,认为离子半径更大的低价元素掺杂是减小LMO2材料中Li/Ni混排的好办法。HU等[2]在纳米LiCoO2表面生长了超薄的Al2O3,通过不同温度的烧结来获得不同的核-壳结构的材料。用TEM和ED分析了界面层的厚度以及各元素的浓度分布,600 ℃处理后界面处元素分布梯度较小的样品性能最好。WANG等[3]利用时间分辨的高能X射线原位地观察了富Ni层状材料LiNi0.7Mn0.15Co0.15O2(NMC71515)分别在800 ℃、850 ℃、900 ℃合成过程中的结构演化,以及过渡金属氧化态的变化。成功合成了阳离子混排度小、Li层间距大,晶粒尺寸适中的样品,比容量为200 mA·h/g。MA等[4]在富Li富Mn的层状正极材料Li1.15Mn0.54Ni0.23Co0.08O2中加入BPO4并使其形成LiBPO4+x/2来作为包覆层。形成的包覆层不仅可以保护活性物质,防止HF的攻击,高锂离子电导率更是改善了材料的倍率性能。HE等[5]在富锂材料Li2MnO3的纳米线中引入尖晶石相Li2MnO4来改善其倍率性能,由于尖晶石较高的电子电导率和离子电导率,复合材料在高倍率下还能有较高的容量(10 C下还能保持123.9 mA·h/g)。CHEN等[6]先用磷酸二氢铵处理富镍材料表面残余的氢氧化锂与氧化锂得到磷酸锂包覆的富镍材料,提高了正极材料的离子电导,又用PPy对材料进行二次包覆,提高了材料的电子电导率,包覆后的材料在0.1 C的倍率下循环50周容量保持率由86%提高到95%,以10 C的倍率进行充放电,容量由125.7 mA·h/g提高到159.7 mA·h/g。DING等[7]用PVP辅助的湿化学的方法合成了PrPO4包覆的富锂材料,经过表面修饰的材料初始库仑效率由81.8 %提升到90%,100周循环的容量保持率由71.7%提高到89.3%。进一步分析表明在包覆PrPO4纳米层的过程中,富锂材料的体相结构丢失了部分的锂和氧,从而形成了具有3D快离子通道的结构,导致了Li2MnO3化学活化,同时表面的这种尖晶石结构能够有效阻挡有害的界面反应。PARK等[8]制备了LiMn2O4、LiNi0.5Mn1.5O4、LiCo0.5Mn1.5O4三种尖晶石掺杂的富锂相复合正极,这些复合正极都表现出更多的容量,以及在循环中保持电压衰减更慢。在3种尖晶石相中,LiCo0.5Mn1.5O4的提升效果最好。HARRIS等[9]研究了Li[NiMnCo]O2系列正极材料的过渡金属原子排列和结构,基于电中性原则,简单的总能量固定,结合模拟退火算法生成模型结构。该方法重现了Li[Li1/3Mn2/3]O2结构,而且构建了Li[NiMnCo1−2x]O2(=0.02、0.1、0.33),后者从7Li核磁共振谱被证实。该结构是固溶体,有着高度的无序性,并且有明显的离子配对。KATO等[10]用PLD在LiCoO2电极表面分别沉积非晶LiTaO3和LiNbO3层,厚度约300 nm。SIMS测得非晶的LiTaO3和LiNbO3锂离子扩散系数分别为8.0×10-13cm2/s和5.0×10-13cm2/s,且LiNbO3包覆的材料经过循环其表面碳酸锂成分少,同时LiNbO3性能没有衰退,具有更好的稳定性。KIM等[11]合成了2%(摩尔分数)Al掺杂的Li[Ni0.76Co0.09Mn0.15]O2成分梯度分布的材料,即表面富集Mn,贫Ni。Al掺杂稳定了体相结构,Ni和Mn的梯度分布稳定了表面结构。TAI等[12]采用剪切剥离的方法得到LiCoO2、LiMn2O4和LiFePO4纳米片状结构材料。这些纳米片状结构材料展示出较高的倍率性能和长循环性能,且当LiCoO2纳米片厚度减小到2~3个原子层(1.7 nm)时,会变为零应变响应。CHANG等[13]研究了超分支结构的低聚物(STOBA)作为添加剂与正极材料的相互作用,X射线光电子能谱的数据表明STOBA中的N原子与正极材料中的金属原子之间能形成稳定的化学键,这种化学键能确保STOBA均匀地覆盖在正极材料表面,同时正极材料表面的STOBA层能使PVDF均匀地覆盖在正极材料表面,并减少正极表面氟化锂的形成。MOHANTY等[14]研究了高容量富锂锰基材料的衰减特性,第一周即发生成分和结构的变化增加了离子输运的阻力,观察到四面体位的Mn3+、层间阳离子互占位、结构重排的条纹相、高电压态阳离子的聚集、锂离子缺失和结构转变条纹相等。
1.2 尖晶石正极材料
LIU等[15]用3D-TXM研究了LMO正极在循环中裂纹的形成与其容量衰减的关系,并且认为Mn的溶解也是容量衰减的原因之一。VU等[16]用水热法制备了(1-)Li1.2Mn0.6Ni0.2O2·LiMn1.5Ni0.5O4(0.15 <<0.3)材料,并考察了不同烧结温度(650 ℃、750 ℃、850 ℃)对于最终复合材料的组成、结构和性能的影响。发现所有材料都由4种不同空间群的物质组成,只不过比例不同。650 ℃烧结的材料中阳离子无序度很高,具有320 mA·h/g的容量。而850 ℃烧结的样品,阳离子无序度较小,具有更好的容量保持率(55周循环后99%)。KAN等[17]合成了固溶体形式的LiNi0.5Mn1.5O4(0.71<<1)的尖晶石正极,并对其结构和电化学性能进行了详细考察。XAS(射线吸收谱)和BVS(键价求和)分析表明材料中只有Ni具有氧化还原活性,而材料中大量的Li空位是低荷电状态下还能发生氧化还原反应的关键。TANG等[18]用蚕丝丝胶蛋白质作为LiNi0.5Mn1.5O4尖晶石正极黏结剂,该黏结剂机械强度高,可稳定正极表面固体电解质界面层和抑制电极的自放电行为,同时锂离子界面扩散阻抗也明显降低。DARUL等[19]研究了热分解柠檬酸盐合成高电压尖晶石LiNi0.5Mn1.5O4材料在高压下的性能。XRD结构分析发现在6 GPa高压下,立方相尖晶石的结构依然稳定。压力在增加的过程中,作者通过分析体相模量得出材料的耐压性随着四面体位置的锂含量的增加而增加。
1.3 聚阴离子正极材料
CHERKASHININ等[20]通过在LiCoPO4中引入LiCo2P3O10提高了LiCoPO4的电子电导率,这是由于比有更具局域的电子结构。还将LiCoO2与LiCoPO4进行对比,结果发现的存在减弱了Co—O共价键的强度,从而降低Co2+电子的能级,使得LiCoPO4与LiCoO2相比具有更高的电位。HU等[21]通过改变合成条件合成了1#和2#两种橄榄石α-LiMn0.5Fe0.5PO4材料,XRD精修结果表明两种材料都存在约5%的Fe2+-Li+互占位,但是却具有不同的倍率性能。通过STEM观察发现对于样品2#,小于10 nm的β-LiMn0.5Fe0.5PO4镶嵌在100 nm左右的α-LiMn0.5Fe0.5PO4晶格当中,从而阻挡了Li+沿[100]方向的扩散,因此具有较差的倍率性能。
1.4 其它正极材料
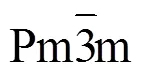
2 负极材料
2.1 硅基负极材料
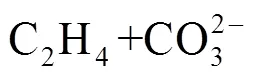
2.2 其它负极材料
HUANG等[34]利用溶胶-凝胶法合成了NaEuTiO4,并接着用离子交换法将其转化成了LiEuTiO4。研究表明,LiEuTiO4具有0.8 V 的嵌锂电位,同时具有优异的循环性能和倍率性能,在100 mA/g的速率下第二周放电容量高达219.2 mA·h/g,并且循环500周后放电容量保持在217 mA·h/g左右,库仑效率为99.2%。与传统的钛基负极材料不同,LiEuTiO4在嵌锂时的变价元素为Eu,从+3价还原为+2价。HAN等[35]在纳米ZnO、MnO2表面生长了一层金属有机框架ZIF-8来帮助Li+进行传导。结果表明,在相同的电流密度下,表面修饰后的材料相对于原始材料分别有了28%和31%的容量提升。通过进一步把这个表面层在700 ℃进行裂解,得到了54%和69%的容量提升。HWANG等[36]制备并研究了一种Li-Cu复合电极,电极采用微米级金属锂粉和金属铜粉混合制备而成,在电化学循环过程中金属铜粉当导电骨架可以有效地缓冲金属锂的体积形变。使用这种复合电极组装的Li-Cu电池在3 C倍率下可以稳定循环200次,复合电极的比容量可以达到1158 mA·h/g。XU等[37]研究了二维层状有机聚合物C3N和C2N-450的电化学性能。其中C2N-450具有933.2 mA·h/g的比容量和0.15 V(. Li/Li+)的还原电位,由于具有稳定的类聚苯胺结构C2N-450材料能够有效的循环长达500次不产生容量衰减。虽然该材料在倍率性能上还存在巨大的优化空间,但对于有机物负极材料而言具有一定的意义。BECKING等[38]研究了滚压对金属锂界面的影响和循环过程中枝晶的生长情况。发现通过对锂带进行简单的滚压加工可以减薄金属锂带表面的自钝化层(Li2CO3),从而改善金属锂沉积均匀度,延长金属锂负极的循环寿命。CHOUDHURY等[39]使用Li-In合金方法构筑了一种具有高离子电导率金属锂负极SEI层。由于铟具有较低的表面扩散势垒,同时由于与金属锂沉积脱嵌的电位差,铟在金属锂负极界面的铟并不参与电化学循环过程。所有由铟构成的界面层可以有效地阻隔金属锂与电解液之间的反应,并实现快速Li+迁移通道。LIANG等[40]报道了醌类化合物可以作为水性可充电电池的负极材料。无论水性电池中介质的pH值(-1~15)、荷电离子种类、温度或者气体成分如何,醌型化合物均可以被设计成稳定的负极材料。而且这类化合物可以跟多种正极/电解液联合使用作为水性可充电电池的负极材料,可以让水性电池具有长循环寿命、高容量、快速的动力学性能以及优良的能量密度。AUSDERAU等[41]用透射X射线显微镜技术研究了合金负极Cu6Sn5脱嵌锂过程,通过对纳米级的X射线图像的分割,最终他们发现合金负极Cu6Sn5在脱嵌锂过程会生成Li2CuSn、Sn、Cu相。将按Ga∶Sn为88∶12 的质量比得到一种常温下的液态合金负极,这种液态合金具有流动性和强表面张力,因此其有自修复能力,就可以解决电极在充放电过程中由于体积变化而使电极粉化的问题,从而提高其电化学性能。这种合金电极在4000 mA/g密度下循环4000周后仍保持400 mA·h/g的容量。GU等[42]用高压辊压和刻蚀等方法合成了一种具有高延展性的多原子层铝薄膜,将铝薄膜和石墨烯做成混合薄膜作为负极,石墨烯能缓解铝在锂化过程中的体积膨胀,同时提高电极的能量密度。因此该混合电极具有1089 mA·h/cm3的高体积比容量,良好的大倍率充放电性能和长循环寿命。LI等[43]用镍纳米管构筑三维集流体,负载纳米Fe3O4活性材料,并在其上覆盖MnO2纳米层,这个呼吸式混合电极1 C循环1000周后容量保持为1450 mA·h/g,保持率96%。HAN等[44]通过MnOOH纳米线、C2O42+和Sn2+氧化还原反应得到薄层碳包覆的SnO2纳米管负极材料SnO2@C,相比于一般的SnO2纳米管,其具有更高的电导率和更低的电阻率。而且其中空结构可以缓解SnO2在充放电过程中的体积变化,因此其具有更优异的电化学性能。LIU等[45]使用功能化碳纳米管涂布在隔膜表面来实现金属锂枝晶抑制,发现功能化碳纳米管涂层可以有效改变金属锂枝晶的生长方向,认为导致这一现象的主要原因在于碳纳米管涂层能够有效地改变界面电场分布,形成更为均匀的金属锂沉积。使用功能化碳纳米管涂层的隔膜制备了LFP-Li电池,电池经历800次循环后容量保持依旧能达到初始容量的80%。ZHANG等[46]研究了集流体表面LiF层对形成柱状金属锂沉积的影响,通过第一性原理计算发现LiF(100)晶面结合能为-0.14 eV小于Cu(100),Li在LiF(100)晶面的扩散势垒,低于Cu(100)的扩散势垒,从而认为Li更容易穿过表面的LiF层,可以在衬底表面上形成更致密的沉积层,并形成这种柱状结构锂沉积。该负极在碳酸脂类电解液中循环库仑效率约为83%。WANG等[47]提出可以将小分子有机物马来酸作为锂离子电池的负极,后续通过电化学测试表明材料具有超高的可逆容量,46.2 mA/g的电流密度下的可逆容量为1500 mA·h/g,甚至在电流密度为 46.2 A/g时仍有570.8 mA·h/g的可逆容量,同时在2.31 A/g电流密度下循环500周后容量保持98.1%。进一步对充放电机理进行了研究指出,马来酸作为负极具有优良的电化学性能主要归因于其很小的体积形变和独特的锂离子存储机理,材料在电化学反应时以共轭的羧酸基团为活性位点,整个反应过程进行了12个电子的传递。WANG等[48]通过优化脱水诱导纳米结构的方法合成了钛酸锂水合物,后续研究表明将其作为锂离子电池负极时具有优越的倍率性能和循环稳定性,大约35 C倍率下比容量为130 mA·h/g,并且每周容量衰减仅为0.001%的情况下能够循环超过10000周,通过原位同步X射线衍射分析表明,材料在充放电过程中并未发生两相转变。指出在水热法和溶胶-凝胶法进行材料合成时,后续热处理过程应该寻找一个最佳脱水温度来保证材料的最优性能。
3 电解质及添加剂
RUSTOMJI等[49]分别采用CH2F2和CH3F来作为超级电容器和金属锂电池的液化气电解质,其优点在于低熔点和低黏度的特性。从而具有较宽的工作温度区间,并且当温度升高到超临界点附近时其电导率急剧下降,从而有效切断内部电路,提高安全性。SUN等[50]根据三元相图Li3PS4-Li4SnS4- Li4SiS4,使用固相反应合成类LGPS(Li10GeP2S12)结构的超离子导体Li10+δ[SnSi1−]1+δP2−S12{Li4−[SnSi1−]1−PS4}。认为常温下Li10.35[Sn0.27Si1.08]P1.65S12{Li3.45[Sn0.09Si0.36]P0.55S4}具有该体系中最高的离子电导率(1.1×10−2S/cm)。经CV测试该新固态电解质的稳定电压可高达5 V,组装了电池LiCoO2/Li10.35[Sn0.27Si1.08]-P1.65S12{Li3.45[Sn0.09Si0.36] P0.55S4}/In-Li可稳定的可逆循环。HE 等[51]报道了一种由1 mol/L LiPF6、FEC/HFDEC和1%(质量分数)LiDFOB组成的氟化电解液,这种电解液能显著提高NMC532/石墨全电池在4.6 V高压下的循环稳定性。通过一系列表征,他们发现这种电解液具有高的离子电导率、耐氧化、易浸润并且能在负极表面形成稳定的钝化膜,具体表现为能使NMC532中的Ni和Co在相同的截止电压下充电到更高的价态,同时在石墨负极表面形成不含过渡金属Mn的钝化膜。更进一步,同步辐射XRD的数据显示,该电解液有助于保持正极的晶格完整性。LIU等[52]用离子交换法由Na2Mg2P3O9N合成了Li2Mg2P3O9N。研究表明,Li2Mg2P3O9N所属空间群为P213,室温下的离子电导率约为10−6S/cm。此外作者通过原位中子衍射研究了采用非熔融锂盐离子交换合成Li2Mg2P3O9N过程中的相变机理,分析表明,离子交换过程中通过两相反应从固溶体Na2−xLiMg2P3O9N 最终转化为Li2Mg2P3O9N,同时通过结构精修指明了相变过程中缺锂态时Li占据Li1位,并在富锂态时迁移到Li3位。KWON等[53]报道了一种高离子电导率的固态聚合物电解质薄膜。这种电解质薄膜的设计关键在于功能性的无机纳米颗粒,它们的内部含有连通的介孔,而这些介孔的表面包含腈基。薄膜在5.2 V高的电压下显示了电化学稳定性,在室温下的离子电导率为2×10−3S/cm,在低于0℃的时候离子电导率大于10−4S/cm,使用混合电解质薄膜和钛酸锂负极的电池在低于−10 ℃时展示了151 mA·h/g的放电容量。CHOI 等[54]将离子液体(LiTFSI/Pyr14TFSI)和BaTiO3纳米陶瓷粉复合形成一种准固态的电解质,该电解质具有较高的热稳定性、宽的电化学窗口和离子电导率(30 ℃下仅1.3×10−3S/cm),且其锂离子迁移数高达0.35。DIETRICH等[55]研究了非晶态(Li2S)(P2S5)(100-)固体电解质材料,拉曼光谱和魔角旋转核磁共振谱研究表明,随着Li2S含量的增加,非晶态材料中阴离子的含量会减少,而的含量会增加,使材料的离子电导率增大,但是当>75后,阴离子基团对离子电导率的影响变得很小。KRAFT等[56]用超离子导体Li6PS5X(X = Cl、Br、I)研究了晶格极化率对离子电导率的影响。实验中通过控制卤素离子的占比来改变阴离子极化率,采用超声波声速测量法确定晶格刚度和德拜频率的变化,同时结合了电化学阻抗谱和中子衍射谱,结果表明晶格柔韧性对离子电导率具有重要的影响,更柔和的化学键能够降低活化能和离子运动的前置因子。SU等[57]提出了一种原位方法模拟了电池在充放电过程中固态电解质与电极材料间的界面机械形变。将这种方法用在了包含聚合物电解质和V2O5-薄膜电极的电池系统中,并通过有限元模型分析了在应力下的挠度,结果表明,电解质对电极材料的依从性与应变率有关,并且因聚合物分子质量的不同而不同,电化学循环过程中的界面化学变化导致了电解质和电极间吸附能的显著衰减。KIREEVA等[58]采用化学信息学对设计全固态电池电解质材料提出合理的方法。该方法着重于几个方面:① 找出影响石榴石结构的氧化物材料锂离子电导的参数响应;② 基于已有实验数据建立定量模型描述组分-结构-离子电导之间的关系;③ 划分材料作为石榴石型固态电解质的化学工作空间用于虚拟筛选。WU等[59]探究了钙钛矿Li3xLa0.67xTiO3锂离子固态电解质的晶界处具有低离子电导的原因,合成了不同晶界尺寸从25 nm到3.11 μm的样品。通过SEM和TEM的研究发现,边界并没有二次相,而晶界离子电导随着尺寸的减小而降低。认为晶界的离子电导不止受晶体学相边界的影响,还与边界吸附的电子有关。造成晶界低锂离子电导的原因是锂离子在空间电荷界面层的消耗。HU等[60]研究了La(1-)/3LiNbO3(LLNbO)固态电解质在不同退火条件下对于结构引起的变化,使用高分辨暗场透射电镜和结构建模共同研究了单晶LLNbO固态电解质界面的结构。发现当进行高温退火之后La元素在层状钙钛矿结构中会出现显著的扩散行为,结构中La元素会占据A位,导致O原子出现无序化现象。同时在结构中会出现随机分布的正八面体NbO6,因此在高温退火后会显著降低LLNbO的离子电导率。CHENG等[61]在常规电解液中添加纳米金刚石来实现金属锂枝晶生长抑制,发现使用普通电解液1 mol/L LiPF6EC/DEC(1∶1)组装的Li-Cu电池,以0.5 mA/cm2电流密度沉积6 h后在Cu箔集流体表面会形成直径约为1.2 μm的组装金属锂阵列。而当在电解液中添加直径小于5 nm的纳米金刚石后,所沉积的金属锂阵列直径会增长至310 nm,并经历3次循环后不产生显著枝晶。认为在电解液中的纳米金刚石会吸附锂离子,使金属锂在集流体界面更为均匀的成核,从而降低了金属锂枝晶产率。KOZEN等[62]设计了一种有机-无机复合电解质层用于金属锂枝晶生长的抑制。先使用含有DOL成分的电解液在金属锂负极界面上进行预沉积,形成约800 nm厚度的有机聚合物层后,在电极外侧使用ALD沉积LiPON。在这种具有有机-无机复合电解质层的金属锂负极循环200次后依旧不产生任何金属锂枝晶。但在长循环后外侧的无机电解质(LiPON)层会发生破裂,但底层的有机电解质可以稳定无机电解液层避免无机层剥离。同时在裂缝处形成的SEI的电导率较低,锂离子依旧择优选择电导率更高的位点进行迁移和沉积,因此避免了裂缝处出现金属锂枝晶。WANG等[63]研究了苯并咪唑锂盐作为电解液添加剂的作用,它可以通过路易斯酸碱反应稳定LiPF6,引入拉电子基团—CF3可稳定咪唑环使之可满足高电压体系的应用,同时它可触发碳酸烷基酯的聚合在正极表面形成稳定的界面层,提高高压材料的循环性能。SAHORE等[64]研究了VC和TMSPi作为电解液添加剂对Li1.03(Ni0.5Mn0.3Co0.2)0.97O2循环性能的影响,1/10 C容量、1 C容量和60%的电阻与循环次数呈线性关系,但添加剂的协同作用是明显的,优化电解液和添加剂的比例可以最大限度地降低1/10 C容量衰减和内阻的提升。SU等[65]研究了1.0%(质量分数)TFEOP添加于电解液中对NMC532/石墨电池在3.0~4.6 V范围循环性能的影响,XPS和NMR分析表明容量保持能力的提升来自于添加剂正极表面的聚合,选择该类具有可打开聚合的环状结构和氟代烷基拉电子基团的磷酸酯化合物是一个寻找正极成膜添加剂的 方向。
4 电池技术
4.1 锂空电池
ZHOU等[66]研究了以六甲基磷酸酰胺(HMPA)为电解液,LPON保护的金属Li为负极的锂氧气电池,取得了较好的循环可逆性,分析得到主要基于HMPA对于放电产物过氧化锂、碳酸锂和氢氧化锂等副产物具有较高的溶解度。LUO等[67]通过使用环境透射电子显微镜研究了Li-O2电池的反应机理。研究表明,在放电开始时,由于具有充足的氧气,正极反应产物为LiO2,随之通过歧化反应产生Li2O2和O2,氧气的释放促使内层为Li2O2而外壳为Li2O的核壳结构的形成,并且充电过程中核壳结构发生分解皱缩。作者进一步指出通过锂离子扩散、电子传递、反应位点的紧密耦合,以及氧气释放过程的调节,使得Li-O2电池在放电过程中产生形貌复杂的产物。针对Li-O2电池中LiTFSI-DMSO(二甲亚砜)电解液与金属锂之间的化学反应问题,LIU等[68]采用一种高盐浓度LiTFSI-DMSO电解液(1∶3摩尔比)实现抑制电解液对金属锂的副反应。当电解液中锂盐浓度上升后所有的DMSO分子会被锂盐中阴离子集团络合,从而提升了活化能势垒,进而降低与金属锂的反应速率。因此,使用这种高盐浓度的电解液可以有效地增加空气电极和金属锂负极的稳定性,提升Li-O2电池的循环寿命。
4.2 锂硫电池
CONDER等[69]使用原位XRD技术在Li-S电池中直接观测到了多硫离子,观察到多硫离子会吸附在玻璃纤维隔膜的表面,并以此原位地观察循环过程中多硫离子的演变,随着S的脱嵌锂,只有长链的多硫离子会吸附在玻璃纤维隔膜的表面。玻璃纤维的成分SiO2对多硫离子具有吸附作用,抑制多硫离子的穿梭效应,从而提高Li-S的电化学性能。FAN等[70]制备了氨基官能团化的碳化硼纳米片/石墨烯薄膜并置于正极表面用作阻隔层。该导电的且具有离子选择结构的阻隔层不仅可以降低电池的电荷转移电阻,且可以抑制多硫离子的穿梭效应。具有该阻隔层的Li-S电池具有较为优异的电化学性能,在S的含量达60%、3 C下,其首周比容量高达1100 mA·h/g,且在1000周内其容量衰减率每周仅0.0037%。ZHANG等[71]制备了纳米的Li2S颗粒,并使用原位的X射线吸收光谱(XAS)研究其前两周的充电机制。Li2S的首周充电包括两个相转变过程:先被氧化形成多硫离子,接着转变为S。在第一周的放电末态会有多硫离子残留,该多硫离子不仅可以促进Li2S/电解液之间的电荷转移过程,且可以同Li2S发生化学反应促进Li2S的氧化。CHUNG等[72]设计一种贝壳状的电极Li2S(中心)-CNF-CNT纸(壳),该贝壳状的电极结构可以将Li2S的氧化还原产物包裹在导电壳中,有利于电子和离子的传输。由此制备了Li2S负载量高达8 mg/cm2的电极,且在电解液/Li2S比例仅9/1的情况下,具有较好的电化学性能。MENG等[73]首先使用手磨和球磨S浆料的方式制备S正极并进行对比,认为球磨得到的S正极具有更好的电化学性能。使用低温(50 ℃)ALD的方法在球磨S正极的表面包覆一层Al2O3,经Al2O3包覆后S正极的循环性能和库容效率都得到了提高,这是因为Al2O3包覆层不仅可以吸附多硫离子且可以抑制多硫离子的溶解。ZENG等[74]将S共聚于聚间氨基苯硫酚(PMAT)上形成高度交联共聚物cp(S-PMAT)。该cp(S-PMAT)电极具有较为优异的电化学性能,在0.1 C下放电比容量高达1240 mA·h/g,在1 C和5 C下分别有比容量880 mA·h/g和600 mA·h/g,且在2 C下1000周后仍有比容量495 mA·h/g。认为PMAT中具有高导电通道,而PMAT中的硫醇官能团与S之间的化学结合可以抑制多硫离子的溶解。
5 电池表征、电池模型和测量技术
KOERVER等[75]以LiNi0.8Co0.1Mn0.1O2为正极、β-Li3PS4为硫基固态电解质,用EIS和XPS研究了正极侧NCM和硫基电解质之间的副反应以及随着循环的变化。在首周充电过程中,硫基电解质的氧化分解产物会增加阻抗,降低首周库仑效率。而且NCM在脱锂的过程中晶格会收缩,导致与电解质的机械接触变差,从而失去活性。BIE等[76]使用Li2O2作为补锂剂用以补偿NCM/graphite全电池的首周活性锂损失,球磨6 h后的NCM对Li2O2的分解具有催化作用,在4.6 V下其首周充电比容量高达1098.8 mA·h/g,通过添加2% Li2O2,NCM/graphite全电池的比容量从160.0 mA·h/g增加到179.4 mA·h/g(高12%),但Li2O2分解形成Li+和O2后会形成空位,导致极片容量衰减。HAFIZ等[77]利用高能X射线对正极材料(以磷酸铁锂LFP为例)照射后的非弹性散射效应(康普顿散射)来探测其中过渡金属的氧化还原轨道在动量空间的图像,并靠这个手段发现电极电势与过渡金属3D电子轨道的局域化有很大关系,而电势在循环过程中的下降与过渡金属和氧原子之间的成键发生变化有关。STEINHAUER等[78]使用原位的中子反射(NR)和原子力显微镜(AFM)研究碳表面SEI结构和形貌的演变,观测到在开路电压下,碳表面就会形成富锂吸附层,且在该电位附近,第一分解产物开始在碳表面沉积。在负电位扫描时NR数据显示在低截止电位(0.02 V. Li/Li+)下,碳表面SEI厚度最大可达192 Å,而在正电位扫描时,该SEI层厚度有轻微的减少,NR的散射长度密度同样可以为SEI的化学特性和结构演变提供额外的信息。WI 等[79]用原位的电化学阻抗谱、GITT和X射线衍射谱研究了LiMn0.8Fe0.2PO4的相转变和动力学,结果表明磷酸铁锰锂在脱嵌锂过程中的反应路径是不同的,同时他们发现磷酸铁锰锂在电化学中表现出来的缓慢动力学是由Mn的氧化还原反应引起的。GIEU等[80]采用XPS、SAM/SEM及飞行时间二次离子质谱等表面分析手段仔细研究了LMO/Li4Ti5O12电池正负极表面膜成分随循环周数的变化。LMO正极侧CEI厚度相较于负极Li4Ti5O12侧较薄,且正极CEI厚度、成分基本不随周数和SOC变化;但在负极侧,充电态的SEI较厚,放电态随着MnF2等的溶解会变薄。MASCARO 等[81]利用基于AFM的静电力显微技术去探测磷酸铁锂表面局域离子扩散性质,通过这种技术测得的磷酸铁锂[010]方向锂离子传输的活化能和单离子输运跳跃势垒与通过DFT计算的结果相一致。这种基于AFM的探测方法能将局域结构和传输性质直接联系起来,对理解离子输运有重要意义。CHEN等[82]采用三维的木质结构作为锂离子电池的集流体框架,提高了活性物质的负载密度。在其多通道结构中注入活性物质磷酸铁锂后,可以得到800 μm厚的电极,并且其垂直通道的构架保证了低的弯曲度,从而保证了离子和电子的快速传输。LIU等[83]采用高温快速烧结法将石榴石结构的Li7La2.75Ca0.25Zr1.75Nb0.25O12(LLCZNO)和V2O5正极材料制备成连续相分布电极。相比于普通电极制备方法,获得的连续相分布电极室温下的界面电阻从2.5×104Ω·cm2下降到71 Ω·cm2,在100 ℃下电阻率进一步下降到31 Ω·cm2。认为这种电阻率下降的原因在于高温烧结时可以将V2O5材料界面熔化并与固态电解质具有更好的结合界面。SCHULZ等[84]使用核磁共振技术定量地研究了锂离子电池在不同充放电态下碳负极界面SEI和碳负极中锂离子含量的关系,并依据实验数据对锂离子电池容量衰减建模。通过调节伽玛射线强度可以有效地实现对负极不同深度的锂元素含量的检测,从而实现对SEI和负极内锂含量的区别。这种方法有助于更好地配合其它检测手段,应用于锂离子商用电池寿命预测研究。TAIWO等[85]使用微米CT和同步辐射三维成像技术对液态金属锂负极粉化现象进行了研究,通过两种三维成像技术分别研究了在不同循环次数下,金属锂负极形貌演变。并观察到随循环次数延长金属锂负极粉化程度增加,并获得粉化后的金属锂枝晶生长进入隔膜微孔中的直接证据。除常规认为的树枝状金属锂枝晶对电池的短路造成极大危险,苔藓状的沉积金属锂也可能造成电池内部短路。WANG等[86]使用原位中子深度剖析研究锂脱离和沉积过程中石榴石型固体电解质与锂的界面,分别研究了Li/电解质/Li(LGL)和Li/电解质/碳管(LGC)两种电池,观察到在LGC电池的碳管与电解质的界面处会形成具有各种形貌的锂,他们认为这是因为其较差的界面接触引起的,而LGL电池则较好。SONG等[87]用原位的电化学质谱结合电化学石英晶体微量天平研究了磷酸铁锂和磷酸铁钠的界面化学反应和表面还原电势。发现对于传统电解质,磷酸铁锂和磷酸钠锂正极的质量在充电时减少,放电时增加。但对于水溶液电解质,磷酸铁锂展示了不同的性质,即充电时质量增加,放电时质量能够减少。这是由于在水溶液中循环的磷酸铁锂,表面的还原氧化电势低于体相的还原氧化电势,并且表面锂离子溶剂化和去溶剂化的速率小于体相。LEE等[88]用中子衍射、TEM、NMR等研究了Li掺杂高电压尖晶石LiNi0.5Mn1.5O4材料,发现锂在有序相变前掺入了尖晶石中的16c的位置。在有序相变后锂移动进入了16d(4b)位置,说明锂的移动和有序-无序相变有紧密的联系。LÉTICHE等[89]成功地在Si/Al2O3/Pt功能性集流体上生长了高电压正极LiMn1.5Ni0.5O4薄膜。他们发现沉积气压是决定样品中Ni-Mn有序度的重要因素,10-2mbar(1bar=105Pa)下700 ℃煅烧的样品具有65 μA·h/(cm2·μm)的容量,容量保持率也不错。库仑效率则与膜的厚度紧密相关。他们的工作是相关集流体上LNMO正极薄膜的研究中最系统的。
6 理论计算、界面反应及其它
YANG等[90]把富锂层状正极材料Li2MnO3表面的一部分Li用Ni来取代,构建了一个Ni有序的表面模型,针对这个表面模型进行了电子结构、氧的稳定性和阳离子迁移势垒的计算来考察Ni在其中起到的作用。计算结果表明,Ni的存在可以使氧更稳定,而且可以提高脱Li后Li的迁移势垒,防止层状结构变为尖晶石或者岩盐相。GIORDANO等[91]对EC在层状氧化物(LiMO2)和岩盐相氧化物(MO)表面可能发生的化学反应进行了计算模拟研究。结果发现,在层状氧化物表面,EC的解离是比另外3个过程(亲核反应、亲电和解离同时带走一个氧原子)在能量上更有利的。而在岩盐相氧化物(MO)表面,随着过渡金属价态的升高,EC的解离也变得更加容易发生。HIRAYAMA等[92]提出了几个方法来解决电子全息实验中存在的3个问题:①用计算模拟的分布和实验结果进行比对的方法来减少样品中的电场对相分布的影响;②用低能氩离子束去除聚焦离子束方法中产生的高电子电导的有害层;③开发一种新的隔绝空气的样品台来阻止样品与空气反应。AHMAD等[93]研究了金属电极与固态电解质的固-固界面的电学沉积稳定性,稳定性相图显示两个影响稳定性的固有因素:压力驱动的机制和相对金属密度驱动的机制。前者在高摩尔体积分数时起主导,而后者在低摩尔体积分数时起主导作用。BEDROV等[94]通过分子动力学模拟研究了SEI的两种模型组分Li2EDC和Li2BDC的力学和传输特性。这两种材料的有序和无序也被分别考虑,其中有序相具有更高的导电性。Li2BDC相比于Li2EDC具有更缓和的、低温度下起始的阴离子移动性。在120 ℃以下,两种材料都具有单离子电导行为。有序的Li2EDC和Li2BDC具有高度的各向异性机械特性,而后者具有更小的剪切弹性系数。DAS等[95]采用第一性原理计算研究了B掺杂石墨烯BC作为高容量负极材料的特性。结果表明B掺杂含量提高达到=2时,质量容量具有最显著的提高。认为这种提高是由于BC2比其它的BC具有更多的费米能级以上的空电子态。还发现BC2的锂离子扩散势垒和开路电压都有所降低,具有更好的Li动力学性能。MAYO等[96]通过第一性原理随机结构搜索(AIRSS)和种类交换方法,筛选多种Li-Sn和Li-Sb的金属互化物作为锂离子电池负极材料。Li-Sn的理论电压曲线和实验具有很好的吻合。计算结果显示Li2Sn具有最稳定的生成能,它的机械稳定性通过声子谱态密度很好的给出。这个通过AIRSS得到的新结构随着Li浓度的增加具有连续的结构演变。还通过第一性原理核磁共振计算研究了Li3Sb的结构。WANG等[97]计算研究了锂硅电极在嵌锂过程中SEI的破裂机制,模拟了LiSi的应力传输到两个主要的非有机SEI组分:LiF和Li2O。结果表明,LiF在>1时有效的结合,使得整个界面结构产生可逆的形变,形成非局域稳定的孔洞。而Li2O与LiSi的结合更加坚固,在所有情况下,都具有明显的畸变,从理论上解释了SEI具有较高的LiF/Li2O含量比,可以有更好的延展性。PASCAL等[98]通过第一性原理分子动力学计算研究了孤立锂离子多硫化物的溶解性,研究了其溶解的自由能,焓和熵从两个方面:液相单配位基在DMF中的溶解,在双(2-甲氧基乙基)醚的螯合作用。结果表明,多硫化物的溶解伴随着明显的熵降低,归因于对锂-溶剂的静电相互作用增强进行补偿。熵的丢失降低了溶解的锂离子多硫化物的稳定性,尤其是在基于聚醚原子团的溶剂。认为聚醚溶剂作为Li-S电池的电解液组分可以很好地降低多硫化物的溶解通过形成类溶剂化物。KIM等[99]通过实验和计算机模拟研究了Ti掺杂LiCoO2材料。作者发现Ti掺杂到Co的位置,同时生成Li空位是最有可能的掺杂模式。但是这种掺杂模式下的Ti的固溶度很低,导致大部分Ti形成第二相。作者利用这个结论合成了性能提高了的表面富Ti的少量Ti掺杂的LiCoO2材料。LIU等[100]发现原子尺度的氧空位能够极大地提高锂电池的倍率性能。作者在CuGeO3表面合成了原子尺度的氧空位,发现表面电荷的不均匀分布造成局部地区的电场,这个电场产生的哥伦布力提高了Li+的移动速度,从而提高材料倍率性能。
[1] CHEN M, ZHAO E, CHEN D, et al. Decreasing Li/Ni disorder and improving the electrochemical performances of Ni-rich LiNi0.8Co0.1Mn0.1O2by Ca doping[J]. Inorganic Chemistry, 2017, 56(14): 8355-8362.
[2] HU L, BRUENER P, GREHL T, et al. Control of chemical structure in core-shell nanocrystals for the stabilization of battery electrode/electrolyte interfaces[J]. Chemistry of Materials, 2017, 29(14): 5896-5905.
[3] WANG D, KOU R, REN Y, et al. Synthetic control of kinetic reaction pathway and cationic ordering in high-Ni layered oxide cathodes[J]. Advanced Materials (Deerfield Beach, Fla.), 2017, doi: 10.1002/adma.201606715.
[4] MA L, LI Y, CHEN Z, et al. Improved rate capability of Li-rich cathode materials by building a Li+-conductive LiBPO4+x/2nanolayer from residual Li2CO3on the surface[J]. Chemelectrochem, 2017, 4(6): 1443-1449.
[5] HE H, CONG H, SUN Y, et al. Spinel-layered integrate structured nanorods with both high capacity and superior high-rate capability as cathode material for lithium-ion batteries[J]. Nano Research, 2017, 10(2): 556-569.
[6] CHEN S, HE T, SU Y, et al. Ni-rich LiNi0.8Co0.1Mn0.1O2oxide coated by dual-conductive layers as high performance cathode material for lithium-ion batteries[J]. Acs Applied Materials & Interfaces, 2017, 9(35): 29732-29743.
[7] DING F, LI J, DENG F, et al. Surface heterostructure induced by PrPO4modification in Li1.2Mn0.54Ni0.13Co0.13O2cathode material for high-performance lithium-ion batteries with mitigating voltage decay[J]. Acs Applied Materials & Interfaces, 2017, 9(33): 27936-27945.
[8] PARK K, YEON D, KIM J H, et al. Spinel-embedded lithium-rich oxide composites for Li-ion batteries[J]. Journal of Power Sources, 2017, 360: 453-459.
[9] HARRIS K J, FOSTER J M, TESSARO M Z, et al. Structure solution of metal-oxide Li battery cathodes from simulated annealing and lithium NMR spectroscopy[J]. Chemistry of Materials, 2017, 29(13): 5550-5557.
[10] KATO M, HAYASHI T, HASEGAWA G, et al. Electrochemical properties of LiCoO2thin film surface modified by lithium tantalate and lithium niobate coatings[J]. Solid State Ionics, 2017, 308: 54-60.
[11] KIM U H, MYUNG S T, YOON C S, et al. Extending the battery life using an Al-doped LiNi0.76Co0.09Mn0.15O2cathode with concentration gradients for lithium ion batteries[J]. Acs Energy Letters, 2017, 2(8): 1848-1854.
[12] TAI Z, SUBRAMANIYAM C M, CHOU S L, et al. Few atomic layered lithium cathode materials to achieve ultrahigh rate capability in lithium-ion batteries[J]. Advanced Materials (Deerfield Beach, Fla.), 2017, doi: 10.1002/adma.201700605.
[13] CHANG L S, WU H C, LIN Y C, et al. XPS study on the STOBA coverage on Li(Ni0.4Co0.2Mn0.4)O2oxide in pristine electrodes[J]. Surface and Interface Analysis, 2017, 49(10): 1017-1022.
[14] MOHANTY D, MAZUMDER B, DEVARAJ A, et al. Resolving the degradation pathways in high-voltage oxides for high-energy-density lithium-ion batteries; Alternation in chemistry, composition and crystal structures[J]. Nano Energy, 2017, 36: 76-84.
[15] LIU Z, HAN K, CHEN-WIEGART Y C K, et al. X-ray nanotomography analysis of the microstructural evolution of LiMn2O4electrodes[J]. Journal of Power Sources, 2017, 360: 460-469.
[16] VU N H, ARUNKUMAR P, IM J C, et al. Effect of synthesis temperature on the structural defects of integrated spinel-layered Li1.2Mn0.75Ni0.25O2+δ: A strategy to develop high-capacity cathode materials for Li-ion batteries[J]. Journal of Materials Chemistry A, 2017, 5(30): 15730-15742.
[17] KAN W H, KUPPAN S, CHENG L, et al. Crystal chemistry and electrochemistry of LiMn1.5Ni0.5O4solid solution cathode materials[J]. Chemistry of Materials, 2017, 29(16): 6818-6828.
[18] TANG Y, DENG J, LI W, et al. Water-soluble sericin protein enabling stable solid-electrolyte interphase for fast charging high voltage battery electrode[J]. Advanced Materials, 2017, 29(33): doi: 10.1002/adma.201701828.
[19] DARUL J, PISZORA P. Li0.5Ni0.5Mn2O4spinel: Its synthesis, structure and high pressure properties[J]. Journal of Alloys and Compounds, 2017, 722: 452-457.
[20] CHERKASHININ G, SHARATH S U, JAEGERMANN W. Toward enhanced electronic and ionic conductivity in olivine LiCoPO4thin film electrode material for 5 V lithium batteries: Effect of LiCo2P3O10impurity phase[J]. Advanced Energy Materials, 2017, 7(13): doi: 10.1002/aenm.201602321.
[21] HU J, XIAO Y, TANG H, et al. Tuning Li-ion diffusion in alpha-LiMn1-FePO4nanocrystals by antisite defects and embedded beta-phase for advanced Li-ion batteries[J]. Nano Letters, 2017, doi: 10.1021/acs.nanolett.7b01978.
[22] LAI K T, ANTONYSHYN I, PROTS Y, et al. Anti-perovskite Li-battery cathode materials[J]. Journal of the American Chemical Society, 2017, 139(28): 9645-9649.
[23] JUNG S K, KIM H, CHO M G, et al. Lithium-free transition metal monoxides for positive electrodes in lithium-ion batteries[J]. Nature Energy, 2017, 2(2): doi: 10.1038/nenergy.2016.208.
[24] GOMEZ-BALLESTEROS J L, BALBUENA P B. Reduction of electrolyte components on a coated Si anode of lithium-ion batteries[J]. Journal of Physical Chemistry Letters, 2017, 8(14): 3404-3408.
[25] KIM K J, WORTMAN J, KIM S Y, et al. Atomistic simulation derived insight on the irreversible structural changes of Si electrode during fast and slow delithiation[J]. Nano Letters, 2017, 17(7): 4330-4338.
[26] CHAE S, KIM N, MA J, et al. One-to-one comparison of graphite-blended negative electrodes using silicon nanolayer-embedded graphite versus commercial benchmarking materials for high-energy lithium-ion batteries[J]. Advanced Energy Materials, 2017, 7(15): doi: 10.1002/aenm.201700071.
[27] KUMAR R, LU P, XIAO X, et al. Strain-induced lithium losses in the solid electrolyte interphase on silicon electrodes[J]. Acs Applied Materials & Interfaces, 2017, 9(34): 28406-28417.
[28] CHOI S, KWON T W, COSKUN A, et al. Highly elastic binders integrating polyrotaxanes for silicon microparticle anodes in lithium ion batteries[J]. Science, 2017, 357(6348): doi: 10.1126/science. aal4373.
[29] LANG J, DING B, ZHANG S, et al. Scalable synthesis of 2D Si nanosheets[J]. Advanced Materials, 2017, 29(31): doi: 10.1002/adma.201701777.
[30] SHI F, ROSS P N, SOMORJAI G A, et al. The chemistry of electrolyte reduction on silicon electrodes revealed byATR-FTIR spectroscopy[J]. Journal of Physical Chemistry C, 2017, 121(27): 14476-14483.
[31] SU H, BARRAGAN A A, GENG L, et al. Colloidal synthesis of silicon@carbon composite materials for lithium-ion batteries[J]. Angewandte Chemie (International ed. in English), 2017, doi: 10.1002/ange.201705200 .
[32] HIROSE T, MORISHITA M, YOSHITAKE H, et al. Study of structural changes that occurred during charge/discharge of carbon-coated SiO anode by nuclear magnetic resonance[J]. Solid State Ionics, 2017, 303: 154-160.
33] WANG H, CHEW H B. Nanoscale mechanics of the solid electrolyte interphase on lithiated-silicon electrodes[J]. Acs Applied Materials & Interfaces, 2017, 9(31): 25662-25667.
[34] HUANG J, YANG K, ZHANG Z, et al. Layered perovskite LiEuTiO4as a 0.8 V lithium intercalation electrode[J]. Chemical Communications (Cambridge, England), 2017, 53(55): 7800-7803.
[35] HAN Y, YU D, ZHOU J, et al. Lithium ion highway by surface coordination polymerization:growth of metal-organic framework thin layers on metal oxides for exceptional rate and cycling performances[J]. Chemistry (Weinheim an der Bergstrasse, Germany), 2017, doi: 10.1002/chem.201703016.
[36] HWANG S W, YOM J H, CHO S M, et al. Electrochemical behavior of Li-Cu composite powder electrodes in lithium metal secondary batteries[J]. Acs Applied Materials & Interfaces, 2017, 9(27): 22530-22538.
[37] XU J, MAHMOOD J, DOU Y, et al. 2D frameworks of C2N and C3N as new anode materials for lithium-ion batteries[J]. Advanced Materials (Deerfield Beach, Fla.), 2017, doi: 10.1002/adma. 201702007.
[38] BECKING J, GROEBMEYER A, KOLEK M, et al. Lithium-metal foil surface modification: An effective method to improve the cycling performance of lithium-metal batteries[J]. Advanced Materials Interfaces, 2017, 4(16): doi: 10.1002/admi.201700166.
[39] CHOUDHURY S, TU Z, STALIN S, et al. Electroless formation of hybrid lithium anodes for fast interfacial ion transport[J]. Angewandte Chemie (International ed. in English), 2017, doi: 10.1002/anie.201707754.
[40] LIANG Y, JING Y, GHEYTANI S, et al. Universal quinone electrodes for long cycle life aqueous rechargeable batteries[J]. Nature Materials, 2017, 16(8): doi: 10.1038/nmat4919.
[41] AUSDERAU L J, GONZALEZ MALABET H J, BUCKLEY J R, et al. Elemental and chemical mapping of high capacity intermetallic Li-ion anodes with transmission X-ray microscopy[J]. JOM, 2017, 69(9): 1478-1483.
[42] GU J, LI B, DU Z, et al. Multi-atomic layers of metallic aluminum for ultralong life lithium storage with high volumetric capacity[J]. Advanced Functional Materials, 2017, 27(27): doi: 10.1002/adfm.201700840.
[43] LI Y Q, LI J C, LANG X Y, et al. Lithium ion breathable electrodes with 3D hierarchical architecture for ultrastable and high-capacity lithium storage[J]. Advanced Functional Materials, 2017, 27(29): doi: 10.1002/adfm.201700447.
[44] HAN C, ZHANG B, ZHAO K, et al. Oxalate-assisted formation of uniform carbon-confined SnO2nanotubes with enhanced lithium storage[J]. Chemical Communications (Cambridge, England), 2017, 53(69): 9542-9545.
[45] LIU Y, LIU Q, XIN L, et al. Making Li-metal electrodes rechargeable by controlling the dendrite growth direction[J]. Nature Energy, 2017, 2(7): doi: 10.1038/nenergy.2017.83.
[46] ZHANG X Q, CHEN X, XU R, et al. Columnar lithium metal anodes[J]. Angewandte Chemie (International ed. in English), 2017, doi: 10.1002/anie.201707093.
[47] WANG Y, DENG Y, QU Q, et al. Ultrahigh-capacity organic anode with high-rate capability and long cycle life for lithium-ion batteries[J]. Acs Energy Letters, 2017, 2(9): 2140-2148.
[48] WANG S, QUAN W, ZHU Z, et al. Lithium titanate hydrates with superfast and stable cycling in lithium ion batteries[J]. Nat. Commun., 2017, 8(1): 627.
[49] RUSTOMJI C S, YANG Y, KIM T K, et al. Liquefied gas electrolytes for electrochemical energy storage devices[J]. Science, 2017, 356(6345): doi: 10.1126/science.aal4263.
[50] SUN Y, SUZUKI K, HORI S, et al. Superionic conductors: Li10+[SnySi1]1+δP2-S12with a Li10GeP2S12-type structure in the Li3PS4-Li4SnS4-Li4SiS4quasi-ternary system[J]. Chemistry of Materials, 2017, 29(14): 5858-5864.
[51] HE M, SU C C, FENG Z, et al. High voltage LiNi0.5Mn0.3Co0.2O2/graphite cell cycled at 4.6 V with a FEC/HFDEC-based electrolyte[J]. Advanced Energy Materials, 2017, 7(15): doi: 10.1002/aenm.201700109.
[52] LIU J, WHITFIELD P S, SACCOMANNO M R, et al.neutron diffraction studies of the ion exchange synthesis mechanism of Li2Mg2P3O9N: Evidence for a hidden phase transition[J]. Journal of the American Chemical Society, 2017, 139(27): 9192-9202.
[53] KWON T, CHOI I, PARK M J. Highly conductive solid-state hybrid electrolytes operating at subzero temperatures[J]. Acs Applied Materials & Interfaces, 2017, 9(28): 24250-24258.
[54] CHOI H, KIM H W, KIM J K, et al. Nanocomposite quasi-solid-state electrolyte for high-safety lithium batteries[J]. Nano Research, 2017, 10(9): 3092-3102.
[55] DIETRICH C, WEBER D A, SEDLMAIER S J, et al. Lithium ion conductivity in Li2S-P2S5glasses - building units and local structure evolution during the crystallization of superionic conductors Li3PS4, Li7P3S11and Li4P2S7[J]. Journal of Materials Chemistry A, 2017, 5(34): 18111-18119.
[56] KRAFT M A, CULVER S P, CALDERON M, et al. Influence of lattice polarizability on the ionic conductivity in the lithium superionic argyrodites Li6PS5X (X = Cl, Br, I)[J]. Journal of the American Chemical Society, 2017, doi: 10.1021/jacs.7b06327.
[57] SU X, GUO K, MA T, et al. Deformation and chemomechanical degradation at solid electrolyte-electrode interfaces[J]. Acs Energy Letters, 2017, 2(8): 1729-1733.
[58] KIREEVA N, PERVOV V S. Materials space of solid-state electrolytes: Unraveling chemical composition-structure-ionic conductivity relationships in garnet-type metal oxides using cheminformatics virtual screening approaches[J]. Physical Chemistry Chemical Physics, 2017, 19(31): 20904-20918.
[59] WU J F, GUO X. Origin of the low grain boundary conductivity in lithium ion conducting perovskites: Li3xLa0.67-TiO3[J]. Physical Chemistry Chemical Physics, 2017, 19(8): 5880-5887.
[60] HU X, FISHER C A J, KOBAYASHI S, et al. Atomic scale imaging of structural changes in solid electrolyte lanthanum lithium niobate upon annealing[J]. Acta Materialia, 2017, 127: 211-219.
[61] CHENG X B, ZHAO M Q, CHEN C, et al. Nanodiamonds suppress the growth of lithium dendrites[J]. Nature Communications, 2017, 8: doi: 10.1038/s41467-017-00519-2.
[62] KOZEN A C, LIN C F, ZHAO O, et al. Stabilization of lithium metal anodes by hybrid artificial solid electrolyte interphase[J]. Chemistry of Materials, 2017, 29(15): 6298-6307.
[63] WANG F M, PRADANAWATI S A, YEH N H, et al. Robust benzimidazole-based electrolyte overcomes high-voltage and high-temperature applications in 5 V class lithium ion batteries[J]. Chemistry of Materials, 2017, 29(13): 5537-5549.
[64] SAHORE R, PEEBLES C, ABRAHAM D P, et al. Additive effects in high-voltage layered-oxide cells: A statistics of mixtures approach[J]. Journal of Power Sources, 2017, 362: 342-348.
[65] SU C C, HE M, PEEBLES C, et al. Functionality selection principle for high voltage lithium-ion battery electrolyte additives[J]. Acs Applied Materials & Interfaces, 2017, doi: 10.1021/acsami.7b08953.
[66] ZHOU B, GUO L, ZHANG Y, et al. A high-performance Li-O2battery with a strongly solvating hexamethylphosphoramide electrolyte and a LiPON-protected lithium anode[J]. Advanced Materials, 2017, 29(30): doi: 10.1002/adma.201701568.
[67] LUO L, LIU B, SONG S, et al. Revealing the reaction mechanisms of Li-O2batteries using environmental transmission electron microscopy[J]. Nature Nanotechnology, 2017, 12(6): doi: 10.1038/nnano.2017.27.
[68] LIU B, XU W, YAN P, et al. Stabilization of Li metal anode in DMSO-based electrolytes via optimization of salt-solvent coordination for Li-O2batteries[J]. Advanced Energy Materials, 2017, 7(14): doi: 10.1002/aenm.201602605.
[69] CONDER J, BOUCHET R, TRABESINGER S, et al. Direct observation of lithium polysulfides in lithium-sulfur batteries using operando X-ray diffraction[J]. Nature Energy, 2017, 2(6): doi:10.1038/nenergy.2017.69.
[70] FAN Y, YANG Z, HUA W, et al. Functionalized boron nitride nanosheets/graphene interlayer for fast and long-life lithium-sulfur batteries[J]. Advanced Energy Materials, 2017, 7(13): doi: 10.1002/aenm.201602380.
[71] ZHANG L, SUN D, FENG J, et al. Revealing the electrochemical charging mechanism of nanosized Li2S byand operando X-ray absorption spectroscopy[J]. Nano Letters, 2017, doi: 10.1021/acs.nanolett.7b02381.
[72] CHUNG S H, HAN P, CHANG C H, et al. A shell-shaped carbon architecture with high-loading capability for lithium sulfide cathodes[J]. Advanced Energy Materials, 2017, 7(17): doi: 10.1002/aenm.201700537.
[73] MENG X, LIU Y, CAO Y, et al. High-performance high-loading lithium-sulfur batteries by low temperature atomic layer deposition of aluminum oxide on nanophase S cathodes[J]. Advanced Materials Interfaces, 2017, 4(17): doi: 10.1002/admi.201700096.
[74] ZENG S, LI L, XIE L, et al. Conducting polymers crosslinked with sulfur as cathode materials for high-rate, ultralong-life lithium-sulfur batteries[J]. Chemsuschem, 2017, 10(17): 3378-3386.
[75] KOERVER R, AYGUEN I, LEICHTWEISS T, et al. Capacity fade in solid-state batteries: Interphase formation and chemomechanical processes in nickel-rich layered oxide cathodes and lithium thiophosphate solid electrolytes[J]. Chemistry of Materials, 2017, 29(13): 5574-5582.
[76] BIE Y, YANG J, WANG J, et al. Li2O2as a cathode additive for the initial anode irreversibility compensation in lithium-ion batteries[J]. Chemical Communications, 2017, 53(59): 8324-8327.
[77] HAFIZ H, SUZUKI K, BARBIELLINI B, et al. Visualizing redox orbitals and their potentials in advanced lithium-ion battery materials using high-resolution X-ray Compton scattering[J]. Science Advances, 2017, 3(8): e1700971.
[78] STEINHAUER M, STICH M, KURNIAWAN M, et al.studies of solid electrolyte interphase (Sei) formation on crystalline carbon surfaces by neutron reflectometry and atomic force microscopy[J]. Acs Appl. Mater. Interfaces, 2017, doi: 10.1021/ acsami.7b09181.
[79] WI S, PARK J, LEE S, et al. Insights on the delithiation/lithiation reactions of LiMn0.8Fe0.2PO4mesocrystals in Li+batteries bytechniques[J]. Nano Energy, 2017, 39: 371-379.
[80] GIEU J B, WINKLER V, COURREGES C, et al. New insights into the characterization of the electrode/electrolyte interfaces within LiMn2O4/Li4Ti5O12cells, by X-ray photoelectron spectroscopy, scanning Auger microscopy and time-of-flight secondary ion mass spectrometry[J]. Journal of Materials Chemistry A, 2017, 5(29): 15315-15325.
[81] MASCARO A, WANG Z, HOVINGTON P, et al. Measuring spatially resolved collective ionic transport on lithium battery cathodes using atomic force microscopy[J]. Nano Letters, 2017, 17(7): 4489-4496.
[82] CHEN C, ZHANG Y, LI Y, et al. Highly conductive, lightweight, low-tortuosity carbon frameworks as ultrathick 3D current collectors[J]. Advanced Energy Materials, 2017, 7(17): doi: 10.1002/aenm.201700595.
[83] LIU B, FU K, GONG Y, et al. Rapid thermal annealing of cathode-garnet interface toward high-temperature solid state batteries[J]. Nano Letters, 2017, doi: 10.1021/acs.nanolett.7b01934.
[84] SCHULZ A, BAKHRU H, DEROSA D, et al. Quantifying lithium in the solid electrolyte interphase layer and beyond using lithium-nuclear reaction analysis technique[J]. Journal of Power Sources, 2017, 360: 129-135.
[85] TAIWO O O, FINEGAN D P, PAZ-GARCIA J M, et al. Investigating the evolving microstructure of lithium metal electrodes in 3D using X-ray computed tomography[J]. Physical Chemistry Chemical Physics, 2017, 19(33): 22111-22120.
[86] WANG C, GONG Y, DAI J, et al.neutron depth profiling of lithium metal-garnet interfaces for solid state batteries[J]. J. Am. Chem. Soc., 2017, doi: 10.1021/jacs.7b07904.
[87] SONG X, LIU T, AMINE J, et al.mass-electrochemical study of surface redox potential and interfacial chemical reactions of Li(Na)FePO4nanocrystals for Li(Na)-ion batteries[J]. Nano Energy, 2017, 37: 90-97.
[88] LEE J, DUPRE N, AVDEEV M, et al. Understanding the cation ordering transition in high-voltage spinel LiNi0.5Mn1.5O4by doping Li instead of Ni[J]. Scientific Reports, 2017, 7, doi: 10.1038/s41598-017-07139-2.
[89] LETICHE M, HALLOT M, HUVE M, et al. Tuning the cation ordering with the deposition pressure in sputtered LiMn1.5Ni0.5O4thin film deposited on functional current collectors for Li-ion microbattery applications[J]. Chemistry of Materials, 2017, 29(14): 6044-6057.
[90] YANG M Y, KIM S, KIM K, et al. Role of ordered Ni atoms in Li layers for Li-rich layered cathode materials[J]. Advanced Functional Materials, 2017, 27(35): 1700982.
[91] GIORDANO L, KARAYAYLALI P, YU Y, et al. Chemical reactivity descriptor for the oxide-electrolyte interface in Li-ion batteries[J]. Journal of Physical Chemistry Letters, 2017, 8(16): 3881-3887.
[92] HIRAYAMA T, AIZAWA Y, YAMAMOTO K, et al. Advanced electron holography techniques forobservation of solid-state lithium ion conductors[J]. Ultramicroscopy, 2017, 176: 86-92.
[93] AHMAD Z, VISWANATHAN V. Stability of electrodeposition at solid-solid interfaces and implications for metal anodes[J]. Physical Review Letters, 2017, 119(5): doi: 10.1103/PhysRevLett.119.056003.
[94] BEDROV D, BORODIN O, HOOPER J B. Li+transport and mechanical properties of model solid electrolyte interphases (SEI): Insight from atomistic molecular dynamics simulations[J]. Journal of Physical Chemistry C, 2017, 121(30): 16098-16109.
[95] DAS D, HARDIKAR R P, HAN S S, et al. Monolayer BC2: An ultrahigh capacity anode material for Li ion batteries[J]. Physical Chemistry Chemical Physics : PCCP, 2017, doi: 10.1039/C7CP04451H.
[96] MAYO M, MORRIS A J. Structure prediction of Li-Sn and Li-Sb intermetallics for lithium ion batteries anodes[J]. Chemistry of Materials, 2017, 29(14): 5787-5795.
[97] WANG H, CHEW H B. Nanoscale mechanics of the solid electrolyte interphase on lithiated-silicon electrodes[J]. Acs Applied Materials & Interfaces, 2017, doi: 10.1021/acsami.7b07626.
[98] PASCAL T A, WUJCIK K H, WANG D R, et al. Thermodynamic origins of the solvent-dependent stability of lithium polysulfides from first principles[J]. Physical Chemistry Chemical Physics, 2017, 19(2): 1441-1448.
[99] KIM S, CHOI S, LEE K, et al. Self-assembly of core-shell structures driven by low doping limit of Ti in LiCoO2: First-principles thermodynamic and experimental investigation[J]. Physical Chemistry Chemical Physics, 2017, 19(5): 4104-4113.
[100] LIU Y, ZHOU T, ZHENG Y, et al. Local electric field facilitates high-performance Li-ion batteries[J]. Acs Nano, 2017, 11(8): 8519-8526.
Reviews of selected 100 recent papers for lithium batteries (Aug. 1,2017 to Sep. 30,2017)
ZHAO Junnian, WU Yida, ZHAN Yuanjie, CHEN Yuyang,CHEN Bin, JIN Zhou, ZHANG Hua, QI Wenbin, YU Hailong, BEN Liubin,LIU Yanyan, HUANG Xuejie
(Institute of Physics, Chinese Academy of Sciences, Beijing 100190, China)
This bimonthly review paper highlights 100 recent published papers on lithium batteries. We searched the Web of Science and found 1880 papers online from Aug. 1, 2017 to Sep. 30, 2017. 100 of them were selected to be highlighted. Layered oxide and spinel cathode materials are still under extensive investigations for the effects of structure evolution and modificationson their cycling property and thermal stability. Large efforts were devoted to Si、Sn and oxides based anode material for improving their cycling propeties with new preparation method. Their capacity fading mechnism is also analyzed. The cycling properties of metallic lithium electrode are improved by designing current collector and surface cover layer. The studies of solid state electrolytes are focus on the method of preparation and the transport mechanism. Additives to liquid electrolyte can help to improve the cell’s stability at elavated temperatures. There are a few papers related to Li/S battery, Li-air battery for improving their cycling performance and more papers related to cell analyses, theoretical simulations, and modeling.
lithium batteries; cathode material; anode material; electrolyte; battery technology
10.12028/j.issn.2095-4239.2017.0151
TM 911
A
2095-4239(2017)06-1175-13
2017-10-18;
2017-10-20。
赵俊年(1992—),男,博士研究生,研究方向为锂金属电池和锂负极保护,E-mail:13501388124@163.com;
黄学杰,研究员,研究方向为锂离子电池及其关键材料,E-mail:xjhuang@iphy.ac.cn。
