α-卤代酮与水杨醛的Rap-Stoermer反应研究进展*
2017-11-24董晓晨黄译瑶
李 阳,汪 洋,董晓晨,蔡 巍,黄译瑶
(1.渤海大学 化学化工学院,辽宁 锦州 121000;2.辽宁思百得医药科技有限公司,辽宁 沈阳 110000)
α-卤代酮与水杨醛的Rap-Stoermer反应研究进展*
李 阳1,汪 洋1,董晓晨1,蔡 巍2,黄译瑶1
(1.渤海大学 化学化工学院,辽宁 锦州 121000;2.辽宁思百得医药科技有限公司,辽宁 沈阳 110000)
按照反应策略的分类,将对Rap-Stoermer反应的研究进展在这四个方面予以简单介绍:(1)无机碱促进的Rap-Stoermer反应;(2)有机碱催化的Rap-Stoermer反应;(3)现代合成技术在Rap-Stoermer反应的应用;(4)绿色的Rap-Stoermer 反应。
Rap-Stoermer反应;无机碱;有机碱;现代合成技术;绿色合成
前 言
Rap和Stoermer分别在1895年和1900年发现了一个合成苯并呋喃环的方法,即Rap-Stoermer反应,为该类化合物的合成提供了一个简便、高效的途径[1]。如图1所示,该反应是一个形成碳碳键的反应,通过α-卤代酮与水杨醛或取代水杨醛发生亲核取代、亲核加成以及脱水消去等一系列串联过程,简便高效地合成C2-位碳基取代的苯并呋喃类化合物,是合成苯并呋喃类衍生物最直接的方法之一。
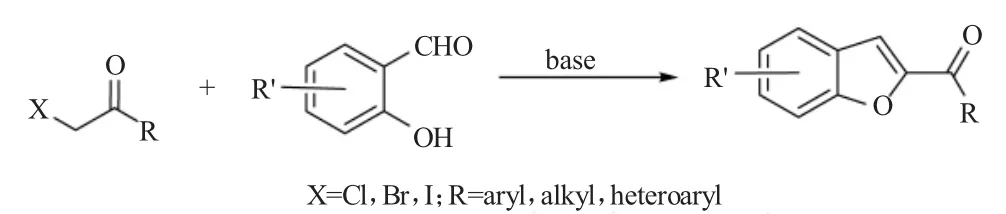
图1 Rap-Stoermer反应通式Fig.1 The general reaction equation of Rap-Stoermer reaction
Rap-Stoermer反应是水杨醛与α-卤代酮之间的反应,它是有机化学领域一个重要的有机人名反应。但自从该反应发现以来一直没有受到化学工作者的关注与重视,直到最近十几年,才成为有机化学反应研究的一个热点,并且对该反应的研究取得一系列重要进展,使得Rap-Stoermer反应收率不断提高,同时也向着绿色反应的方向发展。但关于Rap-Stoermer反应的研究进展还鲜有文献报道。鉴于此,为了更好地了解这方面的最新动态,本文将对近十几年来Rap-Stoermer反应的进展情况在如下四个方面予以简单介绍。
1 无机碱促进的Rap-Stoermer反应
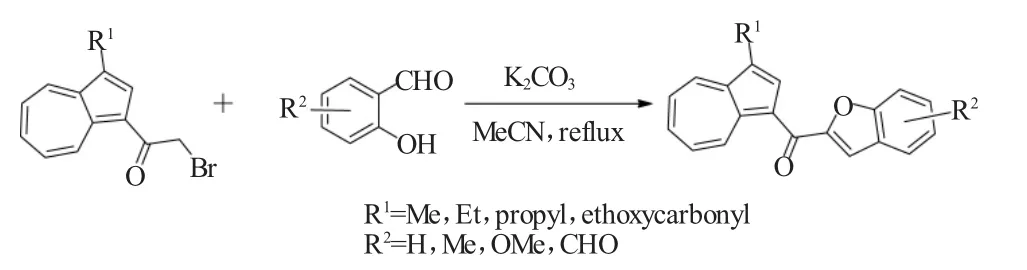
图2 K2CO3促进的溴乙酰基奥与水杨醛的Rap-Stoermer反应Fig.2 Rap-Stoermer reaction of 1-(bromoacetyl)azulenes with salicylaldehydes promoted by K2CO3
在2002年,Yamashiro等[2]首次尝试使用了溴乙酰基奥作为新颖的反应底物与各种水杨醛在传统的反应条件下(K2CO3作为碱,乙腈作为溶剂)进行Rap-Stoermer反应,从而成功合成了结构新颖而又有趣的苯并呋喃酰基奥类衍生物,如图2所示。
2005 年,Kirilmis等[3]报道了 Rap-Stoermer反应的两种不同合成路线来制备得到了结构新颖而又有趣的双(2-苯并呋喃基)甲酮类化合物。在路线1中,作者采用2-溴乙酰基苯并呋喃作为反应底物与水杨醛在NaH作为碱的条件下进行Rap-Stoermer反应,以84%的收率得到相应的目标产品。而在路线2中,使用1,3-二氯丙酮作为反应物与水杨醛进行Rap-Stoermer反应,该反应使用K2CO3作为碱较为理想,以82%的收率得到了相同的目标化合物。其反应方程式如图3所示。
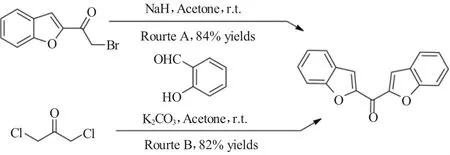
图3 Rap-Stoermer反应的两种不同路线合成双(2-苯并呋喃基)甲酮Fig.3 Use of Rap-Stoermer reaction for the synthesis of bisbenzofuran-2-yl-methanone via two different routes
2006年,Karatas等[4]描述了5-溴水杨醛和1-(2,4,6-三甲苯基)-1-甲基-3-氯乙酰基环丁烷在回流的乙腈作为溶剂碳酸钾作为碱的条件下发生Rap-Stoermer反应,制备结构新颖的苯并呋喃类衍生物,即 (5-溴苯并呋喃-2-基)(3-甲基-3-(2,4,6-三甲苯基)环丁基)甲酮(图示4)。

图4 K2CO3促进的Rap-Stoermer反应Fig.4 Rap-Stoermer reaction promoted by K2CO3
同年,Pautus等[5]报道了水杨醛与各种烷基取代的溴乙酰基苯类化合物的Rap-Stoermer反应。作者通过对反应条件的优化实验发现,最佳的反应条件是使用等物质的量的NaH作为碱,N,N-二甲基甲酰胺(DMF)作为溶剂,反应温度80℃,如图5所示。
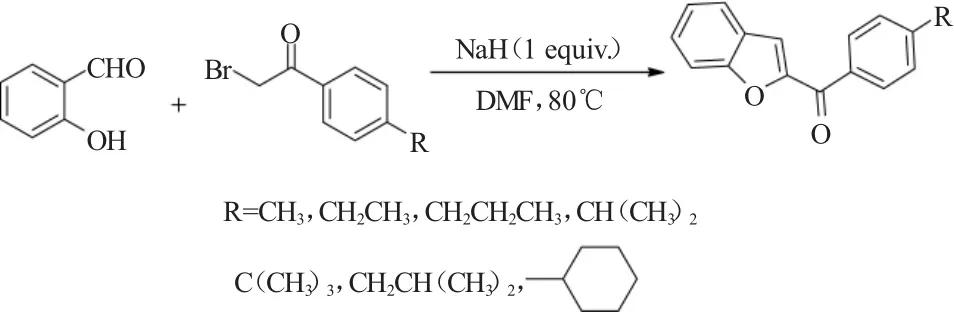
图5 NaH促进的水杨醛与溴乙酰基苯的Rap-Stoermer反应Fig.5 Rap-Stoermer reaction of salicylaldehyde with phenacyl bromides promoted by NaH
2008年,Kirilmis等[6]报道 1- 氯 -3-(2,4,6- 三甲苯基)二甲基酮和2-乙酰基苯酚也可以在Rap-Stoermer反应条件下进行有效的反应,得到相应的2,4,6-三甲苯基取代的苯并呋喃酰基化合物。该反应被视为制备具有高抗菌活性的苯并呋喃类药物的关键反应步骤,如图6所示。
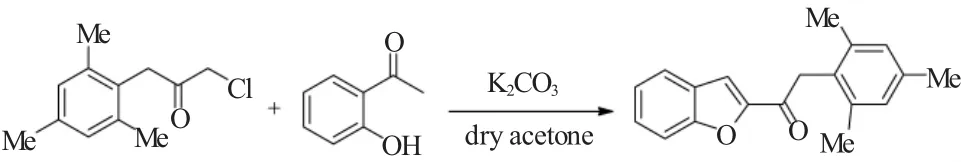
图6 1-氯-3-(2,4,6-三甲苯基)二甲基酮和2-乙酰基苯酚的Rap-Stoermer反应Fig.6 Rap-Stoermer reaction of 1-chloro-3-mesitylpropan-2-one with salicylaldehyde
2010年,Kumaraswamy等[7]报道一种室温条件下的水杨醛或硫代水杨醛与α-溴代酮的Rap-Stoermer反应。条件优化实验发现,当采用1.1当量的Cs2CO3作为碱时,该Rap-Stoermer反应可以在室温下进行,而且以较高的收率得到相应的苯并呋喃酰基类化合物,其反应如图7所示。
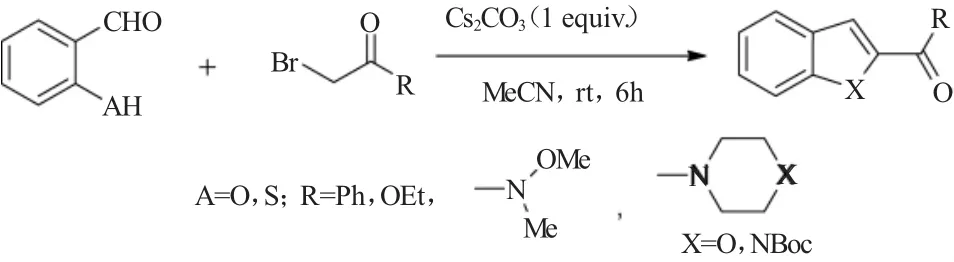
图7 Cs2CO3促进的水杨醛或硫代水杨醛与α-溴代酮的Rap-Stoermer反应Fig.7 Rap-Stoermer reaction of salicylaldehyde/2-mercaptobenzaldehyde with α-bromoketones promoted by Cs2CO3
2011年,Parekh等[8]通过水杨醛和溴乙酸乙酯的Rap-Stoermer反应得到了2-乙酯基取代的苯并呋喃,该化合物可作为合成具有重要生物活性分子的前体化合物。在该反应中,作者使用DMF作为溶剂,K2CO3作为碱(图示 8)。

图8 K2CO3促进的水杨醛和溴乙酸乙酯的Rap-Stoermer反应Fig.8 Rap-Stoermer reaction of salisaldehyde with ethyl bromoacetate promoted by K2CO3
2 有机碱催化的Rap-Stoermer反应
2007年,Rǎdutiu课题组[9]报道了一种新的关于2-溴乙酰基吩恶噻与水杨醛钾盐的Rap-Stoermer反应。该反应巧妙地使用冠醚如15-冠-5-醚或18-冠-6-醚作为催化剂在二氯甲烷作为溶剂的条件下,有效合成了结构新颖且有趣的2-苯并呋喃酰基取代的吩恶噻类衍生物,其反应如图9所示。
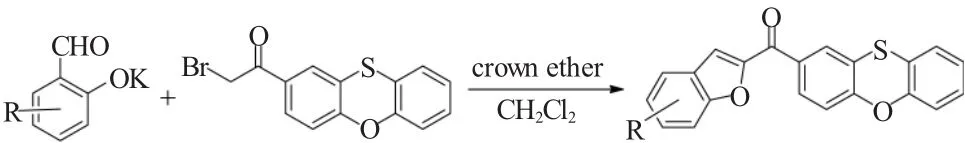
图9 冠醚催化的2-溴乙酰基吩恶噻与水杨醛钾的Rap-Stoermer反应Fig.9 Crown ether-catalyzed Rap-Stoermer reaction of potassium 2-formylphenolates with 2-bromoacetyl phenoxathiin
2010年,Shang等[10]报道了在二甲基氨基吡啶(DMAP)催化条件下,各种水杨醛与卤代酮的Rap-Stoermer反应可以有效地在水介质中反应,以很好的收率得到一系列相应的苯并呋喃酰基类化合物(图10)。该研究报道促进了Rap-Stoermer反应向着绿色反应的方向发展,而且也具有非常好的实用价值。
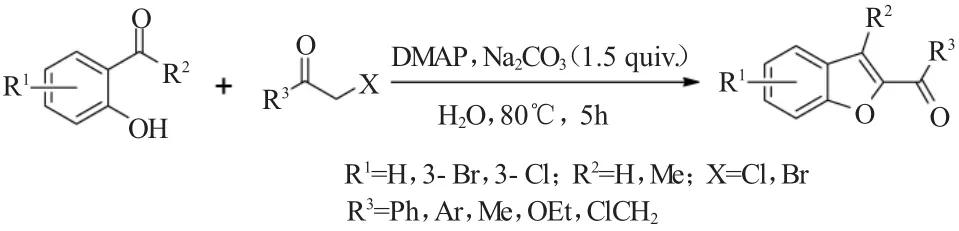
图10 DMAP催化的水杨醛与卤代酮的Rap-Stoermer反应Fig.10 Rap-Stoermer reaction of salicylaldehydes and halogenated ketones catalyzed by DMAP
2012年,Meshram等[11]人发现当使用20mol%的 1,4- 重氮二环(2,2,2)辛烷(DABCO)时,取代水杨醛与卤乙酰基苯的Rap-Stoermer反应可以在温和的室温条件下发生,不需要使用无机碱,如图11所示。在该反应中,DABCO既作为碱又充当着一种亲核试剂的角色。
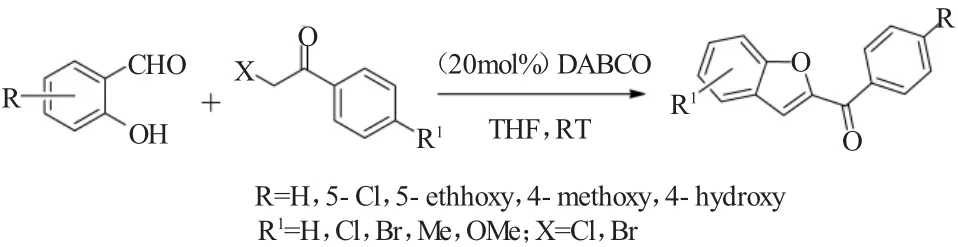
图11 DABCO催化的水杨醛与卤乙酰基苯的Rap-Stoermer反应Fig.11 Rap-Stoermer reaction of salicylaldehydes and phenacyl halides catalyzed by DABCO
2015年,Rangaswamy等[12]开发了一种室温条件下的邻羟基苯乙酮与氯乙酰基苯类化合物的Rap-Stoermer反应。该方法使用1,8-二氮杂二环十一碳-7-烯(DBU)作为催化剂,在二氯甲烷(DCM)为溶剂,在分子筛和氮气保护的存在的条件下,可有效地合成2-芳酰基-3-甲基苯并呋喃类衍生物(图12)。
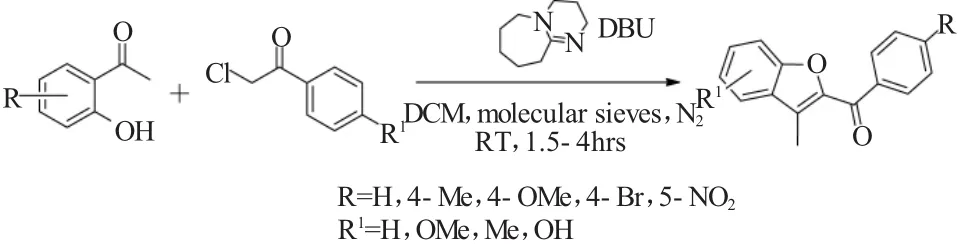
图12 DBU催化的邻羟基苯乙酮与氯乙酰基苯的Rap-Stoermer反应Fig.12 Rap-Stoermer reaction of 1-(2-hydroxyphenyl)ethanone and phenacyl chlorides catalyzed by DBU
3 应用现代合成技术的Rap-Stoermer反应
2000年,Bogdal等[13]描述了一种高效的微波辐射诱导的Rap-Stoermer反应。在家用微波炉辐射条件下,使用K2CO3作为碱,四丁基溴化铵(TBAB)为相转移催化剂取代水杨醛与二倍量的氯乙酸酯在短时间内就可有效地完成Rap-Stoermer反应,其反应如图13所示。
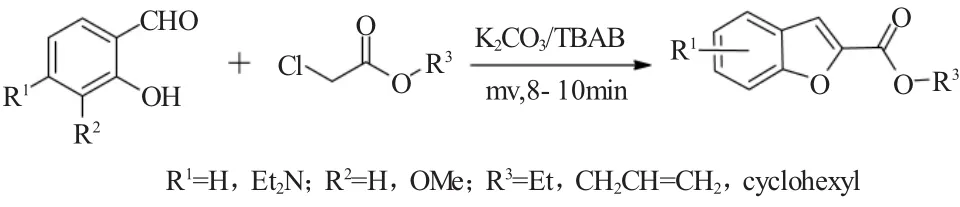
图13 微波辐射诱导的取代水杨醛与氯乙酸酯的Rap-Stoermer反应Fig.13 Microwave-induced Rap-Stoermer of salicylaldehydes with chloroacetic acid esters
2012年,我们课题组[14]提出了用15mol%聚乙二醇-400(PEG-400)作为促进剂并在超声辅助的条件下2,6-二溴乙酰基吡啶与各种叔丁基取代的水杨醛可有效地发生Rap-Stoermer反应,以较高的收率得到结构新颖而又有趣的含有叔丁基官能团的2,6-双苯并呋喃酰基取代的吡啶类衍生物,其反应式如图14所示。该反应具有反应时间短,收率高等优点。

图14 超声辅助的2,6-二溴乙酰基吡啶与叔丁基水杨醛的Rap-Stoermer反应Fig.14 Ultrasound-assisted Rap-Stoermer reaction of 2,6-bis(bromoacetyl)pyridine with t-butylsalicylaldehydes
同年,我们组[15]又报道了3,6-双氯乙酰基-9-甲基咔唑与各种水杨醛在聚乙二醇-400(PEG-400)为促进剂,在超声辅助的条件下的Rap-Stoermer反应,有效合成了结构新颖的3,6-双苯并呋喃酰基-9-甲基咔唑类化合物,如图15所示。

图15 超声辅助的3,6-双氯乙酰基-9-甲基咔唑与水杨醛的Rap-Stoermer反应Fig.15 Ultrasound-assisted Rap-Stoermer reaction of 3,6-dichloroacetyl-9-methyl-9H-carbazole with salicylaldehydes
2015年,我们组[16]进一步进行扩展性研究,发现氯乙酰基二茂铁与取代的邻羟基苯乙酮在聚乙二醇-400(PEG-400)作为促进剂,并且在不用超声辅助的条件下也能发生Rap-Stoermer反应。该反应进行的很顺利,有效地合成了结构新颖,有潜在生物活性的2-二茂铁酰基-3-甲基苯并呋喃类化合物,如图16所示。在相同的反应条件下,碘代水杨醛同样也可以与氯乙酰基二茂铁发生期待的Rap-Stoermer反应[17],得到相应的苯并呋喃酰基二茂铁类化合物(图17)。
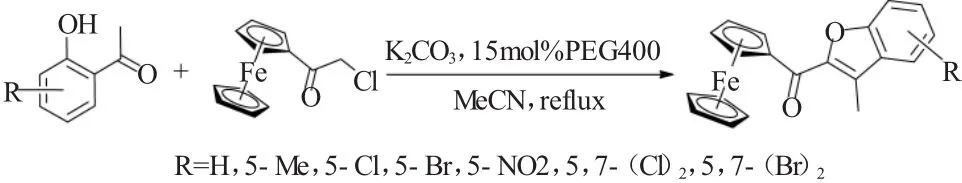
图16 PEG-400促进的氯乙酰基二茂铁与邻羟基苯乙酮的Rap-Stoermer反应Fig.16 PEG-400 promoted Rap-Stoermer reaction of 1-chloroacetylferrocene and 2′-hydroxyacetophenones
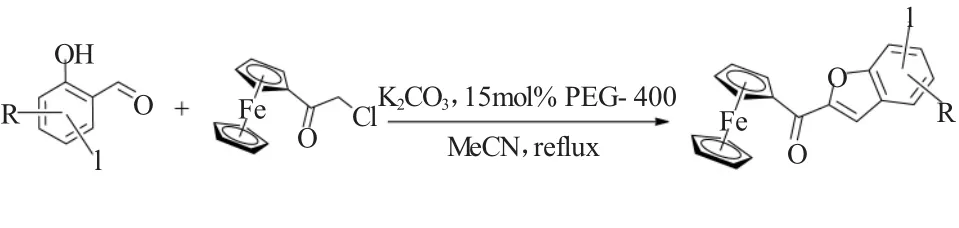
图17 PEG-400促进的氯乙酰基二茂铁与碘代水杨醛的Rap-Stoermer反应Fig.17 PEG-400 promoted Rap-Stoermer reaction of 1-chloroacetylferrocene and iodo-substituted salicylaldehydes
4 反应条件绿色的Rap-Stoermer反应
2003年,Yoshizawa课题组[18]报道了一种绿色的无溶剂研磨的方法进行卤代水杨醛与溴乙酰基苯的Rap-Stoermer反应,如图18所示。该反应在不需要有机溶剂的条件下几乎定量地得到相应的苯并呋喃类化合物。而且该反应条件下,后处理非常简单,仅用水洗反应所得的粗产物就可得到分析纯的产品。
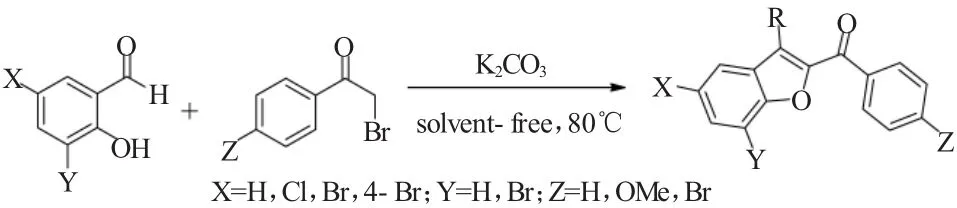
图18 卤代水杨醛与溴乙酰基苯在无溶剂条件下的Rap-Stoermer反应Fig.18 Solvent-free Rap-Stoermer reaction of halo-substituted salicylaldehydes with phenacyl bromides
绿色的无溶剂微波辐射合成方法在有机合成化学领域已占据了重要的地位,并受到了化学工作者的广泛关注[19~21]。在这方面,Rao 等[22]在 2007 年报道了将这种绿色的无溶剂微波辐射合成方法应用到水杨醛与溴乙酰基或碘乙酰基苯的Rap-Stoermer反应,该反应在2.2当量的K3PO4存在下进行地很顺利,高收率地合成了相应的苯并呋喃类衍生物(图19)。这一开发的合成方法具有绿色环保,反应时间短和收率高等优点。
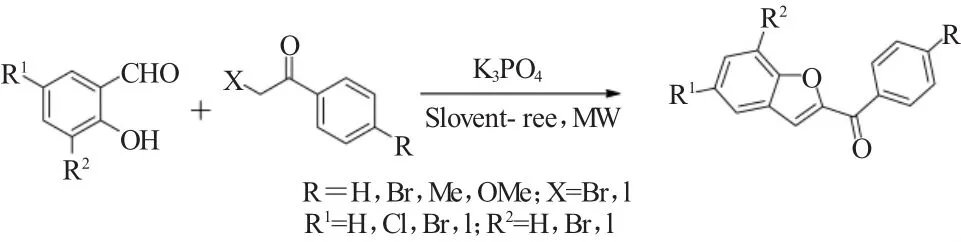
图19 卤代水杨醛与溴乙酰基苯在无溶剂条件下的Rap-Stoermer反应Fig.19 Microwave-assisted solvent-free Rap-Stoermer reaction of salicylaldehydes with phenacyl halides
2008年,Sharifi等[23]开发了一种条件温和、环境友好的Rap-Stoermer反应。水杨醛或邻羟基苯乙酮与氯/溴乙酰基苯在KF/Al2O3催化系统作用下,无需使用有机溶剂和加热的条件下就可以有效地进行Rap-Stoermer反应(图20)。作者所报道的这种固态的Rap-Stoermer反应对其反应机理细节的研究具有很好的启发作用。
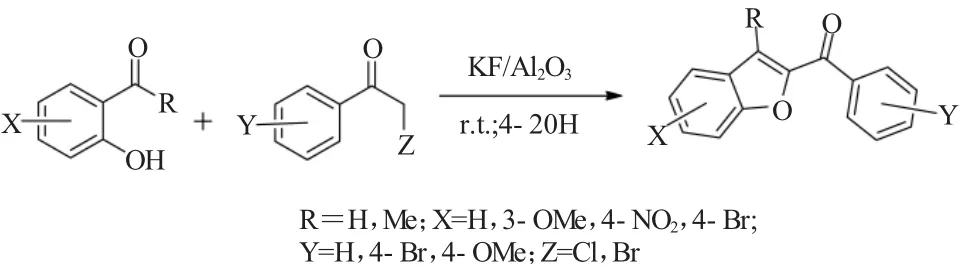
图20 KF/Al2O3催化的水杨醛或邻羟基苯乙酮与氯/溴乙酰基苯的Rap-Stoermer无溶剂反应Fig.20 Solvent-free Rap-Stoermer reaction of salicylaldehydes or 2′-hydroxyacetophenones with phenacyl halides catalyzed by KF/Al2O3
5 结论与展望
总之,Rap-Stoermer反应是合成苯并呋喃类衍生物最直接的方法之一。在这过去的十几年里,有机化学工作者对Rap-Stoermer反应,这一经典而又实用的人名反应的研究与应用方面取得了显著的进展,不仅反应所需条件已经变得更为温和,操作变得更为简单,而且更多的绿色化反应介质也已经在该反应中得到应用,这就更进一步地扩大了该反应的应用范围,使其成为有机合成中更为有效的反应途径之一。本文按照反应策略的分类,清楚地展示了最近十几年来有关应用Rap-Stoermer反应制备各种新颖的、有意义的苯并呋喃类化合物的工作,目的是为有机化学家提供有用的和最新的参考数据。我们有理由相信在未来的化学世界,Rap-Stoermer反应将继续成为有机化学领域一个不可或缺的合成工具。
[1]STOERMER,R.Synthesen und Abbaureactionen in der Cumaronreihe[J].Annalen der Chemie,1900,312(3):237~261.
[2]YAMASHIRO S.Synthesis of 1-(2-benzofurancarbonyl)azulenes using 1-(bromoacetyl)azulenes as new building blocks[J].Journal of Heterocyclic Chemistry,2002,39(4):671~683.
[3]KIRILMIS C,KOCA M,CUKUROVALI A,et al.Synthesis,reactivity and biological activity of novel bisbenzofuran-2-ylmethanone derivatives[J].Molecules,2005,10(11):1399~1408.
[4]KARATAS F,KOCA M,KARA H,et al.Synthesis and oxidant properties of novel (5-bromobenzofuran-2-yl)(3-methyl-3-mesitylcyclobutyl)ketonethiosemicarbazone[J].European Journal of Medicinal Chemistry,2006,41(5):664~669.
[5]PAUTUS S,YEE S W,JAYNE M,et al.Synthesis and CYP26A1 inhibitory activity of 1-[benzofuran-2-yl-(4-alkyl/arylphenyl)-methyl]-1H-triazoles[J].Bioorganic Medicinal Chemistry,2006,14(11):3643~3653.
[6]KIRILMIS C,AHMEDZADE M,SERVI S,et al.Synthesis and antimicrobial activity of some novel derivatives of benzofuran:Part 2.The synthesis and antimicrobial activity of some novel 1-(1-benzofuran-2-yl)-2-mesitylethanone derivatives[J].European Journal of Medicinal Chemistry,2008,43:300~308.
[7]KUMARASWAMY G,RAMAKRISHNA G,RAJU R,et al.An expedient synthesis of enantioenriched substituted(2-benzofuryl)arylcarbinols via tandem Rape-Stoermer and asymmetric transfer hydrogenation reactions[J].Tetrahedron,2010,66(52):9814~9818.
[8]PAREKH S,BHAVSAR D,SAVANT M,et al.Synthesis of some novel benzofuran-2-yl(4,5-dihyro-3,5-substituted diphenylpyrazol-1-yl)methanones and studies on the antiproliferative effects and reversal of multidrug resistance of human MDR1-gene transfected mouse lymphoma cells in vitro[J].European Journal of Medicinal Chemistry,2011,46(5):1942~1948.
[9]RǍDUTIU A C,BACIU I,CAPROIU M T,et al.Reaction of 2-(α-bromoacetyl)-phenoxathiin with substituted o-,m-,or pformyl-aroxides[J].ARKIVOC,2007(13):8~22.
[10]SHANG Y,WANG C,HE X,et al.DMAP-catalyzed cascade reaction:one-pot synthesis of benzofurans in water[J].Tetrahedron,2010,66(50):9629~9633.
[11]MESHRAM H M,REDDY B C,PRASAD B R V,et al.DABCO-promoted efficient and convenient synthesis of benzofurans[J].Synthetic Communications,2012,42(11):1669~1676.
[12]RANGASWAMY J,KUMAR H V,HARINI S T,et al.An easy access to benzofurans via DBU induced condensation reaction of active 2-hydroxy acetophenones with phenacyl chlorides:A novel class of antioxidant agents [J].Journal of Heterocyclic Chemistry,2015,52(3):938~943.
[13]BOGDAL D,WARZALA M.Microwave-assisted preparation of benzo[b]furans under solventless phase-transfer catalytic conditions[J].Tetrahedron,2000,56(44):8769~8773.
[14]LI Y,TAO X,LIN G,et al.Synthesis of novel 2,6-bis(5-tbutylbenzo[b]furan-2-ylcarbonyl)pyridines[J].Heterocyclic Communications,2012,18(4):207~210.
[15]LI Y,YAN Y,GAO W.PEG-400-promoted and ultrasoundassisted Rap-Stoermer reaction for efficient synthesis of benzofuran-2-yl(carbazolyl)-methanone derivatives[J].Heterocycles,2012,85(2):421~429.
[16]ZHUOMA B,LI Y,GAO W.First synthesis of 2?ferrocenoyl-3-methylbenzofuran derivatives[J].Journal of Chemical Research,2015,39(2):82~85.
[17]LI Y,ZHUOMA B,GAO W.A novel synthesis of 2-ferrocenoyl-substituted iodobenzofurans[J].Journal of Heterocyclic Chemistry,2016,5(4):2625.
[18]YOSHIZAWA K,TOYOTA S,TODA F,et al.Preparative and mechanistic studies of solvent-free Rap-Stoermer reactions[J].Green Chemistry,2003,5(3):353~356.
[19]罗世霞,陈晓靓,朱淮武,等.含取代噻吩环吡啶酰胺分子的微波合成与光谱表征[J].化学研究与应用,2014,26(6):855~859.
[20]ZHANG H,JIANG L.Microwave-assisted solvent-free synthesis of imidazo[1,2-a]pyridines via a three-component reaction[J].Tetrahedron Letters,2015,56(21):2777~2779.
[21]ZHANG D,ZHANG Y,ZHAO T.A rapid and efficient solventfree microwave-assisted synthesis of pyrazolone derivatives containing substituted isoxazole ring[J].Tetrahedron,2016,72(22):2979~2987.
[22]RAO M L N,AWASTHI D K,BANERJEE D.Microwave-mediated solvent free Rap-Stoermer reaction for efficient synthesis of benzofurans[J].Tetrahedron Letters,2007,48(3):431~434.
[23]SHARIFI A,ABAEE M S,TAVAKKOLI A,et al.An efficient and general procedure for room-temperature synthesis of benzofurans under solvent-free conditions using KF/Al2O3[J].Journal of Iran Chemistry Society,2008,5(1):113~117.
Research Progress in Rap-Stoermer Reaction of ɑ-haloketones with Salicylaldehydes
LI Yang1,WANG Yang1,DONG Xiao-chen1,CAI Wei2and HUANG Yi-yao1
(1.College of Chemistry,Chemical Engineering,Bohai University,Jinzhou 121000,China;2.Sebest Pharmaceutical Technology Co.,Ltd,Shenyang 110000,China)
According to its reaction strategy,the research progress in Rap-Stoermer reaction are reviewed in four parts as follows:(1) inorganic base promoted Rap-Stoermer reaction;(2)organic base catalyzed Rap-Stoermer reaction;(3)the applications of modern synthetic technology in Rap-Stoermer reaction;(4)eco-friendly Rap-Stoermer reaction.
Rap-Stoermer reaction;inorganic base;organic base;modern synthetic technology;eco-friendly reaction
O625
A
1001-0017(2017)05-0360-04
2017-04-07 *基金项目:国家自然科学基金(编号:21476028,21402011),辽宁省自然科学基金(编号:201602006)。
李阳(1979-),男,辽宁锦州人,副教授,主要研究方向:有机合成。E-mail:bhuzh@163.com
