硒摄入与胰腺癌风险的Meta分析
2017-11-23HIDAYATKhemayanto凌晨洁袁林喜尹雪斌秦立强
HIDAYAT Khemayanto, 凌晨洁, 张 峥, 袁林喜, 尹雪斌, 秦立强*
1.苏州大学医学部公共卫生学院, 营养与食品卫生教研室, 江苏 苏州 215123; 2.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 3.中国科学技术大学苏州研究院, 江苏 苏州 215123
硒摄入与胰腺癌风险的Meta分析
HIDAYAT Khemayanto1§, 凌晨洁1§, 张 峥1, 袁林喜2, 尹雪斌3, 秦立强1*
1.苏州大学医学部公共卫生学院, 营养与食品卫生教研室, 江苏 苏州 215123; 2.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 3.中国科学技术大学苏州研究院, 江苏 苏州 215123
全球每年因胰腺癌死亡的人数超过25万。尽管有相关研究证实了胰腺癌的一些危险因素,但是饮食或营养素与胰腺癌的关系仍不明确。少数观察性研究探讨了硒摄入和胰腺癌的关系,但研究结果并不一致。将在PubMed和Embase数据库中检索到的2017年5月前发表的相关观察性研究进行了meta分析,分析硒摄入和胰腺癌发病风险之间的关系,并利用随机效应模型计算总体效应量相对危险度(RR)及其95%可信区间(CI)。研究共纳入3项病例对照研究和3项队列研究,总的RR为0.76(95% CI:0.62~0.93),无异质性(P=0.66,I2=0%)和发表偏倚(Begg检验:P>0.1;Egger检验:P>0.1)。结果显示硒摄入可能降低胰腺癌的发病风险。
硒;胰腺癌;观察流行病学;meta分析
胰腺癌是癌症致死的第八大因素,据统计,全球每年因胰腺癌死亡的人数超过25万[1]。尽管诸如乳腺癌、结肠癌和前列腺癌等癌症的生存率在不断上升[2],但是胰腺癌患者的生存率在过去的几十年里并无明显改善[3]。迄今为止,仍无有效的胰腺癌筛查方法,大部分胰腺癌患者在确诊时已经处于晚期,因而胰腺癌患者往往预后差、生存率低[4]。鉴于胰腺癌发病率低,一般人群筛查试验不能有效地筛查出胰腺癌患者。因此,寻找危险因素对降低胰腺癌的发病率和死亡率至关重要。有研究证实吸烟、某些遗传疾病、肥胖和2型糖尿病是胰腺癌的危险因素[5],但是饮食或营养素与胰腺癌的关系的相关研究结果不一,早期的病例对照研究发现蔬菜摄入能减少胰腺癌的发病风险[6];但后来在荷兰实施的大样本队列研究则没有发现蔬菜的保护作用[7]。在日本实施的病例对照研究发现作为抗氧化剂的维生素C能减少55%的胰腺癌发病风险[8],而荷兰的队列研究也并没有发现维生素C的保护作用[7]。因此,饮食或营养素与胰腺癌的关系值得进一步研究。
硒是人体必需微量元素之一,参与体内如甲状腺激素代谢、抗氧化防御系统和免疫功能等重要生理代谢[9]。近年来,硒在预防癌症中的潜在作用受到越来越多的关注。多项观察性研究的meta分析显示,硒摄入有助于减少前列腺癌、膀胱癌和肺癌的发生。Etminan 等[10]的meta分析发现汇总11个队列研究后,硒摄取较高人群患前列腺癌的相对危险度(RRs)为0.72(95%可信区间,95% CI:0.61~0.84),Amaral等[11]汇总了7个流行病学研究发现硒摄取与膀胱癌的发病风险呈负相关(比值比,OR=0.61,95% CI:0.42~0.87),而Fritz等[12]的研究则认为在基础血硒水平较低的人群中硒摄取能降低肺癌的发病风险。因此,本研究通过meta分析探讨硒摄入和胰腺癌发病风险之间的关系,以期为通过改善硒营养水平来降低胰腺癌发病风险提供参考。
1 材料与方法
1.1文献检索
本次meta分析根据PRISMA推荐的标准进行研究设计、实施和报告[13]。在PubMed和Embase两大数据库中搜索有关硒摄入和胰腺癌关系的研究,关键词如下:“selenium” OR “trace elements” OR “minerals” OR “anti-oxidant” OR “micronutrients” OR “nutrient” OR “dietary” OR “nutritional”) AND (“pancreatic cancer” OR “pancreatic adenocarcinoma” OR “pancreatic tumor” OR “pancreatic neoplasms” OR “cancer of pancreas” OR “tumor of pancreas” OR “neoplasms of pancreas”, 搜索截至2017年5月。
1.2研究选择
文献纳入标准如下:①研究类型为观察性研究(如:队列研究、病例对照研究和巢式病例对照研究等);②研究的暴露因素为硒摄入(膳食和/或补充剂);③研究的结局变量为胰腺癌的发病率或患病率;④报告数据为RRs、ORs或风险比(HRs)及其95% CI。若多篇文献研究同一人群,则选取数据更详细的一篇。
1.3数据提取和文献质量评估
使用标准的数据收集表格,从每一篇入选文献中提取下列数据:第一作者的姓氏、发表年份、国家、研究类型、研究对象、随访年限(仅用于队列研究)、研究人数、病例数、多因素修正后的效应量及其95% CI和校正因素。文献质量用9-star Newcastle-Ottawa Scale(NOS)评估,该量表根据研究组的选择、组间的可比性以及暴露和结局的确定来决定文献质量[14]。文献检索、研究选择和数据提取由两位研究人员独立完成。若文献入选标准存在分歧,则由小组讨论解决。
1.4统计学分析
胰腺癌是一种发病率低的疾病,此时OR近似RR/HR。本研究将RR作为效应量,OR和HR则直接视为RR。采用D-L随机效应模型法合并总体效应量[15]。异质性评价采用Q值和I2统计量。对于Q值,P<0.1可认为具有统计学意义,即具有异质性。同时使用Begg秩相关检验法和Egger线性回归分析法来检测潜在发表偏倚[16]。由于研究纳入的样本量小,因此未进行亚组分析。敏感性分析仅对队列研究进行。以上统计学分析均采用STATA软件11.0版(STATA Corp., College Station, TX, USA),所有P值均为双侧检验,除特定说明外,显著性水平均为P<0.05。
2 结果与分析
2.1研究基本特征
图1为研究选择流程图,并标注了文献排除的原因。所有纳入文献的基本资料汇总于表1。本次研究最终纳入3项病例对照研究[17~19]和3项队列研究[20~22]。这6项研究中,3项研究由美国开展,其余分别在澳大利亚、芬兰和英国。5项研究的研究对象包括男性和女性,另外一项全部为男性[17]。3项病例对照研究共纳入胰腺癌患者1 020例、对照组2 937例。3项队列研究共有128 215例研究对象,其中发生胰腺癌的有444例。通过自填式膳食问卷调查[17]、半定量食物频率问卷调查[18]和7 d饮食日记调查[19]收集研究对象硒的基线摄入情况。随访时间为10~17年。大部分研究调整了年龄、身体质量指数(BMI)、吸烟、能量摄入量以及糖尿病史对效应量的影响。文献质量评估结果显示,其中4项研究得分≥7分。
2.2Meta分析主要结果
所有入选研究中,仅有一项结果显示硒摄入和胰腺癌存在负相关。Meta分析结果显示汇总RR值为0.76(95% CI:0.62~0.93,P=0.007),研究间无异质性(P=0.718,I2=0%)(图2)。
2.3灵敏度分析和发表偏倚分析
若仅对队列研究进行合并,合并RR值为0.82(95% CI:0.59~1.14)。依次排除6项研究中的一项,进行敏感性分析,结果显示RR从0.73(95% CI:0.58~0.93)到0.81(95% CI:0.60~1.02)(图3)。漏斗图分析没有发现明显的发表偏倚(图4),Begg检验(P=0.851)和Egger检验(P=0.728)结果也表明本次研究无发表偏倚。

图1 Meta分析研究筛选流程图Fig.1 Flow chart of articles selection in meta-analysis.
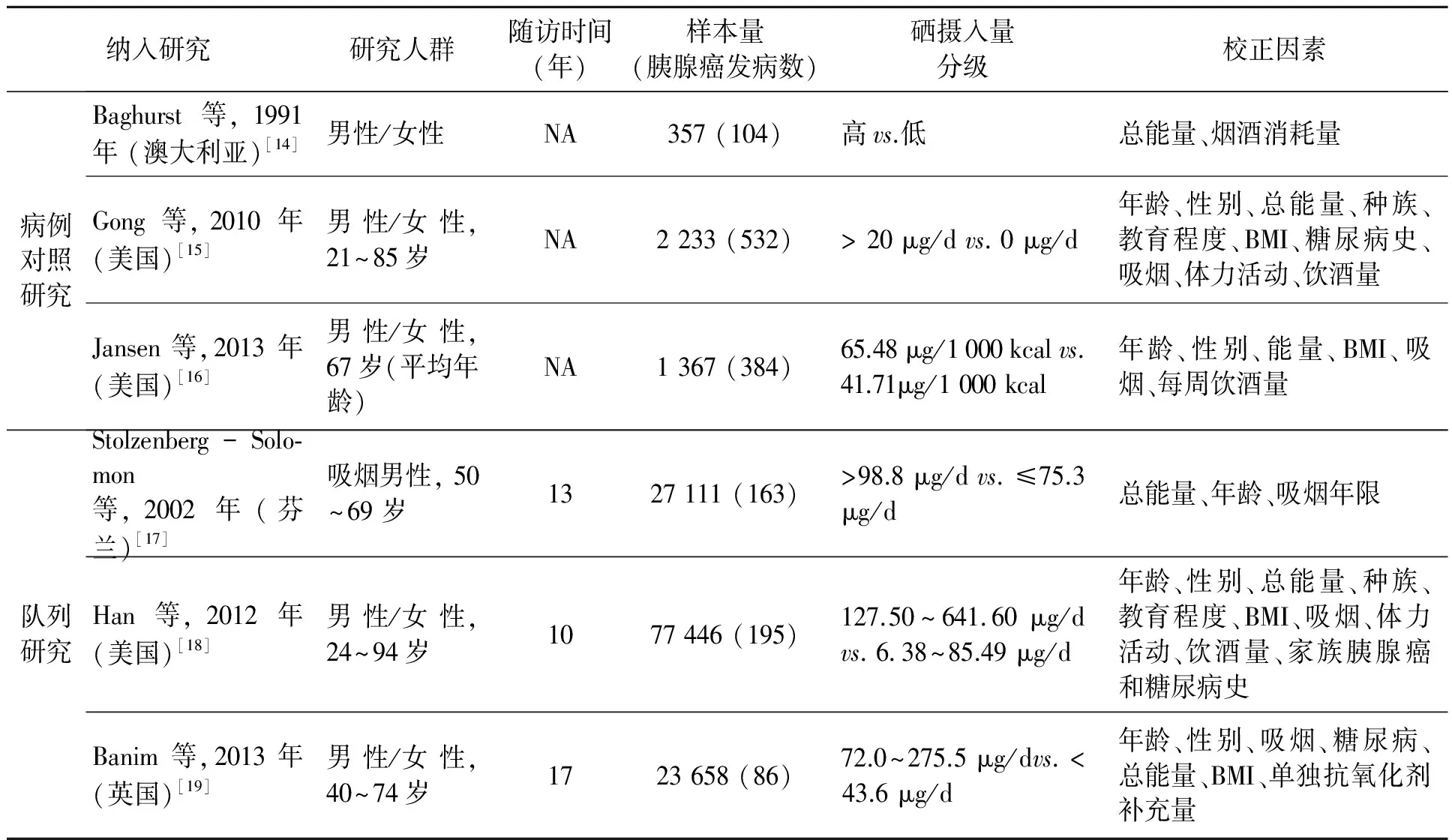
表1 Meta分析纳入研究基本特征及效应量Table 1 Characteristics of studies included in the meta-analysis.
注:BMI:身体质量指数;NA:不适用。

图2 硒摄入和胰腺癌的meta分析森林图Fig.2 Meta-analysis of selenium and risk of pancreatic cancer.
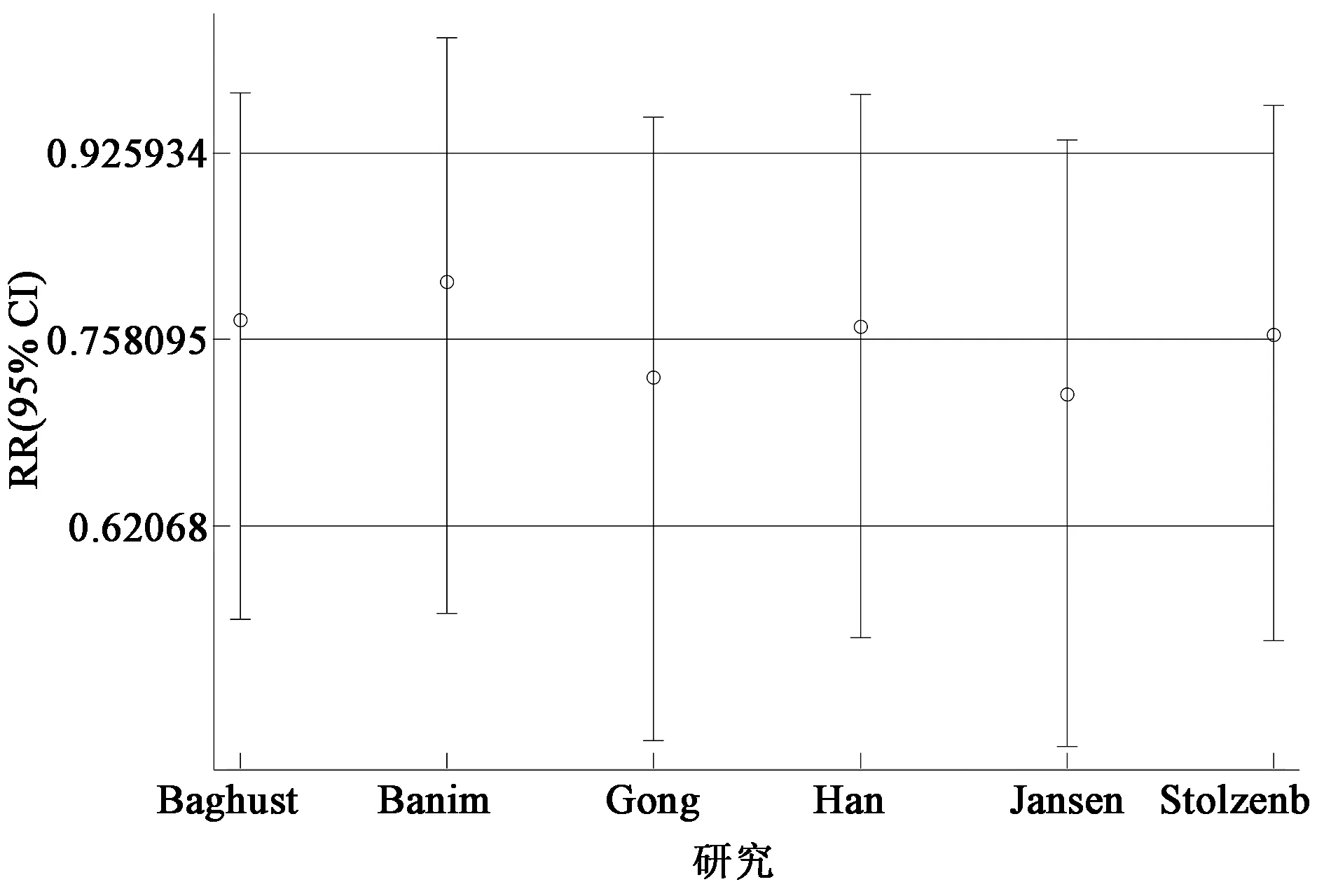
图3 硒摄取与胰腺癌关系的敏感性分析Fig.3 The analysis of sensitivity of selenium intake and pancreatic cancer risk.
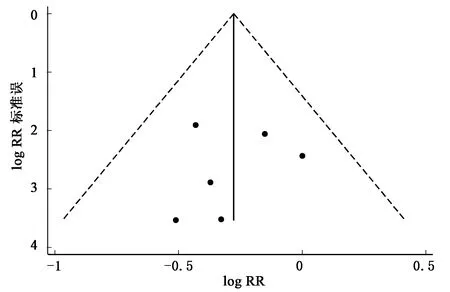
图4 硒摄取与胰腺癌关系发表偏倚的漏斗图Fig.4 Funnel plot of selenium intake and pancreatic cancer risk.
3 讨论
本次研究中共纳入的6项观察性研究探讨硒摄入和胰腺癌发病风险的关系。6项研究的结果不尽相同,一项纳入27 111例的队列研究结果显示,膳食硒摄入和胰腺癌之间无相关性[20]。但是,该研究招募的研究对象是老年男性吸烟者,该人群本身胰腺癌患病风险高,其结果外推到一般人群尤其是非吸烟人群时需慎重。欧洲肿瘤前瞻性研究(EPIC)在英国的队列进行了10年随访,与对照比较,膳食硒摄入量四分位最高组硒摄入与胰腺癌存在负相关[22]。此外,一项有关维生素和生活方式的研究(VITAL)发现,硒中等水平消费组人群硒的补充和胰腺癌之间存在负相关,而硒高消费组则观察不到这一结果[21]。其余3项病例对照研究的结果也不一致。Baghurst[17]和Gong[18]的研究认为硒摄入和胰腺癌之间无关联,但Jansen[16]发现两者之间存在负相关。因此,我们对6项研究进行meta分析,结果显示硒摄入能够显著降低胰腺癌的发病风险。
Wang等[23]和Chen等[24]的meta分析也研究了硒摄入和胰腺癌之间的相关性,但是他们的研究结果存在明显的局限性。Wang等[23]在提取 Jansen等[19]的研究数据时,使用的RR值为五分位的第四剂量组(OR=0.45,95% CI:0.30~0.68)而非按要求的第五剂量组(最高剂量组,OR=0.65,95% CI:0.45~0.94)。Chen等[24]则纳入了有关趾甲硒浓度和胰腺癌风险的研究[25],该研究在分析VC和VE时纳入了Gong等[18]的研究,但在硒和胰腺癌的meta分析时则遗漏了Gong的研究。另外,对于Han等[21]的研究,两篇meta分析均只提取了膳食硒而非包括膳食硒和补充硒的总硒,本研究的meta分析则提取了总的硒摄入来进行meta分析,因此结果能够更可靠地反映硒摄取与胰腺癌发病风险之间的关系。本次分析研究间没有观察到异质性,但以上两篇meta分析异质性显著,很大可能是提取和合并数据不当导致的。
Kise等[26]用N-亚硝基双(2-氧丙基)胺诱导豚鼠胰腺癌,同时在饮水中添加硒,18周后可触及肿瘤数显著减少,而且血液中谷胱甘肽过氧化物酶活性也高于对照组。Appel等[27]则用重氮丝氨酸诱导大鼠胰腺癌变,添加硒则能降低诱导癌变后期大鼠的不典型腺泡细胞灶的多样性。尽管目前对硒的抗肿瘤作用的具体机制尚不明确,但是硒能够使氧自由基失活、促进DNA修复和诱导细胞凋亡,从而起到抗肿瘤作用。某些硒蛋白(谷胱甘肽过氧化物酶和硒蛋白P)表达异常,尤其是与清除活性氧和减少氧化损伤相关硒蛋白的异常表达,表明含硒酶的抗氧化特性与肿瘤的发生与发展关系密切[28]。硒的抗肿瘤作用与细胞中的硒化氢和硒代蛋氨酸的活性密切相关,通过蛋白巯基修饰和蛋氨酸拟态,使RNA和硫醇的甲基化效率更高[29]。硒同时也是金属拮抗剂,硒对减少砷、镉和铅暴露引起的氧化应激起至关重要的作用[30]。此外,硒还可通过增强p53的活性,帮助DNA修复或细胞凋亡[31]。
本次meta分析的结果存在以下局限:①分析基于3项病例对照研究和3项队列研究。选择偏倚是病例对照研究中常见的偏倚,且胰腺癌患者确诊后其生活方式和饮食习惯往往会发生改变,从而易产生回忆偏倚;②本次分析样本量少,根据潜在混杂因素进行分组分析或利用meta回归分析深入调查研究间异质性的来源,其结果因效能过低而受限。另外,所有入选研究均在西方人群中开展,且其中有一项是对男性吸烟者进行的研究[17]。
总之,本文对6项观察性研究进行了meta分析,结果显示硒摄入能够降低24%的胰腺癌发病风险。为了进一步阐明这种关系,需要在血清硒水平低、尤其在亚洲人群中进行更多的前瞻性研究,探讨膳食硒摄取量以及硒补充剂长期使用对胰腺癌发病风险的影响。
[1] Siegel R L, Miller K D, Jemal A. Global cancer statistics, 2016 [J]. CA Cancer J. Clin., 2016, 66(1):7-30.
[2] American Cancer Society. Cancer facts & figures 2013. Atlanta: american cancer society[EB/OL]. http://www.cancer.org/research/cancerfactsfigures/cancerfactsfigures/cancer-facts-figures-2013,2016.
[3] Rossi M L, Rehman A A, Gondi C S. Therapeutic options for the management of pancreatic cancer [J]. World J. Gastroenterol., 2014, 20(32):11142-11159.
[4] Klapman J, Malafa M P. Early detection of pancreatic cancer: Why, who, and how to screen [J]. Cancer Control, 2008, 15(4):280-287.
[5] Ryan D P, Hong T S, Bardeesy N. Pancreatic adenocarcinoma [J]. New Engl. J. Med., 2014, 371(11):1039-1049.
[6] Norell S E, Ahlbom A, Erwald R,etal.. Diet and pancreatic cancer: A case-control study [J]. Am. J. Epidemiol., 1986, 124(6):894-902.
[7] Heinen M M, Verhage B A, Goldbohm R A,etal.. Intake of vegetables, fruits, carotenoids and vitamins C and E and pancreatic cancer risk in the Netherlands cohort study[J]. Int. J. Cancer, 2012, 130(1):147-158.
[8] Lin Y, Tamakoshi A, Hayakawa T,etal.. Nutritional factors and risk of pancreatic cancer: A population-based case-control study based on direct interview in Japan [J]. J. Gastroenterol., 2005, 40(3):297-301.
[9] Brown K M, Arthur J R. Selenium, selenoproteins and human health: A review [J]. Public Health Nutr., 2001, 4(2B):593-599.
[10] Etminan M, FitzGerald J M, Gleave M,etal.. Intake of selenium in the prevention of prostate cancer: A systematic review and meta-analysis [J]. Cancer Causes Control, 2005, 16(9):1125-1131.
[11] Amaral A F, Cantor K P, Silverman D T,etal.. Selenium and bladder cancer risk: A meta-analysis [J]. Cancer Epidemiol. Biomarkers, 2010, 19(9):2407-2415.
[12] Fritz H, Kennedy D, Fergusson D,etal.. Selenium and lung cancer: A systematic review and meta analysis [J]. PLoS ONE, 2011, 6(11):e26259.
[13] Moher D, Liberati A, Tetzlaff J,etal.. Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement [J]. PLoS Med., 2009, 6(7):e1000097.
[14] Wells G A, Shea B, O′Connell D,etal.. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomized studies in meta-analyses 2000[J]. Appl. Engin. Agric.,2014,18(6):727-734.
[15] DerSimonian R, Laird N. Meta-analysis in clinical trials [J]. Control Clin. Trials, 1986, 7(3):177-188.
[16] Egger M, Davey Smith G, Schneider M,etal.. Bias in meta-analysis detected by a simple, graphical test [J]. Brit. Med. J., 1997, 315(7109):629-634.
[17] Baghurst P A, McMichael A J, Slavotinek A H,etal.. A case-control study of diet and cancer of the pancreas [J]. Am. J. Epidemio., 1991, 134(2):167-179.
[18] Gong Z, Holly E A, Wang F,etal.. Intake of fatty acids and antioxidants and pancreatic cancer in a large population-based case-control study in the San Francisco Bay Area [J]. Int. J. Cancer, 2010,127(8):1893-1904.
[19] Jansen R J, Robinson D P, Stolzenberg-Solomon R Z,etal.. Nutrients from fruit and vegetable consumption reduce the risk of pancreatic cancer [J]. J. Gastrointest. Cancer, 2013, 44(2):152-161.
[20] Stolzenberg-Solomon R Z, Pietinen P, Taylor P R,etal.. Prospective study of diet and pancreatic cancer in male smokers [J]. Am. J. Epidemiol., 2002,155(9):783-792.
[21] Han X, Li J, Brasky T M,etal.. Antioxidant intake and pancreatic cancer risk: the vitamins and lifestyle (VITAL) study [J]. Cancer, 2013,119(7): 1314-1320.
[22] Banim P J, Luben R, McTaggart A,etal.. Dietary antioxidants and the aetiology of pancreatic cancer: A cohort study using data from food diaries and biomarkers [J]. Gut, 2013, 62(10):1489-1496.
[23] Wang L, Wang J, Liu X,etal.. Association between selenium intake and the risk of pancreatic cancer: A meta-analysis of observational studies [J]. Biosci. Rep., 2016, 36(5): e00395.
[24] Chen J, Jiang W, Shao L,etal.. Association between intake of antioxidants and pancreatic cancer risk: A meta-analysis [J]. Int. J. Food Sci. Nutr., 2016, 67(7), 744-753.
[25] Amaral A F, Porta M, Silverman D T,etal.. Pancreatic cancer risk and levels of trace elements [J]. Gut, 2012, 61(11):1583-1588.
[26] Kise Y, Yamamura M, Kogata M,etal.. Inhibitory effect of selenium on hamster pancreatic cancer induction by N′-nitrosobis (2-oxopropyl) amine [J]. Int. J. Cancer, 1990, 46(1):95-100.
[27] Appel M J, Woutersen R A. Effects of dietary beta-carotene and selenium on initiation and promotion of pancreatic carcinogenesis in azaserine-treated rats [J]. Carcinogenesis, 1996, 17(7):1411-1416.
[28] Murawaki Y, Tsuchiya H, Kanbe T,etal.. Aberrant expression of selenoproteins in the progression of colorectal cancer [J]. Cancer Lett., 2008, 259(2):218-230.
[29] Jackson M, Combs G F J. Selenium and anticarcinogenesis: underlying mechanisms [J]. Curr. Opin. Clin. Nutr. Metab. Care, 2008, 11(6):718-726.
[30] Schrauzer G N. Anticarcinogenic effects of selenium [J]. Cell Mol. Life Sci., 2000, 57:1864-1873.
[31] Smith M L, Lancia J K, Mercer T I,etal.. Selenium compounds regulate p53 by common and distinctive mechanisms [J]. Anticancer Res., 2004, 24(3a):1401-1408.
秦立强教授团队介绍
秦立强教授团队长期从事营养元素硒的研究,团队共有7名研究人员,教授1名,副教授5名,讲师1名。其中博士生导师1名,硕士生导师4名,在读研究生15名。团队近五年发表SCI文章30余篇,在研国家自然科学基金项目5项。在《中华流行病学杂志》、《卫生研究》、《生物技术进展》、“Nutrients”、“J. Health. Sci.”等期刊发表10篇硒与健康的论文,团队与苏州硒谷科技有限公司成立了联合实验室,获批了苏州大学研究生工作站。带头人秦立强教授为中国营养学会理事、江苏省营养学会常务理事,是江苏省科协选派苏州硒谷科技有限公司的首席专家。
SeleniumIntakeandRiskofPancreaticCancer:AMeta-analysisofObservationalStudies
HIDAYAT Khemayanto1§, LING Chenjie1§, ZHANG Zheng1, YUAN Linxi2, YIN Xuebin3, QIN Liqiang1*
1.DepartmentofNutritionandFoodHygiene,SchoolofPublicHealth,SoochowUniversity,JiangsuSuzhou215123,China; 2.JiangsuBio-engineeringResearchCentreofSelenium,JiangsuSuzhou215123,China; 3.SuzhouInstituteofAdvancedStudy,UniversityofScienceandTechnologyofChina,JiangsuSuzhou215123,China
Globally, pancreatic cancer causes more than a quarter of a million deaths annually. Although some risk factors have been identified, the association between diet or individual nutrients and pancreatic cancer risk remains unclear. The association between selenium (Se) intake and the risk of pancreatic cancer has been examined by a few observational studies, but remains controversial because of inconsistent results. Therefore, we aimed to conduct this meta-analysis to investigate the association between Se intake and risk of pancreatic cancer. PubMed and Embase databases were searched for observational studies up to May 2017. The summary relative risks (RRs) with 95% confidence intervals (CIs) were calculated with a random-effect model. Final analysis included three cohort studies and three case-control studies. The combined RR of pancreatic cancer for Se intake was 0.76 with a 95% CI of 0.62~0.93. There were no evidence of heterogeneity (P=0.66,I2=0%) and publication bias (Begg′s test:P>0.1; Egger′s test:P>0.1). This meta-analysis provided evidence of a significant inverse association between Se intake and pancreatic cancer.
selenium; pancreatic cancer; observational study; meta-analysis
2017-06-22;接受日期2017-07-10
国家自然科学基金项目(81472974;81273067)资助。
§Hidayat Khemayanto与凌晨洁为本文共同第一作者。Hidayat Khemayanto,博士研究生,主要从事微量营养素研究。E-mail:khemzie_khem@yahoo.com;凌晨洁,硕士研究生,主要从事营养相关疾病研究。E-mail:296013327@qq.com。*通信作者:秦立强,教授,博士生导师,主要从事营养与食品卫生研究。E-mail:qinliqiang@suda.edu.cn
10.19586/j.2095-2341.2017.0066
