生物样品中硒的形态分析方法研究进展
2017-11-23张泽洲朱元元侯遇珠袁林喜尹雪斌
张泽洲, 朱元元, 李 梦, 李 单, 侯遇珠, 袁林喜*, 尹雪斌
1.江苏省硒生物工程技术研究中心, 江苏 苏州 215123;2.中国地质大学(武汉), 生物地质与环境地质国家重点实验室, 武汉 430074;3.中国科学技术大学苏州研究院, 功能农业重点实验室, 江苏 苏州 215123
生物样品中硒的形态分析方法研究进展
张泽洲1,2, 朱元元1, 李 梦1, 李 单1, 侯遇珠1, 袁林喜1*, 尹雪斌3*
1.江苏省硒生物工程技术研究中心, 江苏 苏州 215123;2.中国地质大学(武汉), 生物地质与环境地质国家重点实验室, 武汉 430074;3.中国科学技术大学苏州研究院, 功能农业重点实验室, 江苏 苏州 215123
对近年来关于生物样品中微量元素硒的形态分析方法的研究成果进行了综述,总结了高硒生物样品(>10 mg Se/kg)和低硒生物样品(<1 mg Se/kg)的硒形态组分提取方法,以及利用液相色谱-原子荧光光谱(LC-AFS)、高效液相色谱与电感耦合等离子质谱(HPLC-ICP-MS)等仪器联用的方法分离、检测硒的形态组分。此外,对利用同步辐射X射线微区分析方法(STXM)原位微区分析微生物样品的硒形态及其分布进行了综述与展望。
硒形态分析;硒代氨基酸;液相色谱-原子荧光光谱(LC-AFS);高效液相色谱与电感耦合等离子质谱(HPLC-ICP-MS);同步辐射X射线微区分析(STXM)
硒是人和动物所必需的微量元素,具有提高免疫力、保护心脏等作用[1]。大量研究表明[2~7],硒的生理、毒理影响以及环境行为、生物利用度和迁移程度主要取决于其形态。目前的研究发现硒在环境介质中主要以Se2-、Se0、Se4+、Se6+的形式存在,一般通过化学试剂连续提取的方法予以分析[8,9];硒在植物样品中主要以硒代蛋氨酸(SeMet)、硒代胱氨酸(SeCys2)、硒甲基硒代半胱氨酸(SeMeCys)、Se4+、Se6+、纳米硒等形式存在[4,10,11],而硒在动物和微生物样品中主要以硒代胱氨酸(SeCys2)的形式存在[12~16],一般采用液相色谱-原子荧光光谱(LC-AFS)、高效液相色谱与电感耦合等离子质谱(HPLC-ICP-MS)等仪器联用的方法予以分析。
本文综述了近几年来对不同基质生物样品中硒形态的提取方法,以及硒形态组分分离检测方法的研究进展,以期为生物样品中硒形态的准确分析提供参考。
1 生物样品中硒形态组分的提取
在对生物样品中硒的形态进行分析时,选择恰当的样品前处理提取方法十分重要。目前对生物样品中硒形态组分的提取方法主要包括液相萃取、微波萃取、固相萃取和酶提法等技术[17],而酶提法因具有反应条件温和、产物不易变性和提取效率高等优点而被广泛应用[4,13,18,19]。常规提取方法主要通过Tris-HCl缓冲液、结合纤维素酶(针对于谷物类、豆类及蔬菜类等植物类样品)或脂肪酶(针对于肉类、蛋类等动物类样品)的预处理,利用蛋白酶K和蛋白酶XIV的连续酶解提取,从而获得样品的硒代氨基酸形态特征[20]。
张如等[21]从壶瓶碎米荠新鲜叶片中分离纯化耐硒内生菌株,并运用上述常规酶提法研究内生菌株CSN-1对亚硒酸钠的体外代谢特征,发现其可将亚硒酸钠转化为硒代胱氨酸。张涛等[22]采取多种非特异性蛋白酶分阶段对大米样品进行硒形态提取,蛋白酶断开蛋白链中的肽键,使之尽可能完全水解,并用色谱与质谱联用分析其中的含硒氨基酸,确定了富硒大米中的硒形态。Gergely等[23]利用常规酶提法分析了双孢蘑菇中硒形态的分布,并对酶消解、Tris-HCl缓冲液、NaOH这3种提取方案的效果进行比较,结果发现蛋白酶与Tris-HCl结合对样品进行预处理的提取率较高。
尽管常规酶提取法能处理大部分常见的生物样品,但是在实际检测过程中,对高硒含量和低硒含量的生物样品、真菌类样品均存在硒的提取率较低、代表性不足等问题,下文针对这些特殊样品提取方法的研究进行了总结和归纳。
1.1高硒含量生物样品中硒形态的提取
由于高硒含量(>10 mg Se/kg)的生物样品(如高硒植物样品、高硒动物样品)中游离硒代氨基酸的含量相对较高[24],可缩减提取过程中的酶解步骤,即可在Tris-HCl(pH 7.5)的缓冲条件下,仅加入蛋白酶XIV(植物样品需同时加入纤维素酶,动物样品需同时加入脂肪酶)。相对于常规酶提法,此方法可以显著缩短提取时间、提高检测效率。Yuan等[4]利用上述改进的提取方法对硒超累积植物壶瓶碎米荠(100~8 000 μg Se/kg)的根、茎、叶组织进行了硒形态分析,发现硒的提取率高达80%以上,其主要硒形态为硒代胱氨酸,占总硒含量的74%~99%,显著有别于沙漠王羽、双钩黄芪等硒超累积植物(主要硒形态为硒甲基硒代半胱氨酸)。Zhu等[12]利用上述方法对富硒鸡蛋中硒的形态进行了检测分析,发现鸡蛋中主要存在的硒形态为硒代蛋氨酸,占总硒的60%以上,此外,蛋黄中有部分硒代胱氨酸被检出,而在蛋青中并没有其他硒形态出现。
1.2低硒含量生物样品中硒形态的提取
对于一些硒含量较低(<1 mg Se/kg)且难以酶解的生物样品,若提取方法只是加酶水解后离心提取上清液进行检测,样品中各硒形态的含量不仅达不到仪器的检测限,且样品中复杂的基质也会严重影响仪器的检测结果,甚至对仪器造成损害。而且,这类样品中硒代氨基酸多存在于多肽或硒蛋白中,水解过程较长且提取效果不理想。因此,可以采用“蛋白酶XIV+超声辅助(+加热震荡)+提纯浓缩”的改进方法,在此改进方法中,甲醇-水相可以提高各硒形态的溶解度,以提高该方法的提取率;氯仿可萃取出脂溶性或非极性且较为复杂的基质,并且可以使未水解完全的蛋白质变质沉淀,以达到除杂的目的[5, 6]。
2 硒形态组分的分离与检测
利用光谱法、质谱法等单一检测方法分析硒形态,虽然简单经济,但干扰因素多且选择性差。1980年,Hirschfeld[25]首次提出联用技术,推动了仪器联用技术的迅速发展和应用。仪器联用技术通常将高灵敏度的检测技术与高选择性的分离技术串联在一起,利用该技术检测硒形态具有灵敏度高、准确度强和分析速度快等优势[26]。分离技术如气相色谱、液相色谱以及毛细管电泳法等的迅速发展,检测技术如原子荧光、原子吸收、等离子体质谱等技术的更新,以及各种连接技术的陆续发现,为硒的形态分析提供了技术支持。目前普遍运用且较为成熟的联用技术为液相色谱-原子荧光光谱[4,21,27,28]以及高效液相色谱与电感耦合等离子质谱[5,6,29~31]。
2.1LC-AFS联用
液相色谱-原子荧光光谱联用技术采用液相色谱作为硒形态的分离系统,同市面上的其他色谱联用系统相比,原子荧光检测器结构简单、价格便宜,更易于推广应用[32]。但该系统中的检测器AFS相比ICP-MS,具有较高仪器检测限,因此一些低硒样品中各硒形态由于含量低于检测限而无法进行检测,进而限制了检测样品类型的范围。Yuan等[4]用LC-UV-AFS对壶瓶碎米荠进行硒形态检测,其中液相色谱部分用Hamilton PRPX-100阴离子交换柱(4.1 mm×250 mm×10 μm),流动相为40 mmoL/L的NH4H2PO4溶液(pH 6.0),流速为1 mL/min,并以UV-HG-AFS作为检测器。结果检测出硒代胱氨酸、硒代蛋氨酸、亚硒酸根及硒甲基半胱氨酸4种硒化合物。Zhu等[12]利用上述检测方法快速分离检测出了鸡蛋中的硒形态,4种硒形态在7 min内均能良好分离。该硒形态分离检测方法还成功应用于食用菌[13,15]、植物内生菌[21]及水稻[33]等作物。
2.2HPLC-ICP-MS联用
高效液相色谱(HPLC)是利用各种色谱柱对不同种类样品进行分离的高效分离技术,该分离技术尤为适用于热稳定性差且极性强的硒形态分析,而电感耦合等离子质谱具有元素专一性且检测限低等优点,将二者联用可明显提高检测的灵敏度、准确性以及分析速度,该联用技术可用于多种生物样品中硒等元素的形态定量分析[34]。
通常用于元素分析的高效液相分离技术包括:排阻色谱、手性色谱、反相色谱和阴离子交换色谱等。由于阴离子交换色谱具有固有的分离再现性和分离非挥发性硒化合物的优势,常被用于分离硒形态[35~37]。基于PRP-X100型阴离子交换柱,采用不同的流动相测定多种样品中硒形态的研究方法被广泛应用。Sanchez等[38]以80 mmoL KH2PO4/K2HPO4(pH 6.0)作为流动相检测出水藻中硒的形态为无机硒和硒代氨基酸。Floor等[36]利用梯度洗脱的方法,采用pH为3.0~4.8、10~20 mmoL柠檬酸盐作为流动相测定酸性环境样品中的硒形态,但酸性环境样品中溶酸性流动相会形成沉淀损坏色谱柱。而铵盐在等离子体条件下为挥发性物质,不会产生盐沉淀,进而保护雾化器以及避免对检测过程造成干扰[39,40]。
ICP-MS在分析检测硒形态时,在灵敏度、选择性及专一性方面与其他检测器相比具有明显的优势,但同时也存在较为明显的多原子离子干扰(40Ar和36Ar+对77Se,40Ar和36Ar对76Se等)[41]。目前可以克服该问题的方法为检测样品中硒的其他天然同位素,选择尽可能不受干扰或干扰较小且丰度高的同位素。硒有6种天然同位素分别是74Se、76Se、77Se、78Se、80Se、82Se。同位素80Se(天然丰度最大,为49.61%)不能使用质谱来检测,原因是氩的二聚物Ar2在质荷比等于80处存在干扰峰;同位素74Se的丰度太小(天然丰度为0.89%),造成仪器的灵敏度响应值低;同位素76Se(天然丰度为9.37%)受多原子离子40Ar、36Ar的干扰;同位素77Se(天然丰度为7.63%)和82Se(天然丰度为8.73%)的天然丰度无法满足仪器的灵敏度检测要求;而78Se具有相对较高的天然丰度值(23.77%),在ICP-MS的信号响应高,因此,可以采用78Se作为监测质量数。另一种方法是利用碰撞反应池技术(CCT)除去形成的多原子离子。罗乐等[42]利用HPLC-ICP-MS联用技术分析了在工业废渣中硒的形态,结果证明CCT动态反应碰撞模式能有效降低多原子离子检测的干扰,优化ICP-MS检测环境。
因此,本研究组建立了基于SHIMADZU LC-20AT-Thermo Fisher Series X2的HPLC-ICP-MS分离检测方法:选用Hamilton PRPX-100阴离子交换柱(4.1 mm×250 mm×10 μm),以6 mmoL/L柠檬酸铵+2%甲醇溶液(pH 5.3)作为流动相,流速为1 mL/min,选用78Se作为检测质量数对5种硒形态混标进行11次重复检测,得出该方法的仪器检测限(LOD)及方法检测限(LOQ)(数据未发表)。在该方法条件下,5种硒形态仪器检测限为0.52~1.81 ng/g,方法检测限为1.55~5.44 ng/g,且该方法具有良好重现性,RSD为0.85%~3.00%,故该HPLC-ICP-MS分离检测方法可满足大部分样品的硒形态检测,甚至可检出一些痕量硒化合物。
3 同步辐射X射线微区分析方法在硒形态原位分析中的应用
同步辐射X射线微区分析方法(scanning transmission X-ray microscope,STXM)因其具有能量高、穿透力强、检测限低(mg/kg级)、可进行快速面扫描以及三维重构、元素形态特征分析以及无损分析等独特优势,并对特定元素在生物体中的分布、成像、存在形式以及相互关系的研究中具有重要的地位,在微生物与元素的成矿作用、代谢作用等研究中具有巨大的应用潜力[43]。Yoon等[44]用STXM C 1s谱峰获得了Caulobactercrosentus生物膜中的蛋白和胞外聚合物的分布图,随后获得了Al k边成像特征,确定了Al在生物膜中的分布及其形态特征。Toner等[45]用STXM方法获得了P.putida生物膜的分布特征,并观察到发生在膜上的Mn(Ⅱ)通过酶催化氧化为Mn(Ⅲ)和Mn(Ⅳ)的动态过程。2006年,Dynes等[46]极大地推进了STXM方法的发展,他们通过C k和O k获得一种细菌-藻类生物膜的细胞和胞外聚合物分布特征及其中的氧化物组成特征,并通过Fe L谱峰定量获得Fe(Ⅱ)与Fe(Ⅲ)的比值,以及Mn、Ni的含量,从而获得了高分辨的多元素化学形态成像。2011年,美国农业部的Banuelos等[47]首次应用斯坦福同步辐射加速器方法测试了1株耐旱、耐盐、超累积硒的沙漠仙人掌中硒的分布及其形态特征,发现硒在该植物的叶面锥体、种子中极端富集硒,而且以硒代蛋氨酸的形式存在。在国内,中国科学院生态环境研究中心的朱永官团队借助上海光源的微束荧光法获得了大米中硒(Se)和锌(Zn)的二维分布图,发现Se主要集中在大米的表面,Zn主要集中在大米的顶端,对营养元素的迁移、转化、富集机制提供了重要的信息[48]。
本研究组在上海同步辐射光源利用STXM线站对湖北恩施硒矿区分离的嗜菌微生物开展了原位分析,获得了有效的硒原位分布(图1)及形态数据(表1)。从硒形态的空间分布来看(图1),硒的赋存均发生在微生物的表面,尤其是微生物聚集的地方;各硒形态分布的位置相对统一,但各分布位置中硒形态占比差异较大(表1),主要的形态为Se4+(56.87%),且硒代胱氨酸占比最少(0.40%);Se0难溶于水,传统的间接化学提取方法无法检测,而同步辐射这类分析方法可以做到非破坏性的直接物理分析,结果显示Se0占总硒的10.63%(未发表数据)。

图1 湖北恩施硒矿区矿坑排水体系中嗜硒细菌的STXM分析Fig.1 STXM analysis of bacterial products isolated from selenium mine-drainage area in Enshi, Hubei.注:A:亚硒酸钠Na2SeO3;B:硒酸钠Na2SeO4;C:单质硒Se;D:硒代蛋氨酸SeMet;E:硒甲基半胱氨酸SeMeCys;F:硒代胱氨酸SeCys2。
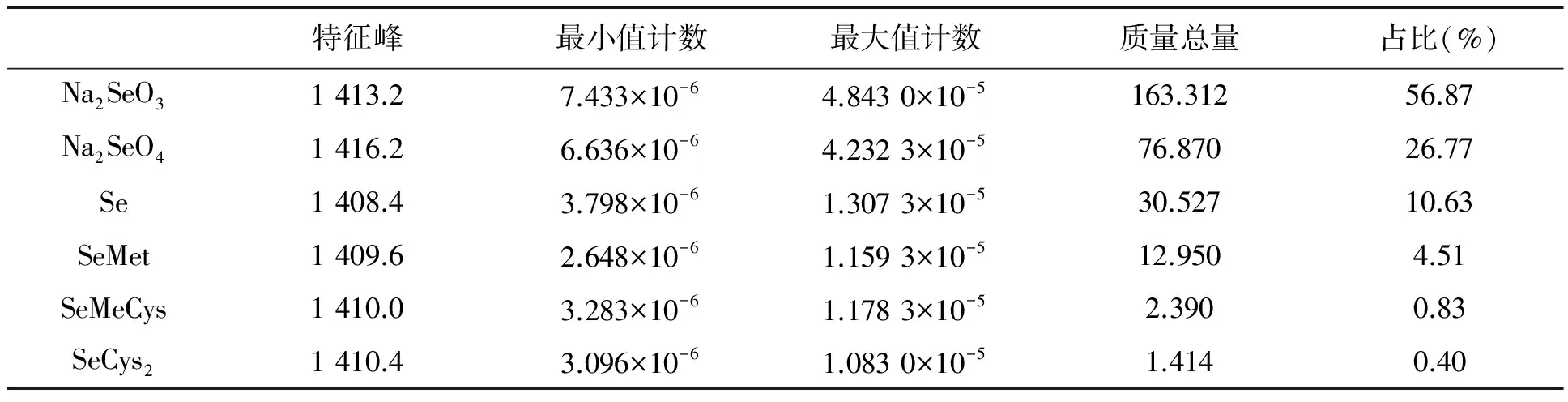
特征峰最小值计数最大值计数质量总量占比(%)Na2SeO31413.27.433×10-64.8430×10-5163.31256.87Na2SeO41416.26.636×10-64.2323×10-576.87026.77Se1408.43.798×10-61.3073×10-530.52710.63SeMet1409.62.648×10-61.1593×10-512.9504.51SeMeCys1410.03.283×10-61.1783×10-52.3900.83SeCys21410.43.096×10-61.0830×10-51.4140.40
注:分析条件为双能量扫描(dual energy scan),参数:背景能量为1 405 eV, 10 mm×7.5 mm, 步长0.03 mm,停留时间5 ms; 数据处理:SSRF-STXM双能元素分布软件。
4 展望
硒在毒理学、生理学及环境科学上的重要性愈来愈为人们所重视,硒的测定方法研究从痕量和超痕量向有机硒化合物的方向发展。然而高效液相色谱与电感耦合等离子质谱联用技术并不能提供化合物分子结构,所以无法对多数痕量元素形态进行定性分析。对于缺乏标准物质的硒形态检测,需要其他仪器对硒形态分子结构进行鉴定。由于硒形态稳定性较差,在前处理过程中极易被氧化或相互转化,进而对定性定量工作造成很大困扰。因此,对样品分析前的干燥处理应使用冷冻干燥,避免高温烘干,冻干样品的粉碎应在液氮保护下进行。
硒元素形态体系的分析(包括无机硒、硒代氨基酸、硒多糖、硒核酸、纳米硒等)可为硒与重金属(汞、镉、砷、铅等)、主要营养成分(钙、铁、锌、维生素等)之间关系提供分析基础以及鉴定标准。含有某些微量营养元素的功能食品已得到初步的发展,但这类食品中的微量元素形态分析方法仍有待完善。
[1] 袁丽君, 袁林喜, 尹雪斌, 等. 硒的生理功能、摄入现状与对策研究进展 [J]. 生物技术进展, 2016, 6(6): 396-405.
[2] 吕清慧. 食品中砷和硒形态的HPLC-ICP-MS分析方法研究[D]. 天津:天津科技大学, 硕士学位论文, 2014.
[3] 铁 梅, 方禹之, 孙铁彪, 等. HPLC-ICP-MS联用技术在富硒金针菇硒的形态分析中的应用 [J]. 高等学校化学学报, 2007, 28(4): 635-639.
[4] Yuan L X, Zhu Y Y, Lin Z Q,etal.. A novel selenocystine-accumulating plant in selenium-mine drainage area in Enshi, China [J]. PLoS ONE, 2013, 8(6): e65615.
[5] Banuelos G S, Stushnoff C, Walse S S,etal.. Biofortified, selenium enriched, fruit and cladode from threeOpuntiacactuspear cultivars grown on agricultural drainage sediment for use in nutraceutical foods [J]. Food Chem., 2012, 135(1): 9-16.
[6] Banuelos G S, Arroyo I, Pickering I J,etal.. Selenium biofortification of broccoli and carrots grown in soil amended with Se-enriched hyperaccumulatorStanleyapinnata[J]. Food Chem., 2015, 166:603-608.
[7] 杨红霞. 镉形态分析与微区分布的质谱联用技术方法研究及其在印度芥菜耐镉机制中的应用[D]. 北京:中国地质科学院, 博士学位论文,2013.
[8] Kulp T R, Pratt L M. Speciation and weathering of selenium in Upper Cretaceous chalk and shale from South Dakota and Wyoming, USA [J]. Geochim. Cosmochimi. Acta, 2004, 68(18): 3687-3701.
[9] 李 璐, 秦海波, 苏 惠,等. 硒连续化学提取技术中的若干问题讨论[J]. 地球与环境, 2009, 37(4): 458-463.
[10] 左银虎. 环境与植物中硒形态研究进展[J]. 植物学报, 1999, 16(4): 378-380.
[11] 程建中, 杨 萍, 桂仁意. 植物硒形态分析的研究综述[J]. 浙江农林大学学报, 2012, 29(2): 288-295.
[12] Zhu Y Y, Yin X B. Determination of selenium speciation in eggs by LC-UV-AFS[A]. In: Banuelos G, Lin Z Q, Yin X,etal.. Selenium:Global perspectives of impacts on humans,animals and the environment[C]. Beijing: Univeristy of Science and Technology of China Press, 2011.
[13] 侯遇珠. 安徽石台县天然富硒区居民硒摄入量调查与富硒灵芝材料研究[D]. 合肥:中国科学技术大学, 硕士学位论文,2016.
[14] 胡海涛, 袁林喜, 尹雪斌, 等. 耐硒驯化灵芝菌种的液态发酵中硒的富集特征[J]. 食品与发酵工业, 2012, 38(8): 7-11.
[15] 胡海涛, 袁林喜, 郑 璞,等. 4种食用菌硒积累能力比较与硒形态研究[J]. 中国食用菌, 2012, 31(3): 38-41.
[16] 王复龙, 彭增起, 王蓉蓉, 等. 动物可食用组织中硒的形态研究进展[J]. 肉类研究, 2011, 25(4): 57-60.
[17] 孙 梅, 吴强华. 农产品中硒形态分析的研究进展[J]. 理化检验(化学分册), 2015, 51(11): 1621-1626.
[18] Kapolna E, Hillestrom P R, Laursen K H,etal.. Effect of foliar application of selenium on its uptake and speciation in carrot[J]. Food Chem., 2009, 115(4): 1357-1363.
[19] Kannamkumarath S S, Wrobel K, Wuilloud R G. Studying the distribution pattern of selenium in nut proteins with information obtained from SEC-UV-ICP-MS and CE-ICP-MS [J]. Talanta, 2005, 66(1): 153-159.
[20] 富硒农产品 GH/T 1135-2017 [S]. 北京:中华全国供销合作社,2017.
[21] 张 如,樊 霆, 李 淼,等. 一株耐硒壶瓶碎米荠内生菌分离、鉴定及其体外硒代谢研究[J]. 微生物学通报, 2017,doi:10.13344/j.microbial.china.170208.
[22] 张 涛, 高愈希, 李 柏,等. 高效液相色谱-等离子体质谱联用方法研究富硒大米中硒的形态[J]. 分析化学, 2008, 36(2): 206-210.
[23] Gergely V, Kubachka K M, Mounicou S,etal.. Selenium speciation inAgaricusbisporusandLentinulaedodesmushroom proteins using multi-dimensional chromatography coupled to inductively coupled plasma mass spectrometry[J]. J. Chromatogr. A, 2006, 1101(1-2): 94-102.
[24] 李 娜, 王 旭, 孙芳芳, 等. 硒形态分析研究进展[J]. 湖北农业科学, 2011, 50(3): 437-441.
[25] Hirschfeld T. The hyphenated methods[J]. Anal. Chem., 1980, 52(2): 297-312.
[26] Seubert A. On-line coupling of ion chromatography with ICP-AES and ICP-MS[J]. Trends Anal. Chem., 2001, 20(6-7): 274-287.
[27] 尚德荣, 秦德元, 赵艳芳, 等. 高压液相色谱-氢化物发生原子荧光光谱(HPLC-HG-AFS)联用技术检测水产品中硒的赋存形态[J]. 食品安全质量检测学报, 2013(6): 1847-1852.
[28] 肖志明, 宋 荣, 贾 铮, 等. 液相色谱-氢化物发生原子荧光光谱法测定富硒酵母中硒的形态[J]. 分析化学, 2014(9): 1314-1319.
[29] 曹玉嫔, 闫丽珍, 黄红丽, 等. 超声辅助提取结合高效液相色谱-电感耦合等离子体质谱联用技术测定牛蒡和三七中硒形态[J]. 分析化学, 2015(9): 1329-1334.
[30] 熊 珺, 覃毅磊, 龚 亮,等. HPLC-ICP-MS在线联用分析食品中无机硒和硒氨基酸的形态[J]. 食品工业科技, 2017(4): 67-72.
[31] 张 颖, 杨清清, 宋 毅, 等. 高效液相色谱-电感耦合等离子体质谱联用技术测定富硒食品中无机硒和有机硒的含量[J]. 中国食品卫生杂志, 2017(2): 181-185.
[32] 刘明钟. 原子荧光光谱分析[M]. 北京:化学工业出版社, 2008.
[33] 汤杰夫. 水稻生长过程中硒-汞互作:来自于土培与野外调查的研究[D]. 合肥:中国科学技术大学,硕士学位论文,2016.
[34] Szpunar J. Bio-inorganic speciation analysis by hyphenated techniques[J]. Analyst, 2000, 125(5): 963-988.
[35] Chan Q, Afton S E, Caruso J A. Selenium speciation profiles in selenite-enriched soybean (Glycinemax) by HPLC-ICPMS and ESI-ITMS[J]. Metallomics, 2010, 2(2): 147-153.
[36] Floor G H, Igleslas M, Roman R G,etal.. Selenium speciation in acidic environmental samples: Application to acid rain-soil interaction at Mount Etna volcano[J]. Chemosphere, 2011, 84(11): 1664-1670.
[37] Lenz M, Floor G H, Winkel L H E,etal.. Online preconcentration-IC-ICP-MS for selenium quantification and speciation at Ultratraces[J]. Environ. Sci. Technol., 2012, 46(21): 11988-11994.
[38] Sanchez R D, Mellano F, Morales E,etal.. A simplified method for inorganic selenium and selenoaminoacids speciation based on HPLC-TR-HG-AFS[J]. Talanta, 2013, 106:298-304.
[39] Chen Z, Akter K F, Rahman M M,etal.. The separation of arsenic species in soils and plant tissues by anion-exchange chromatography with inductively coupled mass spectrometry using various mobile phases [J]. Microchem. J., 2008, 89(1): 20-28.
[40] Dasilva E G, Vreola M L R, Zezzi A M A. Speciation analysis of selenium in plankton, Brazil nut and human urine samples by HPLC-ICP-MS[J]. Talanta, 2013, 110:53-57.
[41] 程建中. 富硒雷竹笋和毛竹笋硒形态研究[D]. 杭州:浙江农林大学, 硕士学位论文,2012.
[42] 罗 乐, 降林华, 段 宁. HPLC—ICP—MS在工业废渣中硒形态分析中的应用[J]. 现代化工, 2015(11): 176-179.
[43] Templrton A, Knowles E. Microbial transformations of minerals and metals: Recent advances in geomicrobiology derived from synchrotron-based X-ray spectroscopy and X-Ray microscopy[J]. Ann. Rev. Earth Plant Sci., 2009, 37: 367-391.
[44] Yoon T H, Johnson S B, Benzera K,etal..Insitucharacterization of aluminum-containing mineral-microorganism aqueous suspensions using scanning transmission X-ray microscopy[J]. Langmuir, 2004, 20(24): 10361-10366.
[45] Toner B, Fakra S, Villalobos M,etal.. Spatially resolved characterization of biogenic manganese oxide production within a bacterial biofilm [J]. Appl. Environ. Microb., 2005, 71(3): 1300-1310.
[46] Dynrs J J, Tyliszczak T, Araki T,etal.. Speciation and quantitative mapping of metal species in microbial biofilms using scanning transmission X-ray microscopy [J]. Environ. Sci. Technol., 2006, 40(5): 1556-1565.
[48] Sun G X, Lu X, Williams P N,etal.. Distribution and translocation of selenium from soil to grain and its speciation in paddy rice (OryzasativaL.)[J]. Environ. Sci. Technol., 2010, 44(17): 6706-6711.
ProgressonSeleniumSpeciationAnalysisinBiologicalSamples
ZHANG Zezhou1,2, ZHU Yuanyuan1, LI Meng1, LI Dan1, HOU Yuzhu1, YUAN Linxi1*, YIN Xuebin3*
1.JiangsuBio-engineeringResearchCentreofSelenium,JiangsuSuzhou215123,China; 2.StateKeyLaboratoryofBiogeologyandEnvironmentalGeology,ChinaUniversityofGeosciences,Wuhan430074,China; 3.KeyLaboratoryofFunctionalAgriculture,SuzhouInstituteforAdvancedStudy,UniversityofScienceandTechnologyofChina,JiangsuSuzhou215123,China
Based on recent researches on selenium (Se) speciation analysis on biological samples, the modified extraction methods on Se speciation and composition from high Se contents samples (>10 mg Se/kg) and low Se contents samples (<1 mg Se/kg) were summarized, respectively. The liquid chromatography-atomic fluorescence spectrometry (LC-AFS) and high performance liquid chromatography-inductively coupled plasma-mass spectrometry (HPLC-ICP-MS) employed to separate and determine the Se speciation and composition were discussed. Furthermore, the synchrotron radiation scanning transmission X-ray microscopy (STXM) method was reviewed and prospected on total Se and Se speciation distributionsinsituon bacteria samples.
selenium speciation analysis; selenoaminoacid; liquid chromatography-atomic fluorescence spectrometry (LC-AFS); high performance liquid chromatography-inductively coupled plasma-mass spectrometry (HPLC-ICP-MS); synchrotron radiation scanning transmission X-ray microscopy (STXM)
2017-08-02;接受日期2017-08-29
国家自然科学基金项目(31400091)资助。
张泽洲,博士研究生,研究方向为微量元素分析与应用。E-mail:280602128@qq.com。*通信作者:袁林喜,研究员,博士,研究方向为生物营养强化。E-mail:yuanlinxi001@gmail.com;尹雪斌,副教授,博士,研究方向为功能农业。E-mail:xbyin@ustc.edu.cn
10.19586/j.2095-2341.2017.0106
