高产铁载体根际菌的筛选鉴定及硒活化特性评价
2017-11-23龙云川周少奇
龙云川, 陈 轩, 周少奇,3*
1.贵州科学院贵州省生物研究所, 贵阳 550009; 2.贵州大学资源与环境工程学院, 贵阳 550025; 3.华南理工大学环境与能源学院, 广州 510006
高产铁载体根际菌的筛选鉴定及硒活化特性评价
龙云川1,2, 陈 轩2, 周少奇1,2,3*
1.贵州科学院贵州省生物研究所, 贵阳 550009; 2.贵州大学资源与环境工程学院, 贵阳 550025; 3.华南理工大学环境与能源学院, 广州 510006
通过对高产铁载体根际菌的分离鉴定及其活化土壤硒的性能研究,揭示根际菌产铁载体与活化硒素性能的相关性。利用铬天青(chrome azural S,CAS)平板法从贵州开阳地区玉米根际土壤中筛选出产铁载体菌株,而后定量检测其产铁载体能力,采用Salkowski比色法检测其产吲哚乙酸能力,通过16S rRNA序列对其进行分析鉴定;另外,通过浸提剂提取的水溶态硒、有效硒含量高低反应菌株对土壤硒的活化能力。研究结果显示:5株菌株具有较强的铁载体分泌能力,其中菌株WD06铁载体活性单位高达73%,达到产铁载体能力较高级;各菌株均具有一定的产吲哚乙酸的能力;各菌株可对土壤中的硒起到较强的活化作用,将水溶态硒含量提高2.50~7.85倍、有效硒含量提高0.46~4.72倍;3株硒活化效果较好的菌株中,WD01经鉴定为Klebsiellamichiganensis,WD06为Serratiamarcescens,WD07为Enterobacterxiangfangensis。该研究结果为土壤硒微生物强化策略提供了一定的参考。
根际菌;铁载体;生物强化策略;土壤硒
硒是生命体所必需的微量元素,有“生命火种”的美誉[1]。植物硒是人体摄入硒的主要来源,而土壤硒的生物有效性低是导致植物硒含量偏低的主要原因[2]。因此,提高土壤中硒的生物有效性具有重要的意义[3]。
土壤中硒的形态、迁移及生物有效性受环境中微生物的高度影响[4]。张如等[5]从湖北恩施富硒土壤中获得1株耐硒内生菌,能将亚硒酸钠转化为硒代半胱氨酸,并能提高作物对硒的吸收和转运能力。相关研究发现,在贫硒土壤中也含有大量的能耐受硒和具有硒代谢能力的可培养微生物[6]。Durán等[7]通过接种丛枝菌根真菌和根际菌(Enterobactersp. B16),大幅提高了小麦谷粒中的硒含量。Acua等[6]发现硒活化菌能转化50%~80%的硒,并且能帮助硒转移进入小麦苗叶片内。这些研究表明:接种硒活化菌是一种硒生物强化(biofortification)的有效手段[3,7]。
铁载体是微生物在缺铁环境下分泌的一种可高效结合铁并供给微生物细胞的小分子螯合物,能促进微生物对铁元素的吸收[8]。铁载体也可与Al3+、Cu2+、Cd2+、Pb2+等金属形成可溶的金属-铁载体螯合物从而提高其溶解性,促进植物对金属的富集[9,10]。产铁载体根际菌(siderophore-producing rhizobacteria,SPR)在促进植物生长发育、增加作物产量、提高植物的抗逆性以及抑制根际有害菌群等方面也发挥着重要的作用[11,12]。这都预示着产铁载体根际菌在促植物生长及活化元素方面所具有的巨大潜力。
贵州具有典型的喀斯特山地地貌,当地水土流失严重、土壤贫瘠[13]。SPR植物促生作用将有助于作物生长以及生态恢复。硒是一种类金属元素,其化学性质介于金属和非金属之间,且具有部分金属性[13]。目前,尚无产铁载体根际菌对硒活化的研究报道。但基于铁载体对多种金属元素的活化作用以及硒元素的类金属性,可推测铁载体对硒也具有一定的活化作用,本文将验证并探究产铁载体菌株对硒的活化能力和规律。
本研究以贵州省开阳地区玉米根际土壤为研究对象,利用CAS平板法筛选高产铁载体根际菌株,并定量及定性检测铁载体,分析菌株生物学地位、产吲哚乙酸能力及铁载体分泌规律,同时测定菌株对土壤中硒元素的活化能力,以期为在喀斯特地区富硒土壤上通过微生物强化技术充分利用土壤硒元素资源、生产富硒农产品提供参考。
1 材料与方法
1.1培养基及试剂
铬天青(CAS)检测平板,即铁载体筛选培养基[14]:100 mL含10 mL纯牛奶,0.2 g蔗糖,2 mL 1 mmol/L MgSO4,100 μL 1 mmol/L CaC12,1.8 g琼脂,加热,约60℃时缓慢加入CAS染液和磷酸盐缓冲液各5 mL,即得CAS蓝色检测培养基。
CAS染液:1 mmol/L铬天青,4 mmol/L十六烷基三甲基溴化铵,0.1 mmol/L FeCl3。
磷酸盐缓冲液(pH 6.8):每100 mL含Na2HPO4·12H2O 2.427 g,NaH2PO4·2H2O 0.590 5 g,KH2PO40.075 g,NH4Cl 0.250 g,NaCl 0.125 g。所有上述溶液均用去离子水配制。
KMB液体培养基:甘油 15 mL,酸水解酪蛋白 5 g,K2HPO42.5 g,MgSO41.0 g,去离子水定容至 1 000 mL,pH自然。
SMS液体培养基:1%蔗糖,0.1%(NH4)2SO4,2% K2HPO4,0.05% MgSO4,0.01% NaCl,0.05%酵母浸出物,pH 7.2。
LB液体培养基:胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH 7.2。
Salkowski试剂:0.5 mol/L FeCl32 mL,35% HClO498 mL。
1.2土样的采集与梯度浓度驯化
在贵州省开阳县玉米耕作地中,选取健壮的玉米植株,去除表层杂物和土壤,将玉米连根拔起,抖掉根系周围的大颗粒及松散土壤,收集附着于根系上的细土于无菌采样袋中,做好标记并带回实验室及时进行高产铁载体根际菌的筛选。
我国土壤含硒量平均值为0.290 mg/kg;贵州土壤含硒量的平均值(0.369 mg/kg)高于全国其他地区;而开阳地区属于贵州高硒区,土壤硒的平均含量为3.261 mg/kg[13]。本研究所采集的田间土壤全硒平均含量为1.42 mg/kg,属于硒丰富土壤。
向SMS液体培养基中加入亚硒酸钠,浓度逐步递增,使Se4+浓度梯度分别为20 mg/L、40 mg/L、80 mg/L、120 mg/L、160 mg/L、200 mg/L、400 mg/L、600 mg/L、800 mg/L。称取10 g土样置于90 mL SMS液体培养基中,32℃,150 r/min培养18~24 h后,吸取10 mL培养液于上述含硒液体培养基中进行梯度驯化与富集。将富集后的菌液用稀释涂布法进行分离、纯化及菌种保藏。
1.3高产铁载体微生物的筛选与产铁载体能力测试
产铁载体根际菌的初步筛选采用CAS平板分析法。将抗硒菌株划线接种于CAS检测平板上,32℃培养24~48 h,根据平板上颜色的变化(由蓝到橙)及光圈直径大小初步筛选出产铁载体菌株。
铁载体定量检测[15]:将菌株于KMB液体培养基中28℃培养24~48 h后,10 000 r/min离心10 min,将上清液稀释10倍,加入等体积CAS检测液并混合,静置60 min后于630 nm检测吸光度A。将培养基稀释10倍后,与CAS等体积混匀测得吸光度Ar。依据相关文献[16]对微生物产铁载体的能力进行划分,A/Ar从1.0~0之间以0.2为间隔,每减少0.2增加一个“+”。铁载体活性单位[17](siderophore unit,SU)=[(Ar-A)/Ar]×100。
将分泌铁载体能力较强的菌株接种于LB培养基中培养,按以上方法进行铁载体定量检测,以探究培养基对菌株产铁载体能力的影响。
1.4菌株特性研究
菌株生长规律及铁载体分泌规律测定:将菌株以1%接种量接种于KMB液体培养基中,28℃,160 r/min振荡培养,每隔2 h取样,分光光度计检测OD600值。同时,按步骤1.3进行铁载体定量检测,测定样品OD630值,并计算SU。
菌株产吲哚乙酸测定:采用salkowski比色法[18],将菌株接种于吲哚乙酸培养基中32℃培养48 h,取发酵液1 mL与2 mL Salkowski试剂充分混合,静置30 min后,测定OD530值[12]。
1.5菌株对土壤硒的活化
利用浸提剂提取的化学有效性高低来反映土壤硒的生物有效性[19]。将所采集的田间土壤粉碎、混匀,部分土壤经180℃、4 h干热灭菌;剩余土壤于室内自然风干。称取20 g 土样置于直径为12 cm的无菌培养皿中,吸取5 mL 菌液(108cfu/mL)于上述干燥的土壤中(此时土壤湿度约为50%~60%),室温(20℃)培养10 d;吸取5 mL无菌水置于上述无菌培养皿土样中,室温培养10 d作为对照组。用超纯水浸提土壤中水溶态硒[20];用磷酸二氢钠溶液浸提土壤中有效硒[19]。样品经相关处理后,其硒含量用原子荧光光谱仪测定。
1.6菌株的鉴定
采用DNA抽提试剂盒(上海生工)提取基因组DNA,采用通用引物7F(5′-CAGAGTTTGATCCTGGCT-3′)和1540R(5′-AGGAGGTGATCCAGCCGCA-3′)扩增菌株16S rRNA片段。PCR反应体系(25 μL)为:模板 0.5 μL,10×Buffer 2.5 μL,dNTP 1 μL,酶0.2 μL,引物各0.5 μL,加双蒸水补足至25 μL。PCR 循环条件为:94℃预变性4 min;94℃变性45 s,55℃退火45 s,72℃延伸1 min,共30 个循环;72℃延伸10 min。基因测序后序列结果与NCBI数据库做Blast分析。采用Clustal X软件将序列与标准菌株片段进行比对,运用Mega 5.2构建进化树。
1.7数据处理
采用Microsoft Excel 2013软件进行数据处理,用origin 8.5软件进行图表制作,通过SPSS 21.0软件进行差异显著性分析。
2 结果与分析
2.1铁载体高产菌株的筛选
2.1.1产铁载体菌的定性筛选 土样经梯度浓度驯化后用平板稀释法分离,挑选出11株生长良好、菌落特征不同的单菌落菌株,依次命名为WD01~WD11。利用CAS平板法初步筛选,发现大多数平板产生不同程度紫粉色,部分菌株的CAS检测结果见图1。其中菌株WD01、WD04、WD06、WD07、WD10和WD11(图1)产生的紫粉色圈较大。根据相关文献对产铁载体阳性菌株筛选实验现象[9],认定以上菌株为产铁载体阳性菌株。这些菌株在CAS平板上生长和出圈较快,培养约12 h便可形成产铁载体圈,产铁载体圈与菌落直径比约2~6;培养时间越长菌圈越大,最终可使平板大半部分变为紫粉色;反复传代后菌株产铁载体能力也较稳定。菌株WD09(图1)颜色圈较弱,其产生铁载体能力弱。综上所述,菌株WD01、WD04、WD06、WD07、WD10和WD11有较强的铁载体分泌能力。
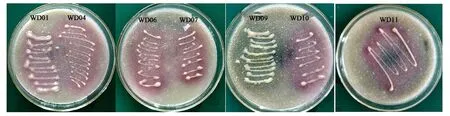
图1 CAS平板筛选产铁载体细菌Fig.1 Isolating of siderophores-producing bacteria by CAS plates.
2.1.2产铁载体能力定量检测 对产铁载体圈较大的菌株进行产铁载体定量检测。各菌株产铁载体量以铁载体活性单位(SU)表示,结果见表1。从表1中看到,菌株产铁载体量在52.59%~65.34%之间;菌株WD01、WD06、WD11分泌铁载体的能力为“++++”,为产铁载体能力较强的菌株;其中,菌株WD06产铁载体能力最强,SU达65.34%。
在本实验过程中发现同种菌株在不同培养基产铁载体量差别较大,如菌株WD01在LB液体培养基中,SU约为25.07%;在KMB液体培养基中,SU则高达63.55%(表1)。该实验结果表明菌株分泌铁载体受培养条件的影响。另一方面,在不同的培养条件下菌株均能产生一定量的铁载体,可能预示其在复杂多变营养条件的自然环境中都能分泌铁载体,保障菌株功能运行[9]。
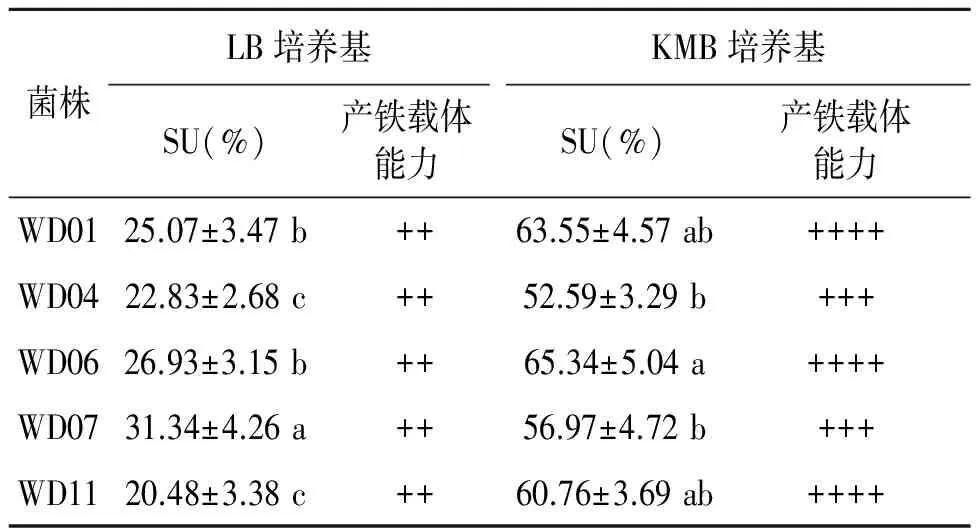
表1 5株菌株产铁载体量(以SU表示)Table 1 Siderophore unit of the 5 strains.
注:同列数据后不同小写字母间差异显著(P<0.05)。
2.2菌株特性研究
2.2.1菌株生长及铁载体分泌规律 由于菌株WD06产铁载体能力最强(SU达65.34%),进一步探究菌株WD06的生长规律及铁载体分泌规律,其结果见图2。菌株的对数生长时期主要在6~22 h,在对数生长期前期(2~10 h),铁载体分泌量快速增加,10 h左右增到最高(SU=0.73,++++)。随着菌体逐渐成熟及细菌数量的增加,对数生长后期SU值缓慢降低。结果表明菌株分泌铁载体并不是简单的累积效应,铁载体的合成、分泌是与其生长状态密切相关的;在菌体生长前期以分泌为主,生长后期为保障细菌功能运转,以吸收为主[16]。
2.2.2菌株产吲哚乙酸能力 菌株产吲哚乙酸结果(图3)显示:各菌株均有一定的产IAA能力,其值在0.72~0.98 mg/L之间,其中菌株WD01产IAA能力最强(0.98 mg/L),差异显著。吲哚乙酸是植物中最为普遍的生长素类物质,其低水平可促进植物初生根的生长,而高浓度的可促进次生根和不定根的生长[12]。结果表明:本研究中的产铁载体菌株具有一定的产IAA能力和促生长潜力。
2.3菌株对土壤硒活化能力

图2 菌株WD06的生长曲线和铁载体分泌曲线Fig.2 Growth curve and siderophore-producing curveof strain WD06.

图3 菌株产吲哚乙酸能力Fig.3 The capacity of indole acetic acid for strains.注:不同小写字母间差异显著(P<0.05)。

图4 土壤处理后水溶态硒和有效硒含量Fig.4 The concentration of water-soluble and available selenium in treated soil.注:CK:对照组;不同小写字母间差异显著(P<0.05)。
图4中可以看到,土壤经各菌株制成的菌剂处理后,其水溶态硒和有效硒均有不同程度的提高。对照组土壤水溶性硒含量为0.026 mg/kg,有效硒含量为0.082 mg/kg;各菌株处理组的土壤水溶性硒含量提高至0.091~0.230 mg/kg,提高了2.50~7.85倍,土壤有效硒含量提高至0.120~0.469 mg/kg,提高了0.46~4.72倍;其中WD07菌株处理组均显著提高了土壤水溶态硒和有效硒含量(P<0.05)。土壤中元素的化学有效性是其生物有效性的前提,是决定着食物链硒水平的关键因素[2,19]。因此,WD07菌株的高化学有效性预示着它在提高土壤硒生物有效性及促进植物吸收硒方面所具有的巨大潜力。
2.4菌株的分子鉴定
综合菌株产铁载体能力及活化土壤硒能力,挑选3株综合效果较好的菌株(WD01、WD06、WD07)进行鉴定。3株菌株的16S rRNA测序结果显示其基因片段长度约为1 400 bp。运用MEGA 5.2软件Blast分析及系统发育树构建,各菌株的生物学分类地位如表2所示。WD01经鉴定为产酸克雷伯菌(Klebsiellamichiganensis);WD06为粘质沙雷菌(Serratiamarcescens);WD07为香坊肠杆菌(Enterobacterxiangfangensis)。
3 讨论

表2 菌株的生物学分类地位Table 2 Taxonomic assignment of strains.
利用土壤中相关微生物对硒元素的活化作用是作物硒生物强化的新型策略。本试验中筛选高产铁载体根际菌,利用铁载体对土壤中硒元素的活化作用提高元素硒的有效性,以期提高作物中硒含量;同时利用菌株分泌吲哚乙酸的能力,以期促进作物的生长。
本研究表明,菌株分泌铁载体受培养条件、培养时间等因素影响。陈伟等[14]探究了培养条件对菌株铁载体分泌的影响,发现培养基碳源、氮源、pH、培养温度等条件影响着铁载体的合成。赵翔等[16]发现亚铁离子可严格抑制荧光脓菌素的合成,但也可诱导儿茶酚胺类铁载体的分泌。可以看出,菌株分泌铁载体受多因素影响,菌株产铁载体调控机制还需进一步的研究。本研究中,若能优化菌株培养条件,其产铁载体能力可能将会更高。
各菌株产铁载体能力相当(产铁载体量均高于50%,菌株WD06最高,达73%),但对土壤硒的活化效果则差异较大。这表明菌株对土壤硒的活化能力除与产铁载体能力有关外,还受其他因素影响。影响因素可能包括:菌株种类、菌体产铁载体种类及浓度、菌液pH、菌体其他分泌物(有机酸等)以及土壤的矿物组成、有机组成、pH等。铁载体类型可分为儿茶酚型、异羟肟酸型、羟基羧酸型,其中儿茶酚型螯合能力最强、羟基羧酸最弱[8]。另有研究发现,一些菌株能分泌有机酸降低土壤pH以活化金属元素;或分泌胞外磷酸酶溶解土壤中难溶性无机磷酸盐,磷元素释放的同时与之伴生的(类)金属元素元素亦被活化[21]。硒活化机理的相关研究还需进一步加强。
大量研究报道了Klebsiellasp.、Serratiasp.及Enterobactersp.作为根际促生菌耐受镉等重金属,并强化受重金属污染土壤的植物修复[21]。也有相关文献报道Klebsiellasp.、Enterobactersp.对土壤硒的活化及促进其向作物转移的作用[6,7,22];而Serratiasp.为首次报道土壤硒活化功能及应用。同时,关于Klebsiellasp.、Serratiasp.及Enterobactersp.在固氮、溶磷、IAA分泌等方面的大量报道[12,20,21]预示着WD01、WD06、WD07在促进植物生长方面的巨大潜力。
本试验展示了产铁载体根际菌具有较好的提高土壤硒有效性的潜力。诸旭东等[19]对田间土壤进行增施磷肥及外源补硒等处理,均提高了硒的化学有效性,最高增幅为52.5%。杨旎等[2]在田间试验中,施加生物有机肥后,土壤中可溶态硒含量由32.67 mg/kg提高到95.05 mg/kg,提高了1.91倍。本试验中各菌剂处理土壤后其水溶性硒含量提高了2.50~7.85倍;有效硒含量提高了0.46~4.72倍,属较高水平。但也应看到,本试验是在人为控制的实验室条件下进行的,没有在田间试验中检测菌株对土壤中硒的化学有效性、作物生长及作物吸收硒的效果。在田间实践应用时,必然面临功能菌株在复杂土壤及环境条件下的定植、生长及繁殖等问题[8]。此外,SPR影响植物吸收硒的相关研究还较少,相关机理也有待深入研究。本试验今后将加强该菌株在田间土壤的定植、铁载体活化土壤硒的机理与关键因素、硒在喀斯特土壤及经济作物中的赋存形态、有效硒在土壤-作物界面及植物内部的转移机制等方面的深入研究,以期为硒的微生物强化技术提供参考。
[1] 袁丽君, 袁林喜, 尹雪斌, 等. 硒的生理功能、摄入现状与对策研究进展[J]. 生物技术进展, 2016, 6(6): 396-405.
[2] 杨 旎, 宗良纲, 严 佳, 等. 改良剂与生物有机肥配施方式对强酸性高硒茶园土壤硒有效性的影响[J]. 土壤, 2014, 46(6): 1069-1075.
[3] Durán P, Acua J J, Gianfreda L,etal.. Endophytic selenobacteria as new inocula for selenium biofortification[J]. Appl. Soil Ecol., 2015, 96(1): 319-326.
[4] 徐巧林, 吴文良, 赵桂慎, 等. 微生物硒代谢机制研究进展[J]. 微生物学通报, 2017, 44(1): 207-216.
[5] 张 如, 樊 霆, 李 淼, 等. 一株耐硒壶瓶碎米荠内生菌分离、鉴定及其体外硒代谢研究[J]. 微生物学通报, 2017, doi:10.13344/j.microbiol.china.170208.
[7] Durán P, Acua J J, Jorquera M A,etal.. Enhanced selenium content in wheat grain by co-inoculation of selenobacteria and arbuscular mycorrhizal fungi: A preliminary study as a potential Se biofortification strategy[J]. J. Cereal Sci., 2013, 57(3): 275-280.
[8] 王英丽, 林庆祺, 李 宇, 等. 产铁载体根际菌在植物修复重金属污染土壤中的应用潜力[J]. 应用生态学报, 2013, 24(7): 2081-2088.
[9] 魏本杰, 曾晓希, 刘志成, 等. 产铁载体菌的筛选鉴定及活化镉的性能探究[J]. 环境科学与技术, 2014, 37(11): 26-31.
[10] 晋银佳, 刘 文, 朱 跃, 等. 荧光假单胞菌产铁载体对油麦菜吸收砂基和水基中镉的影响[J]. 环境工程学报, 2016, 10(1): 415-420.
[11] Rajkumar M, Ae N, Prasad M N V,etal.. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J]. Trends Biotechnol., 2010, 28(3): 142-149.
[12] 王小兵, 叶赛克, 汪晓丽, 等. 江苏沿海滩涂植物根际促生菌的筛选鉴定及其耐盐促生特性[J]. 扬州大学学报(农业与生命科学版), 2016, 37(2): 81-86.
[13] 李 娟, 龙 健, 汪境仁. 贵州开阳地区土壤中硒的地球化学特征[J]. 土壤通报, 2004, 35(5): 579-582.
[14] 陈 伟, 舒健虹, 陈 莹, 等. 黑麦草根际铁载体产生菌WN-H3的分离鉴定及其产铁载体培养条件的优化[J]. 生物技术通报, 2016, 32(10): 219-226.
[15] 赵 翔, 谢志雄, 陈绍兴, 等. 适合高产铁载体细菌筛选-检测体系的改进与探析[J]. 微生物学通报, 2006, 33(6): 95-98.
[16] 赵 翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonasfluorescenssp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691-695.
[17] Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Anal. Biochem., 1987, 160(1): 47-56.
[18] Bric J M, Bostock R M, Silverstone S E. Rapid in situ assay for indoleacetic acid production by bacteria immobilized on a nitrocellulose membrane[J]. Appl. Environ. Micro., 1991, 57(2): 535-538.
[19] 诸旭东, 宗良纲, 马 迅, 等. 内源调控与外源补硒对红壤中硒有效性及水稻产量的影响[J]. 土壤通报, 2016, 47(2): 398-404.
[20] Sheng X F, Xia J J, Jiang C Y,etal.. Characterization of heavy metal-resistant endophytic bacteria from rape (Brassicanapus) roots and their potential in promoting the growth and lead accumulation of rape[J]. Environ. Pollut., 2008, 156(3): 1164-1170.
[21] 郭军康, 董明芳, 丁永祯, 等. 根际促生菌影响植物吸收和转运重金属的研究进展[J]. 生态环境学报, 2015, 24(7): 1228-1234.
[22] Mora M L, Durán P, Acua J,etal.. Improving selenium status in plant nutrition and quality[J]. J. Soil Sci. Plant Nut., 2015, 15(2): 586-503.
周少奇教授团队介绍
周少奇教授团队主要从事水污染控制、环境微生物、特色植物栽培相关研究,已发表学术论文100余篇。团队在硒学领域开展了土壤硒地球化学循环、硒微生物强化及富硒植物(茶)开发等研究。团队有高级职称2人、中级职称2人、研究生若干。团队负责人周少奇教授是国家“万人计划”科技创新领军人才。
Isolation,IdentificationandAssessmentonSeleniumBiofortificationofSiderophore-producingRhizobacteria
LONG Yunchuan1,2, CHEN Xuan2, ZHOU Shaoqi1,2,3*
1.GuizhouInstituteofBiology,GuizhouAcademyofSciences,Guiyang550009,China; 2.CollegeofResourceandEnvironmentalEngineering,GuizhouUniversity,Guiyang550025,China; 3.SchoolofEnvironmentandEnergy,SouthChinaUniversityofTechnology,Guangzhou510006,China
The present study focused on revealing the correlation between the siderophore production by siderophore-producing rhizobacteria (SPR) and selenium (Se) bioavailability in the soils by isolating, identifying and assessing on Se biofortification of SPR. Siderophore-producing bacteria were isolated and quantitative detected using chrome azural S (CAS) plate method from Guizhou Kaiyang maize rhizosphere soils. The capacity of indoleacetic acid (IAA) was detected using Salkowski colorimetry, and the identification was taken by 16S rRNA gene sequence analysis. Moreover, the Se activation test of strains in soils were carried out in lab plates. The results showed that the 5 strains had strong siderophore production ability, among which the siderophore activity unit of WD06 reached up to 73%. All strains had a certain capacity of IAA production. Furthermore, all strains could improve the water-soluble Se contents with 2.50 to 7.85 times and the available Se contents with 0.46 to 4.72 times. Identification on the three best performance strains revealed that WD01 asKlebsiellamichiganensis, WD06 asSerratiamarcescensand WD07 asEnterobacterxiangfangensis. The present results were helpful for soil Se biofortification via microbial strategy.
rhizobacteria; siderophore; biofortification strategy; soil selenium
2017-06-05;接受日期2017-07-10
国家重点研发计划项目(2016YFC0400702);科技基础性工作专项项目(2014FY120100);贵州科学院青年基金项目(黔科院J合字[2016]5号)资助。
龙云川,助理研究员,硕士,主要从事环境微生物研究。E-mail:sculyc@163.com。*通信作者:周少奇,教授,博士生导师,博士,主要从事环境科学与工程研究。E-mail:2975742087@qq.com
10.19586/j.2095-2341.2017.0053
