硒超积累植物壶瓶碎米荠的根际微生物特征研究
2017-11-23袁林喜
袁林喜, 张 影
1.中国科学技术大学地球与空间科学学院, 合肥 230026; 2.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 3.中国科学技术大学纳米学院, 江苏 苏州 215123
硒超积累植物壶瓶碎米荠的根际微生物特征研究
袁林喜1,2, 张 影3
1.中国科学技术大学地球与空间科学学院, 合肥 230026; 2.江苏省硒生物工程技术研究中心, 江苏 苏州 215123; 3.中国科学技术大学纳米学院, 江苏 苏州 215123
对湖北恩施的硒超积累植物——壶瓶碎米荠的根际微生物特征进行16S rRNA基因文库分析,结果显示其根际微生物相较于非根际土壤微生物具有更高的丰度和更低的复杂度,而且主要由α-变形菌纲(15%~22%)、β-变形菌纲(10%~16%)、放线菌纲(10%~18%)、酸杆菌纲(8%~15%)、γ-变形菌纲(5%~16%)等组成;此外,根际微生物还存在很多特异性微生物,如:硝化螺旋菌纲(2%~5%)、芽单孢菌纲(2%~5%)、疣微菌纲(2%~4%)、浮霉菌纲(1%~2%)、其他(丰佑菌纲、鞘脂杆菌纲、芽孢杆菌纲、梭菌纲)(3%~4%)。代表性的根际微生物α-变形菌纲和硝化螺旋菌纲可能在壶瓶碎米荠对硒的吸收、积累过程中扮演了重要的作用。
壶瓶碎米荠;根际微生物;硒超积累;α-变形菌纲;硝化螺旋菌纲
2013年,Yuan等[1]在湖北恩施硒矿区的矿坑排水系统中发现一种新型硒的超积累植物——壶瓶碎米荠(Cardiminehupingshanesis),其在根中可累积硒高达8 000 μg/kg(干重),在其叶中也可累积硒高达3 000 μg/kg(干重),可与之前在美国加利福尼亚富硒区发现的硒超积累植物双钩黄芪(Astragalusbisulcatus)和沙漠王羽(Stanleyapinnata)[2]相媲美。所不同的是,中国恩施所发现的壶瓶碎米荠积累的硒是以硒代胱氨酸(SeCys2)形式存在的,显著与双钩黄芪和沙漠王羽中的硒甲基硒代半胱氨酸(SeMeCys)的形态不同[2],因此,目前的硒代胱氨酸甲基转化酶(SMT)机制无法解释壶瓶碎米荠超积累硒代胱氨酸的现象[2,3]。
植物的根际是一个特殊生态环境,其中聚居着大量的微生物,包括细菌、放线菌、真菌、藻、原生动物和病毒,它们在根上的繁殖和分布受根系生长发育的影响而表现出较为明显的根际效应,对土壤-植物根部间的微量元素的迁移、转化具有重要的作用[4]。然而,对于根际微生物对植物硒的吸收转化作用的认识比较晚,直到1997年,Norman Terry研究组在利用人造湿地清除加州索尔顿湖(天然富硒湖泊)中高含量的硒时,发现根际微生物大量参与亚硒酸盐的还原与挥发,较没有根际微生物参与下的硒清除效率高3~5倍[5],由此揭开了植物与根际微生物相互作用的研究。随后,该研究组通过直接对比两种湿地植物盐沼芦苇(Scirpusrobustuspursh)和兔脚草(Polypogonmonspeliensis(L.) Desf.)在根际微生物参与和抑制根际微生物参与的条件下对硒与汞的吸收效果,发现根际微生物可以显著提高湿地植物组织对硒与汞的积累水平[6];此后,根际微生物的显著作用,尤其是在植物组织对硒的积累中的作用分别在印度芥菜(Indianmustard)、芸薹属植物(Brassicajunca)、豆科植物、小麦、萝卜、黑麦草、生菜等植物中均得到证实[7~10]。
本研究对硒超积累植物壶瓶碎米荠的根际微生物进行了分析,获得了其根际微生物的群落特征,以期为了解壶瓶碎米荠对硒的超积累机制提供参考。
1 材料与方法
1.1研究区域与样品采集
1.1.1研究区域状况 研究区域位于湖北省恩施市双河镇新塘乡鱼塘坝(E 109°48′31″,N 30°09′27″,H 1 758 m)(图1A)。该区拥有世界上唯一成矿的硒矿床,曾经在2001年进行开采,但在2006年开始禁止开采,目前形成了2个矿坑、3处尾矿、3条渗滤水系统(图1B)[1]。
1.1.2样品采集 在硒矿尾矿1附近的渗滤水系统1中采集一株生长良好的壶瓶碎米荠的根际土壤(1-5)和非植物生长土壤(1-1),在硒矿尾矿2的渗滤水系统2中采集4株生长良好的壶瓶碎米荠的根际土壤(2-1, 2-2, 2-3GJ, 2-3GX),在硒矿尾矿3的渗滤水系统3中采集非植物生长土壤(3-1,3-3)。其中,根际土壤的采集方法为将壶瓶碎米荠连根拔起,抖掉表面的浮土,然后用灭菌袋收集剩下的根际土壤50~100 g;同时,现场用无菌水收集根际土壤中的微生物,作为根际微生物样品,无菌低温保存。现场用便携式检测仪(Mettler Toledo F2-Meter)测定土壤样品温度、pH、土壤氧化还原电位(Eh)指标。
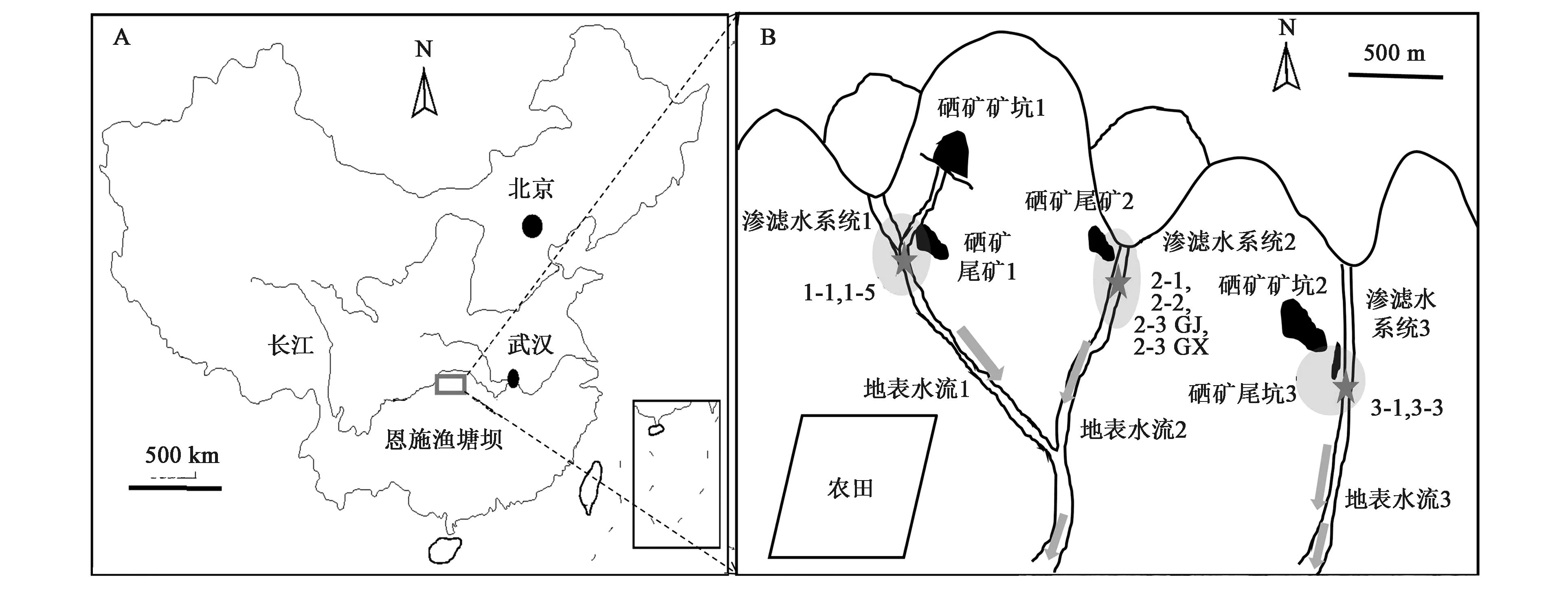
图1 研究区域与采样示意图Fig.1 Schematic of study site and sampling.注:A为研究区域地理位置;B为研究区域地表特征示意图及样品采集位置。
1.2土壤分析方法
土壤中的总硒、总砷含量通过混酸(HNO3- HClO4按4∶1体积混合)消解、经盐酸氢化后用原子荧光光谱法检测[1,11]。土壤中的汞含量通过HNO3-FeCl3-H2O2体系消解后用原子荧光光谱法检测[11]。土壤中的Mg、Al、Fe、Ni、Cu、Zn、Cd、Sb、Pb含量通过HNO3-HClO4-HF体系消解后用ICP-MS检测[11]。土壤中硒的结合形态分别通过水提的水溶态组分、KH2PO4-K2HPO4体系提取的可交换态组分、HCl提取的酸溶态组分、K2S2O8提取的有机结合态组分和残留态组分,并通过原子荧光光谱法检测各组分中硒含量[12]。
1.3土壤微生物16SrRNA基因文库分析
利用土壤DNA提取试剂盒提取土壤微生物样品的基因组DNA,并采用V6~V8可变区引物B968F:5′-AACGCGAAGAACCTTAC-3′和B1401R:5′-GCGTGTGTACAAGACCC-3′,对16S rRNA高变区进行扩增,扩增片段大小约为1 500 bp。PCR反应体系为(50 μL):1.0 μL引物B968F,1.0 μL引物B1401R,2.0 μL模板DNA,25μL Premix-Taq,加灭菌二次去离子水至50 μL。其PCR反应流程:95℃ 4 min;94℃ 40 s,55℃ 45 s,72℃ 60 s,30个循环;72℃ 10 min,4℃保存[13]。菌株的PCR扩增产物由中国典型培养物保藏中心(CCTCC)完成测序,将所得的测序结果与EzBioCloud网站中序列进行Blast对比分析鉴定。
2 结果与分析
2.1土壤理化指标特征
由表1所示,壶瓶碎米荠的根际土壤(1-5,2-1,2-2,2-3GJ,2-3GX)和非根际土壤(1-1,3-1,3-3)的pH并没有显著差别,但是在温度和Eh上有一些变化,根际土壤样品的温度和Eh要低于非根际土壤样品的。从矿物元素(Mg、Al、Fe、Ni、Cu、Zn、As、Cd、Sb、Hg、Pb、Se)含量的角度上,根际土壤样品在Mg、Ni、Zn、Cd的含量上普遍高于非根际土壤,而在Fe、Cu、As、Sb、Hg的含量上有所降低,但是Pb、Se、Al的分布几乎没有明显的差别。这些数据表明壶瓶碎米荠的根际土壤与非根际土壤之间的元素分布有明显的差异。
2.2土壤中硒的结合态特征

表1 壶瓶碎米荠的根际土壤与非根际土壤的理化参数特征Table 1 Physio-chemical parameters characteristics of the rhizosphere soil and non-rhizosphere soil of Cardamine hupingshanesis.
图2显示了根际土壤和非根际土壤中硒的结合态特征。一般而言,水溶态硒(F1)与可交换态硒(F2)用来表征土壤中的生物可利用硒,其与硒的生物地球化学循环密切相关。图2显示本研究中样品的生物可利用硒的比例在3%~5%,其中根际土壤中的生物可利用硒比例略高于非根际土壤,尤其在硒含量较高的1-5样品中,生物可利用硒总量明显高于其他样品。此外,根际土壤的酸溶态硒(F3)与有机结合态硒(F4)的比例也明显较非根际土壤高,而酸溶态硒与有机结合态硒往往被认为可以被微生物转化为生物可利用硒,因此很可能指示了根际微生物的参与。
2.3微生物群落结构特征

图2 土壤样品中硒含量与硒的赋存状态Fig.2 Total Se contents and Se-fractions distributions in soil samples.F1:水溶态硒;F2:可交换态硒;F3:酸溶态硒;F4:有机结合态硒;F5:残留态硒
本研究的16S rRNA基因文库可以鉴定到纲水平上(50%),经统计分析,结果显示(图3):整体而言,非根际土壤中未分类微生物比例(30%~50%)明显较根际土壤(10%~25%)要大,这表明非根际微生物群落结构可能更为复杂,鉴定难度更大。根际微生物主要由α-变形菌纲(15%~22%)、β-变形菌纲(10%~16%)、放线菌纲(10%~18%)、酸杆菌纲(8%~15%)、γ-变形菌纲(5%~16%)等组成,而非根际微生物主要由β-变形菌纲(24%~36%)、酸杆菌纲(6%~12%)、α-变形菌纲(5%~10%)、放线菌纲(3%~10%)、γ-变形菌纲(1%~5%)等组成;此外,根际微生物还存在很多特异性微生物,如:硝化螺旋菌纲(2%~5%)、芽单孢菌纲(2%~5%)、疣微菌纲(2%~4%)、浮霉菌纲(1%~2%)、其他(丰佑菌纲、鞘脂杆菌纲、芽孢杆菌纲、梭菌纲)(3%~4%)。
通过计算α多样性指标来表征单个样品的物种多样性(表2),其中chao1和ACE指标是通过所测样品中OTU数量来预测微生物的数量,是衡量物种丰度的标准;Shannon、npShannon和Simpson指标是综合OTU丰度和OTU均匀度两方面因素的多样性指数。一般而言,chao1、ACE、Shannon、npShannon指数越大,Simpson指数越小,表征了样品的物种丰富越丰富。因此,根际微生物的物种丰度(1-5, 2-1, 2-2, 2-3GJ, 2-3GX)明显比非根际微生物的物种丰度(1-1, 3-1, 3-3)要高。而且,根际微生物样品的物种丰度较为接近,而非根际微生物中1-1的物种丰度最低。

图3 纲水平上微生物的群落结构组成特征Fig.3 Bacterial community compositions characteristics on class level via 16S rRNA analysis.

表2 土壤微生物α多样性指标(97%相似性水平)Table 2 α-diversity indicators in bacteria communities from soil samples (97% similarity level).
样品间的聚类分析结果(数据未提供)表明根际微生物样品与非根际微生物样品显著分为两大类,具有明显的差异。而根际微生物样品中,2-1与2-2、1-5与2-3GJ样品间的物种相似性较高,仅2-3GX的区别较为明显;非根际微生物中1-1与3-1之间具有一定的物种相似性,但与3-3差别较大。
2.4土壤微生物多样性影响因子分析
主成分分析(PCA)显示(图4)第一主成分可以解释57.1%的差异性,第二主成分可以解释19.1%的差异性,在由第一主成分与第二主成分组成的象限内可以很好地将样品区分为3个部分,其中根际微生物样品(1-5, 2-1, 2-2, 2-3GJ, 2-3GX)的特征性物种为α-变形菌纲和硝化螺旋菌纲,非根际微生物样品(3-1, 3-3)的特征性物种为β-变形菌纲,但是非根际微生物样品1-1显著区别于其他样品,具有放线菌纲、酸杆菌纲、γ-变形菌纲多个特征性物种。
3 讨论

图4 样品物种多样性影响因子的主成分分析(PCA)Fig.4 Principal components analysis (PCA) on bacteria community diversity from soils.
2005年,Gregorio等[14]从硒超积累植物——双钩黄芪(Astragalusbisulcatus)的根际分离得到1株硒耐受型菌株Stenotrophomonasmaltophilia,可以在120 h之内将2.0 mmol/L的Se(IV)溶液中的87%的Se(IV)还原为纳米态Se0,体现了该根际微生物菌株对硒的超强代谢能力;但是,对硒超积累植物的根际微生物特征的系统研究直到2011年才由美国科罗拉多州立大学的Pilon-Smits课题组开始着手分析,其在科罗拉多州和怀俄明州的硒超积累植物——沙漠王羽的根际分离得到24种代表性耐硒真菌,在含硒10 mg/L的高硒培养基中仍能生长,而来自于同样研究区域的硒的非积累植物的根际真菌在10 mg/L的高硒培养基中无法生长[15]; 随后,其在沙漠王羽和双钩黄芪的根际发现大量根瘤菌和根结核存在,研究证实该硒超积累植物根际存在大量固氮菌、内生真菌可以将根际的硒化物转化为单质硒,形成结核形态,从而改变了植物根际的硒分布与形态,这很可能是该硒超积累植物对硒的超高耐受能力的一种机制[16,17];通过将从硒超积累植物根际分离的真菌菌株转接到各种对硒积累程度不一样的植物根际(如:硒超积累植物、硒积累植物、硒非积累植物等),可以发现这些根际真菌能显著改变所有植物的根际硒的分布与植物组织中硒的积累,而且,硒的积累植物对转接的根际真菌响应明显优于硒的非积累植物[18,19]。
目前对于已发现的两种硒的超积累植物双钩黄芪和沙漠王羽的研究显示,其对硒的超积累机制可能有两种模式:一种模式是叶片等器官组织中的硒代半胱氨酸甲基转化酶(SMT)的高效、过量表达。正常情况下,硒代半胱氨酸(SeCys)会非特异性取代半胱氨酸(Cys)进入植物蛋白结构中,如果这种取代比例过大,将会破坏植物蛋白的结构和功能,从而对植物造成损害,严重的会导致植物生理异常甚至死亡。但是,如果SMT能在植物器官中高效、过量表达,会优先将SeCys甲基化为不能进入植物蛋白的MeSeCys,从而有效防止硒对植物的毒害。这很可能就是双钩黄芪和沙漠王羽在体内大量累积MeSeCys的原因[2,3]。更为有意义的是,将双钩黄芪中的SMT转到非积累植物拟南芥(Arabidopsis)和印度芥菜(Indianmustard)中,可以显著提高其对硒的累积达数十倍[20]。另一种模式是根际微生物的参与。对硒超积累植物双钩黄芪的根际微生物研究显示,双钩黄芪根际存在大量根瘤菌,其可以在根际大量产生一种特异性硒代氨基酸——γ谷氨酰-硒甲基硒代半胱氨酸(γGMSC),从而在双钩黄芪对硒的超积累中扮演了重要的角色[21]。
本研究结果表明壶瓶碎米荠的根际较非根际存在更为丰富的微生物群落,但是其微生物的群落组成却相对简单,而且不同区域的根际微生物的组成较为接近,很可能是由于根际环境的高硒筛选结果,这些代表性的根际微生物α-变形菌纲和硝化螺旋菌纲可能在壶瓶碎米荠对硒的吸收、积累过程中扮演了重要的作用。但是关于根际微生物参与壶瓶碎米荠的根际硒代谢机制尚需要进一步的研究。
致谢:本研究得到了武汉大学中国典型微生物保藏中心彭方副教授及其团队的大力支持,深表感谢!
[1] Yuan L X, Zhu Y Y, Lin Z Q,etal.. A novel selenocystine-accumulating plant in selenium-mine drainage area in Enshi, China[J]. PLoS ONE, 2013, 8(6):e65615.
[2] Freeman J L, Tamaoki M, Stushnoff C,etal.. Molecular mechanisms of selenium tolerance and hyperaccumulation inStanleyapinnata [J]. Plant Physiol., 2010, 153: 1630-1652.
[3] Pilon-Smits E A H, Quinn C F. Selenium metabolism in plants[J]. Plant Cell Monogr., 2010, doi:10.1007/978-3-642-10613-2-10.
[4] Berg G, Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere[J]. FEMS Microb. Ecol., 2009, 68: 1-13.
[5] Azaizeh H, Gowthaman S, Terry N. Microbial selenium volatilization in rhizosphere and bulk soils from a constructed wetland[J]. Environ. Qual., 1997, 26: 666-672.
[6] Souza M P D, Huang C P A, Chee N,etal.. Accumulation of selenium and mercury in wetland plants[J]. Planta,1999, 209(2):259-263.
[7] Souza M P D, Chu D, Zhao M,etal.. Rhizosphere bacteria enhance selenium accumulation and volatilization by Indian mustard [J]. Plant Physiol., 1999, 119: 565-573.
[8] Nakamaru Y, Tagami K, Uchida S. Depletion of selenium in soil solution due to its enhanced sorption in the rhizosphere of soybean[J]. Plant Soil, 2005, 278(1-2): 293-301.
[9] Gregorio S D, Lampis S, Malorgio F,etal..Brassicajunceacan improve selenite and selenate abatement in selenium contaminated soils through the aid of its rhizospheric bacterial population [J]. Plant Soil, 2006, 285(1-2):233-244.
[10] Munier L C, Deneux M S, Mustin C,etal.. Selenium bioavailability and uptake as affected by four different plants in a loamy clay soil with particular attention to mycorrhizae inoculated ryegrass [J]. Environ. Radioact., 2007, 97(2-3):148-158.
[11] 袁林喜. 北极新奥尔松和浙江舟山群岛的典型岛屿生态地质学问题研究[D].合肥:中国科学技术大学,博士学位论文,2010.
[12] Yin X B, Yuan L X, Liu Y,etal.. Phytoremediation and Biofortification: Two Sides of One Coin [M]. Springer Netherlands, 2012.
[13] Weisburg W G, Barns S M, Pelletier D A,etal.. 16S ribosomal DNA amplification for phylogenetic study[J]. J. Bacteriol., 1991, 173(2): 697.
[14] Gregorio S D, Lampis S, Vallini G. Selenite precipitation by a rhizospheric strain ofStenotrophomonassp. isolated from the root system ofAstragalusbisulcatus: A biotechnological perspective[J]. Environ. Int., 2005, 31(2): 233-241.
[15] Wangeline A L, Rodolfo V J, Lindblom S D,etal.. Characterization of rhizosphere fungi from selenium hyperaccumulator and nonhyperaccumulator plants along the eastern Rocky Mountain Front Range[J]. Am. J. Bot., 2011, 98(7): 1139-1147.
[16] Alford É R. Plant selenium accumulation and the rhizosphere effect[R]. ProQuest Dissertations Publishing , 2011.
[17] Lindblom S D, Valdez B J R, Fakra S C,etal.. Influence of microbial associations on selenium localization and speciation in roots ofAstragalusandStanleyahyperaccumulators [J]. Environ. Exp. Bot., 2013, 88: 33-42.
[18] Lindblom S D, Fakra S C, Landon J,etal.. Inoculation of and with selenium-hyperaccumulator rhizosphere fungi affects growth and selenium accumulation [J]. Planta, 2013, 237(3): 717-729.
[19] Lindblom S D, Fakra S C, Landon J,etal.. Inoculation of selenium hyperaccumulatorStaleyapinnataand related non-accumulatorStaleyaelatawith hyperaccumulator rhizosphere fungi-investigation of effects on selenium accumulation and speciation [J]. Physiol. Plant., 2014, 150(1):107-118.
[20] Banuelos G S, Duc D L, Pilon E A H,etal.. Transgenic Indian mustard overexpressing selenocysteine lyase or selenocysteine methyltransferase exhibit enhanced potential for selenium phytoremediation under field conditions [J]. Environ. Sci. Technol., 2007, 41: 599-605.
[21] Alford É R, Pilon E A H, Paschke M W. Metallophytes —— A view from the rhizosphere [J]. Plant Soil,2010,337:33-50.
功能农业研究团队介绍
2008年,中国科学技术大学苏州研究院硒与人体健康重点实验室成立,并于2009年经苏州市科技局认定为苏州市重点实验室。此后,为准确反映功能农业的学科涵盖,于2013年更名为中国科学技术大学苏州研究院功能农业重点实验室。这是赵其国院士在《中国至2050年农业科技发展路线图》中提出功能农业后,首个专注功能农业的研究机构。赵其国院士亲自担任实验室的学术委员会主任,国际硒研究学会发起人林治庆博士担任实验室名誉主任,尹雪斌博士担任实验室主任,袁林喜博士担任实验室副主任,团队聚集了近20位高级研究人员、博士后和研究生、本科生,专注的矿物质包括硒、锌、钙、铁、碘、镁和氟等人体必需元素。侧重矿物质的植物吸收模型与人体吸收模型研究,涵盖矿物质转化过程、规律及其调控机理,安全性、有效性评估,以支撑功能农业标准化工作。在江苏省科技厅的支持下,与苏州硒谷科技有限公司共建江苏省硒生物工程技术研究中心,并由尹雪斌博士担任中心主任,袁林喜博士担任中心常务副主任。目前,已建立我国最为完善的矿物质形态分析技术体系,能够实现农作物和食品中微量-恒量硒代氨基酸形态分析;形成从人工模拟胃肠试验装置、动物试验,到大人群干预的安全性与有效性评估体系;并与产业伙伴、联合实验室共同建立了从温室到大田的稳定性试验体系。先后发表相关学术论文50余篇、专著5部;提交发明专利200余项,授权发明专利50余项。
功能农业实验室定位:致力于成为国际功能农业科技创新中心。以国际硒学会为重要国际间合作平台,围绕功能农业新学科的关键科学问题,务实开展广泛而有效的协同研究,推进功能农业标准化工作,指导、支持功能农业产业化实践,让功能农业服务人类健康,造福13亿中国人。
功能农业实验室使命:以功能农业科技消除人类的“隐性饥饿”,促进人类健康长寿。
CharacterizationonRhizosphereBacteriaCommunitiesfromSeleniumHyperaccumulatorCardaminehupingshanesis
YUAN Linxi1,2, ZHANG Ying3
1.SchoolofEarthandSpaceSciences,UniversityofScienceandTechnologyofChina,Hefei230026,China; 2.JiangsuBio-engineeringResearchCentreofSelenium,JiangsuSuzhou215123,China; 3.SchoolofNanoscience,UniversityofScienceandTechnologyofChina,JiangsuSuzhou215123,China
High-performance 16S rRNA analysis was performed on rhizosphere bacteria fromCardaminehupingshanesisto demonstrate their roles on selenium(Se)-hyperaccumulation byC.hupingshanesis. Compared with the normal soils in study site, there have much higher contents of microorganisms but less microbial diversity in the rhizosphere ofC.hupingshanesis, and it was predominant by α-proteobacteria class (15%~22%), β-proteobacteria class (10%~16%), Actinobacteria class (10%~18%), Acidobacteria class (8%~15%), γ-proteobacteria class (5%~16%). Moreover, some special microorganism were characterized with Nitrospira class (2%~5%), Gemmatimonadetes class (2%~5%), Verrucomicrobiae class (2%~4%), Planctomycetacia class (1%~2%) and others (Opitutae class, Sphingobacteria class, Bacilli class, Clostridia class) (3%~4%). Especially, the typical bacteria, such as α-proteobacteria class and Nitrospira class could play important roles during Se-hyperaccumulation forC.hupingshanesis.
Cardaminehupingshanesis; rhyzosphere bacteria; selenium hyperaccumulation; α-proteobacteria class; Nitrospira class
2017-08-04;接受日期2017-08-24
国家自然科学基金项目(31400091)资助。
袁林喜,研究员,博士,主要从事生物营养强化研究。E-mail:yuanlinxi001@gmail.com
10.19586/j.2095-2341.2017.0102

