纳米硒的生物医学作用研究进展
2017-11-23刘红梅
曹 晖, 刘红梅
华中科技大学化学与化工学院, 武汉 430074
纳米硒的生物医学作用研究进展
曹 晖, 刘红梅*
华中科技大学化学与化工学院, 武汉 430074
硒是人体必需微量营养元素,在生命体中有延缓衰老、清除自由基、保护心血管、抗癌等诸多功效。但是,由于传统补硒剂的安全剂量和毒性剂量范围过于接近,导致硒在保健食品和医药品中的应用受到了限制。纳米硒是近些年来发展的一种新颖的硒形态,综述了纳米硒对生物体的毒性、生物医学作用(如抗氧化、抗癌、抗菌)、用作膳食营养补充剂的潜能等方面的研究进展,并对未来的研究进行了展望,以期为纳米硒的生物医学应用和保障人类的健康提供参考。
硒;纳米硒;抗氧化;抗癌;毒性
硒是人体必需的一种微量营养元素,对人体健康至关重要。缺硒可导致心血管疾病、癌症、大骨节病、病毒感染性疾病等的发病率显著升高,而补硒则有助于预防这些疾病[1~4]。一般认为硒主要通过硒蛋白发挥生物学功能。在硒蛋白中,硒以硒代半胱氨酸(Sec)—第21种天然氨基酸的形式存在。目前已知人体内有25种硒蛋白,它们在抗氧化防御、细胞信号转导、甲状腺激素水平调节、免疫调节等生命过程中发挥着重要作用[5]。其中,抗氧化、清除自由基是硒最重要的生物学功能。例如,硒酶-谷胱甘肽过氧化物酶(GPx)是机体抗氧化防御系统中重要的成员,它们可以催化体内有毒的H2O2和脂质过氧化物(ROOH)变为无毒的水和醇,从而保护蛋白质、DNA和脂类免受氧化损伤。
传统的食物来源或营养补充的硒化合物包括无机硒(常见的有亚硒酸钠、硒酸钠)和有机硒(常见的有硒代蛋氨酸、硒代半胱氨酸)。但是,硒在生物体内的安全剂量范围非常狭窄,很容易因过量而产生毒性,这限制了传统硒化合物在临床疾病防治方面的广泛应用[1,2,4]。因此,开发高效、安全的硒形态是硒营养预防研究的重点,也是将硒广泛应用于临床疾病治疗中急需解决的关键问题。近十多年来,随着纳米技术在生物医药领域的应用突飞猛进,纳米级的无定型单质硒(简称“纳米硒”,缩写为SeNPs)的合成及其生物医学作用也受到研究者们的广泛关注[6,7]。与传统硒化合物相比,纳米硒因具有独特的物理和化学性质,生物利用度高、活性高,有望成为新型的硒营养补充剂和治疗药物。本文将对纳米硒的毒性以及抗氧化、抗菌、抗癌、抗糖尿病等生物医学作用进行综述,并对未来的研究提出一些建议。
1 纳米硒对生物体的毒性
纳米硒的毒性研究是纳米硒能否应用于生物体内的关键。Zhang等[8]首次发现红色无定型纳米硒时就研究了其对小鼠的急性毒性,结果显示纳米硒的半致死剂量(LD50)为113.0 mg/kg体重,而亚硒酸钠的LD50为15.7 mg/kg体重,说明纳米硒的毒性远远低于亚硒酸钠。后续一系列的大鼠或小鼠动物实验显示,高剂量纳米硒(≥2 mg/kg体重)的急性毒性、亚急性毒性、短期毒性和亚慢性毒性均显著低于硒酸钠、亚硒酸、亚硒酸钠、硒代蛋氨酸和甲基硒代蛋氨酸[9~14],而且超营养水平的纳米硒(0.2~0.4 mg/kg体重)对动物没有明显毒性[15]。然而,Li等[16]在探究纳米硒和亚硒酸钠对青鳉鱼毒性影响时发现,纳米硒在肝脏的累积比亚硒酸钠高6倍,并且纳米硒显示出很强的毒性,其LD50比亚硒酸钠小约5倍。其原因可能是,鱼类和鼠类之间由于物种差异导致对不同形态硒的摄入程度及体内代谢不同。总的来说,与传统的无机硒及有机硒化合物相比,纳米硒是一种相对安全的硒形态。纳米硒低毒性的特点使其有了作为治疗药物以及硒营养补充剂的可能。
2 纳米硒的生物医学作用
2.1抗氧化作用
大量研究显示,纳米硒是一种高效的抗氧化剂,其通过多种方式发挥抗氧化作用。
2.1.1直接清除自由基 Huang等[17]通过体外实验发现牛血清白蛋白(BSA)包裹的纳米硒可以直接清除碳中心自由基、二甲基三硝基苯肼(DPPH)自由基、超氧阴离子和单线态氧,而且还可以抑制DNA的氧化。Chen等[18]和Zhai等[19]报道壳聚糖包裹的纳米硒在体外实验中可以直接清除DPPH自由基、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基。
2.1.2激活抗氧化硒酶的活性 纳米硒进入生物体后通过激活抗氧化硒酶GPx、硫氧还蛋白还原酶(TrxR)等的活性发挥抗氧化作用。Zhai等[19]报道给小鼠口服壳聚糖包裹的纳米硒可以增强GPx活性、抑制紫外线导致的脂褐素的形成,其作用优于亚硒酸钠。Wang等[12]报道给小鼠口服牛血清白蛋白(BSA)包裹的纳米硒可以增强GPx和TrxR的活性,其效果与硒代蛋氨酸等同。
2.1.3增强机体抗氧化防御体系中其他关键酶的活性 纳米硒进入生物体后可增强机体抗氧化防御体系关键酶超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性。Bai等[9]最新报道,口服负载纳米硒的壳聚糖微球,不仅激活了小鼠血清和肝脏中GPx活性,而且使SOD和CAT的活性显著增强,显示出超强的抗氧化活性,抑制了脂质过氧化。Hassanin等[20]报道腹腔注射纳米硒抑制了重铬酸钾诱导的大鼠甲状腺损伤,主要是通过增强SOD和CAT活性抑制了氧化损伤。
2.1.4抑制蛋白质糖基化 蛋白质糖基化是体内诱导活性氧(ROS)产生的原因之一。纳米硒通过与蛋白质氨基酸结合而防止蛋白质结构修饰,从而抑制蛋白质糖基化[21]。
2.1.5具有模拟氧化酶活性 Guo等[22]研究首次发现纳米硒具有模拟氧化酶活性,能够催化氧气氧化四甲基联苯胺(TMB)。因此纳米硒可能通过直接的模拟酶活性,参与生物体内氧化还原平衡调节。
2.2抗菌作用
细菌感染是生物医学领域中最具挑战性的难题之一。自抗生素被发现并应用以来,一直都被认为是治疗细菌感染最有效的药物。然而由于抗生素的滥用,多药耐药细菌在全球范围内以前所未有的速度出现,并严重威胁着人类健康。其中金色葡萄球菌是各种感染的重要来源,由于生物膜的形成和抗生素耐药性的产生,使得金色葡萄球菌感染很难治疗。近些年来纳米硒在抗菌方面的应用被广泛研究。Shoeibi和Mashreghi等[23]在粪肠球菌中加入Na2SeO3,通过生物方法合成出尺度在29~195 nm范围内的纳米硒颗粒,其可用于预防和治疗金色葡萄球菌感染。在含有SeO2的培养基中接种芽孢杆菌,生成了粒径在80~200 nm范围内的纳米硒[24]。该纳米硒不仅对金色葡萄球菌具有抑制效果,同时还能抑制烟曲霉和白色念球菌的活性[24]。
TiO2纳米管(TNTs)由于其纳米级的细微结构和规则的空间构造,具有优良的生物相容性,同时也是天然的载药系统。然而,在含氧环境中,Ti表面形成的TNTs很容易受到细菌的感染,并且由细菌感染引发的炎症反应不受控制,导致其无法成为牙科植入物。Liu等[25]发现在真空条件下,利用Na2SeO3与谷胱甘肽(GSH)在TNTs中进行氧化还原,最终合成出了掺入纳米硒的钛纳米管(图1)。该钛纳米管能十分显著地抑制大肠杆菌以及金黄色葡萄球菌的生长。其作用机制包括:纳米硒削弱大肠杆菌膜生成,降低粘附介导蛋白的功能;高浓度的纳米硒会诱导产生破坏性的ROS去损伤细菌。同时这种复合材料还可以抑制巨噬细胞的增殖,控制了炎症反应,甚至能够防止慢性炎症,从而提高了钛作为矫形/牙科植入物的性能。总之,纳米硒可能是一个潜在的抗生素耐药性细菌的优秀“杀手”。

图1 掺入纳米硒的钛纳米管(TNTs)扫描电镜图[25]Fig.1 Scanning electron microscope images of Titania nanotubes (TNTs) incorporating SeNPs[25].A.TNTs; B.结合低浓度纳米硒的TNTs;C.结合中浓度纳米硒的TNTs; D.结合高浓度纳米硒的TNTs。
2.3抗癌作用
大量研究表明,各种形式的硒,包括无机硒化合物、有机硒化合物以及纳米硒,在高剂量时都具有很好的抗癌活性,其抗癌机制一般都是通过诱导癌细胞内ROS过量产生,而过量的ROS可以抑制细胞周期、激活细胞凋亡信号通路,最后导致癌细胞凋亡[4]。但是单一的硒缺乏特异性、靶向性,使得其具有较高的毒副作用。近年来,研究者们利用纳米技术对纳米硒进行功能化修饰,在提高硒的癌细胞靶向性及抗癌活性方面取得了较大进展。

纳米硒还可以作为抗癌药物载体,并与抗癌药物协同杀死癌细胞。血管生成是肿瘤形成、发展以及转移的关键环节。Fu等[30]合成了精氨酸-苷氨酸-天冬氨酸(RGD)肽修饰的、负载阿霉素(DOX)的纳米硒粒子(RGD-NPs),由于RGD肽可以与细胞表面的整合素特异性结合,该RGD-NPs促进DOX和纳米硒被肿瘤血管内皮细胞特异性摄取,从而具有抗血管生成活性。进一步的机理研究显示,该RGD-NPs通过触发ROS介导的DNA损伤,抑制了VEGF-VEGFR2-ERK/AKT信号通路来使细胞凋亡或细胞周期停滞,从而达到抗肿瘤血管生成作用。
多药耐药性是当今癌症治疗急需解决的关键问题。耐药性机制研究发现,癌细胞利用药物流出转运蛋白,例如P-糖蛋白(P-gp)和多药耐药蛋白(MDR1)使得抗癌药物排出癌细胞,从而使癌细胞达到耐药的效果。因此,可以通过RNA干扰(siRNA)使P-gp和MDR1的表达降低来解决耐药性问题。Zheng等[31]首先合成了G5@Se NP,然后负载MRD1的siRNA和顺铂(DDP)形成G5@Se-DDP-siRNA。在顺铂耐药性细胞系A549/DDP细胞中,G5@Se-DDP-siRNA减少了P-gp和MDR1的表达,同时起到协同诱导癌细胞凋亡的作用,而且其对正常细胞的毒性远远小于DDP。此外,动物实验显示G5@Se-DDP-siRNA具有非常显著的抗癌效果,并对主要脏器无明显毒性(图2)。
2.4抗阿尔茨海默症作用

图2 G5@Se-DDP-siRNA抗癌机理[32]Fig.2 The anti-cancer mechanism of G5@Se-DDP-siRNA[32].
阿尔茨海默症(俗称“老年痴呆症”,AD)是严重影响人类健康和患者生活质量的重大多发性疾病,如何治疗AD成为当今最具挑战性的研究方向。大量研究表明,β-淀粉样蛋白(Aβ)的聚集是AD形成的关键所在。因此,很多研究者致力于开发抑制Aβ聚集的新型药物[33]。
Zhang等[34]利用表没食子儿茶素-3-没食子酸酯(EGCG)包裹纳米硒,随后在外层表面涂覆一层特定序列的Tet-1多肽(HLNILSTLWKTR),制备了一种新型的抗Aβ聚集纳米药物Tet-1-EGCG@SeNPs(图3A)。其中,ECGC是已被证实能够改变Aβ的淀粉样蛋白形成途径,使其向高度稳定的小分子寡聚物方向进行,从而抑制Aβ聚集[35];而Tet-1是具有神经元靶向性的多肽[36]。纳米硒与这两者结合,使其具有更好的生物相容性和生物活性,同时还能增强其神经元靶向作用。实验结果显示,Tet-1-ECGC@SeNPs可以有效抑制Aβ纤维形成、使已形成的Aβ纤维解聚为无毒形式(图3B)[34]。而且,Tet-1-ECGC@SeNPs可以通过Tet-1特异性识别神经元上的受体GT1b后被内吞进入细胞,抑制Aβ纤维诱导的ROS产生及细胞凋亡[34]。
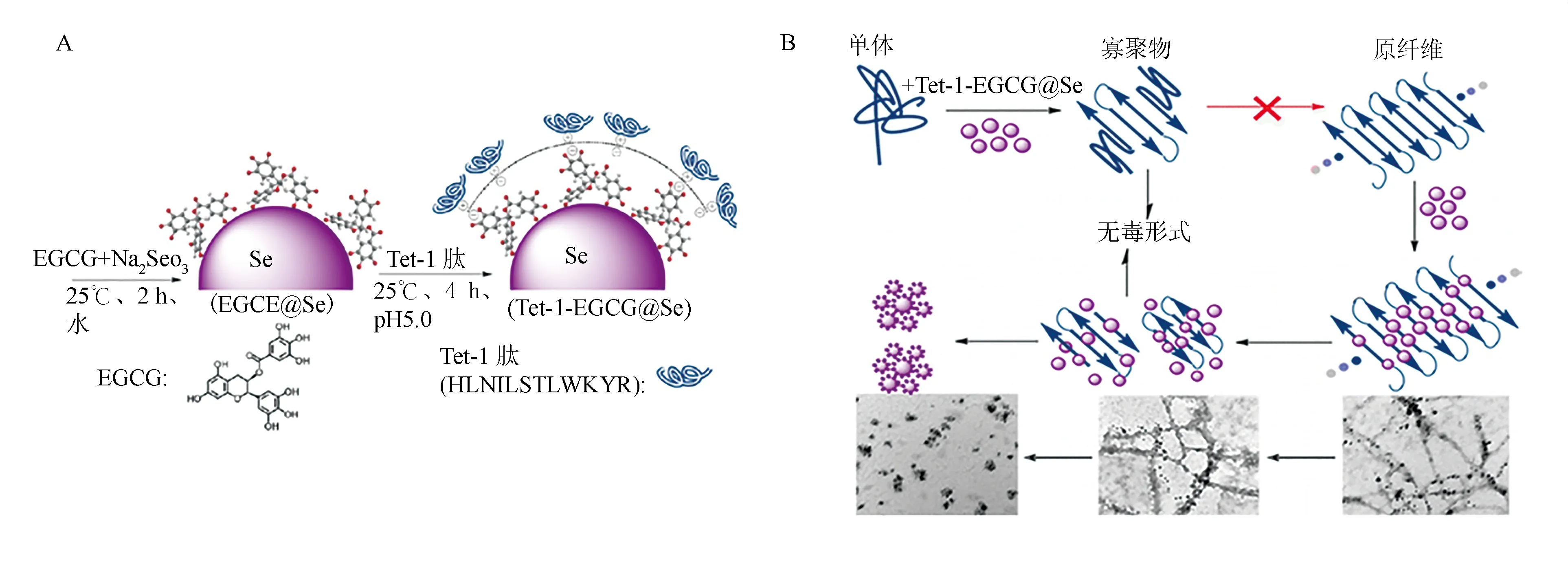
图3 Tet-1-EGCG@SeNPs对Aβ聚集的影响[34]Fig.3 The effect on Aβ aggregation by Tet-1-EGCG@SeNPs[34].A.Tet-1-EGCG@ Se示意图;B.Tet-1-EGCG@Se抑制了Aβ纤维形成。
B6肽可以作为一种转铁蛋白的替代品来介导药物递送,被认为是最具潜力的穿越血脑屏障进行药物运输的候选者之一[37]。而唾液酸(SA)是神经组织的关键部分,并且是大脑生长的营养物质[38]。基于此,Yin等[39]构建了B6-SA-SeNPs三元纳米药物。该纳米硒不仅可以抑制Aβ聚集,也可以解聚Aβ纤维,还能够保护啫铬细胞瘤细胞(PC12细胞)免受Aβ诱导的神经毒性。更重要的是,B6-SA-SeNPs可以通过血脑屏障并有效聚集在PC12细胞中,是一个十分有潜力的抗AD纳米药物。
在AD 患者的老年斑中,除含大量的Aβ聚集体外,还有高浓度的Zn2+和Cu2+,这些金属离子通过与Aβ结合诱导Aβ聚集和氧化应激,促进了AD的发生发展,因此抑制金属离子与Aβ结合是治疗AD的一种新策略[40]。Yang等[41]设计合成了L-Cys修饰的Se/Ru NPs,其对Aβ具有极强的亲和力,并可有效地抑制细胞外Aβ40自组装和Zn2+诱导的Aβ纤维化。此外,Se/Ru NPs可以抑制Zn2+-Aβ介导的ROS的产生并降低其在PC12细胞中的神经毒性。Sun等[42]合成了手性青霉胺包裹的纳米硒(L-/D-Pen@Se NPs),其中D-Pen@Se NPs可以抑制Zn2+诱导的Aβ纤维化,改善小鼠的认知和记忆障碍。该研究为手性纳米药物应用于AD治疗提供了依据。总之,纳米硒复合物可以作为保护神经、治疗AD的新型药物。
2.5抗糖尿病作用
糖尿病是一种慢性进行性代谢紊乱疾病,由多种因素控制。至2013年,全球已有8.3%的成年人患此病,预计在2035年将达到6亿人。因此开发抗糖尿病药物具有重要的科学意义和社会意义。Al-Quraishy等[43]首次报道了纳米硒具有降血糖作用,他们在研究纳米硒对链脲佐菌素诱导的糖尿病的作用时发现,大鼠口服纳米硒治疗28 d后,空腹血糖水平显著降低,表明纳米硒具有类似于胰岛素的降血糖功能。
一般情况下,利用胰岛素可以有效治疗1型和2型糖尿病,但是无论是注射还是口服都有不足,例如疼痛、过敏反应、注射部位周围的脂肪代谢障碍、胃肠道的不稳定性以及渗透吸收差等。因此,Deng等[44]将纳米硒作为胰岛素的载体,通过离子交联/原位还原将胰岛素负载到纳米硒上,形成粒径在120 nm左右的INS-SeNPs。实验发现,INS-SeNPs表现出可控的胰岛素释放和在消化液中稳定的特点,在正常和糖尿病大鼠中均有显著的降血糖作用。并且与皮下注射胰岛素相比,其生物利用率高达9.15%。同时,离体小肠成像实验和细胞实验显示,INS-SeNPs能很好地被肠道吸收。此外,INS-SeNPs可以显著缓解氧化应激、改善胰岛功能、促进葡萄糖的利用,是一个非常有潜力的抗糖尿病药物。
一种新型的神经分泌肽——垂体腺苷酸环化酶激活肽(PACAP)在糖脂代谢中发挥重要作用。PACAP不仅可以通过激活血管活性肠肽的VPAC2受体介导葡萄糖依赖性胰岛素分泌,降低血糖;而且能通过激活VPAC1受体促进胰高血糖素生成,升高血糖。Zhao等[45]将PACAP中特异与VPAC2受体结合的、由32个氨基酸组成的多肽DBAYL与纳米硒结合,形成了一种新型的纳米粒子(命名为SCD)。实验发现,SCD能够显著促进胰岛β细胞增殖、葡萄糖摄取、胰岛素分泌、胰岛素受体的表达,同时明显下调H2O2损伤的胰岛细胞内ROS水平。而且,其在提高胰岛素分泌、降低血糖水平方面的能力比Exendin-4(临床批准药物)更强。因此,SCD通过纳米硒与DBAYL的协同作用有望成为抗2型糖尿病的潜在药物。
2.6膳食硒营养补充剂
胃肠道从胃到结肠的表面覆盖了一层上皮细胞分泌的黏液。小肠的黏液厚度约200 μm,大肠的黏液厚度为480~800 μm[32]。研究发现黏液的毛孔厚度在100 μm左右,允许纳米颗粒穿过黏液层[46]。因此,纳米颗粒的尺寸对于通过黏液屏障十分重要。在通过黏液层后,纳米颗粒还需要穿透上皮细胞。上皮细胞是相互紧密连接的,纳米颗粒由于体积太大而无法利用细胞间隙通过[47]。因此纳米颗粒渗透细胞的主要方式是巨胞饮、网格蛋白介导的内吞、细胞膜穴样内陷以及非网格蛋白非细胞膜穴样内陷介导的细胞摄取[48]。
对于纳米硒来说,其在人体胃肠道摄取、吸收、转移、排泄同样受到尺寸大小、表面性质等的影响。Pornwilard等[49]用果胶、海藻酸/果胶混合物、卵清蛋白、β-乳球蛋白作为保护剂合成纳米硒,然后采用流场流分离法及电感耦合等离子体质谱法实时监测了纳米硒在胃肠道模拟环境中尺寸的变化。结果显示,在有胃蛋白酶存在且pH 2的条件下,纳米硒尺寸趋向于变小;而在pH 7的条件下,颗粒尺寸趋向于变大。由此可知,胃肠道蛋白酶和pH变化对纳米颗粒具有十分显著地影响。因此,在合成纳米硒时应采用某些特定的保护剂以提高纳米硒在胃肠道的稳定性。壳聚糖是一种带正电的天然多糖,因其毒性低且能够提高药物生物粘附和生物利用度而常被用作各种药物的载体[50]。而且,壳聚糖能够抵抗蛋白酶水解,这赋予壳聚糖包裹的药物良好的口服活性[51]。Zhang等[52]考察了壳聚糖作为保护剂合成的纳米硒在各种模拟体液(汗液、胃液、肠液)中的降解情况,发现其在不同时pH及酶环境下都具有优异的稳定性。而且,前述给小鼠口服壳聚糖包裹的纳米硒可以增强GPx活性、抑制紫外线导致的脂褐素的形成,其作用优于亚硒酸[19]。这些结果说明,壳聚糖包裹的纳米硒有作为膳食硒营养补充剂的潜能。
硒是人体必需的微量营养元素,其生物功能包括抗癌、抗氧化等已被广泛研究。硒的生物利用度主要取决于其化学存在形式。与传统的无机硒及有机硒化合物相比,纳米硒生物活性高且毒性相对低。如上所述,目前文献已报道纳米硒具有抗氧化、抗菌、抗癌、抗AD、抗糖尿病等生物医学作用,其有望成为一种新型的治疗药物以及硒营养补充剂。
3 展望
尽管纳米硒已展现出诱人的生物医学作用,且已有多种纳米硒制剂作为保健品上市销售,但是纳米硒作为疾病治疗药物或硒营养补充剂还面临诸多挑战。面临的最大挑战是纳米硒在体内的代谢动力学问题,这是决定纳米硒能否作为治疗药物或营养补充剂的关键。目前对一些传统的硒营养补充剂如硒酸钠、亚硒酸钠、硒代蛋氨酸等在动物体内的利用和代谢已有一定的了解[6],但对纳米硒在体内的吸收、分布、代谢和排泄知之甚少,尤其是对纳米硒在体内发挥生物效应的化学形式不甚了解,是仍以纳米形式直接发挥作用,还是部分或全部转化为其他硒形态?具体又指什么硒形态?未来需要发展一些分析检测手段,尤其是荧光标记技术,跟踪纳米硒在体内的代谢过程。其次,目前对纳米硒的生物效应研究多是体外实验,且仅停留在发表科研论文的层次,将来的研究工作应多从模型动物甚至人体实验的层次来考察纳米硒的生物医学作用,尤其是抗AD作用、抗癌作用。最后,先前的研究显示硒在心脑血管疾病中具有重要作用[1],但是目前关于纳米硒在抑制心脑血管疾病方面是否有更优异的表现尚不清楚,未来的研究应从分子、细胞和整体水平进行探讨,进一步扩展纳米硒在生物医药中的应用。
[1] Liu H, Xu H, Huang K. Selenium in the prevention of atherosclerosis and its underlying mechanisms[J]. Metallomics, 2017, 9:21-37.
[2] Rayman M P. Selenium and human health. Lancet[J]. Lancet, 2012, 379:1256-1268.
[3] Fairweather-Tait S J, Bao Y, Broadley M R,etal.. Selenium in human health and disease[J]. Antioxid. Redox Signal., 2011, 14:1337-1383.
[4] Fernandes A P, Gandin V. Selenium compounds as therapeutic agents in cancer[J]. Biochim. Biophys. Acta., 2014, 1850:1642-1660.
[5] Labunskyy V M, Hatfield D L, Gladyshev V N. Selenoproteins: Molecular pathways and physiological roles[J]. Physiol. Rev., 2014, 94:739-777.
[6] Skalickova S, Milosavljevic V, Cihalova K,etal.. Selenium nanoparticles as a nutritional supplement[J]. Nutrition, 2016,33:83-90.
[7] Wadhwani S A, Shedbalkar U U, Singh R,etal.. Biogenic selenium nanoparticles: Current status and future prospects[J]. Appl. Microbiol. Biotechnol., 2016, 100:2555-2566.
[8] Zhang J S, Gao X Y, Zhang L D,etal.. Biological effects of a nano red elemental selenium[J]. Biofactors, 2001, 15:27-38.
[9] Bai K, Hong B, He J, Hong Z,etal.. Preparation and antioxidant properties of selenium nanoparticles-loaded chitosan microspheres[J]. Int. J. Nanomed., 2017,12:4527-4539.
[10] Benko I, Nagy G, Tanczos B,etal.. Subacute toxicity of nano-selenium compared to other selenium species in mice[J]. Environ. Toxicol. Chem., 2012, 31:2812-2820.
[11] Jia X, Li N, Chen J. A subchronic toxicity study of elemental Nano-Se in Sprague-Dawley rats[J]. Life Sci., 2005, 76:1989-2003.
[12] Wang H, Zhang J, Yu H. Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes: Comparison with selenomethionine in mice[J]. Free Radic. Biol. Med., 2007, 42:1524-1533.
[13] Zhang J, Wang H, Yan X,etal.. Comparison of short-term toxicity between Nano-Se and selenite in mice[J]. Life Sci., 2005, 76:1099-1109.
[14] Zhang J, Wang X, Xu T. Elemental selenium at nano size (nano-se) as a potential chemopreventive agent with reduced risk of selenium toxicity: Comparison with Se-methylselenocysteine in mice[J]. Toxicol. Sci., 2008, 101:22-31.
[15] He Y, Chen S, Liu Z,etal.. Toxicity of selenium nanoparticles in male Sprague-Dawley rats at supranutritional and nonlethal levels[J]. Life Sci., 2014, 115:44-51.
[16] Li H, Zhang J, Wang T,etal.. Elemental selenium particles at nano-size (Nano-Se) are more toxic to Medaka (Oryziaslatipes) as a consequence of hyper-accumulation of selenium A comparison with sodium selenite[J]. Aquat Toxicol., 2008, 89(4):251-256.
[17] Huang B, Zhang J, Hou J,etal.. Free radical scavenging efficiency of nano-Se in vitro[J]. Free Radic. Biol. Med., 2003, 35:805-813.
[18] Chen W, Li Y, Yang S,etal.. Synthesis and antioxidant properties of chitosan and carboxymethyl chitosan-stabilized selenium nanoparticles[J]. Carbohydr. Polym., 2015, 132:574-581.
[19] Zhai X, Zhang C, Zhao G,etal.. Antioxidant capacities of the selenium nanoparticles stabilized by chitosan[J]. J. Nanobiotechnol., 2017, 15(1):4-15.
[20] Hassanin K M A, Abd E K S H, Hashem K S. The prospective protective effect of selenium nanoparticles against chromium-induced oxidative and cellular damage in rat thyroid[J]. Int. J. Nanomed., 2013, 2013:1713-1720.
[21] Yu S, Zhang W, Liu W,etal.. The inhibitory effect of selenium nanoparticles on protein glycation in vitro[J]. Nanotechnology, 2015, 26:145703.
[22] Guo L, Huang K, Liu H. Biocompatibility selenium nanoparticles with an intrinsic oxidase-like activity[J]. J. Nanopart. Res., 2016, 18:74.
[23] Shoeibi S, Mashreghi M. Biosynthesis of selenium nanoparticles using enterococcus faecalis and evaluation of their antibacterial activities[J]. J. Trace Elem. Med. Biol., 2017, 39:135-139.
[24] Shakibaie M, Mohazab N S, Mousavi S A A. Antifungal activity of selenium nanoparticles synthesized byBacillusspecies Msh-1 againstAspergillusfumigatusandCandidaalbicans[J]. Jundishapur J. Microbiol., 2015, 8:26381-26384.
[25] Liu W, Golshan N H, Deng X,etal.. Selenium nanoparticles incorporated into titania nanotubes inhibit bacterial growth and macrophage proliferation[J]. Nanoscale, 2016, 8:15783-15794.
[26] Feng Y, Su J, Zhao Z,etal.. Differential effects of amino acid surface decoration on the anticancer efficacy of selenium nanoparticles[J]. Dalton Trans., 2014, 43:1854-1861.
[27] Zhang Y, Li X, Huang Z,etal.. Enhancement of cell permeabilization apoptosis-inducing activity of selenium nanoparticles by ATP surface decoration[J]. Nanomedicine, 2013, 9:74-84.
[28] Jiang W, Fu Y, Yang F,etal.. Gracilaria lemaneiformis polysaccharide as integrin-targeting surface decorator of selenium nanoparticles to achieve enhanced anticancer efficacy[J]. ACS Appl. Mater. Interfaces, 2014, 6:13738-13748.
[29] Liu W, Li X, Wong Y S,etal.. Selenium nanoparticles as a carrier of 5-fluorouracil to achieve anticancer synergism[J]. ACS Nano, 2012, 6:6578-6591.
[30] Fu X, Yang Y, Li X,etal.. RGD peptide-conjugated selenium nanoparticles: Antiangiogenesis by suppressing VEGF-VEGFR2-ERK/AKT pathway[J]. Nanomedicine, 2016, 12:1627-1639.
[31] Zheng W, Cao C, Liu Y,etal.. Multifunctional polyamidoamine-modified selenium nanoparticles dual-delivering siRNA and cisplatin to A549/DDP cells for reversal multidrug resistance[J]. Acta Biomater., 2015, 11:368-380.
[32] Atuma C, Strugala V, Allen A,etal.. The adherent gastrointestinal mucus gel layer: thickness and physical state in vivo[J]. Am. J. Physiol. Gastrointest Liver Physiol., 2001, 280:G922-929.
[33] Citron M. Strategies for disease modification in Alzheimer's disease[J]. Nat. Rev. Drug Discov., 2004, 5:677-685.
[34] Zhang J, Zhou X, Yu Q,etal.. Epigallocatechin-3-gallate (EGCG)-stabilized selenium nanoparticles coated with Tet-1 peptide to reduce amyloid-β aggregation and cytotoxicity[J]. ACS Appl. Mater. Interfaces, 2014, 6:8475-8487.
[35] Ehrnhoefer D E, Bieschke J, Boeddrich A,etal.. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers[J]. Nat. Struct. Mol. Biol., 2008, 15:558-566.
[36] Park I K, Lasiene J, Chou S H,etal.. Neuron-specific delivery of nucleic acids mediated by Tet1-modified poly(ethylenimine)[J]. J. Gene Med., 2007, 9:691-702.
[37] Liu Z, Gao X, Kang T,etal.. B6 peptide-modified PEG-PLA nanoparticles for enhanced brain delivery of neuroprotective peptide[J]. Bioconjug. Chem., 2013, 24:997-1007.
[38] Wang B, Yu B, Karim M,etal.. Dietary sialic acid supplementation improves learning and memory in piglets[J]. Am. J. Clin. Nutr., 2007, 85:561-569.
[39] Yin T, Yang L, Liu Y,etal.. Sialic acid (SA)-modified selenium nanoparticles coated with a high blood-brain barrier permeability peptide-B6 peptide for potential use in Alzheimer’s disease[J]. Acta Biomater., 2015, 25:172-183.
[40] Rauk A. The chemistry of Alzheimer's disease[J]. Chem. Soc. Rev. , 2009, 38:2698-2715.
[41] Yang L, Chen Q, Liu Y,etal.. Se/Ru nanoparticles as inhibitors of metal-induced Aβ aggregation in Alzheimer's disease[J]. J. Mater. Chem. B Mater. Biol. Med., 2014, 2:1977-1987.
[42] Sun D, Zhang W, Yu Q,etal.. Chiral penicillamine-modified selenium nanoparticles enantioselectively inhibit metal-induced amyloid β aggregation for treating alzheimer’s disease[J]. J. Colloid Interface Sci., 2017,505:1001-1010.
[43] Al-Quraishy S, Dkhil M A, Moneim A E A. Anti-hyperglycemic activity of selenium nanoparticles in streptozotocin-induced diabetic rats[J]. Int. J. Nanomed., 2015, 10:6741-6756.
[44] Deng W, Xie Q, Wang H,etal.. Selenium nanoparticles as versatile carriers for oral delivery of insulin: Insight into the synergic antidiabetic effect and mechanism[J]. Nanomedicine, 2017,13(6):1965-1974.
[45] Zhao S J, Wang D H, Li Y W,etal.. A novel selective VPAC2 agonist peptide-conjugated chitosan modified selenium nanoparticles with enhanced anti-type 2 diabetes synergy effects[J]. Int. J. Nanomed., 2017, 12:2143-2160.
[46] Olmsted S S, Padgett J L, Yudin A I,etal.. Diffusion of macromolecules and virus-like particles in human cervical mucus[J]. Biophys. J., 2001, 81:1930-1937.
[47] Takizawa H, Ohtoshi T, Ohta K,etal.. Interleukin 6/B cell stimulatory factor-II is expressed and released by normal and transformed human bronchial epithelial cells[J]. Biochem. Biophys. Res. Commun., 1992, 187:596-602.
[48] Sahay G, Alakhova D Y, Kabanov A V. Endocytosis of nanomedicines[J]. J. Control. Release, 2010, 145:182-195.
[49] Pornwilard M M, Somchue W, Shiowatana J,etal.. Flow field-flow fractionation for particle size characterization of selenium nanoparticles incubated in gastrointestinal conditions[J]. Food Res. Int., 2014, 57:203-209.
[50] Garcia-Fuentes M, Alonso M J. Chitosan-based drug nanocarriers: where do we stand? [J]. J. Control. Release, 2012, 161:496-504.
[51] Roncal T, Oviedo A, Lópezd A I,etal.. High yield production of monomer-free chitosan oligosaccharides by pepsin catalyzed hydrolysis of a high deacetylation degree chitosan[J]. Carbohydr. Res., 2007, 342:2750-2756.
[52] Zhang C, Zhai X, Zhao G,etal.. Synthesis, characterization, and controlled release of selenium nanoparticles stabilized by chitosan of different molecular weights[J]. Carbohydr. Polym., 2015, 134:158-166.
刘红梅教授团队介绍
刘红梅教授团队主要从事生物无机化学、固体无机化学等方向的研究工作,重点研究硒、硒蛋白与重大疾病的关系及预防机制、无机纳米功能材料的制备及其在生物医学中的潜在应用等。先后承担了国家自然科学基金面上项目3项、湖北省杰出青年基金1项、武汉市青年科技晨光计划1项,发表论文30余篇、专著1部。
AdvancesinBiomedicalEffectsofSeleniumNanoparticles
CAO Hui, LIU Hongmei*
SchoolofChemistryandChemicalEngineering,HuazhongUniversityofScienceandTechnology,Wuhan430074,China
Selenium (Se) is an essential trace element to human, with multiple biological functions of anti-aging, free radical scavenging, cardiovascular protection, anti-cancer, etc. However, the application of Se in healthy food and pharmaceutical products has been limited by the fact that the therapeutic and toxic doses range of traditional Se compounds are too close. Se nanoparticles (SeNPs) is a novel Se species discovered in recent years. This review focused on the development of toxicity and biomedical effects of SeNPs, including anti-oxidant, anti-cancer, anti-bacterial, potential as a dietary supplement, etc. Additionally, we gave some prospects for future researches, which was expected to provide references for the biomedical application of SeNPs and protection of human health.
selenium; selenium nanoparticles; anti-oxidation; anti-cancer; toxicity
2017-07-20;接受日期2017-07-31
武汉市青年科技晨光计划项目(2015070404010184)资助。
曹 晖,硕士研究生,主要从事硒的生物化学研究。E-mail:m15116488700@163.com。*通信作者:刘红梅,教授,主要从事硒/硒蛋白的生物化学及其与重大疾病的关系。E-mail: hmliu2004@126.com
10.19586/j.2095-2341.2017.0093
